СПРАВКА
Источник публикации
М.: ФГБУ "Институт стандартизации", 2025
Примечание к документу
Документ введен в действие с 01.07.2025.
Взамен ГОСТ 32198-2013.
Название документа
"ГОСТ 32198-2025. Межгосударственный стандарт. Средства воспроизводства. Сперма. Методы микробиологического анализа"
(введен в действие Приказом Росстандарта от 28.05.2025 N 494-ст)
"ГОСТ 32198-2025. Межгосударственный стандарт. Средства воспроизводства. Сперма. Методы микробиологического анализа"
(введен в действие Приказом Росстандарта от 28.05.2025 N 494-ст)
Содержание
Приказом Федерального
агентства по техническому
регулированию и метрологии
от 28 мая 2025 г. N 494-ст
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
СРЕДСТВА ВОСПРОИЗВОДСТВА
СПЕРМА
МЕТОДЫ МИКРОБИОЛОГИЧЕСКОГО АНАЛИЗА
Product for reproduction. Semen.
Microbiological analysis technique
ГОСТ 32198-2025
МКС 67.120.30
Дата введения
1 июля 2025 года
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
1 РАЗРАБОТАН Федеральным государственным бюджетным учреждением "Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов" (ФГБУ "ВГНКИ")
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 28 февраля 2025 г. N 182-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Армения | AM | ЗАО "Национальный орган по стандартизации и метрологии" Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Узбекистан | UZ | Узбекское агентство по техническому регулированию |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 28 мая 2025 г. N 494-ст межгосударственный стандарт ГОСТ 32198-2025 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2025 г.
5 ВЗАМЕН ГОСТ 32198-2013
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Настоящий стандарт распространяется на свежеполученную неразбавленную, свежеполученную разбавленную и замороженную сперму сельскохозяйственных животных и птиц (далее - сперма) и устанавливает методы определения микробиологических показателей.
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 8.135 Государственная система обеспечения единства измерений. Стандарт-титры для приготовления буферных растворов - рабочих эталонов pH 2-го и 3-го разрядов. Технические и метрологические характеристики. Методы их определения
ГОСТ 8.423 Государственная система обеспечения единства измерений. Секундомеры механические. Методы и средства поверки
ГОСТ 12.0.004 <1> Система стандартов безопасности труда. Организация обучения безопасности труда. Общие положения
--------------------------------
<1> В Российской Федерации не действует до 1 сентября 2026 г.
ГОСТ 12.1.005 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12.1.008 Система стандартов безопасности труда. Биологическая безопасность. Общие требования
ГОСТ 12.1.019 Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
ГОСТ 12.4.011 Система стандартов безопасности труда. Средства защиты работающих. Общие требования и классификация
ГОСТ 12.4.021 Система стандартов безопасности труда. Системы вентиляционные. Общие требования
ГОСТ 177 Водорода перекись. Технические условия
ГОСТ 1341 Пергамент растительный. Технические условия
ГОСТ 1770 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 2156 Натрий двууглекислый. Технические условия
ГОСТ 2874 <1> Вода питьевая. Гигиенические требования и контроль за качеством
--------------------------------
<1> В Российской Федерации действует ГОСТ Р 51232-98 "Вода питьевая. Общие требования к организации и методам контроля качества".
ГОСТ 3118 Реактивы. Кислота соляная. Технические условия
ГОСТ 4148 Реактивы. Железо (II) сернокислое 7-водное. Технические условия
ГОСТ 4159 Реактивы. Йод. Технические условия
ГОСТ 4172 Реактивы. Натрий фосфорнокислый двузамещенный 12-водный. Технические условия
ГОСТ 4198 Реактивы. Калий фосфорнокислый однозамещенный. Технические условия
ГОСТ 4232 Реактивы. Калий йодистый. Технические условия
ГОСТ 4233 Реактивы. Натрий хлористый. Технические условия
ГОСТ 4234 Реактивы. Калий хлористый. Технические условия
ГОСТ 4328 Реактивы. Натрия гидроокись. Технические условия
ГОСТ 5556 Вата медицинская гигроскопическая. Технические условия
ГОСТ 5833 Реактивы. Сахароза. Технические условия
ГОСТ 5962 Спирт этиловый ректификованный из пищевого сырья. Технические условия
ГОСТ 6038 Реактивы. D-глюкоза. Технические условия
ГОСТ 6259 Реактивы. Глицерин. Технические условия
ГОСТ 6672 Стекла покровные для микропрепаратов. Технические условия
ГОСТ 6691 Реактивы. Карбамид. Технические условия
ГОСТ 6709 <2> Вода дистиллированная. Технические условия
--------------------------------
<2> В Российской Федерации действует ГОСТ Р 58144-2018.
ГОСТ 9147 Посуда и оборудование лабораторные фарфоровые. Технические условия
ГОСТ 9245 Потенциометры постоянного тока измерительные. Общие технические условия
ГОСТ 9284 Стекла предметные для микропрепаратов. Технические условия
ГОСТ 9293 (ИСО 2435-73) Азот газообразный и жидкий. Технические условия
ГОСТ 9949 Ксилол каменноугольный. Технические условия
ГОСТ 12026 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 13037 Вазелин ветеринарный. Технические условия
ГОСТ 13739 Масло иммерсионное для микроскопии. Технические требования. Методы испытаний
ГОСТ 13805 Пептон сухой ферментативный для бактериологических целей. Технические условия
ГОСТ 14919 Электроплиты, электроплитки и жарочные электрошкафы бытовые. Общие технические условия
ГОСТ 16317 Приборы холодильные электрические бытовые. Общие технические условия
ГОСТ 16427 Салфетки и отрезы марлевые медицинские. Технические условия
ГОСТ 17206 Агар микробиологический. Технические условия
ГОСТ 20015 Хлороформ. Технические условия
ГОСТ 20730 Питательные среды. Бульон мясо-пептонный (для ветеринарных целей). Технические условия
ГОСТ 21239 (ИСО 7741-86) Инструменты хирургические. Ножницы. Общие требования и методы испытаний
ГОСТ 21241 Пинцеты медицинские. Общие технические требования и методы испытаний
ГОСТ 22300 Реактивы. Эфиры этиловый и бутиловый уксусной кислоты. Технические условия
ГОСТ 22340 Аквадистилляторы медицинские электрические. Общие технические требования и методы испытаний
ГОСТ 22649 Стерилизаторы воздушные медицинские. Общие технические условия
ГОСТ 23683 Парафины нефтяные твердые. Технические условия
ГОСТ 24363 Реактивы. Калия гидроокись. Технические условия
ГОСТ 25336 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 25706 Лупы. Типы, основные параметры. Общие технические требования
ГОСТ 27775 Искусственное осеменение сельскохозяйственных животных. Термины и определения
ГОСТ 28498 Термометры жидкостные стеклянные. Общие технические требования. Методы испытаний
ГОСТ 29230 (ИСО 835-4-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 4. Пипетки выдувные
ГОСТ 32222 Средства воспроизводства. Сперма. Методы отбора проб
ГОСТ 33567 Сахар молочный. Технические условия
ГОСТ ISO 7218 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям
ГОСТ ISO 7886-1 Шприцы инъекционные однократного применения стерильные. Часть 1. Шприцы для ручного использования
ГОСТ ISO 11133 Микробиология пищевых продуктов, кормов для животных и воды. Приготовление, производство, хранение и определение рабочих характеристик питательных сред
ГОСТ ISO/IEC 17025 Общие требования к компетентности испытательных и калибровочных лабораторий
ГОСТ OIML R 76-1 Государственная система обеспечения единства измерений. Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов и классификаторов на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации (www.easc.by) или по указателям национальных стандартов, издаваемым в государствах, указанных в предисловии, или на официальных сайтах соответствующих национальных органов по стандартизации. Если на документ дана недатированная ссылка, то следует использовать документ, действующий на текущий момент, с учетом всех внесенных в него изменений. Если заменен ссылочный документ, на который дана датированная ссылка, то следует использовать указанную версию этого документа. Если после принятия настоящего стандарта в ссылочный документ, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение применяется без учета данного изменения. Если ссылочный документ отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3.1 В настоящем стандарте применены термины по ГОСТ 27775, а также следующие термины с соответствующими определениями:
3.1.1 бактерии группы кишечной палочки (колиформные бактерии): Неспорообразующие грамотрицательные палочки, ферментирующие с образованием газа лактозу при 37 °C и принадлежащие к родам - Escherichia, Klebsiella, Enterobacter, Citrobacter.
3.1.2 биологическая проба; биопроба: Метод исследования, основанный на заражении лабораторных животных различными способами: подкожно, внутримышечно, внутрибрюшинно и др. - с целью идентификации микроорганизмов по вирулентности или воспроизведения и изучения инфекционного процесса и патологоанатомических изменений.
3.1.3 бродильный титр: Наименьший объем исследуемого материала, выраженный в см3, в котором обнаружена хотя бы одна бактерия группы кишечной палочки, разлагающая углеводы на кислоту и газ при (43 +/- 1) °C в течение 24 ч.
3.1.4 гемолитические свойства: Способность микроорганизмов гемолизировать эритроциты крови.
3.1.5 коли-индекс: Показатель, указывающий на число бактерий вида Escherichia coli в 1 см3 спермы.
3.1.6 коли-титр: Наименьший объем исследуемого материала, выраженный в см3, в котором обнаружена одна Escherichia coli (после идентификации).
Примечание - Коли-титр выражают также степенью разведения: 1:10 = 0,1; 1:100 = 0,01 и т.д.
3.1.7 плазмокоагуляция: Способность патогенных микроорганизмов (преимущественно стафилококков) свертывать цитратную плазму крови кролика.
3.1.8 санитарно-показательные микроорганизмы: Все разновидности бактерий группы кишечной палочки, наличие которых является показателем загрязнения и свидетельствует о нарушении санитарного режима.
3.1.9 чистая культура: Культура микроорганизма, которая представляет собой один биологический вид без содержания других форм.
3.1.10 штамм: Чистая культура одного вида микроорганизмов, выделенная из определенного источника, обладающая специфическими физиолого-биохимическими признаками.
3.2 В настоящем стандарте применены следующие сокращения:
ГРМ - гидролизат рыбной муки;
ГМФ - гидролизат мяса (говяжьего) ферментативный;
ДНК - дезоксирибонуклеиновая кислота;
ЕМ - единицы мутности;
МПА - мясо-пептонный агар;
МПБ - мясо-пептонный бульон;
МППА - мясо-печеночный пептонный агар;
ОСО - отраслевой стандартный образец;
ПЖА - полужидкий агар.
4.1 Условия выполнения исследований
4.1.1 Требования к обучению персонала безопасности труда - по ГОСТ 12.0.004.
4.1.2 Средства защиты работающих - по ГОСТ 12.4.011, воздух рабочей зоны должен соответствовать требованиям ГОСТ 12.1.005, вентиляция - по ГОСТ 12.4.021, при работе с электрическим оборудованием - ГОСТ 12.1.019.
4.1.3 Требования безопасности при работе с химическими реактивами - по ГОСТ 12.1.007.
4.1.4 Требования биологической безопасности, производственная санитария и санитарно-противоэпидемический режим должны соответствовать требованиям ГОСТ 12.1.008.
4.1.5 Общие требования проведения микробиологических исследований и работы с микроорганизмами 1 - 2 групп опасности - по ГОСТ ISO 7218 или нормативным правовым актам, действующим на территории государства, принявшего стандарт.
4.1.6 Требования к персоналу - по ГОСТ ISO 7218, ГОСТ ISO/IEC 17025.
4.1.7 К проведению исследований допускаются квалифицированные сотрудники, имеющие опыт работы с микроорганизмами 1 - 2 групп опасности, изучившие методики микробиологических работ.
4.1.8 Обеззараживание спермы после проведения микробиологических исследований, посевов на питательных средах, а также использованных индивидуальных средств защиты и инструментов проводят согласно санитарно-эпидемиологическим требованиям, действующим на территории стран, принявших стандарт.
5 Средства измерений, испытательное и вспомогательное оборудование, стандартные образцы, посуда, материалы, реактивы и питательные среды
Аквадистиллятор по ГОСТ 22340.
Анализатор потенциометрический для контроля pH, обеспечивающий измерение с погрешностью до +/- 0,01 ед. pH по ГОСТ 9245.
Анаэростат или эксикатор 2-250 по ГОСТ 25336 со вставкой для эксикатора 1-230 по ГОСТ 9147.
Асбестовый фильтр.
Бактериологическая петля диаметром около 3 мм.
Баня водяная с обогревом, позволяющая поддерживать температуру от 0 °C до 100 °C с погрешностью +/- 2 °C.
Бокс биологической безопасности для микробиологических исследований.
Бумага фильтровальная по ГОСТ 12026.
Бумага пергаментная по ГОСТ 1341.
Вата медицинская гигроскопическая по ГОСТ 5556.
Весы неавтоматического действия по ГОСТ OIML R 76-1, класс точности высокий, с наибольшим пределом взвешивания 200 г, действительная цена деления шкалы 0,001 г.
Воронка стеклянная ВФ-100-150 по ГОСТ 25336.
Газогенерирующие пакеты, обеспечивающие микроаэрофильные и анаэробные условия.
Колбы мерные стеклянные 1-100-2, 1-300-2, 1-500-2, 1-1000-2 по ГОСТ 1770.
Корнцанг.
Микроскоп световой биологический с бинокулярной насадкой с увеличением 40 - 1000x.
Морозильная камера, поддерживающая температуру минус (20 +/- 2) °C.
Электроплита по ГОСТ 14919.
Ножницы по ГОСТ 21239.
Оптический стандарт мутности бактерийных взвесей (ОСО мутности) 10 МЕ.
Пинцет анатомический ГОСТ 21241.
Пипетки градуированные прямые, полного слива, 2-го класса точности вместимостью 1,0 см3, 2,0 см3, 5,0 см3, 10,0 см3 по ГОСТ 29230.
Посуда лабораторная мерная по ГОСТ 1770.
Пробирки П1 или П2 по ГОСТ 25336.
Салфетки марлевые стерильные и нестерильные по ГОСТ 16427.
Секундомер или таймер по ГОСТ 8.423.
Сосуд Дьюара.
Стандарт-титры для pH-метрии по ГОСТ 8.135.
Стекла покровные 18 x 18 по ГОСТ 6672.
Стекла предметные 26 x 76 по ГОСТ 9284.
Стерилизатор паровой (автоклав) по ГОСТ 22649.
Ступка 3 или ступка 4 по ГОСТ 9147.
Сушильный шкаф, поддерживающий температуру от 120 °C до 180 °C.
Счетная камера Вольфгюгеля.
Счетчик колоний микроорганизмов типа СКМ-1 или лупа по ГОСТ 25706 с увеличением в 2 - 10 раз.
Термометры жидкостные стеклянные с диапазоном измерения температуры от 0 °C до 50 °C и от 50 °C до 100 °C по ГОСТ 28498.
Термостат, поддерживающий температуру (37 +/- 1) °C.
Термостат, поддерживающий температуру (24 +/- 1) °C.
Термостат, поддерживающий температуру (44 +/- 1) °C.
Фильтры мембранные стерильные с размерами пор 0,22 мкм, 1,2 - 3,0 мкм.
Холодильник бытовой с рабочим диапазоном температур от 2 °C до 8 °C по ГОСТ 16317.
Центрифуга лабораторная 1000 об./мин; 10 тыс об./мин.
Цилиндры мерные вместимостью 10, 25, 50, 100, 500, 1000 см3 по ГОСТ 1770.
Чашки Петри ЧБН-1-100 или ЧБН-2-100 по ГОСТ 25336.
Шприцы инъекционные стерильные вместимостью 1,0 см3 (инсулиновые) или 2,0 см3 по ГОСТ ISO 7886-1.
Тест-штаммы микроорганизмов Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Enterococcus faecalis, Salmonella enteritidis, Proteus vulgaris, Candida albicans; Clostridium perfringens; Mycoplasma synoviae.
Мыши белые лабораторные, клинически здоровые, массой 14 - 16 г.
Свинки морские, клинически здоровые, массой 350 - 400 г.
Кролики, клинически здоровые, массой 2 кг.
Агар микробиологический по ГОСТ 17206.
Азот жидкий по ГОСТ 9293.
Бромтимоловый синий.
Бульон мясо-пептонный по ГОСТ 20730.
Вазелин по ГОСТ 13037.
Вода водопроводная по ГОСТ 2874.
Вода дистиллированная по ГОСТ 6709.
Гидрофосфат натрия Na2HPO4·7H2O.
Глицерин по ГОСТ 6259.
Глюкоза по ГОСТ 6038.
Дифибринированная стерильная кровь барана.
Желатин.
Железо сернокислое по ГОСТ 4148, х.ч, ч.д.а.
Желчь говяжья сухая.
Желчь бычья натуральная стерильная.
Йод по ГОСТ 4159, х.ч.
Калий йодистый по ГОСТ 4232, х.ч.
Калий фосфорнокислый однозамещенный по ГОСТ 4198, х.ч, ч.д.а.
Калий хлористый по ГОСТ 4234, х.ч.
Калия гидроокись по ГОСТ 24363, х.ч, ч.д.а.
Калия теллурит.
Кислота розоловая.
Краситель Азур-эозин по Романовскому.
Кристалл-, генциан- или метилвиолет для микробиологических целей.
Ксилол по ГОСТ 9949.
Лактоза по ГОСТ 33567.
Мальтоза.
Маннит (маннитол).
Масло иммерсионное для микроскопии по ГОСТ 13739.
Метиленовый синий.
Метиловый спирт.
Мочевина по ГОСТ 6691, ч.д.а.
Набор диагностический индикаторный бумажный для межродовой и видовой дифференциации энтеробактерий, в состав которого входят следующие компоненты:
- диски с сорбитом, инозитом, лизином, орнитином, цитратом натрия, малонатом натрия, для определения галактозидазы, уреазы, фенилаланиндезаминазы (диски с фенилаланином, диски с хлоридом железа), сероводорода, для реакции Фогеса-Проскауэра;
- полоски для определения оксидазы и индола.
Набор для биохимической идентификации анаэробных бактерий, в состав которого входят следующие компоненты:
- микротитровальные пластинки с субстратами для тестов: индол, глюкоза, мальтоза, фруктоза, галактоза, лактоза, мелецитоза, уреаза, нитраты, сахароза, салицин, трегалоза, маннитол, рамноза, 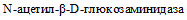 ,
,  , эскулин, манноза, раффиноза, целлобиоза, ксилоза, арабиноза и сорбитол;
, эскулин, манноза, раффиноза, целлобиоза, ксилоза, арабиноза и сорбитол;
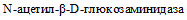 ,
,  , эскулин, манноза, раффиноза, целлобиоза, ксилоза, арабиноза и сорбитол;
, эскулин, манноза, раффиноза, целлобиоза, ксилоза, арабиноза и сорбитол;- инструкция;
- цветная шкала для учета результатов;
- полиэтиленовые пакетики для инкубации;
- бланки для регистрации результатов;
- суспензионная среда;
- реактив для теста на индол;
- реактив для теста на нитраты;
- парафиновое (вазелиновое) масло, стерильное.
Набор для идентификации анаэробных бактерий, в состав которого входят следующие компоненты:
- стрипы из микролунок, содержащих дегидрированные субстраты (активные ингредиенты) для тестов: L-триптофан, мочевина, D-глюкоза, D-маннит, D-лактоза, D-сахароза, D-мальтоза, салицин, D-ксилоза, L-арабиноза, желатин (бычий), эскулин железа цитрат, глицерин, D-целлобиоза, D-манноза, D-мелецитоза, D-раффиноза, D-сорбит, L-рамноза, D-трегалоза;
- контейнеры для инкубации;
- суспензионная среда;
- бланки для учета результатов;
- инструкция, поставляемая в наборе.
Реактивы и материалы, не включенные в набор:
- стандарт МакФарланда (3 McF);
- реактив для выявления подкисления сред с углеводами;
- реактив для теста на индол;
- реактив для теста на каталазу (3%-ная перекись водорода);
- минеральное масло.
Набор для идентификации бактерий рода Campylobacter, в состав которого входят следующие компоненты:
- стрипы из микролунок, содержащих дегидрированные субстраты (активные ингредиенты) для тестов: мочевина, нитрат калия, 5-бром-4-хлор-3-индоксилацетат, гиппурат натрия, 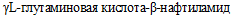 , трифенилтетразолий хлорид,
, трифенилтетразолий хлорид,  ,
,  ,
,  , 2-нафтилфосфат, тиосульфат натрия, D-глюкоза, сукцинат натрия, налидиксовая кислота, цефазолин, натрия ацетат, натрия пропионовая, кислота яблочная, кислота тринатрийцитрат, эритромицин;
, 2-нафтилфосфат, тиосульфат натрия, D-глюкоза, сукцинат натрия, налидиксовая кислота, цефазолин, натрия ацетат, натрия пропионовая, кислота яблочная, кислота тринатрийцитрат, эритромицин;
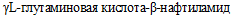 , трифенилтетразолий хлорид,
, трифенилтетразолий хлорид,  ,
,  ,
,  , 2-нафтилфосфат, тиосульфат натрия, D-глюкоза, сукцинат натрия, налидиксовая кислота, цефазолин, натрия ацетат, натрия пропионовая, кислота яблочная, кислота тринатрийцитрат, эритромицин;
, 2-нафтилфосфат, тиосульфат натрия, D-глюкоза, сукцинат натрия, налидиксовая кислота, цефазолин, натрия ацетат, натрия пропионовая, кислота яблочная, кислота тринатрийцитрат, эритромицин;- стерильный 0,85%-ный раствор натрия хлорида;
- контейнеры для инкубации;
- стандарт МакФарланда (6 McF);
- бланки для учета результатов;
- инструкция, поставляемая в наборе.
Реактивы и материалы, не включенные в набор:
- реактивы для теста на индол;
- реактив для определения гидролиза гиппуровой кислоты;
- реактив для выявления подкисления сред с углеводами;
- минеральное масло.
Набор для биохимической дифференциации энтеробактерий, в состав которого входят следующие компоненты:
- пластина полимерная, содержащая субстраты для тестов: на выявление уреазы,  , лизиндекарбоксилазы, орнитиндекарбоксилазы, аргининдигидролазы; образования сероводорода, индола, ацетоина; ферментацию глюкозы, сахарозы, маннита, малоната, цитрата, цитрата натрия с глюкозой, инозитола, сорбитола, арабинозы, мальтозы;
, лизиндекарбоксилазы, орнитиндекарбоксилазы, аргининдигидролазы; образования сероводорода, индола, ацетоина; ферментацию глюкозы, сахарозы, маннита, малоната, цитрата, цитрата натрия с глюкозой, инозитола, сорбитола, арабинозы, мальтозы;
 , лизиндекарбоксилазы, орнитиндекарбоксилазы, аргининдигидролазы; образования сероводорода, индола, ацетоина; ферментацию глюкозы, сахарозы, маннита, малоната, цитрата, цитрата натрия с глюкозой, инозитола, сорбитола, арабинозы, мальтозы;
, лизиндекарбоксилазы, орнитиндекарбоксилазы, аргининдигидролазы; образования сероводорода, индола, ацетоина; ферментацию глюкозы, сахарозы, маннита, малоната, цитрата, цитрата натрия с глюкозой, инозитола, сорбитола, арабинозы, мальтозы;- альфа-нафтол;
- пара-диметиламинобензальдегид;
- хлорид железа (3+) гексагидрат;
- калия гидроксид;
- буферный раствор;
- вазелиновое масло;
- таблица биохимических свойств энтеробактерий.
Набор для биохимической идентификации бактерий семейства Enterobacteriaceae, в состав которого входят следующие компоненты:
- стрипы из микролунок, содержащих дегидрированные субстраты (активные ингредиенты) для тестов:  , L-аргинин, L-лизин, L-орнитин, натрия цитрат трехзамещенный, натрия тиосульфат, мочевина, L-триптофан, натрия пируват, желатин (бычий), D-глюкоза, D-маннит, инозит, D-сорбит, L-рамноза, D-сахароза, D-мелибиоза, амигдалин, L-арабиноза.
, L-аргинин, L-лизин, L-орнитин, натрия цитрат трехзамещенный, натрия тиосульфат, мочевина, L-триптофан, натрия пируват, желатин (бычий), D-глюкоза, D-маннит, инозит, D-сорбит, L-рамноза, D-сахароза, D-мелибиоза, амигдалин, L-арабиноза.
 , L-аргинин, L-лизин, L-орнитин, натрия цитрат трехзамещенный, натрия тиосульфат, мочевина, L-триптофан, натрия пируват, желатин (бычий), D-глюкоза, D-маннит, инозит, D-сорбит, L-рамноза, D-сахароза, D-мелибиоза, амигдалин, L-арабиноза.
, L-аргинин, L-лизин, L-орнитин, натрия цитрат трехзамещенный, натрия тиосульфат, мочевина, L-триптофан, натрия пируват, желатин (бычий), D-глюкоза, D-маннит, инозит, D-сорбит, L-рамноза, D-сахароза, D-мелибиоза, амигдалин, L-арабиноза.Реактивы и материалы, не включенные в набор:
- стерильный 0,85%-ный раствор натрия хлорида;
- реактив для выявления ферментации триптофандеаминазы;
- реактивы для теста на индол;
- реактивы для постановки реакции Фогеса-Проскауэра;
- реактив для теста на оксидазу;
- минеральное масло.
Набор для биохимической идентификации Enterobacteriaceae, в состав которого входят следующие компоненты:
- планшет полимерный с крышкой, стрипованный, маркированный, содержащий субстраты (активные ингредиенты) для тестов: на наличие уреазы, образование индола, наличие лизиндекарбоксилазы, утилизацию маннита, цитрата натрия, сахарозы, инозита, наличие фенилаланиндезаминазы, образование сероводорода, наличие аргининдигидролазы, орнитиндекарбоксилазы, утилизацию лактозы, малоната натрия, сорбита, дульцита, мальтозы, наличие  , утилизацию арабинозы, рамнозы, адонита, рафинозы, салицина, глюкозы, наличие нитратредуктазы;
, утилизацию арабинозы, рамнозы, адонита, рафинозы, салицина, глюкозы, наличие нитратредуктазы;
 , утилизацию арабинозы, рамнозы, адонита, рафинозы, салицина, глюкозы, наличие нитратредуктазы;
, утилизацию арабинозы, рамнозы, адонита, рафинозы, салицина, глюкозы, наличие нитратредуктазы;- стерильная пленка (защитная пленка);
- масло вазелиновое стерильное;
- реактив по Эрлиху;
- 10%-ный раствор хлорида железа (III);
- 1%-ный раствор риванола;
- 1%-ный раствор кислоты хлористоводородной.
Натрия гидрокарбонат по ГОСТ 2156, ч.д.а.
Натрия гидроокись по ГОСТ 4328, х.ч. или ч.д.а.
Натрий фосфорнокислый двузамещенный 12-водный по ГОСТ 4172, ч.д.а.
Натрий хлористый по ГОСТ 4233, х.ч.
Нейтральрот.
Парафин по ГОСТ 23683.
Пептон сухой ферментативный для бактериологических целей по ГОСТ 13805.
Перекись водорода по ГОСТ 177.
Реактив Эрлиха.
Сахароза по ГОСТ 5833.
Соляная кислота концентрированная (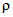 1,18 - 1,19 г/см) по ГОСТ 3118.
1,18 - 1,19 г/см) по ГОСТ 3118.
Спирт этиловый ректификованный по ГОСТ 5962.
Тест-системы для выявления возбудителей микоплазмоза/уреаплазмоза методом полимеразной цепной реакции.
Твин-80.
Фенол, ч.д.а.
Фуксин основной для микробиологических целей.
Хлороформ по ГОСТ 20015.
Экстракт дрожжевой.
Эозин водорастворимый.
Эфир по ГОСТ 22300.
Эфир петролейный, ч.
Для исследований методом ПЦР применяют оборудование и расходные материалы в соответствии с инструкциями по применению коммерческих тест-систем для выявления возбудителей микоплазмоза/уреаплазмоза методом полимеразной цепной реакции, применяемым на территории государства, принявшего стандарт.
Допускается применение других средств измерений с метрологическими характеристиками и испытательного оборудования с техническими характеристиками, а также материалов и реактивов по качеству не ниже указанных.
Допускается использование готовых и сухих питательных сред, предназначенных для указанных целей, а также сред, приготовленных по прописи производителя. Питательные среды должны соответствовать ГОСТ ISO 11133.
Допускается использование оборудования и материалов (чашек Петри, пипеток, пробирок, флаконов, бутылок) однократного применения, аналогичных по техническим характеристикам, подходящих для использования в микробиологии и не содержащих веществ, подавляющих рост микроорганизмов.
Допускается использование производственных готовых биохимических наборов для идентификации изолированных колоний.
6.1 Общие требования
Для проведения исследований используют свежеполученную неразбавленную и разбавленную сперму, хранившуюся не более 6 ч при температуре 2 °C - 5 °C, и замороженную сперму, хранившуюся не более 30 мин после оттаивания.
6.2 Отбор проб
Отбор проб проводят по ГОСТ 32222.
0,9 г хлористого натрия растворяют в 100,0 см3 дистиллированной воды, разливают в пробирки по 5,0 см3 и по 10,0 см3 и стерилизуют при температуре (121 +/- 1) °C в течение 15 мин.
Готовый раствор хранят при температуре (20 +/- 2) °C не более 14 сут.
10,0 г пептона и 5,0 г хлористого натрия добавляют к 1 дм3 мясной воды. Устанавливают pH 7,0 - 7,2, кипятят, фильтруют через бумажный фильтр. Стерилизуют при температуре (121 +/- 1) °C в течение 20 мин. При выпадении осадка в мясо-пептонном бульоне его повторно фильтруют с последующей стерилизацией.
Для приготовления мясо-пептонного агара в 1 дм3 мясо-пептонного бульона перед стерилизацией добавляют 15,0 - 20,0 г агар-агара и кипятят на слабом огне при постоянном помешивании до полного растворения агара. Устанавливают pH 7,0 - 7,2, разливают в пробирки или флаконы и стерилизуют при температуре (121 +/- 1) °C в течение 20 мин.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 30 сут.
Приготовление мясной воды: мясо освобождают от костей, жира, фасций и сухожилий, режут на кусочки и пропускают через мясорубку. К фаршу добавляют двойное по массе количество воды, перемешивают и выдерживают при температуре (5 +/- 3) °C в течение 18 - 20 ч. Затем смесь помешивают и кипятят в течение 1 ч. Жир, пену и всплывающие кусочки во время кипячения несколько раз удаляют, а воду добавляют до первоначального объема. Контроль окончания кипячения: 2,0 - 3,0 см3 экстракта пропускают через бумажный фильтр в пробирку. Если фильтр прозрачный, кипячение заканчивают. Мясную воду сливают, фарш при этом отжимают через 2 - 3 слоя марли, фильтруют через бумажный фильтр, разливают в колбы вместимостью не более 2 дм3 и стерилизуют в автоклаве при температуре (121 +/- 1) °C в течение 40 мин.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 3 мес.
Примечание - Вместо указанного мясо-пептонного (агара), мясо-пептонного бульона допустимо применение готового сухого питательного агара (ГМФ-агар (бульон), ГРМ-агар (бульон)), из которого готовят питательную среду в соответствии с указаниями на этикетке.
К мясо-пептонному бульону, приготовленному по 7.1.2, добавляют 2% агар-агара, предварительно измельченного, замоченного и хорошо промытого водой. Среду кипятят на слабом огне при постоянном помешивании до полного растворения агара. При помутнении среды ее просветляют. Агар в горячем состоянии фильтруют через вату, разливают во флаконы или колбы и стерилизуют в автоклаве при (121 +/- 1) °C в течение 10 - 20 мин. К расплавленному мясо-пептонному агару добавляют стерильный концентрированный (40%-ный и более) раствор глюкозы из расчета ее содержания в мясо-пептонном агаре в количестве 1% и стерилизуют в автоклаве в течение 30 мин при температуре 105 °C - 110 °C. Готовая среда должна иметь pH 7,0 - 7,2.
Готовую среду до использования хранят в темном месте при температуре от (5 +/- 3) °C не более 30 сут.
Примечание - Вместо указанного мясо-пептонного агара допускается применение готового сухого питательного агара (ГМФ-агар, ГРМ-агар), из которого готовят питательную среду в соответствии с указаниями, прилагаемыми к препарату, и добавляют 1% глюкозы.
К расплавленному стерильному 2,0%-ному мясо-пептонному агару, приготовленному по 7.1.2 и охлажденному до 45 °C (не выше) с соблюдением правил стерильности, прибавляют 5,0% дефибринированной, стерильно взятой крови барана. Приготовленную среду разливают в стерильные чашки Петри (предварительно нагретые в термостате) слоем в 5 мм, дают застыть, подсушивают в термостате. Слой агара должен быть равномерно окрашен в красный цвет.
Готовую среду хранят при температуре (5 +/- 3) °C не более 2 сут.
Примечание - Вместо указанного мясо-пептонного агара допустимо применение готового сухого питательного агара (ГМФ-агар, ГРМ-агар), из которого готовят питательную среду, к которой добавляют 5% дефибринированной, стерильно взятой крови барана.
Приготовление дефибринированной крови барана. В стерильную колбу (со стеклянными бусами) вместимостью 50 см3 помещают только что взятую стерильно кровь барана и непрерывно встряхивают в течение 15 мин. В результате чего находящийся в крови фибрин выпадет в осадок, обволакивая бусы. Дефибринированную кровь в асептических условиях сливают в другую стерильную колбу или пробирку.
Дефибринированную кровь хранят при температуре (5 +/- 1) °C в течение 7 сут.
К 100,0 см3 мясо-пептонного бульона с pH 7,0, приготовленного по 7.1.2, добавляют 6,5 г хлористого натрия. Разливают в пробирки по 5,0 см3 и стерилизуют при температуре (121 +/- 1) °C 20 мин.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 30 сут.
На 1 дм3 мясо-пептонного бульона добавляют 2,5 г маннита, устанавливают pH 7,0 - 7,1 и кипятят 15 мин. Добавляют насыщенный водный раствор нейтральрота до окрашивания среды в вишнево-красный цвет. Среду фильтруют, разливают в пробирки с поплавками по 5,0 - 7,0 см3 и автоклавируют в течение 15 мин при температуре (121 +/- 1) °C.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 7 сут.
7.1.7 Приготовление среды Эйкмана (глюкозо-пептонная)
В 1 дм3 водопроводной воды растворяют 10,0 г пептона и 5,0 г хлористого натрия. Среду кипятят и фильтруют. Добавляют 10,0 г глюкозы и устанавливают pH 7,4. Повторно кипятят и при необходимости фильтруют. В среду добавляют 0,026 г бромтимолового синего. Среду разливают в пробирки с поплавками по 5,0 - 7,0 см3. Среду стерилизуют при температуре (112 +/- 1) °C в течение 20 мин.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 7 сут.
В 1 дм3 дистиллированной воды растворяют при нагревании 10,0 г пептона, 5,0 г натрия хлористого, 5,0 г лактозы. Устанавливают pH 7,4 - 7,6, добавляют 1,0 см3 1,6%-ного спиртового раствора бромтимолового синего и разливают по 5,0 - 7,0 см3 в пробирки с поплавками. Среду стерилизуют при температуре (112 +/- 2) °C 12 мин.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 7 сут.
10,0 г пептона, 2,5 г лактозы, 5,0 г сухой говяжьей желчи или 50,0 см3 натуральной желчи, 2,0 см3 раствора генцианвиолета, или кристаллического фиолетового, или метилового фиолетового добавляют к 1000,0 см3 дистиллированной воды (в случае использования натуральной желчи - к 950,0 см3 дистиллированной воды), тщательно перемешивают, нагревают на слабом огне до кипения, кипятят 1 - 2 мин, фильтруют через ватно-марлевый фильтр и охлаждают до 45 °C - 55 °C. Значение pH после стерилизации при 25 °C должно быть (7,3 +/- 0,2). Среду разливают по 5,0 - 7,0 см3 в пробирки с поплавками и стерилизуют в течение 20 мин при температуре (115 +/- 1) °C.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 30 сут.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
Приготовление раствора генцианвиолета, или кристаллического фиолетового, или метилового фиолетового концентрацией 10,0 г/дм3: 1,0 г одной из анилиновых красок переносят в фарфоровую ступку и постепенно растворяют в дистиллированной воде. Раствор переливают в мерную колбу вместимостью 100,0 см3 и доливают дистиллированной водой до метки.
7.1.10 Приготовление бульона МакКонки
20,0 г пептона, 10,0 г лактозы, 5,0 г хлористого натрия, 5,0 г сухой говяжьей желчи или 50,0 см3 натуральной желчи, 1,0 см3 раствора бромкрезолового пурпурного добавляют к 1 дм3 дистиллированной воды (если используют натуральную желчь - к 950,0 см3 воды), тщательно перемешивают, нагревают на слабом огне до кипения и кипятят 1 - 2 мин, фильтруют через ватно-марлевый фильтр, охлаждают до 45 °C - 55 °C, устанавливают pH таким образом, чтобы после стерилизации он составлял при 25 °C (7,2 +/- 0,1). Среду разливают по 10,0 см3 в пробирки с поплавками и стерилизуют в автоклаве при (121 +/- 1) °C в течение 15 мин.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 30 сут.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
Приготовление щелочного раствора бромкрезолового пурпурного: 1,0 г бромкрезолового пурпурного переносят в фарфоровую ступку с 19,0 см3 раствора гидроокиси натрия концентрации 0,1 моль/дм3 и после растворения добавляют 80,0 см3 дистиллированной воды.
7.1.11 Приготовление среды Кода (SDS-бульон: питательная среда для выделения и идентификации энтеробактерий сухая)
Пептон ферментативный сухой - 13,0 г, натрия хлорид - 6,6 г, лактоза - 10,0 г, сульфанол - 2,2 г, бромтимоловый синий, индикатор - 0,05 г, натрий углекислый - 0,28 г добавляют к 1 дм3 воды дистиллированной (до 1 дм3), кипятят 1 - 2 мин, фильтруют через бумажный фильтр, охлаждают, устанавливают pH 7,6 - 8,0, кипятят и разливают по 5,0 см3 в стерильные пробирки. Готовая к употреблению среда должна быть прозрачной зеленовато-синего цвета.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 7 сут.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
7.1.13 Приготовление среды Левина
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
Аммоний-железо (II) сульфат [FeSO4·(NH4)2SO4·6H2O] (соль Мора) - 0,2 г, натрий тиосульфат (Na2S2O3·5H2O) - 0,3 г, предварительно растворяют в 50,0 см3 дистиллированной воды. 10,0 г лактозы, 10,0 г сахарозы, 1,0 г глюкозы, 10,0 г мочевины растворяют при подогревании в водяной бане в объемах 50,0 см3 дистиллированной воды каждый. 25,0 г сухого питательного агара расплавляют в 750,0 см3 дистиллированной воды при нагревании и помешивании. Затем все ингредиенты смешивают с расплавленным агаром, фильтруют через ватно-марлевый фильтр. Устанавливают pH 7,2 - 7,4. Добавляют 4,0 см3 индикатора фенолового красного (0,4%-ный водный раствор), хорошо перемешивают, разливают в пробирки по 6 - 7 см3. Стерилизуют текучим паром три дня подряд по 20 мин или при температуре (112 +/- 2) °C 15 мин. Среду скашивают, оставляя столбик не менее 2 - 2,5 см. Готовая среда бледно-розового цвета.
Готовую среду до использования хранят в течение 3 сут в темном месте при температуре (20 +/- 2) °C или в течение 14 сут при температуре (5 +/- 3) °C.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
Примечание - Готовая к употреблению среда имеет красновато-бурый или оранжево-красный цвет. При скашивании следует оставлять столбик высотой 2 - 2,5 см.
Коммерческую сухую среду готовят согласно указаниям на этикетке.
Примечание - Расплавленную среду скашивают без столбика.
В 1 дм3 бульона Хоттингера добавляют 4,0 г натрия хлорида и 3,0 г агар-агара, кипятят до полного растворения агара при постоянном помешивании, фильтруют через ватно-марлевый фильтр, охлаждают, устанавливают pH 7,2 - 7,4. Разливают в пробирки по 5,0 - 7,0 см3. Среду стерилизуют 30 мин при (121 +/- 1) °C и охлаждают в вертикальном положении.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 30 сут.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
Растворяют 5,0 г пептона, 5,0 г калия гидрофосфата, 5,0 г глюкозы в 1000,0 см3 воды дистиллированной, кипятят 2 - 3 мин, фильтруют через бумажный фильтр, устанавливают pH 6,9 - 7,0, разливают в пробирки по 5,0 - 7,0 см3. Стерилизуют 20 мин при температуре (112 +/- 1) °C или по 20 мин три дня текучим паром.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 30 сут.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
Примечание - Среду Кларка применяют для постановки реакций с метиловым красным (метилротом) и Фогес-Проскауэра.
В 1 дм3 холодной дистиллированной воды растворяют 3,0 г дрожжевого сухого экстракта (или экстракта жидкого - 100,0 см3), нагревают, затем последовательно добавляют 5,0 г натрия хлорида, 1,0 г натрия гидрофосфата, 2,0 г L-фенилаланина (или DL-фенилаланин), 12,0 г агар-агара, кипятят до полного расплавления агара 5 - 10 мин, фильтруют через ватно-марлевый фильтр, устанавливают pH 7,0 - 7,2 и разливают по 5,0 см3 в пробирки. Стерилизуют 30 мин при температуре (112 +/- 1) °C и охлаждают в скошенном положении. Готовая среда не окрашена.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 30 сут.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
К стерильному расплавленному агару на бульоне Хоттингера или мартеновском бульоне (бульон Хоттингера или мартеновский бульон - 1000,0 см3, агар-агар - 15,0 г) с pH 6,9 - 7,0 добавляют 5,0 г глюкозы, 20,0 см3 раствора мочевины и 12,0 см3 индикатора бромтимолблау. Среду разливают в стерильные пробирки по 5,0 см3 и стерилизуют однократно текучим паром 20 мин.
Перед употреблением среду скашивают. Готовая среда имеет зеленовато-оливковый цвет.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 30 сут.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
В 1 дм3 дистиллированной воды добавляют 10,0 г казеинового пептона, 5,0 г говяжьего экстракта, 20,0 г маннита, 1,2 г глицина, 1,0 г Твин 80, 3,0 г пирувата натрия, 5,0 г дрожжевого экстракта, 5,0 г хлорида натрия, 5,0 г хлорида лития. Тщательно перемешивают и нагревают. Кипятят в течение 1 мин до полного растворения. Охлаждают до комнатной температуры и устанавливают pH так, чтобы после стерилизации он составлял (6,9 +/- 0,2) при температуре 25 °C. Разливают в пробирки по 9,0 см3. Стерилизуют автоклавированием при (121 +/- 1) °C в течение 15 мин. Охлаждают до температуры 45 °C - 50 °C и асептически добавляют 0,1 см3 1%-ного раствора теллурита калия в каждую пробирку. Поверх среды вносят по 5,0 см3 стерильного вазелинового масла по 7.1.25. Перед использованием пробирки со средой прогревают в водяной бане 15 мин при температуре 100 °C для удаления воздуха.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 7 сут.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке (бульон Жиолитти-Кантони одинарной концентрации).
Масло разливают по 20,0 - 50,0 см3 в пробирки или колбы и стерилизуют при температуре (121 +/- 1) °C в течение 20 мин.
Масло вазелиновое до использования хранят в темном месте при температуре (5 +/- 3) °C не более трех месяцев.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
7.1.27 Агар Фогеля-Джонсона
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
7.1.28 Среда N 10 для идентификации Staphylococcus aureus
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
7.1.29 Приготовление желточно-солевого агара
Желточно-солевой агар готовят на основе сухого питательного агара, или МПБ, или бульона Хоттингера.
При использовании МПБ к последнему добавляют 2,0% агар-агара и 6,5% хлористого натрия. При использовании бульона Хоттингера содержание аминного азота в нем должно составлять 150,0 мг, для получения солевого агара добавляют 2,0% агар-агара и 6,5% хлористого натрия.
В случае использования сухого питательного агара к последнему добавляют 6,5% хлористого натрия.
Солевой агар разливают во флаконы по 200,0 см3 и стерилизуют при (121 +/- 1) °C в течение 30 мин.
На 100,0 см3 расплавленного и остуженного до 45 °C солевого агара добавляют 20,0 см3 рабочего раствора желтка, размешивают и в условиях бокса разливают в чашки по 15 - 17 см3.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 14 сут.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
Приготовление рабочего раствора желтка осуществляют следующим образом.
На дно стерильной чашки помещают яйцо, которое предварительно тщательно протирают ватой, смоченной спиртом. Пинцетом пробивают с двух противоположных сторон яйца два отверстия. Через одно из этих отверстий из яйца полностью удаляют белок, а затем, несколько увеличив отверстие, выливают желток в стерильную банку с 5 - 6 бусинами. К желтку постепенно добавляют частями по 20,0 - 30,0 см3, 180,0 - 200,0 см3 стерильного изотонического раствора натрия хлорида. Затем содержимое тщательно встряхивают в течение 1 мин.
Непосредственно перед посевом к 1 дм3 расплавленного и охлажденного до температуры 60 °C - 70 °C мясо-пептонного агара, содержащего 65,0 г хлористого натрия, с pH (7,4 +/- 0,1), добавляют 100,0 см3 стерильного обезжиренного молока. Тщательно перемешивают и разливают в чашки Петри.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 3 сут.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
Печеночную воду - 250,0 см3, мясо-пептонный бульон с pH 7,0 - 750,0 см3, натрия хлорид - 1,25 г смешивают, устанавливают pH 7,6 - 7,8 и кипятят 15 мин. Среду фильтруют через бумажный фильтр. 100,0 г печени крупного рогатого скота режут на кусочки массой по 1,5 - 2 г и помещают в пробирки по 2 - 3 кусочка, заливают по 7,0 - 8,0 см3 бульона и добавляют по 0,5 см3 вазелинового масла по 7.1.25. Стерилизуют при температуре (121 +/- 1) °C в течение 30 мин.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 90 сут.
Коммерческую сухую среду готовят согласно указаниям на этикетке.
100,0 см3 3,0%-ного мясо-пептонного агара с 1,0% глюкозы расплавляют в водяной бане и добавляют 10,0 см3 20,0%-ного раствора сульфита натрия и 1,0 см3 раствора 8,0%-ного хлорного железа. Оба раствора готовят на стерильной дистиллированной воде. Среду после приготовления не стерилизуют.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 3 сут.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
7.1.33 Приготовление кровяного агара по Цейсслеру
К 3,0%-ному мясо-пептонному агару добавляют 1,0% - 2,0% глюкозы, устанавливают pH 7,0 - 7,2 и разливают во флаконы по 100,0 см3, стерилизуют при (112 +/- 1) °C в течение 30 мин. Перед употреблением к расплавленной и охлажденной до 45 °C среде добавляют 15,0% - 20,0% свежевзятой дифибринированной крови по 7.1.4. Среду разливают в чашки Петри.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 3 сут.
7.1.34 Приготовление молочной среды
Телячью печень разрезают на кусочки по 1,0 - 1,5 г и кипятят в тройном по весу количестве водопроводной воды 30 мин, затем промывают водопроводной водой, подсушивают фильтровальной бумагой, помещают в стерильные пробирки по 2 - 3 кусочка и сверху наливают по 8,0 - 10,0 см3 цельного молока. Стерилизуют текучим паром трижды по 20 мин ежедневно или при (112 +/- 1) °C в течение 15 мин однократно.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 30 сут.
Примечание - Вместо указанной печени допустимо добавление на каждую пробирку с 10,0 см3 стерильного цельного молока по 1,5 - 2 см3 стерильной сыворотки крови барана или быка. Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 3 сут.
7.1.35 Приготовление среды с углеводами для определения биохимических свойств клостридий
К полужидкой пептонной среде (1,0% пептона, 0,5% хлорида натрия, 0,5% агар-агара) с pH 7,4 после ее расплавления добавляют 0,5% нужного углевода (глюкоза, сахароза, маннит, глицерин, мальтоза, галактоза) и 1,0% фуксина кислого, перемешивают и разливают в пробирки по 10,0 - 12,0 см3. Стерилизуют при (112 +/- 1) °C 30 мин и хранят столбиками. Перед употреблением агар регенерируют в кипящей водяной бане в течение 30 мин, охлаждают до 50 °C.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 30 сут.
В 1 дм3 дистиллированной воды добавляют 5,0 г пептического перевара животной ткани, 3,0 г мясного экстракта, 120,0 г желатина. Подогревают до 50 °C и разливают в пробирки по 7,0 - 9,0 см3. Стерилизуют при температуре (121 +/- 1) °C в течение 15 мин. Конечное значение pH (6,8 +/- 0,2) при 25 °C.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 30 сут.
Коммерческую сухую среду готовят согласно указаниям на этикетке.
10,0 см3 пероксида водорода с содержанием основного вещества 30,0% (в случае, если пероксид водорода имеет другое содержание основного вещества, то сделать пересчет) переносят в мерную колбу вместимостью 100 см3, добавляют дистиллированную воду до метки.
Срок годности - не более 7 сут.
В 95,0 см3 спирта этилового 96° растворяют 1,0 г парадиметиламинобензальдегида, затем добавляют 20,0 см3 соляной кислоты концентрированной ( 1,18 - 1,19 г/см).
1,18 - 1,19 г/см).
Реактив хранят в закрытом темном флаконе с притертой пробкой при температуре (5 +/- 1) °C не более 30 сут.
Примечание - Для обнаружения индола в суточную бульонную культуру добавляют 1 - 2 см3 эфира, сильно встряхивают и осторожно по стенкам пробирки приливают 1,0 см3 реактива Эрлиха. Реакцию оценивают не позднее чем через 5 мин. Образование красного кольца - положительная реакция; желто-коричневого кольца - отрицательная реакция.
Коммерческий реактив подготавливают и используют согласно указаниям на этикетке.
В 30 см3 спирта этилового 96° растворяют 0,01 г метилового красного, затем добавляют 20 см3 воды дистиллированной и перемешивают.
Реактив хранят в закрытом темном флаконе с притертой пробкой при температуре (5 +/- 1) °C не более 30 сут.
Примечание - Для постановки реакции к 2,5 см3 двухсуточной культуры бактерий в среде Кларка добавляют 8 - 10 капель индикатора метилрота, пробирку встряхивают, после чего учитывают реакцию. Розовое окрашивание - положительная реакция; желтое окрашивание - отрицательная реакция, светло-оранжевое окрашивание - сомнительная реакция.
Коммерческий реактив подготавливают и используют согласно указаниям на этикетке.
Реактив 1: в 500,0 см3 растворяют 30,0 г  (C10H8O).
(C10H8O).
 (C10H8O).
(C10H8O).Реактив 2: в 300,0 см3 воды дистиллированной растворяют 120,0 г калия гидроокиси (KOH).
Реактивы хранят в закрытых темных флаконах с притертой пробкой при температуре (5 +/- 1) °C не более 30 сут.
Примечание - Для постановки реакции к 2,5 см3 двухсуточной культуры бактерий в среде Кларка добавляют вначале 1,0 см3 реактива 1, затем 0,4 см3 реактива 2; пробирку встряхивают; результат учитывают через 3 - 5 мин. Окрашивание в розовый цвет - положительная реакция; желтый цвет - отрицательная реакция, светло-оранжевый цвет - сомнительная реакция.
Коммерческие реактивы подготавливают и используют согласно указаниям на этикетке.
Приготовление насыщенного спиртового раствора фуксина.
8,0 - 9,0 г основного кристаллического фуксина вносят во флакон, добавляют 100,0 см3 этилового спирта 96° и помещают на 18 - 24 ч в термостат с температурой (37 +/- 1) °C. Содержимое флакона периодически перемешивают. В течение указанного времени значительная часть краски растворяется, и на дне флакона остается осадок, свидетельствующий о насыщении раствора.
Насыщенный раствор хранят во флаконах из темного стекла не более 30 сут.
Приготовление водно-спиртового раствора фуксина осуществляют следующим образом. Из насыщенного спиртового раствора готовят водно-спиртовой раствор фуксина. Для этого к 1,0 см3 насыщенного раствора добавляют 9,0 см3 дистиллированной воды.
Срок годности - 1 сут.
Приготовление карболового кристаллического фиолетового, генциан-фиолетового или метилового фиолетового для окраски по Граму осуществляют следующим образом.
1,0 г кристалл-, генциан- или метилвиолета гомогенизируют в ступке с 2,0 г кристаллической карболовой кислоты (фенола). Во время растирания небольшими порциями добавляют 10,0 см3 этилового спирта 96°. После того как краска полностью растворится, добавляют при постоянном помешивании 100,0 см3 дистиллированной воды. Раствор краски фильтруют через бумажный фильтр через сутки. Растворы нестойкие.
Хранят в темном прохладном месте. Срок годности - до 2 мес.
Приготовление раствора Люголя осуществляют следующим образом. В 10,0 см3 дистиллированной воды растворяют 2,0 г йодистого калия. Затем добавляют 1,0 г кристаллического йода. Раствор выдерживают 5 - 6 ч до полного растворения йода, после чего добавляют 290,0 см3 дистиллированной воды.
Хранят раствор во флаконах из темного стекла не более 30 сут.
Примечание - Можно использовать коммерческие наборы для окраски мазков по Граму.
К 90,0 см3 бульона из экстракта говяжьего сердца добавляют 10,0 см3 дрожжевого экстракта концентрацией 250 г/дм3, 5,0 см3 раствора фенолового красного концентрацией 0,6 г/дм3, доводят до кипения и кипятят в течение 10 мин. Среду разливают во флаконы и стерилизуют автоклавированием при температуре 121 °C в течение 15 мин.
Среду охлаждают до температуры 40 °C - 45 °C и добавляют 20,0 см3 стерильной лошадиной сыворотки, не подвергнутой нагреву и проверенной на контаминацию микоплазмами, 1,20 см3 стерильного раствора дезоксирибонуклеиновой кислоты концентрацией 2 г/дм3 и 0,25 см3 пенициллина с содержанием пенициллина 20000 МЕ/см3. Устанавливают pH 7,8 раствором едкого натра массовой концентрацией 10%. Готовую среду разливают по 10,0 см3 в стерильные пробирки.
Готовую среду до использования хранят при температуре (5 +/- 3) °C не более 7 сут.
Приготовление бульона экстракта говяжьего сердца осуществляют следующим образом. Смешивают 500 г говяжьего сердца, 10 г ферментативного пептона, 5 г хлорида натрия, доводят объем раствора дистиллированной водой до 1000 см3, стерилизуют автоклавированием в течение 15 мин при температуре 121 °C и фильтруют через ватно-марлевый фильтр.
К 200,0 см3 гидролизата бычьего сердца добавляют 400,0 см3 мясной воды или 13 г мясного экстракта (3,0 - 3,5% сухих веществ на 1 дм3 среды), 5,0 г экстракта хлебопекарных дрожжей (1,5 г сухих веществ на 1 дм3 среды); 5 г натрия хлорида; доводят объем среды до 1 дм3 водой очищенной. Среду перемешивают. Доводят pH среды до (8,1 +/- 0,1) 10%-ным раствором натрия гидроксида. Среду нагревают до кипения, кипятят 2 - 3 мин и фильтруют.
Среды разливают во флаконы и стерилизуют автоклавированием при температуре 110 °C в течение 30 мин. pH готовой среды (7,8 +/- 0,1).
Питательную среду охлаждают до температуры 40 °C - 45 °C и добавляют 15% - 20% нормальной сыворотки крови лошади без консерванта, 1% стерильного раствора аргинина, 1% стерильного раствора глюкозы. При необходимости вносят в питательную среду раствор фенолового красного 5,0 см3 в дозе 0,6 г/дм3. Готовую среду разливают по 10,0 см3 в пробирки и хранят при температуре (5 +/- 3) °C не более 7 сут.
К 90,0 см3 бульона из экстракта говяжьего сердца добавляют 2,0 см3 раствора моногидрата глюкозы концентрацией 500 г/дм3, 12,0 см3 свиной сыворотки, инактивированной при 56 °C в течение 30 мин, 5,0 см3 раствора фенолового красного концентрацией 0,6 г/дм3. Стерилизуют автоклавированием при температуре 121 °C в течение 15 мин, охлаждают до температуры 40 °C - 45 °C, а затем добавляют 0,25 см3 пенициллина (20000 МЕ/см3), 0,025 см3 смеси витаминов, 1,0 см3 раствора никотинамидадениндинуклеотида концентрацией 10 г/см3 и 1,0 см3 раствора цистеина гидрохлорида концентрацией 10 г/дм3. Значение pH среды доводят до 7,8 добавлением стерильного раствора едкого натра массовой концентрацией 10%. Готовую среду разливают по 10,0 см3 в стерильные пробирки.
Готовую среду до использования хранят при температуре (5 +/- 3) °C не более 7 сут.
Приготовление смеси витаминов осуществляют следующим образом. Берут 100 мг биотина, 100 мг пантотената кальция, 100 мг хлорида холина, 100 мг фолиевой кислоты, 200 мг инозита, 100 мг никотинамида, 100 мг гидрохлорида пиридоксина, 10 мг рибофлавина, 100 мг гидрохлорида тиамина, смешивают в стерильных условиях и доводят объем раствора стерильной дистиллированной водой до 1000 см3. Готовую смесь стерилизуют автоклавированием в течение 10 - 15 мин при 110 °C.
Срок хранения смеси витаминов в защищенном от света месте при комнатной температуре - не более 1 мес.
7.1.45 Среда Фриса (для обнаружения не птичьих микоплазм)
Для приготовления жидкой среды Фриса берут 800 см3 сбалансированного модифицированного солевого раствора Хенкса, 67 см3 дистиллированной воды, 135 см3 экстракта из сердца и мозгов, 248 см3 бульона PPLO, 60 см3 дрожжевого экстракта концентрацией 170 г/дм3, 250 мг бацитрацина, 250 мг метициллина, 4,5 см3 фенолового красного концентрацией 5 г/дм3. Среду стерилизуют автоклавированием при температуре 121 °C в течение 15 мин, затем охлаждают до температуры 40 °C - 45 °C, значение pH доводят до 7,40 - 7,45 и добавляют стерильно 165 см3 лошадиной сыворотки, 165 см3 свиной сыворотки, проверенных на контаминацию микоплазмами.
Готовую среду разливают по 10,0 см3 в стерильные пробирки.
Готовую среду до использования хранят при температуре (5 +/- 3) °C не более 7 сут.
Приготовление сбалансированного солевого раствора Хэнкса (модифицированного) осуществляют следующим образом. Берут 6,4 г хлорида натрия, 0,32 г хлорида калия, 0,08 г сульфата магния, 0,08 г хлорида магния, 0,112 г безводного хлорида кальция, 0,0596 г гидрофосфата дигидрата натрия, 0,0048 г безводного дигидрофосфата калия и доводят объем раствора дистиллированной водой до 800 см3. Стерилизуют через мембранный фильтр с размером пор 0,22 мкм.
С соблюдением правил асептики добавляют компоненты в следующих пропорциях: 65% стерильного бульона из триптического перевара сердца крупного рогатого скота; 20% стерильной сыворотки крови лошадей, инактивированной при 56 °C в течение 30 мин; 10% стерильного 25%-ного дрожжевого экстракта; 5% стерильной молочной сыворотки, инактивированной при 56 °C в течение 30 мин; 0,5% стерильного хлористого натрия; 0,5% стерильного 40%-ного раствора глюкозы; 0,002% стерильного фенолового красного; раствор ацетата таллия в конечной концентрации 1:2000; раствор пенициллина из расчета 1000 ЕД/см3 питательной среды. Готовую среду разливают по 10,0 см3 в стерильные пробирки. pH готовой среды 8,0.
Готовую среду до использования хранят при температуре (5 +/- 3) °C не более 7 сут.
Для приготовления жидкой питательной среды смешивают равные объемы пептона Мартена и мясной воды. Двунормальным раствором соляной кислоты pH доводят до 5,8 - 6,0, жидкую среду разливают в колбы по 200 - 400 см3 и стерилизуют 30 мин при температуре 120 °C. Перед употреблением на 100 см3 бульона добавляют 20 см3 неинактивированной сыворотки крови лошади, 10 см3 дрожжевого экстракта (pH 6,0), 6 см3 25%-ного водного раствора мочевины и 0,3 см3 0,5%-ного раствора фенолового красного. Для подавления роста сопутствующей микрофлоры при выделении уреаплазм в питательную среду вносят пенициллин (1000 ЕД). Раствор мочевины стерилизуют через мембранный фильтр с размером пор 0,22 мкм. Готовую среду разливают по 10,0 см3 в стерильные пробирки.
Готовую среду до использования хранят при температуре (5 +/- 3) °C не более 7 сут.
Для подавления сопутствующей микрофлоры в питательные среды, используемые для первичного выделения грибов, после стерилизации добавляют антибиотики: пенициллин - 50 ЕД и стрептомицин - 100 ЕД на 1,0 см3 среды, имеющей температуру (45 +/- 1) °C.
Неохмеленное пивное сусло (промежуточный продукт производства пива), содержащее 12,0% - 14,0% сахаров, фильтруют через тонкий слой ваты или 3 - 4 слоя марли, разбавляют водой в пропорциях 1:2 или 1:3 до 3° - 7° по ареометру Баллинга, затем добавляют 2,0% агар-агара, устанавливают pH 6,0 - 6,8. Среду стерилизуют при (112 +/- 1) °C в течение 10 - 20 мин.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 30 сут.
В 500,0 см3 воды добавляют 40,0 г кукурузной муки и выдерживают при 65 °C в течение 1 ч, после чего настой фильтруют через бумажный фильтр. 20,0 г агар-агара растворяют в 500,0 см3 воды, дистиллированной при кипячении. Обе части растворов смешивают и фильтруют через ватно-марлевый фильтр. Среду стерилизуют 15 мин при (121 +/- 1) °C.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 30 сут.
В дистиллированную воду добавляют 1,0% пептона, 0,5% поваренной соли и 2 - 3 капли 0,05%-ного раствора бромтимолового синего.
Примечание - Синяя окраска индикатора при pH 7,6 переходит в желтую при pH 6,0 и ниже. Для растворения бромтимолового синего можно использовать 20%-ный этанол или дистиллированную воду с добавлением 3,2 см3 0,05 N раствора едкого натра на 100,0 мг индикатора.
Среду в количестве 4,5 см3 разливают в пробирки, предварительно поместив в них стеклянные "поплавки". Среду стерилизуют при температуре (112 +/- 1) °C в течение 15 - 20 мин.
Концентрированные 20%-ные растворы глюкозы, лактозы, сахарозы, мальтозы стерилизуют через мембранный фильтр с размером пор 0,22 мкм и добавляют по 0,5 см3 к стерильной пептонной воде, так чтобы конечная концентрация углевода в пробирке было равна 2%.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 30 сут.
В 1 дм3 дистиллированной воды растворяют 40,0 г глюкозы (мальтозы или декстрозы), 10,0 г пептона. Среду стерилизуют в колбах при температуре (121 +/- 1) °C в течение 15 мин. Для приготовления агаризированной среды добавляют 18,0 г агар-агара.
Перед использованием среду в колбах расплавляют на водяной бане и стерильно разливают по 15,0 - 20,0 см3 в чашки Петри.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 30 сут.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
В 1 дм3 дистиллированной воды растворяют 10,0 г пептона, 1,0 г дрожжевого экстракта, 40,0 г глюкозы, 15,0 г агар-агара, 1,0 г 2,3,5-трифенилтетразолхлорида; среду кипятят, разливают в колбы и стерилизуют при температуре (121 +/- 1) °C в течение 20 - 40 мин. Готовая среда должна иметь pH 6,0 - 6,2.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 30 сут.
7.2.6 Приготовление агара Литмана
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
В 1 дм3 дистиллированной воды растворяют 30,0 г сахарозы, 3,0 г натрия азотнокислого, 1,0 г калия фосфорнокислого одноосновного, 0,5 г калия хлористого, 0,5 г магния сернокислого, 0,01 г железа сернокислого, 15,0 - 20,0 г агар-агара.
Среду разливают в колбы и стерилизуют при температуре (121 +/- 1) °C в течение 15 мин. Перед использованием среду в колбах расплавляют на водяной бане и стерильно разливают по 15,0 - 20,0 см3 в чашки Петри.
Готовую среду до использования хранят в темном месте при температуре (5 +/- 3) °C не более 14 сут.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
7.2.9 Солодовый агар
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
7.2.10 Микологический агар Киммига
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
7.2.11 Агар с бенгальским розовым и хлортетрациклином
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
Коммерческую сухую среду готовят в соответствии с указаниями на этикетке.
7.3.1.1 Сущность метода
Сущность метода заключается в приготовлении суспензии с равномерным, насколько это возможно, распределением микроорганизмов, содержащихся в сперме.
Ряд десятикратных разведений готовят с целью сокращения количества микроорганизмов в единице объема, чтобы после инкубации установить наличие роста бактерий или произвести подсчет колоний, как установлено в стандарте.
7.3.1.2 Подготовка проб к исследованиям
Из сосуда Дьюара с помощью корнцанга вынимают соломинки с замороженной спермой и погружают их в водяную баню при температуре (37 +/- 1) °C на 10 с, затем вынимают и протирают насухо салфеткой марлевой и обрабатывают ватным тампоном, смоченным 70%-ным спиртом-ректификатом. Стерильным пинцетом придерживают один конец пайеты, а другой конец срезают стерильными ножницами и выливают содержимое в стерильную сухую пробирку.
Колпачки флаконов (пробирок, колбочек) со свежеполученной неразбавленной и свежеполученной разбавленной спермой обрабатывают ватным тампоном, смоченным 70%-ным спиртом-ректификатом.
7.3.1.3 Приготовление разведений
Свежеполученную неразбавленную и свежеполученную разбавленную сперму перемешивают путем пятикратного медленного переворачивания флакона.
Разведения спермы для посевов готовят следующим образом: к 4,5 или 9,0 см3 стерильного 0,9%-ного раствора хлористого натрия добавляют соответственно 0,5 или 1,0 см3 спермы свежеполученной неразбавленной, свежеполученной разбавленной или замороженной после оттаивания. Тщательно перемешивают и готовят десятикратные разведения от 1:10 до 1:1000.
Для оптимальной точности пипетку вводят в эякулят не более чем на 1,0 см. Избегают какого-либо соприкосновения пипетки, содержащей инокулят, со стерильным 0,9%-ным раствором хлористого натрия.
При разведении спермы можно пользоваться одной стерильной пипеткой. Инокулят набирают резиновой грушей или пипетатором для пипеток и тщательно (не менее трех раз) промывают пипетку раствором из той пробирки, в которую перенесли суспензию. Если эти требования не могут быть выполнены, то для каждого разведения берут новую стерильную пипетку.
Следует учитывать, что приготовление разведений с использованием одной пипетки может привести в отдельных случаях к завышению показателей вследствие адсорбции микроорганизмов на стенках пипетки. В результате адсорбированные микроорганизмы могут попадать в пробирку с более высоким разведением.
Между окончанием приготовления десятикратных разведений и внесением их в питательную среду должно проходить не более 30 мин.
7.3.2 Определение общего количества микробных клеток (общего микробного числа) в 1 см3 спермы
7.3.2.1 Сущность метода
Сущность метода заключается в определении общего количества микробных клеток в 1,0 см3 спермы, способных образовывать на питательном агаре колонии, видимые невооруженным глазом и при увеличении в два раза после инкубации при температуре (37 +/- 1) °C в течение 48 ч.
7.3.2.2 Проведение исследования
Для количественного учета КОЕ в 1,0 см3 спермы в две параллельные стерильные бактериологические чашки Петри вносят по 1,0 см3 из разведений 1:10, 1:100, 1:1000, приготовленных по 7.3.1, и добавляют 15,0 см3 стерильного, расплавленного и охлажденного до температуры 44 °C - 45 °C мясо-пептонного агара с 1% глюкозы по 7.1.3. Осторожно покачивая чашки, засеянный материал равномерно распределяют в агаре. Для контроля стерильности разливают 15,0 см3 мясо-пептонного агара с 1% глюкозы в чашку Петри без разведений эякулята. После застывания среды чашки Петри инкубируют в течение 44 - 48 ч при температуре (37 +/- 1,0) °C.
7.3.2.3 Обработка результатов
Количество выросших колоний подсчитывают в каждой чашке, поместив их вверх дном на темном фоне. При подсчете пользуются лупой или прибором для счета колоний.
При небольшом количестве выросших колоний подсчитывают их на всей площади чашки. Подсчитанные колонии отмечают на чашке восковым карандашом или чернилами. При сравнительно большом росте микробов дно чашки делят карандашом на секторы (2, 4, 8) и подсчитывают число колоний отдельно в каждом секторе. Полученные числа складывают. При равномерном распределении колоний можно ограничиться подсчетом на 1/2 или 1/4 площади чашки. Полученные числа умножают на 2 или 4, соответственно.
Подсчет большого числа колоний (до 600) на чашках Петри проводят, используя счетную камеру Вольфгюгеля. В счетной камере подсчитывают число колоний в 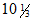 - 12 квадратах в разных частях чашки, суммируют и определяют среднее арифметическое из числа колоний, приходящееся на один квадрат (т.е. 1,0 см2). Пересчитывают количество колоний на всю площадь чашки Петри.
- 12 квадратах в разных частях чашки, суммируют и определяют среднее арифметическое из числа колоний, приходящееся на один квадрат (т.е. 1,0 см2). Пересчитывают количество колоний на всю площадь чашки Петри.
Пример
На чашке в 10 квадратах счетной камеры Вольфгюгеля выросло 90 колоний. Среднее арифметическое на один квадрат равно 9. Площадь чашки при диаметре 10 см равна  , или 3,14·52 = 78,5 см2. Следовательно, на всей чашке выросло 9·78,5 = 706 колоний.
, или 3,14·52 = 78,5 см2. Следовательно, на всей чашке выросло 9·78,5 = 706 колоний.
По результатам подсчета вычисляют среднее арифметическое значение числа колоний из всех посевов одного разведения. Полученные результаты округляют до целых чисел.
Общее количество микробных клеток в 1,0 см3 спермы C определяют следующим образом: результаты, полученные при вычислении средних арифметических значений числа колоний, умножают на разведения, суммируют и делят на количество разведений.
 , (1)
, (1)где  - вычисленное среднее арифметическое значений числа колоний на чашках с разведением спермы 1:10;
- вычисленное среднее арифметическое значений числа колоний на чашках с разведением спермы 1:10;
N - количество разведений.
Результат округляют до целого числа и выражают в КОЕ/см3.
Пример
В чашках с разведением спермы 1:10 подсчитано 106 и 126 колоний, в чашках с разведением спермы 1:100 подсчитано 9 и 13 колоний, в чашках с разведением спермы 1:1000 подсчитано 1 и 2 колонии. Следовательно, 1 см3 спермы содержит
 .
.Выполнив вычисления, получаем значение общего количества микробных клеток, равное 1420 КОЕ/см3.
Санитарная оценка качества спермы: в зависимости от количества микроорганизмов в 1,0 см3 спермы и коли-титра различают пять степеней чистоты спермы в соответствии с показателями, указанными в таблице 3.
7.3.3 Определение коли-титра (коли-индекса) спермы
7.3.3.1 Сущность метода
Сущность метода заключается в сбраживании микробами углеводов - маннита, глюкозы, лактозы (в зависимости от используемой среды) - в течение 24 ч инкубации при температуре (43 +/- 1) °C, которое сопровождается выделением газа и изменением цвета среды/помутнением.
Количество кишечной палочки, обнаруженной в сперме, выражают в виде коли-титра (титр кишечной палочки) или коли-индекса.
Коли-титр можно перевести в коли-индекс и наоборот. Для перевода коли-титра в коли-индекс единицу делят на объем, выражающий коли-титр. Для перевода коли-индекса в коли-титр необходимо единицу разделить на число, выражающее коли-индекс.
Пример
При коли-титре, равном 0,01 см3, коли-индекс равен 100 (в 1 см3 содержится 100 кишечных палочек).
7.3.3.2 Проведение исследования
Коли-титр определяют методом бродильных проб при посеве на одну из сред: Булира, Эйкмана (глюкозо-пептонная среда), типа Эйкмана (лактозо-пептонная среда) по 7.1.6 - 7.1.8. Для этого в три пробирки, содержащие по 5,0 - 7,0 см3 одной из сред, высевают по 1,0 см3 из одного разведения или из различных разведений спермы в пропорции 1:10, 1:100, 1:1000. Если в пробе необходимо определить коли-титр и общее количество бактерий, то высев можно производить одновременно одной пипеткой.
Пробирки с посевом выдерживают в термостате при температуре (43 +/- 1) °C в течение 18 - 24 ч. В результате осмотра пробирок устанавливают бродильный титр.
При отсутствии изменения цвета/помутнения среды и газообразования реакцию считают отрицательной. При изменении цвета среды/помутнении и газообразовании (пузырек в газовке) реакцию считают положительной.
При наличии положительной реакции на бродильный титр проводят исследование на идентификацию кишечной палочки. Для этого из пробирок с измененным цветом/помутнением среды и газообразованием производят посев на среду Эндо по 7.1.12 с таким расчетом, чтобы получить изолированные колонии.
Перед посевом дно чашки со средой Эндо делят на сектора для каждого разведения. Из каждой пробирки петлей высевают минимальное количество материала на отдельный сектор в виде густо пересекающихся штрихов. Чашки с посевами инкубируют 18 - 24 ч при температуре (37 +/- 1,0) °C.
При отсутствии роста на среде Эндо колоний, типичных для бактерий группы кишечной палочки, сперму считают не загрязненной микроорганизмами этого вида.
При появлении на среде Эндо колоний, типичных для бактерий группы кишечной палочки (красных, нередко с металлическим блеском, розовых, бледно-розовых), а также бесцветных колоний проводят их изучение.
Из изолированных колоний, характерных для бактерий группы кишечной палочки, приготавливают препараты, которые окрашивают по Граму и микроскопируют.
При окраске используют растворы красок, приготовленные по 7.1.41. На мазок культуры, фиксированной на огне, помещают полоску фильтровальной бумаги и наливают карболовый генцианвиолет. Выдерживают 1 - 2 мин, после чего снимают фильтровальную бумажку, сливают краску, мазок промывают водой и наливают на него раствор Люголя. Через 1 - 2 мин раствор сливают и наливают этиловый спирт на 20 - 30 с. Затем мазок промывают водой и дополнительно окрашивают водным фуксином в течение 1 - 2 мин. Затем промывают водой, просушивают мазок фильтровальной бумагой и микроскопируют с иммерсионной системой. Микробы, окрашенные по Граму в темно-фиолетовый цвет, - грамположительные; микробы, окрашенные в красный цвет, - грамотрицательные.
Кишечная палочка - мелкая грамотрицательная палочка с закругленными концами, не образующая спор, может быть биполярно окрашена.
Для колоний, характерных для кишечной палочки, ставят вторую бродильную пробу, производя высев в пробирки с одной из сред: Булира, Эйкмана (глюкозо-пептонная среда), типа Эйкмана (лактозо-пептонная среда) по 7.1.6 - 7.1.8 с последующим инкубированием при температуре (43 +/- 1) °C в течение 18 - 24 ч. При наличии видимых признаков роста бактерий без газообразования - отрицательный результат. При изменении цвета среды/помутнении и газообразовании (газ в газовке) - результат положительный.
7.3.3.4 Обработка результатов
При посеве в три пробирки со средой, содержащей углеводы из одного и того же разведения спермы, коли-титр устанавливают по таблице 1.
Таблица 1
Коли-титр при посеве одного и того же разведения спермы
Варианты опыта | Разведение спермы | Коли-титр, см3 | ||
0,1 | 0,1 | 0,1 | ||
А | - | - | - | Св. 0,3 |
Б | + | - | - | 0,3 |
В | + | + | - | Менее 0,3 |
Г | + | + | + | Менее 0,3 |
Примечание - "+" - кишечная палочка обнаружена, "-" - кишечная палочка не обнаружена. | ||||
При посеве в три пробирки со средой, содержащей углеводы из разных разведений спермы, коли-титр устанавливают по таблице 2.
Таблица 2
Коли-титр при посеве разных разведений спермы
Варианты опыта | Разведение спермы | Коли-титр, см3 | ||
0,1 | 0,01 | 0,001 | ||
А | - | - | - | Св. 0,111 |
Б | + | - | - | 0,1 |
В | + | + | - | 0,01 |
Г | + | + | + | Менее 0,001 |
Примечание - "+" - кишечная палочка обнаружена, "-" - кишечная палочка не обнаружена. | ||||
В зависимости от количества микроорганизмов в 1,0 см3 спермы и коли-титра различают пять степеней чистоты спермы в соответствии с показателями, указанными в таблице 3.
Таблица 3
Степень чистоты спермы | Количество микробных тел в 1 см3 | Коли-титр, см3 | Санитарная оценка качества спермы |
I | - | Св. 0,1 или 0,3 | Стерильна |
II | До 100 | 0,1 или 0,3 | Незначительно загрязнена |
III | До 2000 | 0,1 или 0,3 | Слабо загрязнена |
IV | До 5000 | 0,1 или 0,3 | Средне загрязнена |
V | Св. 5000 | 0,01 или менее 0,3 | Сильно загрязнена |
7.3.4 Исследование на наличие колиформных бактерий родов Escherichia, Enterobacter, Citrobacter, Klebsiella
7.3.4.1 Сущность метода
Сущность метода заключается в выделении колиформных бактерий с последующим подтверждением по микроскопическим, биохимическим и культуральным признакам принадлежности выделенных типичных колоний к бактериям семейства Enterobacteriaceae, дифференциацией бактерий до рода и вида и определения патогенности выделенных культур в биологической пробе на белых мышах.
7.3.4.2 Проведение исследования
В пробирку, содержащую 5,0 - 7,0 см3 одной из сред: Кода, Кесслер или МакКонки по 7.1.9 - 7.1.11, с помощью пипетки высевают 1,0 см3 спермы, разведенной в пропорции 1:10 0,9%-ным стерильным раствором натрия хлорида. Посев инкубируют при температуре (37 +/- 1) °C в течение 18 - 24 ч.
После инкубирования пробирки с посевами просматривают. Отсутствие изменения цвета, помутнения среды и газообразования свидетельствует об отсутствии в пробе спермы колиформных бактерий.
При изменении цвета среды (пожелтение, помутнение) и/или газообразовании (пузырек в газовке) производят посев на одну из дифференциально-диагностических сред для энтеробактерий: Эндо, Левина, Агар МакКонки по 7.1.12 - 7.1.14 с таким расчетом, чтобы получить изолированные колонии. Чашки с посевами инкубируют при температуре (37 +/- 1) °C. Через 18 - 24 ч чашки просматривают и оценивают колонии по характеру роста на принадлежность к родам Escherichia, Enterobacter, Citrobacter, Klebsiella.
Две-три типичные колонии энтеробактерий пересевают на скошенный мясо-пептонный агар по 7.1.2 и инкубируют при температуре (37 +/- 1) °C в течение 18 - 24 ч.
Подтверждение принадлежности микроорганизмов к родам Escherichia, Enterobacter, Citrobacter, Klebsiella осуществляют следующим образом. Из суточных культур бактерий со скошенного агара готовят мазки, окрашивают по Граму по 7.3.3.3 и микроскопируют. При наличии в мазках из культур однородных мелких грамотрицательных палочек, не образующих спор и капсул, изучают их ферментативные свойства и определяют их подвижность.
Ферментативные свойства изучают у двух-трех агаровых культур бактерий, выделенных из спермы. Для этого агаровые культуры высевают на мясо-пептонный агар, мясо-пептонный бульон и комбинированные среды Олькеницкого или Клиглера, цитратный агар Симмонса, ПЖА, среду Кларка по 7.1.2, 7.1.15 - 7.1.19. Засеянные пробирки инкубируют при температуре (37 +/- 1) °C. Ферментативные свойства культур предварительно учитывают через 24 ч, окончательно - через 48 ч. Изучение ферментативных свойств выделенных культур можно проводить также с помощью коммерческих наборов для биохимической идентификации энтеробактерий согласно инструкциям по применению производителя или по нормативным правовым актам, действующим на территории государства, принявшего настоящий стандарт. Родовую и видовую принадлежность культур устанавливают по ферментативным и биохимическим свойствам (см. таблицу 4).
При использовании комбинированной среды Олькеницкого или Клиглера учитывают изменения, вызываемые представителями разных родов энтеробактерий в этой среде, после чего данную культуру изучают по другим необходимым биохимическим тестам.
Для определения индола используют 1 - 2-суточную бульонную культуру и реактив Эрлиха по 7.1.38 или тест-полоски, пропитанные реактивом Ковача.
Для постановки реакции с метилротом и реакции Фогес-Проскауэра используют культуру, полученную на среде Кларка по 7.1.39, 7.1.40.
Подвижность энтеробактерий определяют на среде ПЖА по 7.1.18. Диффузный рост после 18 - 24 ч инкубирования при температуре (37 +/- 1) °C свидетельствует о подвижности микроорганизма.
Патогенные свойства определяют у культур бактерий, относящихся к родам Escherichia, Enterobacter, Citrobacter, Klebsiella в биопробе на белых мышах.
Таблица 4
по биохимическим свойствам
Тесты | Роды и виды бактерий | ||||||
Escherichia coli | Citrobacter | Enterobacter | Klebsiella pneumoniae | ||||
freundii | diversus | amalonaticus | aerogenes | cloacae | |||
Основные | |||||||
Глюкоза | + | + | + | + | + | + | + |
Лактоза | + | +/- | +/- | +/- | + | + | + |
Рост на агаре Симонса | - | + | + | +/- | + | + | + |
Образование индола | + | - | + | + | - | - | +/- |
Образование сероводорода | - | + | - | - | - | - | - |
Расщепление мочевины | - | +/- | + | +/- | - | + | + |
Дополнительные | |||||||
Реакция с метилротом | + | + | + | + | - | - | +/- |
Реакция Фогес-Проскауэра | - | - | - | - | + | + | +/- |
Подвижность | +/- | + | + | + | + | + | - |
Примечание - "+" - ферментация сахара (КГ), образование индола и т.д., "-" - отсутствие ферментации сахара, образования индола и т.д., "+/-" - различные показатели у разных штаммов. | |||||||
Для определения патогенных свойств бактерий используют две-три агаровые культуры выделенных микроорганизмов. С каждой из суточных агаровых культур одного вида бактерий готовят смывы стерильным физиологическим раствором, устанавливают взвесь бактерий в концентрации 1·109 клеток см3 (10 МЕ по ОСО мутности), после чего их смешивают в равной пропорции. Приготовленной взвесью культур бактерий в дозе 0,5 см3 заражают внутрибрюшинно три белые мыши массой 14 - 16 г. Культуру признают патогенной в случае гибели двух и более мышей в течение 3 сут после заражения. Наблюдение за зараженными белыми мышами продолжают в течение 5 сут.
Из крови сердца, печени, головного мозга павших белых мышей делают высевы на МПА, МПБ, Эндо; посевы инкубируют при (37 +/- 1) °C в течение 18 - 24 ч. При выделении чистой исходной культуры колиформных бактерий от павших белых мышей биопробу считают положительной.
С целью подбора противомикробных препаратов для санации спермы определяют чувствительность выделенных культур к антибиотикам согласно документам, действующим на территории государства, принявшей стандарт.
7.3.4.3 Обработка результатов
При выделении культур колиформных бактерий родов Escherichia, Enterobacter, Citrobacter, Klebsiella, патогенных для белых мышей при внутрибрюшинном заражении пробу спермы признают контаминированной патогенными штаммами заражаемой культуры.
При выделении культур колиформных бактерий родов Escherichia, Enterobacter, Citrobacter, Klebsiella, не вызывающих гибель белых мышей при внутрибрюшинном заражении, пробу спермы признают контаминированной непатогенными штаммами колиформных бактерий.
7.3.5 Исследование на наличие бактерий рода Proteus
7.3.5.1 Сущность метода
Сущность метода заключается в посеве спермы по методу Шукевича, подтверждении принадлежности выделенных микроорганизмов к бактериям рода Proteus с последующей идентификацией бактерий до вида и определении патогенности выделенных культур в биологической пробе на белых мышах.
7.3.5.2 Проведение исследования
С помощью стерильной пипетки 1 - 2 капли исследуемой спермы вносят в конденсационную воду пробирок со свежескошенным питательным агаром по 7.1.2, не касаясь поверхности среды. Пробирки с посевами инкубируют при температуре (37 +/- 1,0) °C. Предварительный учет результатов проводят через (24 +/- 2) ч, окончательный - через (48 +/- 2) ч инкубирования. После инкубирования пробирки с посевами просматривают.
Бактерии рода Proteus из конденсационной жидкости растут вверх по всей поверхности среды с образованием ползучего вуалеобразного налета с голубым оттенком.
Для подтверждения принадлежности выделенных микроорганизмов с характерными культуральными свойствами к бактериям рода Proteus определяют их способность ферментировать глюкозу и сахарозу, дезаминировать фенилаланин, расщеплять мочевину, подвижность, отношение бактерий к окраске по Граму и их морфологию.
Окраску по Граму и микроскопирование осуществляют следующим образом. Из выделенных культур готовят мазки, окрашивают по Граму по 7.3.3.3 и микроскопируют.
При микроскопии бактерии рода Proteus представляют собой полиморфные грамотрицательные палочки, не образующие спор и капсул; подвижные (перетрихи).
Для определения ферментации глюкозы, лактозы, образования сероводорода и гидролиза мочевины культуры высевают на скошенный трехсахарный агар с мочевиной (по Олькеницкому) или Агар Клиглера и среду с мочевиной (по Преусу) по 7.1.15, 7.1.16, 7.1.21.
Посевы инкубируют при температуре (37 +/- 1,0) °C. Предварительный учет результатов проводят через (24 +/- 2) ч, окончательный - через (48 +/- 2) ч.
Бактерии рода Proteus ферментируют глюкозу с образованием кислоты и газа, лактозотрицательны, некоторые виды образуют сероводород.
Для определения дезаминирования фенилаланина суточную чистую культуру высевают в пробирку со скошенной средой для расщепления фенилаланина по 7.1.20. Посевы инкубируют при температуре (37 +/- 1,0) °C в течение (48 +/- 2) ч. Затем на поверхность агара с выросшей культурой наносят 3 - 5 капель раствора 8% - 10%-ного раствора треххлорного железа.
Появление интенсивной зеленой окраски среды свидетельствует о дезаминировании фенилаланина - положительная реакция. При отрицательной реакции цвет среды не меняется.
Бактерии рода Proteus дезаминируют фенилаланин.
Лактозоотрицательные культуры энтеробактерий, дезаминирующие фенилаланин, проявляющие характерные культуральные свойства (ползучий вуалеобразный рост) относят к бактериям рода Proteus и идентифицируют до вида.
Для определения утилизации цитрата суточную чистую культуру высевают в пробирку со скошенной средой Симмонса по 7.1.17. Посевы инкубируют при температуре (37 +/- 1,0) °C в течение (24 +/- 2) ч. Изменение цвета среды после термостатирования указывает на усвоение цитрата - положительная реакция. При отрицательной реакции цвет среды не меняется.
Для определения индола используют 1 - 2-суточную бульонную культуру и реактив Эрлиха по 7.1.38 или тест-полоски, пропитанные реактивом Ковача.
В таблице 5 приведены биохимические свойства различных видов бактерий рода Proteus.
Таблица 5
Биохимические свойства видов бактерий рода Proteus
Вид бактерий | Подвижность | Глюкоза | Лактоза | Фенилаланин | Сероводород | Индол | Цитрат |
Proteus vulgaris | + | к/г | - | + | + | + | +/- |
Proteus mirabilis | + | к/г | - | + | + | - | + |
Proteus myxofaciens | + | к/г | - | + | - | - | + |
Proteus penneri | + | к/г | - | + | +/- | - | - |
Примечание - "+" - ферментация сахара (КГ), образование индола, дезаминирование фенилаланина, утилизации цитрата и т.д., "-" - отсутствие ферментации сахара, образования индола, утилизации цитрата и т.д., "+/-" - различные показатели у разных штаммов. | |||||||
Изучение ферментативных свойств выделенных культур бактерий рода Proteus можно проводить также с помощью коммерческих наборов для биохимической идентификации энтеробактерий, согласно инструкциям по применению производителя или нормативным правовым актам, действующим на территории государства, принявшего настоящий стандарт.
Патогенные свойства определяют у культур бактерий, относящихся к родам Proteus, в биопробе на белых мышах.
Для определения патогенных свойств бактерий используют 18 - 24 ч агаровые культуры. Из культур одного вида бактерий готовят смывы 0,9%-ным стерильным раствором хлорида натрия, устанавливают взвесь бактерий в концентрации 1·109 клеток/см3 (10 МЕ по ОСО мутности). Приготовленной взвесью культур бактерий в дозе 0,5 см3 заражают внутрибрюшинно три белые мыши массой 14 - 16 г.
Культуру признают патогенной в случае гибели двух и более мышей в течение 3 сут после заражения. Наблюдение за зараженными белыми мышами продолжают в течение 5 сут.
Из крови сердца, печени, головного мозга павших белых мышей делают высевы на МПА, МПБ, Эндо, посевы инкубируют при (37 +/- 1) °C в течение 18 - 24 ч. При выделении чистой исходной культуры бактерий рода Proteus биопробу считают положительной.
С целью подбора противомикробных препаратов для санации спермы определяют чувствительности выделенных культур к антибиотикам согласно документам, действующим на территории государства, принявшей стандарт.
7.3.5.3 Обработка результатов
При выделении культур бактерий рода Proteus, патогенных для белых мышей при внутрибрюшинном заражении, пробу спермы признают контаминированной патогенными штаммами заражаемой культуры.
При выделении культур бактерий рода Proteus, не вызывающих гибель белых мышей при внутрибрюшинном заражении, пробу спермы признают контаминированной непатогенными штаммами бактерий рода Proteus.
7.3.6 Исследование на наличие синегнойной палочки Pseudomonas aeruginosa
7.3.6.1 Сущность метода
Сущность метода заключается в выделении культур с последующим подтверждением по микроскопическим, биохимическим и культуральным признакам принадлежности к бактериям вида Pseudomonas aeruginosa; определении патогенности выделенных культур в биологической пробе на белых мышах.
К бактериям вида Pseudomonas aeruginosa относят аэробные, не образующие спор грамотрицательные оксидазоположительные палочки, образующие пигмент пиоционин, вызывающие гемолиз эритроцитов.
7.3.6.2 Проведение исследования
Для выделения синегнойной палочки с помощью стерильной пипетки 2 - 3 капли спермы высевают на мясо-пептонный бульон с 1% - 2% сахара (глюкозы, лактозы) по 7.1.3 и инкубируют посевы в течение 6 - 7 сут в термостате при температуре (37 +/- 1,0) °C, проверяя рост каждые 1 - 2 сут. О наличии роста синегнойной палочки судят по изменению цвета бульона в зеленовато-голубой.
При наличии роста синегнойной палочки делают пересев с бульона на селективную среду ЦПХ-агар или ХайФлюоро агар по 7.1.22, 7.1.23 с целью получения изолированных колоний. Посевы инкубируют при (37 +/- 1,0) °C в течение 24 ч (до 48 ч для ХайФлюоро агара).
На ЦПХ-агаре синегнойная палочка образует плоские колонии диаметром от 2 до 3 мм с окрашиванием среды в зеленый или сине-зеленый цвет.
На ХайФлюоро агаре синегнойная палочка при росте на среде разрушает флюорогенный субстрат, освобождая флюороген, который дает видимую флюоресценцию при ультрафиолетовом облучении.
Подтверждение принадлежности микроорганизмов к виду Pseudomonas aeruginosa осуществляется следующим образом. Полученные на ЦПХ-агаре (ХайФлюоро агаре) 2 - 3 колонии пересевают на мясо-пептонный агар по 7.1.2, мясо-пептонный агар с 5% дифибринированной крови барана по 7.1.4, мясо-пептонный бульон.
На мясо-пептонном агаре Pseudomonas aeruginosa дает круглые голубовато-серые колонии. Выделяемый клетками Pseudomonas aeruginosa триметиламин напоминает запах земляничного мыла, что является характерным признаком.
Определение присутствия оксидазы: платиново-иридиевой петлей или стеклянной палочкой отбирают культуры, выросшие на поверхности мясо-пептонного агара и наносят штрихи на фильтровальную бумагу, смоченную реактивом для определения оксидазы, результат оценивают в течение 5 мин.
Для определения оксидазы допускается использование дисков или растворов отечественного и импортного (зарегистрированных в установленном порядке) промышленного производства. Для контроля качества дисков и растворов применяют музейные оксидазоположительные (Pseudomonas aeruginosa) и оксидазоотрицательные (Escherichia coli) культуры.
Бактерии вида Pseudomonas aeruginosa - оксидазоположительные.
На кровяном агаре Pseudomonas aeruginosa вызывает гемолиз эритроцитов.
При росте на мясо-пептонном бульоне Pseudomonas aeruginosa продуцирует водорастворимый пигмент пиоцианин, который постепенно окрашивает бульон в зеленовато-голубой цвет.
Определение пиоцианина: в пробирку с бульонной культурой при появлении зеленого окрашивания после 18 - 24 ч инкубирования добавляют 1,0 см3 хлороформа и интенсивно встряхивают. Синее окрашивание капелек хлороформа свидетельствует о наличии пиоцианина и присутствии в среде Pseudomonas aeruginosa.
Окраска по Граму и микроскопия: из выявленных культур готовят мазки, окрашивают по Граму по 7.3.3.3 и микроскопируют. При микроскопировании Pseudomonas aeruginosa представляют собой грамотрицательные палочки, располагающиеся одиночно, парами или короткими цепочками.
Патогенные свойства определяют у культур Pseudomonas aeruginosa в биопробе на белых мышах.
Для определения патогенных свойств бактерий используют агаровые культуры. Из культур одного вида бактерий готовят смывы 0,9%-ным стерильным раствором хлорида натрия, устанавливают взвесь бактерий в концентрации 1·109 клеток/см3 (10 МЕ по ОСО мутности). Приготовленной взвесью культур бактерий в дозе 0,5 см3 заражают внутрибрюшинно три белые мыши массой 14 - 16 г.
Культуру признают патогенной в случае гибели двух и более мышей в течение 3 сут после заражения. Наблюдение за зараженными белыми мышами продолжают в течение 5 сут.
Из крови сердца, печени, головного мозга павших белых мышей делают высевы на МПА, МПБ, посевы инкубируют при (37 +/- 1) °C в течение 18 - 24 ч. При выделении чистой исходной культуры бактерий синегнойной палочки биопробу считают положительной.
С целью подбора противомикробных препаратов для санации спермы определяют чувствительности выделенных культур к антибиотикам согласно документам, действующим на территории государства, принявшего стандарт.
7.3.6.3 Обработка результатов
При выделении культур бактерий вида Pseudomonas aeruginosa, патогенных для белых мышей при внутрибрюшинном заражении, пробу спермы признают контаминированной патогенными штаммами заражаемой культуры.
При выделении культур бактерий вида Pseudomonas aeruginosa, не вызывающих гибель белых мышей при внутрибрюшинном заражении, пробу спермы признают контаминированной непатогенными штаммами бактерий вида Pseudomonas aeruginosa.
7.3.7 Исследование на наличие золотистого стафилококка (Staphylococcus aureus)
7.3.7.1 Сущность метода
Сущность метода заключается в посеве спермы на селективно-диагностические среды, подтверждении по микроскопии, биохимическим признакам принадлежности выделенных типичных и (или) атипичных колоний к Staphylococcus aureus.
7.3.7.2 Проведение исследования
С помощью стерильной пипетки 1,0 см3 спермы, разведенной в соотношении 1:10 0,9%-ным раствором хлорида натрия по 7.1.1, вносят в солевой бульон по 7.1.5 или бульон Жиолитти-Кантони по 7.1.24. Пробирку с посевом выдерживают в термостате при температуре (37 +/- 1,0) °C в течение 24 - 48 ч.
Предположительное присутствие стафилококков на солевом бульоне определяется по помутнению среды; на бульоне Жиолитти-Кантони - по почернению среды (обычно у дна пробирки).
Для получения изолированных колоний стерильной петлей делают пересевы культур на поверхность чашки Петри с одной из агаризованных селективно-диагностических сред: Байрд-Паркера, Фогеля-Джонсона, среда N 10 для идентификации Staphylococcus aureus, желточно-солевого агара, молочно-солевого агара по 7.1.26 - 7.1.30. Пересевы проводят также из пробирок, в которых нет видимых признаков роста. Чашки с посевами выдерживают в термостате при температуре (37 +/- 1,0) °C в течение 24 - 48 ч. После термостатирования посевы просматривают и отмечают рост характерных колоний (см. таблицу 6).
Подтверждение принадлежности микроорганизмов к виду Staphylococcus aureus: у выросших и отобранных микроорганизмов определяют отношение к окраске по Граму; способность образовывать каталазу, способность коагулировать плазму крови кролика, вызывать гемолиз эритроцитов барана на 5%-ном кровяном агаре.
Окраска по Граму и микроскопия заключаются в следующем. Из выявленных культур готовят мазки, окрашивают по Граму в соответствии с 7.3.3.3 и микроскопируют.
При микроскопии стафилококки окрашиваются по Граму положительно, имеют шарообразную форму и располагаются скоплениями, чаще всего напоминающими гроздья винограда.
Таблица 6
на селективно-диагностических средах
Селективная среда | Характеристика колоний Staphylococcus aureus |
Агаризованная среда Байрд-Паркер | Черные блестящие колонии, окруженные прозрачными зонами, размером от 2 до 5 мм |
Агар Фогеля-Джонсона | Колонии черного цвета, окруженные желтой зоной, размером от 1,5 до 3,0 мм |
Среда N 10 для идентификации Staphylococcus aureus | Колонии выпуклые, золотисто-желтого цвета, окруженные желтыми зонами, размером от 2,0 до 4,0 мм |
Желточно-солевой агар | Колонии имеют форму плоских дисков диаметром 2 - 4 мм белого, желтого, кремового, лимонного, золотистого цвета с ровными краями; вокруг колоний образуется радужное кольцо и зона помутнения среды |
Молочно-солевой агар | Слегка выпуклые непрозрачные круглые колонии, окрашенные от белого до оранжевого цвета, диаметром 2 - 4 мм |
С селективной агаровой среды 2 - 3 характерные колонии пересевают на скошенный мясо-пептонный агар, мясо-пептонный агар с 5% дифибринированной крови барана по 7.1.2, 7.1.4. Посевы выдерживают в термостате при температуре (37 +/- 1,0) °C в течение 18 - 24 ч.
На мясо-пептонном агаре стафилококки образуют непрозрачные, круглые, 2 - 4 мм в диаметре ровные колонии, окрашенные в цвет липохромного пигмента (кремовый, желтый, оранжевый).
Тест на каталазу: на предметное стекло наносят 1 - 2 капли 3%-ной перекиси водорода по 7.1.37. С мясо-пептонного агара отбирают колонию с помощью стерильной стеклянной или пластиковой палочки (но только не металлической иглой) и осторожно эмульгируют в перекиси. Появление пузырьков сразу же свидетельствует о выделении бактериями каталазы.
Постановка реакции плазмокоагуляции заключается в следующем. Лиофилизированную кроличью цитратную плазму разводят физиологическим раствором согласно инструкции изготовителя. В пробирку с 0,5 см3 разведенной кроличьей плазмы вносят петлю суточной агаровой культуры. Внесенную культуру тщательно размешивают. Одну пробирку с плазмой оставляют незасеянной, а в другую засевают контрольный штамм Staphylococcus aureus (коагулазоположительный стафилококк). Пробирки помещают в термостат и инкубируют при температуре (37 +/- 1,0) °C в течение 3 - 6 ч. Если через 6 ч коагуляции плазмы не произошло, то оставляют эти пробирки до 24 ч. Если через 24 ч плазма не свернулась, то испытуемую культуру стафилококка относят к коагулазоотрицательной.
При определении коагулазной активности реакцию считают отрицательной в тех случаях, когда в плазме не образуются отдельные нити или сгустки, или в тех случаях, когда в плазме появились отдельные нити [реакцию плазмокоагуляции оценивают на + (один плюс)].
Реакцию считают положительной, если:
+ + + + - сгусток плотный;
+ + + - сгусток имеет небольшой отсек;
+ + - сгусток в виде взвешенного мешочка.
Все три варианта являются положительным результатом.
Бактерии вида Staphylococcus aureus - коагулазоположительные.
Определение гемолитической активности: на мясо-пептонном агаре с 5% дифибринированной крови барана определяют наличие зоны гемолиза в виде полного  просветления вокруг выросших колоний. Staphylococcus aureus на мясо-пептонном агаре с 5% дифибринированной крови барана вызывает
просветления вокруг выросших колоний. Staphylococcus aureus на мясо-пептонном агаре с 5% дифибринированной крови барана вызывает  эритроцитов при инкубации при температуре (37 +/- 1) °C в течение 24 - 48 ч.
эритроцитов при инкубации при температуре (37 +/- 1) °C в течение 24 - 48 ч.
 просветления вокруг выросших колоний. Staphylococcus aureus на мясо-пептонном агаре с 5% дифибринированной крови барана вызывает
просветления вокруг выросших колоний. Staphylococcus aureus на мясо-пептонном агаре с 5% дифибринированной крови барана вызывает  эритроцитов при инкубации при температуре (37 +/- 1) °C в течение 24 - 48 ч.
эритроцитов при инкубации при температуре (37 +/- 1) °C в течение 24 - 48 ч.С целью подбора противомикробных препаратов для санации спермы определяют чувствительности выделенных культур к антибиотикам согласно документам, действующим на территории государства, принявшей стандарт.
7.3.7.3 Обработка результатов
При выделении культур Staphylococcus aureus пробу спермы признают контаминированной микроорганизмами данного вида.
7.3.8 Исследование на наличие бактерий рода Clostridium
7.3.8.1 Сущность метода
Сущность метода заключается в посеве спермы в среду Китта-Тароцци с последующей идентификацией выделенных культур по морфологическим, культуральным, биохимическим признакам и патологическим изменениям у зараженных лабораторных животных.
7.3.8.2 Проведение исследования
Для выделения анаэробных бактерий (клостридий) по 1 - 2 капли спермы засевают в две пробирки со средой Китта-Тароцци по 7.1.31. Среду Китта-Тароцци предварительно регенерируют прогревом в кипящей водяной бане в течение 30 мин, после чего быстро охлаждают до (45 - 50) °C. После посева спермы одну из пробирок выдерживают в водяной бане при температуре 80 °C в течение 20 мин для уничтожения сопутствующей вегетативной микрофлоры.
Засеянные пробирки помещают в термостат при температуре (37 +/- 1,0) °C на 24 - 48 ч.
При отсутствии роста через 48 ч посевы инкубируют до 10 сут с ежедневным контролем роста.
Подтверждение принадлежности микроорганизмов к роду Clostridium.
При обнаружении роста на среде Китта-Тароцци учитывают интенсивность роста, характер осадка, а также наличие и степень газообразования и проводят микроскопическое исследование.
Окраску по Граму и микроскопию проводят следующим образом: из среды Китта-Тароцци готовят мазки, окрашивают по Граму в соответствии с 7.3.3.3 и микроскопируют.
При микроскопии клостридии представляют собой крупные (2 - 10 x 0,5 - 2,0 мкм) спорообразующие грамположительные палочки. Споры располагаются терминально или субтерминально. Морфологические особенности клостридий приведены в приложении А.
Для обнаружения наличия капсул проводят окраску мазков по Ольту; при микроскопии устанавливают наличие капсул у Clostridium perfringens (в мазках из органов).
При обнаружении в мазке микроорганизмов, сходных по морфологическим свойствам с клостридиями, проверку их культуральных и биохимических свойств проводят следующим образом.
Делают посев полученной культуры на кровяной агар Цейсслера, среду Вильсона-Блера (для дифференциации Clostridium perfringens от других клостридий), молоко, желатин; при необходимости делают посевы на среды с углеводами по 7.1.32 - 7.1.36. Чашки помещают, не переворачивая, в микроанаэростат или эксикатор, из которого удаляют воздух. Чашки и пробирки с посевами выдерживают в термостате при (37 +/- 1,0) °C в течение 12 - 48 ч, после чего просматривают рост в чашках и пробирках и отбирают культуры, которые классифицируют по культуральным и биохимическим свойствам (см. приложение Б).
Изучение ферментативных свойств выделенных культур бактерий рода Clostridium можно проводить также с помощью коммерческих наборов для биохимической идентификации анаэробных бактерий, согласно инструкциям по применению производителя или нормативным правовым актам, действующим на территории государства, принявшего настоящий стандарт.
Определение патогенных свойств культур анаэробов (клостридий) проводят следующим образом. При необходимости проверки вирулентности выделенных штаммов суточную культуру, выращенную на среде Китта-Тароцци, вводят подкожно в области брюшных мышц двум морским свинкам массой 350 - 400 г в дозе 0,5 - 1,0 см3.
При наличии вирулентных штаммов клостридий морские свинки погибают через 16 - 48 ч (в зависимости от вида возбудителя).
При вскрытии у павших морских свинок обнаруживают патологоанатомические изменения (см. приложение В).
Из трупа морской свинки делают посевы из места введения материала, крови сердца и печени в среду Китта-Тароцци, МПБ и на МПА, мазки-отпечатки из тех же органов, а также с диафрагмальной поверхности печени. При наличии Clostridium septicum в мазках с поверхности печени обнаруживают длинные нити. Clostridium perfringens в мазках из органов имеет капсулу. Посевы инкубируют в анаэробных условиях при (37 +/- 1,0) °C в течение 12 - 48 ч.
Наблюдение за зараженными животными ведут в течение 8 сут.
7.3.8.3 Обработка результатов
При выделении видов бактерий рода Clostridium пробу спермы признают контаминированной бактериями данного вида.
7.3.9 Исследование на наличие дрожжеподобных микроскопических грибов рода Candida
7.3.9.1 Сущность метода
Сущность метода заключается в первичном выделении дрожжеподобных микроскопических грибов рода Candida, идентификации их и определении их патогенных свойств (для Candida albicans, Candida tropicalis определение патогенных свойств не проводят).
Микологическое исследование спермы на наличие в ней Candida albicans, Candida tropicalis, Candida stellatoidea, Candida pseudotropicalis, Candida krusei, Candida parakrusei, Candida guilliermondi, Candida parapsilosis проводят по следующей схеме: первичное выделение грибов, идентификация и определение патогенных свойств (кроме Candida albicans, Candida tropicalis).
7.3.9.2 Проведение исследования
Свежеполученную неразбавленную сперму в соотношении 1:10 с 0,9%-ным раствором хлорида натрия по 7.1.1 высевают в объеме 0,5 см3 на чашку Петри с питательной средой Сабуро по 7.2.4.
Свежеполученную разбавленную и замороженную сперму высевают без предварительного разбавления или разбавляют в зависимости от дозы расфасованной спермы в соотношении 1:1 - 1:4 и высевают 0,5 см3 на чашку Петри с питательной средой Сабуро по 7.2.4.
Параллельно ставят контроль загрязненности воздуха методом седиментации, используя одну чашку Петри с питательной средой.
Чашки инкубируют при температуре (37 +/- 1) °C до 3 сут.
Выделенную культуру пересевают на бульон Сабуро и культивируют при (37 +/- 1) °C в течение 24 - 48 ч.
Для предварительной дифференциации выделенных дрожжеподобных грибов рода Candida по культуральным признакам используют среды: кукурузный агар, кровяной агар, одну из сред агара Питмана, Пагано-Левин-Трейо с агаром, CHROMagar Candida, агар Сусло по 7.2.1, 7.2.2, 7.2.5 - 7.2.7 с последующей инкубацией при температуре (37 +/- 1) °C в течение 24 - 48 ч. По характеру роста на питательных средах проводят предварительную родовую дифференциацию (см. приложение Г).
Для видовой дифференциации выделенных дрожжеподобных грибов рода Candida по биохимической активности проводят посев на пептонную воду, содержащую 2% углеводов по 7.2.3. Оценка результатов проводится по таблице 7.
Таблица 7
Биохимические свойства грибов рода Candida
Культура | Углеводы | |||
Глюкоза | Мальтоза | Сахароза | Лактоза | |
Candida albicans | К+/Г+ | К+/Г+ | К+/Г- | К-/Г- |
Candida tropicalis | К+/Г+ | К+/Г+ | К+/Г+ | К-/Г- |
Candida pseudotropicalis | К+/Г+ | К-/Г- | К+/Г+ | К+/Г+ |
Candida krusei | К+/Г+ | К-/Г- | К-/Г- | К-/Г- |
Candida paraicrusei | К+/Г+/- | К-/Г- | К-/Г- | К-/Г- |
Candida stellatoidea | К+/Г+ | К+/Г+ | К+/Г+ | К-/Г- |
Candida guillermondi | К-/Г- | К-/Г- | К-/Г- | К-/Г- |
Примечание - "К+" - ферментация углевода; "К-" - отсутствие ферментации углевода; "Г+" - образование газа; "Г-" - отсутствие образования газа; "Г+/-" - результат вариабелен у 50% культур. | ||||
Микроскопическое исследование осуществляют следующим образом. Окрашивают препараты простым методом: 1%-ным спиртовым раствором метиленового синего 1 - 3 мин, 1%-ным водным раствором фуксина 0,5 - 1 мин. Используют также метод окраски по Граму, по Цилю-Нильсену, по Романовскому-Гимзе, окраску препаратов 1%-ным спиртовым раствором генциан фиолетового в течение 2 - 3 мин (удобно заранее пропитать этим раствором полоски фильтровальной бумаги, которые затем накладывают на препарат в каплю воды). При микроскопическом исследовании выявляют клетки типичной морфологии (овальные, круглые), в некоторых случаях с почкой (всегда одной), псевдомицелий, иногда хламидоспоры.
7.3.9.3 Определение патогенных свойств культур грибов рода Candida
Выращенную в течение 24 - 48 ч на агаровой среде культуру гриба смывают стерильным физиологическим раствором и готовят суспензию с концентрацией 300 - 500 тыс клеток в 1,0 см3. Приготовленной суспензией заражают двух кроликов массой до 2,0 кг внутривенно в дозе 1,0 см3.
Вирулентные штаммы Candida вызывают гибель кроликов в период от 3 до 10 сут. В этот период у животных наблюдают депрессию, повышение температуры, исхудание, иногда паралич.
На вскрытии обнаруживают поражения прежде всего почек в виде множественных серовато-белых гранулем в корковом слое, а также печени, селезенки, сердца. Если зараженные кролики не гибнут через 10 сут, их убивают и при обнаружении гранулем в почках штамм относят к слабовирулентным (гибель у животных такие штаммы могут вызывать лишь на 20 - 30 сут после заражения).
В мазках, приготовленных из пораженных очагов павших или убитых животных, обнаруживают дрожжевидные клетки, иногда псевдомицелий.
7.3.9.4 Обработка результатов
При выделении культур Candida stellatoidea, Candida pseudotropicalis, Candida krusei, Candida parakrusei, Candida guilliermondi, Candida parapsilosis пробу спермы признают контаминированной дрожжеподобными микроскопическими грибами. При выделении культур Candida albicans, Candida tropicalis, а также при гибели лабораторных животных, зараженных Candida stellatoidea, Candida pseudotropicalis, Candida krusei, Candida parakrusei, Candida guilliermondi, Candida parapsilosis пробу спермы признают контаминированной вирулентными штаммами дрожжеподобных микроскопических грибов.
7.3.10 Исследование на наличие грибов рода Aspergillus, Absidia, Mucor, Rhizopus
7.3.10.1 Сущность метода
Сущность метода заключается в первичном выделении грибов, их идентификации и определении патогенных свойств (для Aspergillus fumigatus, Absidia corimbifera, Absidia ramosa определение патогенных свойств не проводят).
Микологическое исследование спермы на наличие в ней грибов Aspergillus fumigatus, Aspergillus flavus, Aspergillus niger, Aspergillus nidulans, Aspergillus terreus, Aspergillus versicolor, Absidia corimbifera, Absidia ramosa, Mucor pusillus, Mucor racemosus, Rhizopus nigricans, Rhizopus cohnii проводят по следующей схеме: первичное выделение грибов, идентификация и определение их патогенных свойств (кроме Aspergillus fumigatus, Absidia corimbifera, Absidia ramosa).
7.3.10.2 Проведение исследования
Свежеполученную неразбавленную сперму в соотношении 1:10 с 0,9%-ным раствором натрия хлорида по 7.1.1 высевают в объеме по 0,5 см3 на чашки Петри с питательной средой Сабуро по 7.2.4 и средой Чапека по 7.2.8. Для выделения грибов родов Aspergillus можно использовать коммерческие среды: солодовый агар, микологический агар Киммига, агар с бенгальским розовым и хлортетрациклином, агар Чапека с дрожжевым экстрактом по 7.2.8 - 7.2.12.
Свежеполученную разбавленную и замороженную сперму высевают без предварительного разбавления или разбавляют в зависимости от дозы расфасованной спермы, в пропорции 1:1 - 1:4 и высевают 0,5 см3 на чашку с питательной средой Сабуро по 7.2.4.
При посеве спермы проводят контроль зараженности грибами воздуха в боксе, для чего чашку со средой оставляют открытой в течение 3 мин.
Чашки инкубируют при (24 +/- 1) °C в течение 8 сут. Рост большинства грибов становится заметным через трое суток.
Для подавления сопутствующей микрофлоры в питательные среды, используемые для первичного выделения грибов, после стерилизации можно добавлять антибиотики: пенициллин - 50 ЕД и стрептомицин - 100 ЕД на 1,0 см3 среды, имеющей температуру (45 +/- 1) °C.
Родовую (а иногда и видовую) принадлежность грибов устанавливают в первичном посеве. При росте грибов, относящихся к роду Aspergillus, семейству Mucoracea, выделяют чистые культуры для дальнейшей идентификации (установления вида) и, при необходимости, определения патогенных свойств.
С целью определения видовой принадлежности грибов, относящихся к роду Aspergillus кроме сред Сабуро и Чапека можно использовать коммерческие хромогенные среды для дифференциации аспергилл.
После окончания культивирования проводят макро- и микроскопическое исследования.
Макроскопическое исследование: при определении признаков грибов рассматривают колонии на месте их роста, учитывают цвет, форму, консистенцию колонии, характер роста, форму растущего края, наличие или отсутствие пигмента, его цвет, степень развития воздушного мицелия.
Микроскопическое исследование проводят после приготовления препарата. Для изучения Aspergillus и Mucoracea частицы мицелия, взятые иглой из разных частей колонии: старых (ближе к центру) и молодых (у края), помещают на предметное стекло в каплю жидкости, состоящей из равных частей воды, спирта и глицерина, осторожно снимают их другой иглой, накрывают покровным стеклом и рассматривают сначала при малом увеличении микроскопа (объектив 8x, 10x), затем - при большом (объектив 40x).
Родовую и видовую принадлежности выделенных культур грибов определяют по культурально-морфологическим свойствам, характерным для каждого рода (вида) (см. приложение Д).
7.3.10.3 Определение патогенности Aspergillus и Mucoracea
Выращенную в течение 6 - 8 сут на агаровой среде культуру гриба смывают стерильным физиологическим раствором. Смыв центрифугируют в градуированных пробирках при 1000 об/мин в течение 15 мин. Надосадочную жидкость сливают, осадок разводят до 1,0 см3 стерильным физиологическим раствором. Количество клеток гриба в суспензии подсчитывают в счетной камере Горяева на 1,0 см3. Для приготовления взвеси с плотностью, которая необходима для заражения подопытных животных, пользуются методом последовательного разведения.
Для приготовления споровой суспензии Aspergillus fumigatus желательно добавлять небольшое количество (1 - 2 капли) твина-80 (эфир олеиновой кислоты и сорбита).
Патогенность выделенных грибов определяют на двух кроликах массой до 2,0 кг. Для заражения используют 1,0 см3 суспензии, содержащей 1 x 106 спор, внутривенно. При изучении мукоровых грибов можно пользоваться суспензией, содержащей большее число спор, а также частицы гиф мицелия.
Смерть животного обычно наступает через 4 - 5 сут, иногда значительно позднее. Если в течение 10 сут животное не погибает, его убивают. При патолого-анатомическом вскрытии наиболее тяжелые поражения обнаруживают в легких и почках. Легкие гиперимированы, отечные, с хорошо заметными, особенно на разрезе, множественными серовато-беловатыми небольшими узелками (гранулемами). Почки увеличены, бугристые, гранулемы обычно хорошо заметны.
7.3.10.4 Обработка результатов
При выделении культур Aspergillus flavus, Aspergillus niger, Aspergillus nidulans, Aspergillus terreus, Aspergillus versicolor, Mucor pusillus, Mucor racemosus, Rhizopus nigricans, Rhizopus cohnii пробу спермы признают контаминированной грибами.
При выделении культур Aspergillus fumigatus, Absidia corimbifera, Absidia ramose, а также при гибели лабораторных животных, зараженных Aspergillus flavus, Aspergillus niger, Aspergillus nidulans, Aspergillus terreus, Aspergillus versicolor, Mucor pusillus, Mucor racemosus, Rhizopus nigricans, Rhizopus cohnii, пробу спермы признают контаминированной вирулентными штаммами грибов.
Выявление микроорганизмов рода Mycoplasma и Ureaplasma основано на комбинации микробиологического метода и метода ПЦР.
При проведении исследования на первом этапе определяют наличие или отсутствие генетического материала микроорганизмов рода Mycoplasma, Ureaplasma и/или видов Mycoplasma bovis, Mycoplasma bovigenitalium и Ureaplasma diversum в пробе спермы методом ПЦР по 7.4.1.
Для подтверждения наличия жизнеспособных микроорганизмов рода Mycoplasma и Ureaplasma в пробе спермы исследование проводят по 7.4.2 - 7.4.3.1.
Для выявления генетического материала жизнеспособных микроорганизмов вида Mycoplasma bovis, Mycoplasma bovigenitalium и Ureaplasma diversum исследование проводят по 7.4.2, 7.4.3.2.
7.4.1 Первый этап исследования (определение наличия или отсутствия генетического материала бактерий рода Mycoplasma/Ureaplasma)
Выявление микроорганизмов рода Mycoplasma, Ureaplasma при исследовании спермы всех видов сельскохозяйственных животных и птицы, а также Mycoplasma bovis, Mycoplasma bovigenitalium и Ureaplasma diversum из спермы быков допускается проводить с помощью коммерческих тест-систем на основе ПЦР согласно инструкции по применению производителя или нормативным правовым актам, действующим на территории государства, принявшего настоящий стандарт.
Подготовка исследуемой пробы спермы к экстракции ДНК проводится согласно инструкции производителя набора.
Результат исследований оценивают по 7.4.4.1.
Пробы, содержащие генетический материал бактерий рода Mycoplasma и/или Ureaplasma, подвергают исследованию на определение жизнеспособности данных микроорганизмов.
Для подтверждения наличия в сперме жизнеспособных бактерий рода Mycoplasma и накопления микробной массы высевают по 0,5 см3 спермы в две пробирки со средой Хейфлика по 7.1.42 или средой Каган по 7.1.43, а также в две пробирки с одной из жидких питательных сред: средой Фрея, средой Фрис, питательной средой ИЭМ им. Н.Ф. Гамалеи в модификации ВНИИВС для выделения микоплазм по 7.1.44 - 7.1.46.
Для подтверждения наличия в сперме жизнеспособных бактерий рода Ureaplasma и накопления микробной массы высевают по 0,5 см3 спермы в две пробирки питательной среды для выделения уреаплазм по 7.1.47.
Одну из двух пробирок с посевами на идентичных средах (образцы сравнения) не подвергают термостатированию, а замораживают и сохраняют при температуре минус (20 +/- 2,0) °C до окончания инкубации парного образца.
Вторую часть посевов на идентичных средах культивируют при температуре (37 +/- 1,0) °C в газовой среде с содержанием 5% - 10% углекислого газа в течение 10 сут при визуальном просмотре посевов в проходящем свете на 3, 5, 7, 10 сут.
Рост микроорганизмов рода Mycoplasma и Ureaplasma в жидких питательных средах характеризуется незначительным помутнением без образования пленки и/или осадка, опалесценцией, изменением цвета среды от оранжевого до соломенно-желтого (при использовании сред с индикатором феноловым красным).
Из бульонных культур через 7 - 10 сут инкубации готовят мазки для микроскопии. Стерильно отбирают 2 - 3 см3 бульонной культуры, которую центрифугируют при 10 тыс об/мин в течение 30 мин, из осадка делают мазки, которые окрашивают по Романовскому-Гимзе.
При необходимости отделения крупных биологических структур от жидкой фазы среды, содержащей микроорганизмы, перед центрифугированием проводят фильтрацию через стерильные фильтры с размерами пор 1,2 - 3,0 мкм, фильтрацию проводят в стерильных условиях, исключая контаминацию бульона другими микроорганизмами.
Окраску мазков по Романовскому - Гимзе осуществляют двумя методами.
Метод 1: мазки фиксируют в течение 20 мин метиловым спиртом и окрашивают в течение 24 ч при комнатной температуре краской Романовского - Гимзы, разбавленной дистиллированной водой в соотношении 1:10, после мазок промывают и микроскопируют.
Метод 2: мазки фиксируют в течение 20 мин метиловым спиртом. Подогретую до 90 °C краску Романовского - Гимзы, разбавленную дистиллированной водой в соотношении 1:10, вводят под предметное стекло, положенное мазком вниз. Мазок окрашивают в течение 20 мин, периодически добавляя горячую краску.
В мазках из культур микроорганизмы рода Mycoplasma и Ureaplasma имеют вид полиморфных (округлых, овальных, дисковидных) коккобактерий размером 0,1 - 1,5 мкм, окрашенных в сине-фиолетовый цвет.
По истечении 10 сут переходят к третьему этапу исследования в независимости от наличия/отсутствия видимых признаков роста в жидких питательных средах, прошедших инкубацию, и результата микроскопии.
7.4.3 Третий этап исследования (выявление генетического материала жизнеспособных микоплазм)
7.4.3.1 Для подтверждения наличия в образцах жизнеспособных микроорганизмов рода Mycoplasma и Ureaplasma методом ПЦР тестируют инокуляты спермы в питательных средах, подвергшиеся термостатированию и подвергшиеся замораживанию (образцы сравнения).
Пробирки с инокулятами, подвергшиеся замораживанию, размораживают при комнатной температуре.
Стерильные образцы соответствующих жидких питательных сред используют в качестве отрицательных контролей.
Отбирают по 1,0 см3 проинкубированной в термостате культуральной жидкости и по 1,0 см3 размороженных контрольных образцов. Исследование проводят согласно требованиям методик или инструкций к тест-системам на основе ПЦР.
7.4.3.2 Для выявления генетического материала патогенных для крупного рогатого скота жизнеспособных микроорганизмов вида Mycoplasma bovis, Mycoplasma bovigenitalium и Ureaplasma diversum методом ПЦР проводят тестирование образцов, полученных по 7.4.2 и отобранных по 7.4.3.1. Исследование проводят согласно требованиям методик или инструкций к тест-системам на основе ПЦР для дифференциации. Результат исследований оценивают по 7.4.4.2, 7.4.4.3.
7.4.4 Обработка результатов
7.4.4.1 При выявлении методом ПЦР микроорганизмов рода Mycoplasma, Ureaplasma и/или детекции Mycoplasma bovis, Mycoplasma bovigenitalium, Ureaplasma diversum в соответствии с 7.4.1 пробу спермы признают содержащей генетический материал соответствующих микоплазм и/или уреаплазм.
7.4.4.2 Для оценки наличия в образце жизнеспособных микроорганизмов рода Mycoplasma и Ureaplasma и видов Mycoplasma bovis, Mycoplasma bovigenitalium, Ureaplasma diversum (для спермы быков) сопоставляют результаты ПЦР-тестирования образцов, подвергшихся инкубации и подвергшихся замораживанию после посева на питательные среды (образцы сравнения).
Появление в образце, подвергшемся инкубации, значений порогового цикла (Ct) по соответствующему специфическому каналу детекции или отставание сигнала на два и более значения Ct от значений для образца, подвергшегося замораживанию, свидетельствует о наличии в сперме жизнеспособных микроорганизмов рода Mycoplasma и/или Ureaplasma и/или детектируемых видов.
7.4.4.3 При подтверждении наличия жизнеспособных микоплазм в образцах, подвергшихся культивированию, соответствующую пробу спермы признают контаминированной жизнеспособными микоплазмами и/или уреаплазмами выявленного вида.
Протокол испытания должен включать:
- всю информацию, необходимую для полной идентификации образца;
- используемый метод в соответствии с настоящим стандартом;
- все детали испытания, не установленные этим стандартом или рассматриваемые как дополнительные, а также сведения о любых случаях, вероятно повлиявших на результаты;
- полученный(е) результат(ы).
(справочное)
Таблица А.1
Виды клостридий | Размер палочек (длина x ширина) | Морфология микробов | Расположение спор | Наличие капсулы | Подвижность |
Clostridium perfringens | (4 - 8) x (0,8 - 1,5) мкм | Грамположительные толстые палочки со слегка закругленными концами, расположены одиночно | Центральное, субтерминальное; в молодых культурах отсутствуют | + | Неподвижны |
Clostridium histolyticum | (3 - 5) x (0,5 - 0,8) мкм | Грамположительные стройные тонкие палочки с закругленными концами, расположены одиночно, попарно, редко цепочками | Субтерминальное "Игольное ушко" | - | Перитрих |
Clostridium septicum | (2 - 10) x (0,8 - 2,0) мкм | Грамположительные изолированные палочки с закругленными концами, в мазках-отпечатках с серозных оболочек-нитей | Центральное, субтерминальное | - | Перитрих |
Clostridium oedematiens | (5 - 10) x (0,8 - 1,0) мкм | Грамположительные крупные полиморфные палочки с закругленными или обрубленными концами, расположены одиночно, редко попарно или цепочками из трех - четырех члеников | Центральное, субтерминальное | - | Перитрих |
Clostridium sporogenes | (3 - 7) x (0,8 - 1,1) мкм | Грамположительные палочки с закругленными концами, расположены одиночно, иногда цепочками | Центральное, субтерминальное; в молодых культурах почти у всех палочек | - | Перитрих |
Clostridium sordellii | (2 - 4) x (1,0 - 1,5) мкм | Грамположительные крупные полиморфные палочки с закругленными концами, расположены чаще цепочками по два - четыре членика | Центральное, субтерминальное | - | Перитрих |
(справочное)
БАКТЕРИЙ РОДА Clostridium
Таблица Б.1
Виды клостридий | Рост на среде Китта-Тароцци | Оптимум разряжения воздуха, мм рт. ст. | Форма колоний на кровяном агаре | Рост в молоке | Рост в желатине | Ферментация углеводов | |||||
Глюкоза | Сахароза | Маннит | Глицерин | Мальтоза | Галактоза | ||||||
Clostridium perfringens | Раннее помутнение и бурное интенсивное газообразование через 4 - 5 ч | 40 | Круглые колонии зеленоватого цвета, гемолиз сильный, грязно-коричневого цвета | Бурное свертывание молока, образование губкообразного сгустка | Медленное разжижение желатина 3 - 5 сут | + | + | - | +/- | + | + |
Clostridium histolyticum | Интенсивное помутнение без газообразования | 8 - 15 | Мелкие гладкие колонии (росинки) без гемолиза | Свертывание молока | Сильное помутнение | - | - | - | - | - | - |
Clostridium septicum | Интенсивное помутнение среды, обильное газообразование | 8 - 15 | Нежные кружевные колонии с зоной гемолиза | Свертывание молока | Медленное разжижение желатина | + | - | - | - | + | + |
Clostridium oedematiens | Нежное помутнение среды, рост более интенсивный внизу, через 18 - 24 ч бульон просветляется, на дне выпадает хлоп, газообразование слабое | 3 - 5 | Шероховатые, корневидные, складчатые, с изрезанными краями и выпуклым темным центром, гемолиз сильный, прозрачный, но может отсутствовать (II форма) | Свертывание молока | Разжижает на 2 - 4 сут | + | - | - | - | +/- | - |
Clostridium sordellii | Помутнение более интенсивное внизу, умеренное газообразование; при старении культур - слизистый осадок | 8 - 15 | Неправильной формы, корневидные, складчатые, с сероватой шероховатой поверхностью и изрезанными краями, гемолиз сильный, но может отсутствовать (II форма) | Свертывание молока | Разжижает | + | - | - | - | + | - |
Clostridium sporogenes | Рост обильный, кусочки печени обволакивают слизистым осадком, верх среды прозрачный, газообразование слабое. Культура издает неприятный гнилостный запах | 15 - 20 | Вязкие с изрезанными краями, напоминающие корневище, погружены в агар, поверхность матовая с желтоватым центром, зона гемолиза интенсивная, резко ограниченная (VI форма) | Пептонизация | Разжижает | - | - | - | - | - | - |
(справочное)
ПАТОЛОГОАНАТОМИЧЕСКИЕ ИЗМЕНЕНИЯ У ЛАБОРАТОРНЫХ ЖИВОТНЫХ,
ВЫЗВАННЫЕ БАКТЕРИЯМИ РОДА Clostridium
Таблица В.1
Название возбудителя | Сроки гибели морских свинок, ч | Патологоанатомическая картина у морских свинок, зараженных клостридиями |
Clostridium septicum | 14 - 28 | Кожа легко отделяется от мышц. Мышцы и подкожная клетчатка светло-красного или розового цвета, в подкожной клетчатке большое количество пузырьков газа. Кишечник вздут, наполнен разжиженными массами, содержащими пузырьки газа, сосуды инъецированы. В грудной полости и сердечной сорочке обнаруживают значительное количество транссудата |
Clostridium oedematiens | 12 - 36 | На месте инъекции наблюдается желатинозный, студенистый отек от желтоватого до слабо-розового цвета. Мышцы бледные |
Clostridium sordellii | 12 - 30 | На месте инъекции наблюдается желатинозный, студенистый отек от желтоватого до слабо-розового цвета. Мышцы бледные |
Clostridium perfringens, типы A и D | 36 - 48 | Кожа на месте инъекции часто отслаивается от мускулатуры, образуя мешок. Мышцы имеют вид вареного мяса, серовато-грязного цвета (более выражено при заражении типом A). Кишечник вздут, сосуды инъецированы |
Clostridium perfringens, типы B и C | 36 - 48 | Кожа на месте инъекции легко отделяется, но не отслаивается. Мускулатура сухая, красного цвета различных оттенков. Кишечник вздут, геморрагически воспален, иногда образуются язвы (тип B) |
Clostridium histolyticum | 18 - 48 | При подкожном заражении большей частью наблюдают выздоровление морских свинок. При заражении в мышцу бедра кожа красно-фиолетовая, напряжена, иногда лопается. Мышцы теряют свою структуру, расплавляются и превращаются в кашицеобразную массу с примесью сгустков крови. Мягкие ткани отделяются от костей и сосудов. Газ не образуется, гнилостного распада нет |
Clostridium sporogenes | - | Патогенен в ассоциации с другой микрофлорой. На месте инъекции вызывает язву гнойного характера |
(справочное)
Таблица Г.1
Наименование вида | Агар Сабуро | Сусловый агар | Кровяной агар | Агар Литмана | CHROM agar Candida | Среда Пагано-Левин-Трейо с агаром | Бульон Сабуро | Кукурузный агар |
Цвет и морфология колоний на питательной среде | Микроскопическое строение | |||||||
Candida albicans | Кремовые, гладкие, влажные, с возрастом морщинистые или с редкими бороздками | Белые, кремовые, мягкие, гладкие, блестящие с ровными краями, глубоко врастают в субстрат, 2 - 3 см в диаметре | Тускло-серый рост по всей поверхности среды | Конусовидные, блестящие, вначале гладкие; окраска темно-синяя в старых культурах | Зеленый | Кремовые до слабо-розовых | Глубинный рост | Псевдомицелий хорошо развит, бластоспоры; хламидоспоры крупные, круглые, двухконтурные, находятся на боковых и концевых точках по краям колонии |
Candida tropicalis | Кремовые, гладкие, влажные, с возрастом морщинистые или с редкими бороздками | Серо-белые, круглые, с зубчатыми краями, матовые, слабо врастают в субстрат, 3,5 - 4,5 см в диаметре | Обильные, серые, окруженные мицелиальной бахромой | Плоские бледно-синие | От темно-синего до сине-серого, темный венчик на агаре | Темно-красные | Небольшая поверхностная пленка, пузырьки пены | Псевдомицелий хорошо развит, ветвистый, бластоспор и псевдоконидии обильные, хламидоспоры отсутствуют |
Candida pseudotropicalis | Рост нехарактерный | Серые, матовые, сметанообразной консистенции, слегка приподнятые, 2 - 3,5 см в диаметре | Мелкие, нехарактерные | Плоские бледно-синие | - | Розовые | Поверхностной пленки нет | Псевдомицелий слабо развит, бластоспор мало, хламидоспоры отсутствуют |
Candida ksrusei | Гладкие, сухие | Белые или серые, гладкие, суховатые, матовые плоские, с неровными выямчатыми краями; врастание в глубь среды отсутствует | Мелкие, различной формы, плоские или высокие | Плоские бледно-синие | Бледно-розовый, пурпурный (шершавая поверхность, широкие белые края) | Белые | Широкая поверхностная пленка | Псевдомицелий хорошо развит, бластоспоры удлиненные, хламидоспоры отсутствуют |
Candida parakrusei | Гладкие | Белые с гладкими краями и поверхностной исчерченностью по перифирии, выпуклые; врастание в глубь среды отсутствует; 2 - 3 см в диаметре | Мелкие, зеленовато-белые | Плоские бледно-синие | - | Бледно-розовые | Поверхностного роста нет | Псевдомицелий хорошо развит, бластоспор мало, хламидоспоры отсутствуют |
Candida stellatoidea | Кремовые, гладкие | Белые, желтоватые, мягкие, сметанообразные, складчатые (звездчатые), борозды довольно глубокие | Звездчатой формы | Наличие отростков, суживающихся к концу | - | Бледно-красные | Поверхностного роста нет | Псевдомицелий хорошо развит, большие шарообразные бластоспоры, хламидоспоры обильные |
Candida guilliermondi | Кремовые | Белые, плоские, влажные, гладкие, с короткими отпрысками в субстрат | Тускло-серый рост по всей поверхности среды | Плоские | Бледно-розовый, пурпурный | Темно-красные | Поверхностного роста нет | Псевдомицелий умеренно развит, бластоспоры мелкие, хламидоспоры отсутствуют |
Candida parapsilosis | - | Белые, кремовые до желтоватых, блестящие, мягкие гладкие (иногда слабоскладчатые) колонии с ровными краями | - | - | Белый, бледно-розовый | - | - | Псевдомицелий хорошо развит, тонкий и ветвистый, бластоспоры |
Примечание - На кукурузном агаре рост культур при температуре (24 +/- 1) °C наблюдается через 24 - 48 ч. | ||||||||
(справочное)
Таблица Д.1
Вид | Культурально-морфологические свойства |
Род Aspergillus Мицелий у видов рода Aspergillus бесцветный или светлоокрашенный, с перегородками, у некоторых видов (Aspergillus flavus, Aspergillus niger) образует шаровидные склероции из толстостенных клеток. Цвет колонии определяется массой конидий, развивающихся на конидиеносцах. Конидиеносцы на концах имеют вздутие (верхушечный пузырь) различной формы, на поверхности которого располагаются цилиндрические клетки-стеригмы в один или два яруса, несущие цепочки конидий. Вздутие конидиеносца, стеригмы и цепочки конидий составляют головку аспергилла. Головка называется радиальной в случае, если стеригмы расположены радиально на поверхности всего вздутия и цепочки конидий радиально расходящиеся. Нерадиальная головка имеет прижатые к верху стеригмы, направленные параллельно оси конидиеносца, и сближенные в плотную колонку цепочки конидий | |
Aspergillus fumigatus | Колонии широко разрастающиеся, бархатистые, редко пушисто-войлочные от развития воздушного мицелия, сначала голубовато-зеленые, затем зеленые, с возрастом темнеющие. Обратная сторона колонии бесцветная или окрашена в желто-коричневые тона. Конидиеносцы гладкие, короткие, до 300 мкм длиной и 5 - 8 мкм толщиной, часто более или менее зеленые. Головки нерадиальные - в верхней части колбообразного вздутия до 20 - 30 мкм в диаметре, развиваются одноярусные стеригмы (6 - 8) (длина) x (2 - 3) (толщина) мкм, расположенные не строго параллельно оси конидиеносца. Конидии шиповатые, округлые, обычно 2,5 - 3 мкм в диаметре, цепочки их склеены в колонку |
Aspergillus flavus | Колонии широко разрастающиеся, зеленые, часто с оттенком желтой, лимонной окраски, с возрастом обычно темно-желто-зеленые; на обратной стороне бесцветные, или розовато-тускло-желтоватые. Многие штаммы образуют склероции, хорошо видимые невооруженным глазом, в виде шаровидных твердых образований, сначала белые, затем коричневые. Конидиеносцы (400 - 1000) x (5 - 15) мкм, с бесцветной шероховатой оболочкой, образуют на верхушке у молодых культур продолговатые, позже полукруглые или круглые вздутия 10 - 40 мкм в диаметре. Головки радиальные. Стеригмы или одноярусные (10 - 15) x (3 - 5) мкм (главным образом на маленьких вздутиях) или двухъярусные (на больших вздутиях), в последнем случае стеригмы I яруса - (7 - 10) x (3 - 4) мкм, II яруса - (7 - 10) x (2,5 - 3,5) мкм. Конидии яйцевидные или шаровидные, 3 - 6 мкм в диаметре, от бесцветных до желто-зеленых, иногда почти гладкие, но большей частью с шероховатой оболочкой |
Aspergillus niger | Колонии быстро растущие, бурые, черновато-коричневые или угольно-черные, на обратной стороне бесцветные или желтоватые, иногда образуют твердые белые, с возрастом становящиеся коричневыми, склероции. Конидиеносцы (200 - 400) x (7 - 10) мкм, иногда значительно крупнее, с толстостенной гладкой оболочкой, обычно желтые, а ближе к вершине коричневые. Головки радиальные, крупные. Вздутие шаровидное, 20 - 50 мкм, иногда до 100 мкм в диаметре, стеригмы одно- и двухъярусные. Стеригмы первого яруса (10 - 15) x (6 - 8) мкм, тесно скученные, второго яруса (6 - 10) x (2 - 3) мкм, более или менее коричневые или почти черные. Конидии иногда гладкие, но чаще шероховатые или шиповатые, коричневые или бурые |
Aspergillus terreus | Колонии широко разрастающиеся, бархатистые, плоские, гладкие или с неглубокими радиальными бороздами, орехово-бурые, на обратной стороне палевые, желтые или темно-бурые. Конидиеносцы более или менее извилистые, гладкие, бесцветные, [50 - 150 - (250)] x (5 - 8) мкм, у вершины с полушаровидным вздутием 10 - 16 мкм в диаметре. Головки нерадиальные. Стеригмы двухъярусные. Стеригмы первого яруса (7 - 9) x (2 - 2,5) мкм, второго яруса (5 - 7) x (2 - 2,5) мкм. Конидии шаровидные или слегка эллиптические, гладкие, 2,5 x 2,2 мкм; в цепочках, соединенных в длинную колонку |
Aspergillus versicolor | Колонии медленно растущие, компактные, у некоторых штаммов бархатистые, у других - пушистые или же штамм имеет тот и другой признак; вначале белые, затем приобретают желтые оттенки, оранжево-желтые, дымчато-зеленые или телесного цвета; зеленые тона могут отсутствовать. Обратная сторона и субстрат от желтого и оранжевого цвета до розового, пурпурно-красного или красного. Конидиеносцы (500 - 700) x (5 - 10) мкм, с гладкой бесцветной оболочкой. Головки радиальные. Вздутие бутыльчатое или почти шаровидное, 12 - 20 мкм в диаметре, в верхней, большей, своей части образует радиально расположенные двухъярусные стеригмы - стеригмы первого яруса (3 - 10) x (3 - 5) мкм, второго яруса (5 - 10) x (1,5 - 2) мкм. Конидии шаровидные, обычно слегка шероховатые, 2,5 - 3 мкм в диаметре, в свободно расходящихся цепочках |
Aspergillus nidulans | Колонии широко разрастающиеся, гладкие, бархатистые, темно-зеленые или желтовато-зеленые, на обратной стороне пурпурно-красные, красно-коричневые или с возрастом темно-коричневые. Конидиеносцы более или менее извилистые, гладкие, с коричневой оболочкой [50 - 100 (200)] x (3 - 5) мкм. Головки нерадиальные. Вздутие куполовидное, 7 - 15 мкм в диаметре; двухъярусные стеригмы покрывают верхнюю часть вздутия, направлены параллельно оси конидиеносца, стеригмы первого яруса (5 - 8) x (2 - 3) мкм, второго (5 - 6) x (2 - 2,5) мкм. Конидии шаровидные, 3 - 3,5 мкм в диаметре, гладкие или шероховатые, в массе зеленые, в цепочках, склеенных в колонки. Помимо конидиального имеет сумчатое спороношение, возникшее в результате полового процесса и представленное сумками с аскоспорами, развивающимися внутри плодовых тел - клейстотециев (клейстокарпиев). Клейстотеции шаровидные, 100 - 200 мкм в диаметре, хорошо различимы невооруженным глазом вначале в центре колонии, затем и по ее периферии, имеют желтоватую или коричневую окраску за счет окружающих их покровных клеток, образованных конечными клетками вегетативных гиф, шаровидных, до 25 мкм в диаметре, с очень толстой оболочкой до 4 - 5 мкм. Стенка клейстотециев тонкая, красноватая. Сумки, заполняющие клейстотеции, многочисленные, состоят из восьми аскоспор. Аскоспоры чечевицеобразные, пурпурно-красные, гладкие, с двумя экваториальными гребешковидными образованиями (3,8 - 4,5) x (3,5 - 4) мкм |
Семейство Mucoraceae Мицелий хорошо развит, представлен одиночными, разветвленными гифами с далеко отстоящими друг от друга поперечными перегородками или, чаще, без перегородок, главным образом поверхностный. Иногда мицелий прикрепляется к субстрату с помощью корешекообразных разветвленных выростов-ризоидов. В этом случае он часто развивается в виде дугообразно изогнутых воздушных гиф - столонов. Некоторые виды образуют хламидоспоры - клетки с утолщенной оболочкой, одиночные или собранные цепочкой, могут возникать на протяжении гиф (интеркалярные) или на их концах (терминальные). Бесполое воспроизведение мукоровых грибов эндогенное. Органы бесполого размножения представлены спорангиями, развивающимися на концах простых или разветвленных спорангиеносцев и содержащими многочисленные одноклеточные спорангиоспоры. Характерным образованием внутри спорангии является колонка (столбик) шаровидной, грушевидной и др. формы. У некоторых видов спорангиеносец у основания спорангия расширяется в апофизу. Оболочка спорангия или полностью растворяется в воде, или сохраняется у основания колонки в виде воротничка. Половой процесс происходит путем соединения двух специальных клеток (гаметангиев) и образования зигоспоры. Семейство Mucoraceae объединяет 12 родов, среди них Mucor, Rhizopus, Absidia | |
Род Mucor Спорангиеносцы простые или разветвленные (моноподиально, симподиально, мутовчато), неокрашенные или бледно-окрашенные, отходят одиночно от гиф мицелия. Спорангии шаровидные, без апофизы; оболочка растворяется в воде или разрывается и остается у основания колонки в виде воротничка. Столбик различной формы. Ризоиды и столоны обычно отсутствуют | |
Mucor racemosus | Колонии быстрорастущие, без воздушного вегетативного мицелия, пушистые, 0,8 - 1,5 см высотой, трудно смачиваемые водой, легко разрывающиеся при незначительном прикосновении. Спорангиеносцы отходят от субстрата, кистевидно-разветвленные, до 1,5 см длины и 8 - 20 мкм толщины. Спорангии шаровидные, 40 - 100 - (140) мкм в диаметре, вначале желтоватые, затем темно-коричневые, просвечивающие. Колонка коричневатая или темно-коричневая, обратно-грушевидная, иногда эллиптически-шаровидная, [20 - 60 - (70)] x [15 - 50 - (60)] мкм. Споры эллиптически-шаровидные, эллиптические, [(4) - 5 - 8 - (12)] x [4 - 6 - (8)] мкм или шаровидные (4) - 5 - 8 - (20) мкм в диаметре, бесцветные, в массе бледно-сероватые. Имеются многочисленные хламидоспоры (10 - 20) x (10 - 15) мкм, одиночные или в коротких цепочках. Ризоиды и столоны отсутствуют |
Mucor pusillus | Колонии быстрорастущие, 0,2 - 0,4 см высоты, обычно без воздушного вегетативного мицелия, бархатистые, вначале темно-серые, затем коричневато или рыжевато-темно-серые, с обратной стороны коричневатые. Имеются немногочисленные простые или слабо разветвленные, большей частью неокрашенные ризоиды. Столоны слабо выраженные, также немногочисленные. Споронгиеносцы прямостоящие, отходят от субстрата, прямые, до 0,4 см высоты, 10 - 25 мкм в диаметре, с (1) 2 - 5 (7) мкм короткими веточками в верхней части. Спорангии шаровидные, 20 - 70 (80) мкм в диаметре, вначале неокрашенные, затем серые или свинцово-серые. Колонка яйцевидная или обратно-грушевидная, (20 - 50) x (20 - 45) мкм, коричневато- или серовато-металлического цвета. Споры шаровидные, гладкие, (2,5) - 3,5 - 4,5 (5) мкм в диаметре |
Род Rhizopus Колонии с развитым воздушным мицелием в виде дугообразно изогнутых столонов, прикрепляющихся к субстрату с помощью ризоидов. Спорангиеносцы темно-окрашенные, простые или, реже, разветвленные, отходят пучком по 1 - 5 - (7) мкм от шейки ризоида (т.е. в месте прикрепления столона к субстрату), от столонов или являются продолжением последних. Столоны и ризоиды светло-окрашенные. Спорангии шаровидные или приплюснутые, бурые, черно- или серо-бурые. Колонка светло-окрашенная, от шаровидной до цилиндрической или обратно-грушевидной формы, с воронковидной или блюдцевидной окрашенной апофизой. Споры шаровидные, эллиптические или неправильной формы, часто угловатые и продольно исчерченные. У большинства видов имеются хламидоспоры | |
Rhizopus nigricans | Колонии быстрорастущие войлочные и рыхловойлочные 1 - 1,5 см высотой, вначале оливково-зеленые или оливково-темно-зеленые, затем оливково- или буровато-серые, обычно наползающие на боковые стенки и крышку чашки Петри. Столоны хорошо выражены. Розоиды темно-коричневые, разветвленные, хорошо развитые. Спорангиеносцы обычно прямые, неразветвленные, бурые или темно-бурые, [500 - 3000 - (4000)] x (10 - 35) мкм; отходят пучком по 2 - 3 - 5 мкм, реже от шейки ризоида. Спорангии (50) - 80 - 250 (350) мкм в диаметре, черноватые. Колонка шаровидная или приплюснуто-шаровидная, крупная - (40) - 50 - 120 - (150) мкм в диаметре, бледно-бурая. Апофиза блюдцевидная. Споры эллиптически-шаровидные или неправильной формы, сильно угловатые, с продольной исчерченностью, серые или бледно-коричневато-серые, [4 - 12 - (16)] x [4 - 10 - (12)] мкм. Хламидоспоры отсутствуют |
Rhizopus cohnii | Колонии быстрорастущие, рыхловойлочные или пушисто-рыхло-войлочные, со слабо или хорошо развитым воздушным вегетативным мицелием, 0,2 - 0,6 - (1) см высоты, сначала серые или темно-серые, затем становятся свинцово- или синевато-темно-серыми. Ризоиды слабо выражены, неразветвленные или коротко и слабо разветвленные, коричневатые. Столоны слабо выраженные. Спорангиеносцы темно-коричневые или бледно-буроватые, простые или с раздвоенной или мутовчато разветвленной верхушкой, отходят по 1 - 3 - (5) мкм от шейки ризоида или столоновидных гиф; длина их 75 - 500 - (700) мкм, толщина (6) - 10 - 20 мкм. Спорангии 40 - 120 - (140) мкм в диаметре. Колонка чаще эллиптически-цилиндрическая или обратногрушевидная, [20 - 70 - (100)] x [20 - 60 - (80)] мкм, вначале синевато-серая, затем коричневатая. Апофиза блюдцевидная. Споры шаровидные, гладкие, бледно-голубоватые, в массе синевато-черные, 4 - 6 - (7) мкм в диаметре. Имеются довольно многочисленные хламидоспоры |
Род Absidia Колонии с развитым воздушным мицелием, обычно пушистые и светлоокрашенные. Ризоиды обычно имеются - неокрашенные, простые (стержневидные) или разветвленные, столоны выражены в различной степени. Спорангиеносцы простые или с 1 - 2 - (3) боковыми веточками, отходят мутовкой или одиночно большей частью от вершины дуги столона. Спорангии (без учета апофизы) шаровидные или слегка яйцевидные, мелкие. Колонка полушаровидная, короткоконическая, реже сосочковидная; гладкая или с коническим выступом, булавовидным придатком или с зубчиками; иногда впячивается в полость апофизы. Апофиза воронковидная, реже бокаловидная, придает спорангию обратногрушевидную форму. Споры мелкие, различной формы. Могут иметь хламидоспоры и жировые клетки - крупные шаровидные или другой формы клетки, обычно наполненные каплями жира | |
Absidia corymbifera | Колонии пушистые, превышают 0,3 см высоты, вначале неокрашенные или бледно-пепельного цвета, затем становящиеся пепельными или пепельными с бледно-зеленоватым оттенком, обратная сторона часто желтая или золотисто-желтая. Столоны слабо выраженные. Спорангиеносцы отходят одиночно от столоновидных гиф или являются продолжением последних, до 400 - (600) мкм длины. Апофиза воронковидная. Споры гладкие, эллиптически-шаровидные и эллиптические, [3,5 - 6 - (7)] x [3,5 - 5,5 - (6,5)] мкм. В субстрате и над субстратом образуются жировые клетки различной формы, чаще крестообразные или неправильно шаровидные, до 150 - (200) мкм в диаметре, бледно-серые или неокрашенные. Хламидоспоры отсутствуют |
Absidia ramosa | Колонии пушистые или войлочно-пушистые, 0,7 - 1,5 см высоты, вначале неокрашенные или бледно-серые, затем становящиеся серыми, синевато-серыми, оливково-серыми, иногда с желтоватой или золотисто-желтоватой обратной стороной. Столоны слабо выраженные, неокрашенные или бледно-оливковые. Ризоиды разветвленные. Спорангиеносцы отходят одиночно от столоновидных гиф или являются продолжением последних; прямые или слегка изогнутые, [(6) - 100 - 400 - (600)] x [4 - 10 - (14)] мкм; неразветвленные или с мутовкой веточек до 200 мкм длины ниже верхушечного спорангия. Спорангии шаровидные (без учета апофизы) или слегка яйцевидные, 10 - 80 - (120) мкм в диаметре, серые или темно-серые. Колонка полушаровидная, эллиптически-шаровидная, иногда слегка коническая, [10 - 50 - (60)] x [6 - 40 (50)] мкм, буровато-серая или коричневатая, гладкая или, реже, 1 - 3 - (5) мкм мелкими зубчиками, иногда впячивается в полость апофизы. Апофиза воронковидная, темно-серая или буровато-серая. Споры неокрашенные, короткоцилиндрические, более или менее усеченные на концах, или эллиптически-цилиндрические, [3,5 - 6 - (8)] x [2 - 4 - (5)] мкм. Жировые клетки немногочисленные, образуются в субстрате, шаровидные или неправильно шаровидные, до 100 мкм в диаметре. Хламидоспоры отсутствуют |
УДК 619:619-013.11:576.8.093.4 (083.74):006.354 | МКС 67.120.30 |
Ключевые слова: средства воспроизводства животных, сперма свежеполученная, разбавленная и замороженная, сперма сельскохозяйственных животных, методы микробиологических исследований, условно-патогенная микрофлора, микроскопические грибы, дрожжи, определение патогенности микроорганизмов | |