СПРАВКА
Источник публикации
М.: ИПК Издательство стандартов, 2001
Примечание к документу
Документ утратил силу на территории Российской Федерации с 1 июля 2011 года в связи с изданием Приказа Росстандарта от 04.08.2010 N 202-ст. Взамен введен в действие ГОСТ Р 53853-2010.
Документ включен в Перечень стандартов, содержащих правила и методы исследований (испытаний) и измерений, в том числе правила отбора образцов, необходимые для применения и исполнения требований технического регламента Таможенного союза "О безопасности пищевой продукции" (ТР ТС 021/2011) и осуществления оценки (подтверждения) соответствия продукции (Решение Комиссии Таможенного союза от 09.12.2011 N 880).
С 1 июля 2003 года до вступления в силу технических регламентов акты федеральных органов исполнительной власти в сфере технического регулирования носят рекомендательный характер и подлежат обязательному исполнению только в части, соответствующей целям, указанным в пункте 1 статьи 46 Федерального закона от 27.12.2002 N 184-ФЗ.
Ограничение срока действия снято по Протоколу N 4-93 Межгосударственного совета по стандартизации, метрологии и сертификации ("ИУС", N 4, 1994).
Документ введен в действие с 1 июля 1980 года.
Название документа
"ГОСТ 23481-79. Межгосударственный стандарт. Мясо птицы. Метод гистологического анализа"
(утв. и введен в действие Постановлением Госстандарта СССР от 07.02.1979 N 487)
(ред. от 01.12.1989)
"ГОСТ 23481-79. Межгосударственный стандарт. Мясо птицы. Метод гистологического анализа"
(утв. и введен в действие Постановлением Госстандарта СССР от 07.02.1979 N 487)
(ред. от 01.12.1989)
Утвержден и введен в действие
Постановлением Государственного
комитета СССР по стандартам
от 7 февраля 1979 г. N 487
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЯСО ПТИЦЫ
МЕТОД ГИСТОЛОГИЧЕСКОГО АНАЛИЗА
Poultry meat. Method of histological analysis
ГОСТ 23481-79
Список изменяющих документов (в ред. Изменения N 1, утв. в октябре 1984 г., Изменения N 2, утв. в декабре 1989 г.) |
Группа Н19
ОКСТУ 9210
Дата введения
1 июля 1980 года
1. Разработан и внесен Министерством мясной и молочной промышленности СССР.
2. Утвержден и введен в действие Постановлением Государственного комитета СССР по стандартам от 07.02.79 N 487.
3. Введен впервые.
4. Ссылочные нормативно-технические документы
Обозначение НТД, на который дана ссылка | Номер пункта |
ГОСТ 2290-76 | |
ГОСТ 24104-88 | |
5. Ограничение срока действия снято по протоколу N 4-93 Межгосударственного Совета по стандартизации, метрологии и сертификации (ИУС 4-94).
6. Издание с Изменениями N 1, 2, утвержденными в октябре 1984 г., декабре 1989 г. (ИУС 2-85, 4-90).
Настоящий стандарт распространяется на мясо птицы (тушки кур, цыплят, цыплят-бройлеров, цесарят, цесарок, перепелов, уток, утят, гусей, гусят, индеек, индюшат) и устанавливает метод гистологического анализа при определении степени свежести мяса при сомнении в оценке его качества.
(Измененная редакция, Изм. N 2).
1.1. (Исключен, Изм. N 1).
1.2. Отбирают три образца (тушки). Мороженые тушки размораживают. Из образцов вырезают пробы мышечной ткани площадью не менее 1 см2 на всю глубину мышцы, почки и легкие. Места взятия проб предварительно обрабатывают этиловым спиртом с массовой долей 96% по ГОСТ 5962.
(Измененная редакция, Изм. N 1, 2).
1.3. Пробу вырезают из мест, наиболее быстро подвергающихся порче:
из внутренних брюшных мышц;
из мышц в области шейного зареза;
из почек и легких при наличии их в тушках;
из любых других участков тушки, сомнительных по свежести.
1.4. К каждой пробе со стороны противоположной наружной ее поверхности прикрепляют с помощью иголки и нитки этикетку из плотной белой бумаги, заполненную графитным карандашом, с указанием номера пробы и даты ее взятия.
1.5. При отправке проб в лабораторию, расположенную вне предприятия, все пробы с этикетками помещают в стеклянную банку и заливают водным раствором формалина с массовой долей 10%, который готовят добавлением к одной части раствора формалина с массовой долей 40% по ГОСТ 1625 четырех частей питьевой воды по ГОСТ 2874 <*>. Банку с пробами плотно укупоривают и сопровождают документом, в котором указывают:
наименование предприятия, выработавшего мясо птицы;
номер пробы, вид птицы, номер образца, наименование мышцы или место взятия пробы, органолептическую характеристику партии мяса птицы по ГОСТ 7702.0;
наименование предприятия, на котором отобраны образцы;
причины и цели анализа;
подписи и должности лиц, отобравших пробы;
дату и час взятия пробы.
(Измененная редакция, Изм. N 1, 2).
--------------------------------
<*> На территории Российской Федерации действует ГОСТ Р 51232-98.
2.1. Микротом замораживающий типа X с металлическим шлангом, набором ножей и принадлежностями для точки микротомных ножей (два камня и ремень) и двуокисью углерода газообразной по ГОСТ 8050 или замораживающим устройством с селеновым выпрямителем TOC-II.
Микроскоп ТУ 3-3, ЭД1-404-87 или другого аналогичного типа.
Осветитель ОИ-19.
Весы лабораторные второго класса по ГОСТ 24104. Ножницы медицинские по ГОСТ 21239.
Иглы препаровальные гистологические.
Скальпель медицинский по ГОСТ 21240.
Пинцет медицинский по ГОСТ 21241.
Иглы препаровальные или зонды зубоврачебные.
Бальзам пихтовый по ГОСТ 2290.
Метиленовый синий.
Эозин спирторастворимый.
Бура по ГОСТ 8429.
Кислота уксусная ледяная, х.ч., по ГОСТ 61.
Ксилол по ГОСТ 9949.
Ацетон по ГОСТ 2603.
Глицерин дистиллированный по ГОСТ 6824.
Вода дистиллированная по ГОСТ 6709.
Белок свежего яйца.
Тимол.
Масло вазелиновое медицинское по ГОСТ 3164.
Спирт этиловый ректификованный по ГОСТ 5962 <*>.
--------------------------------
<*> На территории Российской Федерации действует ГОСТ Р 51652-2000.
Тушь черная.
Кальций углекислый по ГОСТ 4530.
Формалин технический по ГОСТ 1625.
Бумага фильтровальная лабораторная по ГОСТ 12026.
Стекла покровные для микропрепаратов по ГОСТ 6672.
Стекла предметные для микропрепаратов по ГОСТ 9284.
Цилиндр 1-100 по ГОСТ 1770.
Колба Кн-1-100 29/32 ТС по ГОСТ 25336.
Чашка ЧКЦ-1-100 по ГОСТ 25336.
Стаканчик СВ-34/12 или СН-85/15 по ГОСТ 25336.
Чашка ЧБН-2 по ГОСТ 25336.
Банки для медикаментов широкогорлые с притертыми пробками.
Воронка ВФ-3-100 ХС по ГОСТ 25336.
Спиртовка СЛ-1 по ГОСТ 25336.
Пипетка 4(5)-1-5 по НТД.
Допускается применение аналогичных средств измерения с метрологическими характеристиками и оборудования с техническими характеристиками не хуже, а реактивов по качеству не ниже указанных в настоящем стандарте.
(Измененная редакция, Изм. N 1, 2).
3.1. Подготовка посуды
Вся посуда для гистологического анализа должна быть тщательно вымыта и высушена. Предметные и покровные стекла подвергают обезжириванию в спирте.
3.2. Приготовление спиртового раствора метиленовой сини с массовой долей 1%
1 г метиленовой сини растворяют в 100 см3 этилового спирта с массовой долей 70%.
3.3. Приготовление спиртового раствора эозина с массовой долей 1%
1 г спирторастворимого эозина растворяют в 100 см3 этилового спирта с массовой долей 70%.
3.2, 3.3. (Измененная редакция, Изм. N 2).
3.4. Приготовление водного раствора метиленовой сини с бурой
2 г буры и 1 г метиленовой сини растворяют в 100 см3 подогретой дистиллированной воды. Раствору дают один раз вскипеть и оставляют на длительное время (месяц и больше) для созревания.
3.5. Приготовление смеси для окрашивания срезов
Смесь составляют из трех растворов: первого - спиртового раствора метиленовой сини с массовой долей 1%; второго - спиртового раствора эозина с массовой долей 1%; третьего - водного раствора метиленовой сини с бурой.
Сливают равные объемы первого и второго растворов (по 10 - 15 капель каждого), 5 - 10 капель третьего раствора и дистиллированную воду в двукратном отношении к общему объему трех растворов.
Смесь готовят непосредственно перед употреблением.
(Измененная редакция, Изм. N 2).
3.6. Подготовка пробы к анализу
3.6.1. Из пробы вырезают кусочки 0,5 см2 на всю глубину ее, прикрепляют к ним этикетку в соответствии с п. 1.4, помещают их в колбу с раствором формалина с массовой долей 10%, взятым в десятикратном объеме, и подогревают в вытяжном шкафу до появления пузырьков воздуха. Содержимое слегка встряхивают и вновь подогревают до появления пузырьков. Эту операцию повторяют 3 раза.
(Измененная редакция, Изм. N 2).
3.6.2. Формалин сливают, в колбу вставляют стеклянную воронку и промывают пробы холодной проточной водой в течение 5 - 7 мин.
3.6.3. Промытые пробы помещают на столик замораживающего микротома и ориентируют его так, чтобы в срез попадали все слои пробы по глубине, а мышечные волокна по своей длине располагались параллельно лезвию ножа. Срезы готовят толщиной 15 - 30 мкм. Почки и легкие ориентируют только по глубине.
3.6.4. Срезы осторожно снимают кисточкой с лезвия ножа и помещают в чашку Петри с дистиллированной водой на несколько секунд для распрямления. Под неповрежденные среды подводят предметное стекло, предварительно покрытое смесью белка яйца с глицерином (2:1), поочередно извлекают срезы из воды с помощью препаровальной иглы и расправляют их на предметном стекле. Выравненные срезы аккуратно накрывают сложенной в три слоя фильтровальной бумагой и, нажимая пальцами, приклеивают их к предметному стеклу.
Предметные стекла со срезами помещают в чашку Петри.
3.6.5. Наклеенные срезы окрашивают смесью метиленовой сини с эозином. Красящую смесь набирают в пипетку и наносят ровным слоем на срезы, находящиеся на предметном стекле. Через 20 - 30 мин срезы промывают дистиллированной водой из пипетки.
Для дифференцирования срезы обрабатывают водой, подкисленной уксусной кислотой (1 - 2 капли кислоты на 100 см3 воды) в течение 1 мин, после чего их промывают дистиллированной водой в течение 5 - 10 мин.
3.6.6. После окрашивания последовательно наносят пипеткой на срезы обезвоживающие растворы, составленные из смеси ацетона с ксилолом и ксилола по табл. 1.
Таблица 1
Номер раствора | Количество частей ацетона | Количество частей ксилола | Продолжительность обработки |
1 | 95 | 5 | 40 - 60 с |
2 | 70 | 30 | 5 - 6 мин |
3 | 30 | 70 | 5 - 10 мин |
4 | - | 100 | 5 мин |
Остатки растворов со срезов на предметных стеклах удаляют фильтровальной бумагой.
3.6.7. Окрашенные и обезвоженные срезы заключают нанесением капли пихтового бальзама и покрывают покровным стеклом с помощью прямой препаровальной иглы или анатомического пинцета так, чтобы избежать образования пузырьков воздуха между предметным и покровным стеклами.
На готовый препарат наклеивают этикетку с указанием номера пробы.
4.1. Готовый препарат устанавливают на предметном столике микроскопа и изучают сначала при малом увеличении объектива 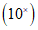 , затем при среднем
, затем при среднем  , реже - под иммерсией
, реже - под иммерсией 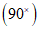 .
.
4.2. Микроскопические структуры на препарате должны быть окрашены в цвета: ядра клеток - в темно-синий, протоплазма клеток - в бледно-синий с розоватым оттенком, бактерии - в фиолетовый. Бактерии по размерам значительно уступают клеточным ядрам. Обычно они имеют шарообразную или палочковидную форму и располагаются скоплениями.
4.3. Свежесть мяса устанавливают по микроструктурным характеристикам в соответствии с табл. 2 и 3.
Наименование показателя | Микроструктурная характеристика мяса птицы | ||
свежего | сомнительной свежести | несвежего | |
Состояние структуры ядер мышечных волокон | Структура ядер мышечных волокон четко выражена | Структура ядер мышечных волокон плохо различима - кариопикноз (сжатие ядер) | Кариорексис - распад ядер или кариолизис - растворение их в большинстве мышечных волокон |
Состояние поперечной и продольной исчерченности в мышечных волокнах | Поперечная и продольная исчерченность четко выражена | Поперечная и продольная исчерченность слабо выражена | Полное исчезновение поперечной и продольной исчерченности мышечных волокон |
Способность мышечных волокон к окраске | Окраска мышечных волокон яркая, равномерная | Окраска мышечных волокон ярко понижена и неравномерна | Окраска мышечных волокон слабо выражена |
Локализация и размножение микрофлоры в мышечной ткани | Допускаются единичные очажки кокковой микрофлоры в местах разреза и в прослойках рыхлой соединительной ткани | Многочисленные очаги кокковой и палочковидной микрофлоры проникают в эндомизий и перимизий мышечных волокон | Усиленное размножение палочковидной микрофлоры и проникновение ее в глубь мышечных волокон |
Наименование показателя | Микроструктурная характеристика почек и легких | ||
в тушках свежего мяса | в тушках мяса сомнительной свежести | в тушках несвежего мяса | |
Состояние почечной ткани | Почечный эпителий извитых канальцев, мальпигиевы клубочки, корковый и мозговой слои четко выражены | Разрушен почечный эпителий извитых канальцев. Стерты границы между канальцами. Ядра разрушены и растворены во многих канальцах | Прямые и извитые канальцы разрушены, распад почечной ткани |
Локализация и размножение микрофлоры в почке | Микрофлора в виде отдельных очажков в полостях прямых канальцев | Кокковая и палочковидная микрофлора в виде очагов в местах разрушенных канальцев | Скопление колоний микрофлоры в местах разрушения почечной ткани |
Состояние паренхимы легкого | Паренхима легкого сохранена, клетки респираторных капилляров не нарушены | Паренхима легкого инфильтрована многочисленными ячеями воздуха, эпителий респираторных капилляров разрушен | Расслоение паренхимы с образованием крупных воздухоносных полостей. Отторжение кусков легкого |
Локализация и размножение микрофлоры в легком | Единичные очаги кокковой микрофлоры в полостях бронхов | Многочисленные очаги кокковой и палочковидной микрофлоры вокруг магистрального бронха, в стенках и просветах сосудов | Скопления колоний палочковидной микрофлоры повсеместно, в местах разрушения легочной ткани |
4.4. Результаты гистологического анализа мяса птицы (тушек) сопоставляют с микроструктурной характеристикой, данной в табл. 2 и 3.