СПРАВКА
Источник публикации
М.: Стандартинформ, 2020
Примечание к документу
Документ введен в действие с 01.06.2020.
Название документа
"ГОСТ Р 58706-2019. Национальный стандарт Российской Федерации. Продукция пищевая специализированная. Определение токсинов T-2 и HT-2 в зерновых и пищевой продукции для питания детей раннего возраста на зерновой основе методом ВЭЖХ-МС/МС после твердофазной очистки"
(утв. и введен в действие Приказом Росстандарта от 29.11.2019 N 1314-ст)
"ГОСТ Р 58706-2019. Национальный стандарт Российской Федерации. Продукция пищевая специализированная. Определение токсинов T-2 и HT-2 в зерновых и пищевой продукции для питания детей раннего возраста на зерновой основе методом ВЭЖХ-МС/МС после твердофазной очистки"
(утв. и введен в действие Приказом Росстандарта от 29.11.2019 N 1314-ст)
Содержание
Приказом Федерального агентства
по техническому регулированию
и метрологии
от 29 ноября 2019 г. N 1314-ст
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРОДУКЦИЯ ПИЩЕВАЯ СПЕЦИАЛИЗИРОВАННАЯ
ОПРЕДЕЛЕНИЕ ТОКСИНОВ T-2 И HT-2 В ЗЕРНОВЫХ И ПИЩЕВОЙ
ПРОДУКЦИИ ДЛЯ ПИТАНИЯ ДЕТЕЙ РАННЕГО ВОЗРАСТА НА ЗЕРНОВОЙ
ОСНОВЕ МЕТОДОМ ВЭЖХ-МС/МС ПОСЛЕ ТВЕРДОФАЗНОЙ ОЧИСТКИ
Foods for special dietary uses. Determination of T-2 and
HT-2 toxins in cereals and cereal based products for infant
and young children by HPLC-MS/MS after SPE-cleanup
ГОСТ Р 58706-2019
ОКС 67.060
Дата введения
1 июня 2020 года
1 РАЗРАБОТАН Федеральным государственным унитарным предприятием "Российский научно-технический центр информации по стандартизации, метрологии и оценке соответствия" (ФГУП "СТАНДАРТИНФОРМ")
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 036 "Продукция специализированная пищевая".
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 29 ноября 2019 г. N 1314-ст
4 Настоящий стандарт разработан с учетом основных нормативных положений стандарта ДИН ЕН 16923:2017 "Продукты пищевые. Определение токсинов T-2 и HT-2 в зерне и зерновых продуктах для детей грудного и младшего возраста методом высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии (ВЭЖХ-МС/МС) после очистки методом твердофазной экстракции (ТФЭ)" (DIN EN 16923:2017 "Foodstuffs - Determination of T-2 toxin and HT-2 toxin in cereals and cereal products for infants and young children by LC-MS/MS after SPE cleanup", NEQ)
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Токсин T-2 и его метаболит токсин HT-2 относятся к группе трихотеценовых микотоксинов, продуцируемых некоторыми видами семейства плесневых грибов рода фузариум. В основном заражаются злаки: кукуруза, пшеница, ячмень, овес и рожь.
ВНИМАНИЕ! Если выполняют какие-либо действия с опасными химическими веществами, то следует принять соответствующие меры предосторожности и защиты, а также необходимо соблюдать требования безопасности по ГОСТ 12.1.007, ГОСТ 12.1.004, ГОСТ 12.1.005, ГОСТ 12.1.019, ГОСТ 12.4.009, ГОСТ 12.4.021.
ВНИМАНИЕ! При использовании настоящего стандарта могут применяться опасные вещества, действия и оборудование. Настоящий стандарт не решает все проблемы безопасности, связанные с его применением. Пользователь настоящего стандарта несет ответственность за принятие соответствующих мер по технике безопасности и охране здоровья, а также определяет необходимые ограничительные предписания перед его применением.
ВНИМАНИЕ! Известно, что токсин T-2 и его метаболит токсин HT-2 обладают канцерогенными свойствами.
Настоящий стандарт устанавливает метод определения токсинов T-2 и HT-2 посредством высокоэффективной жидкостной хроматографии (ВЭЖХ, HPLC) в сочетании с тандемной масс-спектрометрией (МС/МС) после очистки методом твердофазной экстракции (ТФЭ, SPE) в зерновых и пищевой продукции для питания детей раннего возраста на зерновой основе.
Метод валидирован для определения токсина HT-2 в овсяной муке с концентрацией 9,3 и 28,1 мкг/кг, в овсяных хлопьях с концентрацией 16,5 и 21,4 мкг/кг и в сухих завтраках (с содержанием овсяных хлопьев) с концентрацией 8,1 мкг/кг и для токсина T-2 в овсяной муке с концентрацией от 4,4 до 8,3 мкг/кг, в овсяных хлопьях с концентрацией от 4,9 до 6,6 мкг/кг, а также для сухих завтраков (с содержанием овсяных хлопьев) с концентрацией 3,5 мкг/кг.
Лабораторные исследования показали, что этот метод также применим к сильно разбухающим продуктам (овсяная каша на основе сухих зерновых культур и модифицированный крахмал). Однако эти продукты не были проверены в ходе валидации данного метода. Более подробное описание приведено в 6.3.
Данный метод допускается применять к побочным продуктам переработки овса с более высокой концентрацией токсинов T-2 и HT-2. В этом случае следует учитывать этапы разбавления.
Этот метод допускается применять к зерну и зерновым продуктам на основе пшеницы, ячменя и риса для питания детей раннего возраста. В этом случае необходимо проверить метод на всех продуктах в лабораторных условиях (внутренняя валидация). В ходе межлабораторных испытаний проверяется диапазон от 10 до 100 мкг/кг. Предварительные исследования показали, что этот метод охватывает весь диапазон концентраций, несмотря на то, что данный способ был применен только в диапазоне от 3 до 28,1 мкг/кг.
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 12.1.004 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.005 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12.1.019 Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
ГОСТ 12.4.009 Система стандартов безопасности труда. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание
ГОСТ 12.4.021 Система стандартов безопасности труда. Системы вентиляционные. Общие требования
ГОСТ 1770 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 28311 Дозаторы медицинские лабораторные. Общие технические требования и методы испытаний
ГОСТ 33303 Продукты пищевые. Методы отбора проб для определения микотоксинов
ГОСТ Р 52501 (ИСО 3696:1987) Вода для лабораторного анализа. Технические условия
ГОСТ 6709 Вода дистиллированная. Технические условия
ГОСТ 6995 Реактивы. Метанол-яд. Технические условия
ГОСТ ISO 7886-1 Шприцы инъекционные однократного применения стерильные. Часть 1. Шприцы для ручного использования
ГОСТ OIML R 76-1 Государственная система обеспечения единства измерений. Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ Р ИСО 5725-1 Точность (правильность и прецизионность) методов и результатов измерений. Часть 1. Основные положения и определения
ГОСТ Р ИСО 5725-2 Точность (правильность и прецизионность) методов и результатов измерений. Часть 2. Основной метод определения повторяемости и воспроизводимости стандартного метода измерений
ГОСТ Р ИСО 5725-3 Точность (правильность и прецизионность) методов и результатов измерений. Часть 3. Промежуточные показатели прецизионности стандартного метода измерений
ГОСТ Р ИСО 5725-4 Точность (правильность и прецизионность) методов и результатов измерений. Часть 4. Основные методы определения правильности стандартного метода измерений
ГОСТ Р ИСО 5725-5 Точность (правильность и прецизионность) методов и результатов измерений. Часть 5. Альтернативные методы определения прецизионности стандартного метода измерений
ГОСТ Р ИСО 5725-6 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
Токсины T-2 и HT-2 экстрагируют водным раствором ацетонитрила путем встряхивания вручную или перемешивания на лабораторном смесителе. Отфильтрованный и разбавленный экстракт очищают и концентрируют в колонке для твердофазной экстракции или в пропускной колонке. Содержание токсинов определяют методом ВЭЖХ в сочетании с тандемной масс-спектрометрией.
Если не указано иное, используют только химические чистые реактивы для анализа (ч.д.а) и воду 1-й степени чистоты в соответствии с ГОСТ Р 52501. Если не указано иное, чистота растворителей должна быть соответствующей степени чистоты для ВЭЖХ.
4.2 Метанол по ГОСТ 6995, для ВЭЖХ.
4.3 Смесь растворителей. 20 частей ацетонитрила (4.1) смешивают с 80 частями воды (20 + 80, B + B).
4.4 Смесь для экстрагирования. 84 части ацетонитрила (4.1) смешивают с 16 частями воды (84 + 16, B + B).
4.5 Элюент для ВЭЖХ-МС/МС. Примеры элюентов, подходящих для систем ВЭЖХ-МС/МС, приведены в приложении А. Раствор фильтруют через мембранный фильтр (5.18).
4.12 Получение разбавленного силилирующего агента (дополнительно), например, 50 см3 силилирующего агента (4.10) смешивают с 950 см3 циклогексана (4.11).
4.14 Раствор аммиака, молярная концентрация c(NH3) = 13400 моль/м3 или массовая концентрация p(NH3) = 250 г/дм3.
4.16 Материал, защищающий от засорения (препятствующий закупориванию), например промытый морской песок, стеклянные или полиэтиленовые шарики (дополнительно).
4.19 Раствор внутреннего стандарта меченого изотопом токсина [13C24]-T-2, p = 25 мкг/см3, в ацетонитриле. В качестве [13C24]-токсина-T-2 можно также использовать и другие внутренние стандарты токсина T-2, меченые изотопом.
4.20 Раствор внутреннего стандарта меченого изотопом токсина [13C22]-HT-2, p = 25 мкг/см3, в ацетонитриле. В качестве [13C22]-токсина-HT-2 можно также использовать и другие внутренние стандарты токсина HT-2, меченые изотопом.
Пипеткой отбирают по 25 мм3 основных растворов токсинов T-2 и HT-2 (4.17 и 4.18) в мерную колбу объемом 5 см3 и добавляют смесь растворителей до метки (4.3).
Раствор допускается хранить 12 мес при температуре минус 18 °C.
Растворы внутренних стандартов токсинов по 200 мм3 (4.19 и 4.20) разбавляют в мерной колбе объемом 5 см3 смесью растворителей (4.3).
Такой раствор допускается хранить 6 мес при температуре минус 18 °C.
Для градуировки измерительной системы готовят градуировочные растворы с массовой концентрацией от 5 до 100 нг/см3.
Градуировочные растворы приведены в таблице 1.
Таблица 1
Градуировочный раствор | Массовая концентрация каждого аналита, нг/см3 | Массовая концентрация каждого аналита, меченого изотопом, нг/см3 | Смесь основных растворов токсинов (4.21), мм3 | Смесь растворов внутренних стандартов токсинов (4.22), мм3 | Смесь растворителей (4.3), мм3 |
Холостая или контрольная проба внутреннего стандарта (ВЭ) | 0 | 50 | - | 50 | 950 |
1 | 5 | 50 | 10 | 50 | 940 |
2 | 10 | 50 | 20 | 50 | 930 |
3 | 20 | 50 | 40 | 50 | 910 |
4 | 40 | 50 | 80 | 50 | 870 |
5 | 60 | 50 | 120 | 50 | 830 |
6 | 80 | 50 | 160 | 50 | 790 |
7 | 100 | 50 | 200 | 50 | 750 |
Применяют следующие лабораторные приборы:
5.1 Весы лабораторные по ГОСТ OIML R 76-1, предел погрешности: 0,01 г.
5.2 Весы аналитические, предел погрешности: 0,1 мг.
5.5 Дозатор ручной, шприцы микромиллилитровые по ГОСТ ISO 7886-1 или пипетки, от 10 мм3 до 5 см3.
5.6 Дозатор по ГОСТ 28311, на 20 см3.
5.8 Фильтр шприцевой (0,45 мкм) или центробежный фильтр (например, Durapore PVDF (0,45 мкм) или Millipore Ultrafree-MC, 0,5 см3, подходящие для центрифужных пробирок, например пробирка типа "Эппендорф".
5.10 Центрифуга лабораторная.
5.11 Картриджи пустые объемом 6 см3 из полипропилена (PP) и пористые пластины из полиэтилена (PE) или обычные колонки твердофазной экстракции, например CHROMABOND Carbon/Alox/Celite, 6 см3, 500 мг.
5.15 Пробирки по ГОСТ 1770, подходящие для объема до 10,0 см3.
5.16 Пробирки силанизированные (дополнительно).
Заранее тщательно очищенные пробирки (5.15) заполняют до края разбавленным силилирующим агентом (4.12) и оставляют на 1 мин. Затем раствор реагента выливают из пробирки в специальную емкость, чтобы использовать повторно. Пробирки промывают сначала циклогексаном (4.11), а затем ацетонитрилом (4.1) или метанолом (4.2). Промывочные растворы допускается использовать многократно. Далее пробирки дважды промывают дистиллированной водой по ГОСТ 6709 и просушивают.
ПРЕДУПРЕЖДЕНИЕ - Surfasil представляет собой раствор силилхлорида, который, вступая в реакцию с водой, образует пары соляной кислоты. Поэтому после дериватизации пробирки никогда не следует промывать водой.
Если подтверждена пригодность несиланизированных сосудов, то можно использовать, например, пробирки из полипропилена.
5.17 Система для упаривания, например TurboVap LV Zymark или аналог.
5.19.2 Система ввода образцов.
5.19.3 Колонка хроматографическая, например октадецилсилан (ODS), который обеспечивает разрешение пиков токсинов T-2 и HT-2 более одного для распознавания от других сигналов, длина 150 мм, внутренний диаметр 2,00 мм, размер частиц 5 мкм, подходящая предколонка с обращенной фазой.
Также можно использовать колонки других размеров.
5.19.4 Термостат для колонок.
5.19.5 Масс-спектрометр тандемный (МС/МС).
Перед началом анализа по ГОСТ 33303 или другим нормативным документам, действующим на территории государства, принявшего стандарт, образец измельчается до однородного состояния, размер частиц не должен превышать 1 мм.
42 г активированного угля (4.7) смешивают с 30 г нейтрального оксида алюминия (4.8) и 18 г целита 545 (4.9) в стеклянной пробирке объемом 500 см3 (соотношение компонентов в смеси 7:5:3 - активированный уголь/оксид алюминия нейтральный/целит 545; м/м/м) до однородного состояния в шейкере (5.13) в течение 1 ч, 0,5 г однородной смеси переносят в пустые картриджи объемом 6 см3 с тремя пористыми пластинами из полиэтилена (2 пластины внизу и 1 вверху для покрытия).
В качестве альтернативы допускается также использовать доступные колонки для твердофазной экстракции. Должна быть проверена эффективность разделения этих колонок и при необходимости проведена процедура очистки.
25,0 г однородного и мелко измельченного образца (6.1) взвешивают в химическом стакане/колбе Эрленмейера объемом 250 см3 или центрифужной пробирке объемом 250 см3 (5.7) с ценой деления 0,1 г, добавляют 100 см3 экстракционной смеси (4.4) и закрывают пробку. Смесь встряхивают вручную или на шейкере (5.13) в течение 1 ч при комнатной температуре.
В качестве альтернативного способа извлечения также используют лабораторный смеситель (5.14). В этом случае смесь перемешивают до однородного состояния в течение 3 мин с высокой скоростью.
После экстракции чуть больше 10 см3 экстракта фильтруют через складчатый фильтр (5.9) в стеклянную пробирку. Это количество центрифугируют в течение 10 мин при комнатной температуре при 2500 g. Удаляют 10 см3 надосадочной жидкости.
Для сильно набухающих пищевых продуктов, в которых содержание влаги в экстракционной среде увеличивается до 200%, навеску пробы уменьшают до 50% от описанного количества. Для предотвращения комкования набухающего материала добавляют, например, морской песок (4.16) в объеме, подходящем для массы образца.
Изменение объема и/или массы учитывают при окончательном расчете.
Подготовленную колонку с 0,5 г активированного угля/оксида алюминия/целита (6.2) помещают в систему для твердофазной экстракции (5.12) и подставляют пробирку (5.15) для сбора элюата. В колонку твердофазной экстракции добавляют 5,0 см3 экстракта (6.3) и собирают полученный элюат. При этом создают небольшое разрежение, чтобы скорость элюирования достигала от 1 до 2 капель в секунду. Картридж снова промывают 5 см3 экстракционной смеси (4.4) и также собирают элюат.
25 мм3 смеси растворов внутренних стандартов токсинов (4.22) добавляют к объединенным элюатам и высушивают до сухого состояния в атмосфере азота (4.6) в системе для упаривания (5.12) (30 мин при 45 °C и давлении газа 68 947,6 Па).
Остаток повторно растворяют в 500 мкл смеси растворителей (4.3), энергично встряхивая на лабораторном шейкере в течение 60 с (5.4). При необходимости выполняют процедуру в течение 5 мин в ультразвуковой ванне (5.3) при комнатной температуре. Для удаления имеющихся микрочастиц раствор фильтруют через шприцевой фильтр (5.8) или центробежный фильтр (0,45 мкм, 0,5 см3) при минимуме 10 000 g и получают пробу для ввода.
При необходимости допускается прервать очистку образца. Экстракты образцов (сгущенные до сухого состояния) хранятся без потери аналита в течение нескольких дней при температуре 4 °C и примерно две недели при температуре минус 18 °C.
Если содержание аналитов превышает диапазон градуировки, то остаток следует растворить в смеси растворителей объемом более 500 мм3.
6.5 Определение методом ВЭЖХ-МС/МС
В зависимости от системы ВЭЖХ-МС/МС вводят пробу в объеме от 10 до 25 мм3 в соответствии с 6.4.
Применяемую систему измерения настраивают, отмеряя нужный объем аналитов и подбирая оптимальные параметры разделения и обнаружения. В приложении Б приведены некоторые примеры хроматограмм на рисунках Б.1 - Б.4, а в приложении А приведены примерные параметры.
Применяемые измерительные системы должны соответствовать требованиям, представленным в таблице 2.
Таблица 2
Аналит | Минимальное соотношение сигнал/шум для количественной оценки | Минимальное отношение сигнал/шум для подтверждения |
Токсин T-2 | 50:1 при 250 пг <*> | 30:1 при 250 пг |
Токсин HT-2 | 10:1 при 250 пг | 5:1 при 250 пг |
[13C24]-токсин-T-2 | 50:1 при 250 пг | 30:1 при 250 пг |
[13C22]-токсин-HT-2 | 10:1 при 250 пг | 5:1 при 250 пг |
<*> 250 пг - это расчетная абсолютная масса аналита, которая вводится непосредственно в колонку. Сигнал - высота пика, а шум - линейный шум, наблюдаемый на хроматограмме извлеченных ионов. | ||
6.6 Идентификация
Токсины T-2 и HT-2 идентифицируют в результате сравнения времени удерживания основного раствора и раствора исследуемого образца.
Аналит распознают на основе не менее двух массовых переходов. Кроме того, время удерживания (пики в обоих массовых переходах) и относительная площадь двух пиков должны совпадать с аналогичными данными стандартного вещества.
В качестве внутреннего стандарта при количественном определении токсинов T-2 и HT-2 используют соответствующий внутренний стандарт, меченый изотопом. Многоточечную градуировку выполняют с помощью внутреннего стандарта, например в соответствии с таблицей 1.
Для линейной регрессии рассматривают графическую зависимость отношения площади пиков всех аналитов и отношения соответствующей концентрации. Массовую концентрацию каждого токсина в пробе получают из линейной регрессии, выраженной в нг/мл, по уравнению
 , (1)
, (1)где Aa - площадь пика аналита в градуировочном растворе (4.23);
AВЭ - площадь пика внутреннего стандарта в градуировочном растворе (4.23);
Acal - наклон калибровочной прямой, определяемой градуировочными растворами (4.23);
pa - концентрации массы аналитов в градуировочных растворах (4.23), нг/см3;
pВЭ - концентрация внутреннего стандарта в градуировочном растворе (4.23), равная 50 нг/см3;
bcal - точка пересечения градуировочных прямых, определяемая градуировочными растворами (4.23).
Концентрацию массы аналита в растворе образца  , нг/см3, вычисляют по формуле
, нг/см3, вычисляют по формуле
 (2)
(2)где  - площадь (аналитический сигнал) аналита в исследуемом растворе образца;
- площадь (аналитический сигнал) аналита в исследуемом растворе образца;
Массовую долю аналита wa, мкг/кг, вычисляют по формуле
 , (3)
, (3)где Vex - объем раствора для экстракции, равный 100 см3;
Vim - объем смеси растворителей, используемых для повторного растворения сгущенной пробы, равный 0,5 см3;
ms - масса навески, равная 25 г;
Vаликв - аликвотная доля экстракта опытного образца, равная 5 см3.
8.1 Общее положение
Межлабораторное испытание для определения точности метода приведено подробно в приложении В. Значения, полученные в результате подобного межлабораторного испытания, не обязательно применимы к диапазонам концентраций и матрицам, которые отличаются от приведенных в приложении В.
8.2 Повторяемость
Абсолютная разница двух единичных результатов, полученных одним исследователем на одинаковых образцах на одном и том же оборудовании в течение минимального отрезка времени, будет превышать предел повторяемости r в таблицах 3 и 4 не чаще, чем в 5% случаев.
8.3 Воспроизводимость
Абсолютная разница двух единичных результатов, полученных одним исследователем на одинаковых образцах, будет превышать предел воспроизводимости R в таблицах 3 и 4 не чаще, чем в 5% случаев (согласно ГОСТ Р ИСО 5725-1, ГОСТ Р ИСО 5725-2, ГОСТ Р ИСО 5725-3, ГОСТ Р ИСО 5725-4, ГОСТ Р ИСО 5725-5, ГОСТ Р ИСО 5725-6).
Таблица 3
Проба | Среднее арифметическое | Предел повторяемости r, мкг/кг | Предел воспроизводимости R, мкг/кг |
Овсяная мука | 9,57 +/- 1,04 | 4,38 | 6,00 |
Овсяная мука | 26,5 +/- 3,38 | 5,18 | 16,2 |
Овсяные хлопья | 21,1 +/- 3,40 | 7,91 | 17,1 |
Овсяные хлопья | 15,7 +/- 2,60 | 9,17 | 14,2 |
Сухие завтраки с овсяными хлопьями | 8,46 +/- 1,02 | 5,42 | 6,65 |
Таблица 4
Проба | Среднее арифметическое | Предел повторяемости r, мкг/кг | Предел воспроизводимости R, мкг/кг |
Овсяная мука | 4,21 +/- 2,17 | 2,92 | 2,92 |
Овсяная мука | 7,92 +/- 2,25 | 2,71 | 3,38 |
Овсяные хлопья | 6,09 +/- 2,25 | 3,51 | 3,82 |
Овсяные хлопья | 4,58 +/- 2,20 | 2,55 | 2,87 |
Сухие завтраки с овсяными хлопьями | 3,40 +/- 2,20 | 2,39 | 2,63 |
Протокол испытаний должен содержать следующие минимальные данные:
- необходимые сведения для идентификации опытного образца (вид, происхождение, наименование);
- ссылку на настоящий стандарт;
- дату и способ отбора проб (если известен);
- дату поступления пробы;
- дату проведения испытания;
- результаты испытания и единицы, в которых они указаны;
- все особые признаки, установленные во время испытания;
- все рабочие операции, не установленные этим методом или рассматриваемые как необязательные и которые могут повлиять на результаты.
(обязательное)
А.1 Системные настройки для SCIEX API 4000TM и SCIEX API 4000TM QTrap
А.1.1 Настройки хроматографии
Эти и все другие хроматографические настройки в А.2.1, А.3.1 и А.4.1 следует рассматривать как ориентировочные значения. Точные условия для проведения хроматографии зависят от самой лаборатории, и поэтому допускается небольшое отличие параметров. Измерение эталонных растворов должно подтвердить пригодность аналитических растворов.
Разделительная колонка: | Phenomenex фенилгексил, размерами 125 x 2 мм, 5 мкм, с соответствующей предколонкой |
Объем вводимого вещества | 25 мкл |
Температура колонки: | 40 °C |
Скорость потока: | 0,2 см3/мин |
Элюент A: | вода |
Элюент B: | ацетонитрил (4.1) |
Схема градиента приведена в таблице А.1.
Таблица А.1
Время, мин | Элюент A, % | Элюент B, % |
0,0 | 99 | 1 |
8,0 | 99 | 1 |
32,0 | 20 | 80 |
32,0 | 99 | 1 |
40,0 | 99 | 1 |
А.1.2 Параметры детектора
Параметры источника и общие настройки масс-спектрометра (см. таблицу А.2).
Все последующие параметры детектора и параметры в А.2.2, А.3.2 и А.4.2 можно рассматривать в качестве ориентировочных значений. Точные условия для проведения измерений зависят от прибора, и поэтому допускается небольшое отличие параметров. Измерение стандартных растворов должно подтвердить пригодность аналитических растворов.
Ионизация: | химическая ионизация при атмосферном давлении (APCI, англ.: atmospheric pressure chemical ionization) |
Температура: | 350 °C |
Небулайзер: | 96527 Па |
Давление газа в ячейке соударения | 20684 Па |
Потенциал на входе (EP): | 10 эВ |
Напряжение на электроспрее: | |
Положительная ионизация: | 5500 В |
Давление газа ионного источника 1: | 241317 Па |
Давление газа ионного источника 2: | 413685 Па |
Разрешение на квадруполе 1: | единица измерения |
Разрешение на квадруполе 3: | единица измерения |
Специфические условия масс-спектрометрии приведены в таблице А.2.
Таблица А.2
Токсин | Полярность | Материнский ион | Ион-предшественник | Ион-продукт | Энергия столкновения | DP <*> | CXP <**> |
HT-2 | Положительная | (M+H)+ | 425,25 | 262,9 | 17 | 81 | 16,00 |
HT-2 | Положительная | (M+H)+ | 425,25 | 214,7 | 17 | 81 | 16,00 |
T-2 | Положительная | (M+H)+ | 467,35 | 305,1 | 17 | 45 | 18,79 |
T-2 | Положительная | (M+H)+ | 467,35 | 244,9 | 17 | 51 | 14,50 |
[13C24]-токсин-T-2 | Положительная | (M+H)+ | 491,38 | 321,9 | 15 | 36 | 22,00 |
[13C24]-токсин-T-2 | Положительная | (M+H)+ | 491,38 | 260,0 | 13 | 36 | 22,00 |
[13C22]-токсин-HT-2 | Положительная | (M+H)+ | 447,37 | 278,2 | 17 | 41 | 20,00 |
[13C22]-токсин-HT-2 | Положительная | (M+H)+ | 447,37 | 260,1 | 21 | 41 | 24,00 |
Потенциал столкновения на выходе из ячейки
Время удерживания: | токсин HT-2 и [13C22]-токсин-HT-2: | 9,68 мин |
токсин T-2 и [13C24]-токсин-T-2: | 10,30 мин |
А.2 Системные настройки для SCIEX API 2000TM
Хроматографическая колонка: | Phenomenex Gemini C18, размерами 150 x 3,0 мм, 5 мкм, с предколонкой Phenomonex Gemini C18, размерами 4 мм x 2,0 мм, 5 мкм |
Объем вкола: | 30 мм3 |
Температура колонки: | 35 °C |
Скорость потока: | 0,25 см3/мин |
Элюент A: | 0,1% раствор муравьиной кислоты в воде (4.13) |
Элюент B: | 0,1% раствор муравьиной кислоты в ацетонитриле (4.13) |
Схема градиента приведена в таблице А.3.
Таблица А.3
Время, мин | Элюент A, % | Элюент B, % |
0,0 | 70 | 30 |
0,1 | 70 | 30 |
10,0 | 10 | 90 |
15,0 | 10 | 90 |
16,0 | 70 | 30 |
35,0 | 70 | 30 |
Параметры источника и специфические настройки масс-спектрометрии (см. таблицу А.4):
Ионизация: | электрораспылительная ионизация (ESI, англ.: electrospray ionization) |
Температура: | 375 °C |
Небулайзер: | 206843 Па |
Давление газа в ячейке соударения (газ для соударений): | 20684 Па |
Потенциал декластеризации (разделения): | 11 эВ |
Потенциал фокусировки (FP): | 309 эВ |
Напряжение на электроспрее: | |
Положительная ионизация: | 5500 В |
Давление газа ионного источника 1: | 172369 Па |
Давление газа ионного источника 2: | 344738 Па |
Разрешение на квадруполе 1: | единица измерения |
Разрешение на квадруполе 3: | единица измерения |
Таблица А.4
Токсин | Полярность | Материнский ион | Ион-предшественник | Ион-продукт | Энергия столкновения | EP <*> | CEP | CXP <**> |
Токсин HT-2 | Положительная | (M+NH4)+ | 442,2 | 263,3 | 21 | 9,5 | 20 | 2 |
Токсин HT-2 | Положительная | (M+NH4)+ | 442,2 | 215,2 | 21 | 9,5 | 20 | 2 |
Токсин T-2 | Положительная | (M+NH4)+ | 484,4 | 215,2 | 29 | 8,5 | 22 | 6 |
Токсин T-2 | Положительная | (M+NH4)+ | 484,4 | 185,1 | 29 | 7,5 | 20 | 4 |
[13C24]-токсин-T-2 | Положительная | (M+NH4)+ | 508,3 | 229,2 | 29 | 7,0 | 22 | 6 |
[13C24]-токсин-T-2 | Положительная | (M+NH4)+ | 508,3 | 322,3 | 23 | 8,0 | 22 | 8 |
[13C22]-токсин-HT-2 | Положительная | (M+NH4)+ | 464,3 | 278,4 | 19 | 9,5 | 20 | 6 |
[13C22]-токсин-HT-2 | Положительная | (M+NH4)+ | 464,3 | +260,3 | 23 | 9,5 | 20 | 8 |
Время удерживания: | токсин HT-2 и [13C22]-токсин-HT-2: | 7,62 мин |
токсин T-2 и [13C24]-токсин-T-2: | 9,37 мин |
А.3 Системные настройки для SCIEX API 3000TM
Хроматографическая колонка: | Phenomenex Synergi Fusion RP 80, размерами 250 x 2 мм, 5 мкм, с картриджем Phenomenex Security Guard, 4 x 2 мм |
Объем вкола: | 10 мм3 |
Температура колонки: | 25 °C |
Скорость потока: | 0,2 см3/мин |
Элюент A: | 80 частей (1 л воды + 50 мм3 раствора аммиака (4.14); p = 6,25 г/дм3) + 20 частей элюента B |
Элюент B: |
Схема градиента приведена в таблице А.5
Таблица А.5
Время, мин | Элюент A, % | Элюент B, % |
0,0 | 100 | 0 |
25,0 | 37,5 | 62,5 |
26,0 | 100 | 0 |
36,0 | 100 | 0 |
Параметры источника и общие настройки масс-спектрометрии (см. также таблицу А.6):
Ионизация: | электрораспылительная ионизация (ESI, англ.: electrospray ionization) |
Температура: | 400 °C |
Газовая завеса: | 55158 Па |
Небулайзер: | 55158 Па |
Давление газа в ячейке соударения: | 27579 Па |
Потенциал на входе (EP): | 10 эВ |
Напряжение на электроспрее: | |
Положительная ионизация: | 4200 В |
Давление газа ионного источника 1: | 206843 Па |
Давление газа ионного источника 2: | 482633 Па |
Разрешение на квадруполе 1: | единица измерения |
Разрешение на квадруполе 3: | единица измерения |
Таблица А.6
Токсин | Полярность | Материнский ион | Ион-предшественник | Ион-продукт | Энергия столкновения | FP | DP <*> | CXP <**> |
Токсин HT-2 | Положительная | (M+NH4)+ | 442,2 | 215,0 | 19 | 220 | 26 | 14 |
Токсин HT-2 | Положительная | (M+NH4)+ | 442,2 | 197,2 | 21 | 220 | 26 | 14 |
Токсин HT-2 | Положительная | (M+NH4)+ | 442,2 | 233,2 | 17 | 230 | 26 | 16 |
Токсин T-2 | Положительная | (M+NH4)+ | 484,4 | 215,4 | 25 | 270 | 26 | 14 |
Токсин T-2 | Положительная | (M+NH4)+ | 484,4 | 245,4 | 19 | 220 | 26 | 16 |
Токсин T-2 | Положительная | (M+NH4)+ | 484,4 | 185,4 | 31 | 270 | 26 | 12 |
[13C24]-токсин-T-2 | Положительная | (M+NH4)+ | 508,4 | 322,4 | 21 | 170 | 21 | 22 |
[13C22]-токсин-HT-2 | Положительная | (M+NH4)+ | 464,4 | 278,4 | 19 | 200 | 21 | 18 |
Время удерживания: | токсин HT-2 и [13C22]-токсин-HT-2: | 20,72 мин |
токсин T-2 и [13C24]-токсин-T-2: | 26,15 мин |
А.4 Системные настройки для Micromass Quattro LC
Хроматографическая колонка: | Phenomenex Aqua, размерами 150 x 2,1 мм, 3 мкм |
Объем вкола: | 20 мм3 |
Температура колонки: | 40 °C |
Скорость потока: | 0,3 см3/мин |
Элюент: | метанол (4.2)/вода (80 + 20, B + B), изократическое элюирование |
Параметры источника и специфические настройки масс-спектрометрии (см. таблицу А.7):
Ионизация: | электрораспылительная ионизация (ESI, англ.: electrospray ionization) |
Температура: | 350 °C |
Температура источника: | 120 °C |
Температура осушающего газа: | 450 °C |
Скорость потока осушающего газа: | 800 дм3/ч |
Небулайзер: | 45 дм3/ч |
Давление газа в ячейке соударений: | 27579 Па |
Потенциал на входе (EP): | 10 эВ |
Напряжение на капилляре: | |
Положительная ионизация: | 2000 В |
Давление газа ионного источника 1: | 206843 Па |
Давление газа ионного источника 2: | 482633 Па |
Разрешение на квадруполе 1: | единица измерения |
Разрешение на квадруполе 3: | единица измерения |
Таблица А.7
Токсин | Полярность | Материнский ион | Ион-предшественник | Ион-продукт | Энергия столкновения | Напряжение на конусе |
Токсин HT-2 | Положительная | (M+Na)+ | 447,2 | 345,20 | 19 | 30 |
Токсин HT-2 | Положительная | (M+Na)+ | 447,2 | 285,20 | 22 | 30 |
Токсин T-2 | Положительная | (M+Na)+ | 489,3 | 245,30 | 25 | 35 |
Токсин T-2 | Положительная | (M+Na)+ | 489,3 | 387,28 | 20 | 35 |
[13C22]-токсин-HT-2 | Положительная | (M+Na)+ | 469,15 | 300,24 | 20 | 40 |
[13C22]-токсин-HT-2 | Положительная | (M+Na)+ | 469,15 | 362,33 | 20 | 40 |
[13C24]-токсин-T-2 | Положительная | (M+Na)+ | 513,15 | 260,33 | 30 | 45 |
[13C24]-токсин-T-2 | Положительная | (M+Na)+ | 513,15 | 344,28 | 25 | 45 |
Время удерживания: | токсин HT-2 и [13C22]-токсин-HT-2: | 9,32 мин |
токсин T-2 и [13C24]-токсин-T-2: | 10,65 мин |
(справочное)
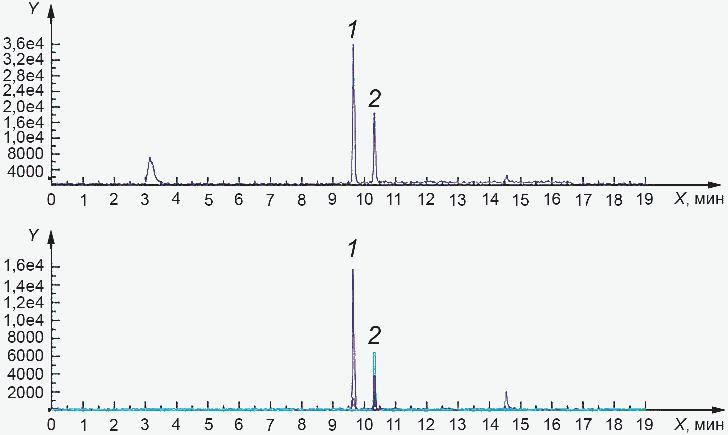
Y - интенсивность, импульс в секунду; 1 - токсин HT-2
при 9,65 мин; 2 - токсин T-2 при 10,34 мин
и хроматограммы по отдельным ионам стандартного раствора
с массовой концентрацией 20 нг/см3
Y - интенсивность, импульс в секунду; 1 - токсин HT-2
при 9,65 мин; 2 - токсин T-2 при 10,34 мин
Рисунок Б.2 - Характерная хроматограмма стандартного
раствора с массовой концентрацией 20 нг/см3

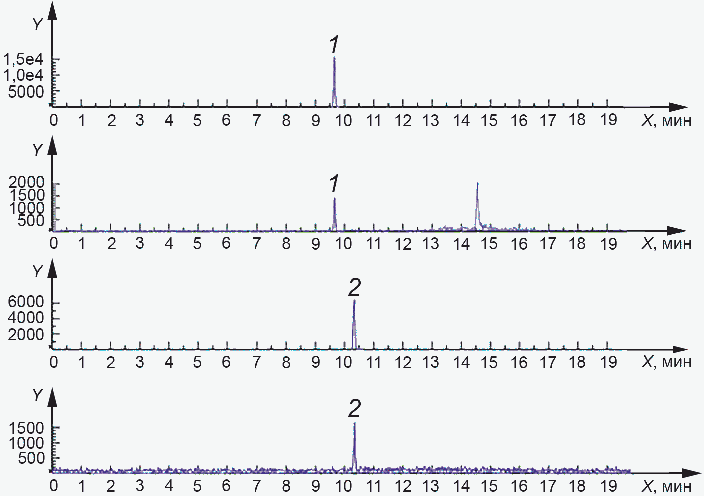
Y - интенсивность, импульс в секунду; 1 - токсин HT-2
при 9,6 мин, массовая доля примерно 9,6 мкг/кг; 2 - токсин
T-2 при 10,3 мин, массовая доля примерно 4,2 мкг/кг
Рисунок Б.3 - Хроматограмма общего ионного тока
и хроматограммы по отдельным ионам образца овсяной муки

Y - интенсивность, импульс в секунду; 1 - токсин HT-2
при 9,6 мин, массовая доля примерно 9,6 мкг/кг; 2 - токсин
T-2 при 10,3 мин, массовая доля примерно 4,2 мкг/кг
образца овсяной муки
(справочное)
Данный метод разработан рабочей группой "Микотоксины" Федерального ведомства по защите прав потребителей и безопасности пищевых продуктов (BVL). Он был проверен в ходе межлабораторных испытаний в 14 лабораториях на пробах овсяной муки, овсяных хлопьев и сухих завтраков с овсяными хлопьями. Данные в таблицах В.1, В.2 получены в ходе межлабораторного испытания в соответствии с серией стандартов ГОСТ Р ИСО 5725.
Таблица В.1
Проба | Овсяная мука ез <*> | Овсяная мука ез <*> | Сухие завтраки с овсянкой ез <*> | Овсяные хлопья ез <*> | Овсяные хлопья ез <*> |
Год проведения межлабораторного испытания | 2009 | 2009 | 2009 | 2009 | 2009 |
Число лабораторий | 14 | 14 | 14 | 14 | 14 |
Число лабораторий, оставшихся в эксперименте по оценке точности после его завершения | 11 | 11 | 12 | 11 | 11 |
Число лабораторий, не соответствующих требованиям | 3 | 3 | 2 | 3 | 3 |
Количество гипотетических результатов | 11 | 11 | 12 | 11 | 11 |
Среднее арифметическое | 9,57 | 26,5 | 8,46 | 21,1 | 15,7 |
Стандартное отклонение повторяемости sr, мкг/кг | 1,56 | 1,85 | 1,94 | 2,83 | 3,28 |
Относительное стандартное отклонение повторяемости RSDr, % | 16,3 | 6,97 | 22,9 | 13,4 | 20,8 |
Предел повторяемости r [r = 2,8·sr], мкг/кг | 4,38 | 5,18 | 5,42 | 7,91 | 9,17 |
Стандартное отклонение воспроизводимости sR, мкг/кг | 2,14 | 5,80 | 2,38 | 6,10 | 5,08 |
Относительное стандартное отклонение воспроизводимости RSDR, % | 22,4 | 21,9 | 28,1 | 28,8 | 32,3 |
Предел воспроизводимости R [R = 2,8·sR], мкг/кг | 6,00 | 16,2 | 6,65 | 17,1 | 14,2 |
Средняя полнота извлечения, % | 95,0 | 90,9 | 96,1 | 88,3 | 89,2 |
Коэффициент Хорвитца <**> | 1,02 | 0,99 | 1,28 | 1,31 | 1,47 |
Таблица В.2
Проба | Овсяная мука ез <*> | Овсяная мука ез <*> | Сухие завтраки с овсянкой ез <*> | Овсяные хлопья ез <*> | Овсяные хлопья ез <*> |
Год проведения межлабораторного испытания | 2009 | 2009 | 2009 | 2009 | 2009 |
Число лабораторий | 14 | 14 | 13 | 14 | 14 |
Число лабораторий, оставшихся после исключения несоответствующих требованиям | 13 | 13 | 12 | 13 | 12 |
Число лабораторий, не соответствующих требованиям | 1 | 1 | 1 | 1 | 2 |
Количество гипотетических результатов | 13 | 13 | 12 | 14 | 12 |
Среднее арифметическое | 4,21 | 7,92 | 3,40 | 6,09 | 4,58 |
Стандартное отклонение повторяемости sr, мкг/кг | 1,04 | 0,97 | 0,85 | 1,25 | 0,91 |
Относительное стандартное отклонение повторяемости RSDr, % | 24,8 | 12,2 | 25,1 | 20,6 | 19,8 |
Предел повторяемости r [r = 2,8·sr], мкг/кг | 2,92 | 2,71 | 2,39 | 3,51 | 2,55 |
Стандартное отклонение воспроизводимости sR, мкг/кг | 1,04 | 1,19 | 0,94 | 1,36 | 1,03 |
Относительное стандартное отклонение воспроизводимости RSDR, % | 24,8 | 15,1 | 27,7 | 22,4 | 22,4 |
Предел воспроизводимости R [R = 2,8·sR], мкг/кг | 2,92 | 3,38 | 2,63 | 3,82 | 2,87 |
Средняя полнота извлечения, % | 107 | 92,2 | 70,8 | 85,9 | 85,2 |
Коэффициент Хорвитца <**> | 1,13 | 0,68 | 1,26 | 1,02 | 1,02 |
УДК 613.2.099:543.061/062/064:006.354 | ОКС 67.060 |
Ключевые слова: продукция пищевая специализированная, определение токсинов, токсины T-2 и HT-2, зерно, пищевая продукция для питания детей раннего возраста, метод ВЭЖХ-МС/МС, метод твердофазной экстракции | |