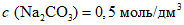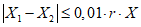СПРАВКА
Источник публикации
В данном виде документ опубликован не был.
Первоначальный текст документа опубликован в издании
М.: Стандартинформ, 2011.
Информацию о публикации документов, создающих данную редакцию, см. в справке к этим документам.
Примечание к документу
Документ утратил силу с 1 июля 2019 года в связи с изданием Приказа Росстандарта от 21.08.2018 N 509-ст. Взамен введен в действие ГОСТ 34430-2018.
Документ включен в Перечень стандартов, содержащих правила и методы исследований (испытаний) и измерений, в том числе правила отбора образцов, необходимые для применения и исполнения требований технического регламента Таможенного союза "О безопасности пищевой продукции" (ТР ТС 021/2011) и осуществления оценки (подтверждения) соответствия продукции (Решение Комиссии Таможенного союза от 09.12.2011 N 880).
Текст данного документа приведен с учетом поправки, опубликованной в "ИУС", N 9, 2015.
Изменение N 1, утв. Приказом Росстандарта от 29.09.2015 N 1401-ст, введено в действие с 1 января 2016 года.
Название документа
"ГОСТ Р 53974-2010. Национальный стандарт Российской Федерации. Ферментные препараты для пищевой промышленности. Метод определения протеолитической активности"
(утв. и введен в действие Приказом Росстандарта от 26.11.2010 N 543-ст)
(ред. от 29.09.2015)
"ГОСТ Р 53974-2010. Национальный стандарт Российской Федерации. Ферментные препараты для пищевой промышленности. Метод определения протеолитической активности"
(утв. и введен в действие Приказом Росстандарта от 26.11.2010 N 543-ст)
(ред. от 29.09.2015)
Содержание
Приказом Федерального
агентства по техническому
регулированию и метрологии
от 26 ноября 2010 г. N 543-ст
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕРМЕНТНЫЕ ПРЕПАРАТЫ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
МЕТОД ОПРЕДЕЛЕНИЯ ПРОТЕОЛИТИЧЕСКОЙ АКТИВНОСТИ
Enzyme preparations for food industry. Method
for determination of proteolitic activity
ГОСТ Р 53974-2010
Список изменяющих документов Росстандарта от 29.09.2015 N 1401-ст) |
ОКС 07.100.30;
ОКСТУ 9291
Дата введения
1 января 2012 года
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения".
1. Разработан Государственным научным учреждением Всероссийским научно-исследовательским институтом пищевой биотехнологии Россельхозакадемии (ГНУ ВНИИПБТ Россельхозакадемии).
2. Внесен Техническим комитетом по стандартизации ТК 176 "Спиртовая, дрожжевая и ликероводочная продукция".
3. Утвержден и введен в действие Приказом Федерального агентства по техническому регулированию и метрологии от 26 ноября 2010 г. N 543-ст.
4. Введен впервые.
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет.
Настоящий стандарт устанавливает метод определения протеолитической активности в ферментных препаратах в кислой, слабокислой, нейтральной и щелочной зонах pH действия ферментов с использованием в качестве субстрата гемоглобина.
(в ред. Изменения N 1, утв. Приказом Росстандарта от 29.09.2015 N 1401-ст)
Установленный в настоящем стандарте метод может быть использован для определения протеолитической активности ферментных препаратов и ферментсодержащих смесей, используемых в пищевой промышленности.
(в ред. Изменения N 1, утв. Приказом Росстандарта от 29.09.2015 N 1401-ст)
Примечание. Протеолитическую активность исследуемых ферментных препаратов (ФП) обеспечивает комплекс протеаз, содержащий в основном сериновые, металлозависимые, карбоксильные протеиназы эндодействия, а также пептидазы экзодействия.
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ Р 53228-2008 Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
(ссылка введена Изменением N 1, утв. Приказом Росстандарта от 29.09.2015 N 1401-ст)
ГОСТ Р ИСО 5725-1-2002. Точность (правильность и прецизионность) методов и результатов измерений. Часть 1. Основные положения и определения
ГОСТ 61-75. Реактивы. Кислота уксусная. Технические условия
ГОСТ 83-79. Реактивы. Натрий углекислый. Технические условия
ГОСТ 199-78. Реактивы. Натрий уксуснокислый 3-водный. Технические условия
ГОСТ 1770-74. Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 3118-77. Реактивы. Кислота соляная. Технические условия
ГОСТ 4109-79. Реактивы. Бром. Технические условия
ГОСТ 4328-77. Реактивы. Натрия гидроокись. Технические условия
ГОСТ 6691-77. Реактивы. Карбамид. Технические условия
ГОСТ 6709-72. Вода дистиллированная. Технические условия
ГОСТ 9147-80. Посуда и оборудование лабораторные фарфоровые. Технические условия
ГОСТ 9656-75. Реактивы. Кислота борная. Технические условия
ГОСТ 10678-76. Кислота ортофосфорная термическая. Технические условия
ГОСТ 10931-74. Реактивы. Натрий молибденовокислый 2-водный. Технические условия
ГОСТ 12026-76. Бумага фильтровальная лабораторная. Технические условия
ГОСТ 13867-68. Продукты химические. Обозначение чистоты
ГОСТ 18289-78. Реактивы. Натрий вольфрамовокислый 2-водный. Технические условия
ГОСТ 18481-81. Ареометры и цилиндры стеклянные. Общие технические условия
ИС МЕГАНОРМ: примечание. ГОСТ 20264.0-74 утратил силу на территории Российской Федерации с 1 мая 2017 года в связи с введением в действие ГОСТ Р 57248-2016 (Приказ Росстандарта от 09.11.2016 N 1649-ст). |
ГОСТ 20264.0-74. Препараты ферментные. Правила приемки и методы отбора проб
ГОСТ 25336-82. Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 28498-90. Термометры жидкостные стеклянные. Общие технические требования. Методы испытаний
ГОСТ 29227-91 (ИСО 835-1-81). Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования.
Примечание. При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1. Гидролиз: расщепление исходного соединения на более простые в присутствии молекулы воды.
3.2. Ферментативный гидролиз: расщепление высокомолекулярных соединений при участии катализаторов белковой природы - гидролитических ферментов (гидролаз, класс 3 [1]).
3.3. Субстрат: соединение или вещество, на которое воздействует данный фермент.
3.4. Белки: высокомолекулярные полипептидные соединения - полимеры аминокислот, соединенные пептидными связями.
3.5. Системные названия ферментов: названия, указывающие природу химической реакции, катализируемой данным ферментом, в соответствии с современной классификацией (КФ), принятой Международной комиссией по ферментам.
Примечания
Системные названия ферментов
Протеазы подразделяют на две основные группы: пептидазы (КФ 3.4.11 - 3.4.15) и протеиназы (КФ 3.4.21 - 3.4.24) [1].
Пептидазы (КФ 3.4.11 - 3.4.15) экзодействия катализируют гидролиз пептидной связи с N- и (или) C-конца пептидной цепи;
- 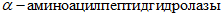 (КФ 3.4.11) - аминопептидазы - расщепляют первую пептидную связь с N-конца полипептидной цепи;
(КФ 3.4.11) - аминопептидазы - расщепляют первую пептидную связь с N-конца полипептидной цепи;
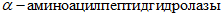 (КФ 3.4.11) - аминопептидазы - расщепляют первую пептидную связь с N-конца полипептидной цепи;
(КФ 3.4.11) - аминопептидазы - расщепляют первую пептидную связь с N-конца полипептидной цепи;- гидролазы пептидиламинокислот или ациламинокислот (КФ 3.4.12) - карбокси-пептидазы - расщепляют первую пептидную связь с C-конца полипептидной цепи с высвобождением отдельных аминокислот или дипептидов;
- дипептидгидролазы (КФ 3.4.13) - дипептидазы - гидролизуют дипептиды;
- дипептидилпептидгидролазы (КФ 3.4.14) и пептидилдипептидгидролазы (КФ 3.4.15) катализируют расщепление дипептидов с N- и C-конца пептидной связи до низкомолекулярных пептидов и свободных аминокислот.
Протеиназы (КФ 3.4.21 - 24) катализируют гидролиз пептидных связей полипептидной цепи с образованием пептидов с различной молекулярной массой:
- сериновые (КФ 3.4.21) - в каталитическом центре находится триада аминокислот: аспарагиновая, гистидин, серин;
- тиоловые (КФ 3.4.22) - в активном центре находится SH-группа цистеина;
- карбоксильные (КФ 3.4.23) - в их каталитическом акте участвуют остатки дикарбоновых аминокислот, имеют оптимальный pH ниже 5,0;
- металлосодержащие (КФ 3.4.24) - содержат в активном центре ионы металлов, ингибируются хилатными соединениями.
3.6. Комплекс протеаз: комплекс гидролитических ферментов, расщепляющих белки до конечных продуктов - свободных аминокислот и (или) пептидов.
в кислой и слабокислой, нейтральной и щелочной зонах pH
(в ред. Изменения N 1, утв. Приказом
Росстандарта от 29.09.2015 N 1401-ст)
Определение протеолитической активности в ферментных препаратах - источниках кислых, слабокислых, нейтральных и щелочных протеаз осуществляют путем гидролиза животного белка гемоглобина в различных зонах pH:
- для кислых протеаз - pH 3,0;
- для слабокислых протеаз - pH 5,3;
- для нейтральных протеаз - pH 7,0;
- для щелочных протеаз - pH 9,0.
4.1. Характеристика метода
(в ред. Изменения N 1, утв. Приказом Росстандарта от 29.09.2015 N 1401-ст)
4.1.1. Метод определения протеолитической активности основан на гидролизе гемоглобина - животного белка в кислой (pH 3,0), слабокислой (pH 5,3), нейтральной (pH 7,0) и щелочной (pH 9,0) зонах исследуемым ферментным препаратом, находящимся в растворе, до низкомолекулярных пептидов и свободных аминокислот с последующей инактивацией фермента путем осаждения непрогидролизованного белка трихлоруксусной кислотой (ТХУ) и определением образовавших пептидов и свободных аминокислот.
(в ред. Изменения N 1, утв. Приказом Росстандарта от 29.09.2015 N 1401-ст)
4.1.2. За единицу общей протеолитической активности (ПС) принимают такое количество фермента, которое за 1 мин при 30 °C приводит гемоглобин в неосаждаемое состояние ТХУ в количестве, соответствующем 1 мкмолю тирозина (1 мкмоль тирозина равен 0,181 мг); активность выражается в ед. ПС/г или ед. ПС/см3 испытуемого препарата.
4.1.3. Количество белка, превращенного в низкомолекулярные пептиды и аминокислоты, определяют по реакции свободных аминокислот с реактивом Фолина и дальнейшим определением оптической плотности образующихся голубых растворов на фотоэлектроколориметре при длине световой волны  .
.
 .
.(в ред. Изменения N 1, утв. Приказом Росстандарта от 29.09.2015 N 1401-ст)
Определение протеолитической активности кислых протеаз осуществляют при pH реакционной смеси 3,0 +/- 0,2, слабокислых протеаз - при pH 5,3 +/- 0,2, нейтральных протеаз - при pH 7,0 +/- 0,2, щелочных протеаз - при pH 9,0 +/- 0,2 и рассчитывают по градуировочному графику, построенному для тирозина.
(в ред. Изменения N 1, утв. Приказом Росстандарта от 29.09.2015 N 1401-ст)
4.2. Средства измерений, вспомогательное оборудование, посуда, реактивы, материалы
4.2.1. Для определения протеолитической активности используют следующие средства измерений, вспомогательное оборудование, посуду, реактивы, материалы:
- весы неавтоматического действия по ГОСТ Р 53228, с пределами абсолютной допускаемой погрешности +/- 0,5 мг;
(в ред. Изменения N 1, утв. Приказом Росстандарта от 29.09.2015 N 1401-ст)
- фотоэлектроколориметр (КФК-3) или спектрофотометр (СФ) любого типа, которые обеспечивают измерение оптической плотности анализируемых растворов при длине световой волны  и 275 нм соответственно с погрешностью измерения коэффициента пропускания не более 1%;
и 275 нм соответственно с погрешностью измерения коэффициента пропускания не более 1%;
 и 275 нм соответственно с погрешностью измерения коэффициента пропускания не более 1%;
и 275 нм соответственно с погрешностью измерения коэффициента пропускания не более 1%;- pH-метр любого типа для измерения в диапазоне от 0 до 14 pH с пределом допускаемой погрешности в эксплуатации +/- 0,1 единицы pH;
- холодильник бытовой;
- магнитную мешалку любой марки, которая обеспечивает скорость вращения до 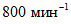 ;
;
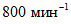 ;
;- ультратермостат или водяной термостат с точностью регулирования температуры +/- 1 °C;
- лабораторную центрифугу любого типа, которая обеспечивает скорость вращения не менее  ;
;
 ;
;- водяную баню любого типа, которая обеспечивает поддержание температуры (100 +/- 1) °C;
- секундомер с емкостью шкалы счетчика 1 мин, ценой деления 1 с и погрешностью +/- 1,5 с;
- пипетки автоматические вместимостью от 0,1 до 1,0 см3, 1,0 см3 и от 0,2 до 5,0 см3 с наконечниками;
- встряхиватель V-3 типа Вортекс или аналогичный для перемешивания жидкости;
- термометры ртутные стеклянные лабораторные от 0 °C до 50 °C и от 0 °C до 100 °C с ценой деления 0,1 °C или 0,5 °C по ГОСТ 28498;
- ареометры общего назначения по ГОСТ 18481;
- холодильник обратный по ГОСТ 25336;
- стаканы и колбы стеклянные лабораторные В-1-150 ТС, В-1-800 ТС, Кн-1-100-14/23 ТС по ГОСТ 25336;
- стаканчики для взвешивания (бюксы) СВ-19/9 по ГОСТ 25336;
- воронки В-75-140 ХС по ГОСТ 25336;
- пробирки П1-14-120 ХС или П1-16-150 ХС по ГОСТ 25336;
- колбы мерные 1-25-2, 1-50-2, 1-100-2, 1-200-2, 1-250-2, 2-1000-2 по ГОСТ 1770;
- цилиндры 1-25-2, 1-50-2, 1-100-2, 1-250-2 по ГОСТ 1770;
- пипетки стеклянные 1-2-2-1, 1-2-2-2, 1-2-2-5, 1-2-2-10 по ГОСТ 29227;
- фарфоровую ступку по ГОСТ 9147;
- бумагу фильтровальную лабораторную по ГОСТ 12026;
- гемоглобин бычий лиофилизированный, содержание основного вещества не менее 95%;
- тирозин, содержание основного вещества 98%;
- трихлоруксусную кислоту;
- кислоту соляную по ГОСТ 3118;
- кислоту ортофосфорную по ГОСТ 10678;
- кислоту уксусную по ГОСТ 61;
- кислоту борную по ГОСТ 9656;
- карбамид по ГОСТ 6691;
- натрий углекислый по ГОСТ 83;
- натрия гидроокись по ГОСТ 4328;
- натрий уксуснокислый по ГОСТ 199;
- натрий вольфрамовокислый 2-водный по ГОСТ 18289;
- натрий молибденовокислый по ГОСТ 10931;
- литий сернокислый;
- бром по ГОСТ 4109;
- воду дистиллированную по ГОСТ 6709.
4.2.2. Все реактивы должны относиться к подгруппе чистоты 2 (х.ч.) или 3 (ч.д.а.) по ГОСТ 13867, кроме ТХУ, которая используется марки ч.
4.2.3. Допускается использование других средств измерения и аппаратуры, которые по метрологическим характеристикам соответствуют указанным в 4.2.1, а также иной лабораторной посуды и реактивов, в том числе и импортного производства, которые аналогичны указанным в 4.2.2.
4.3. Подготовка к анализу
4.3.1. Приготовление универсального буферного раствора молярной концентрации 0,1 моль/дм3
4.3.1.1. Приготовление раствора 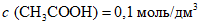 (раствор A)
(раствор A)
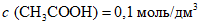 (раствор A)
(раствор A)5,7 см3 ледяной уксусной кислоты растворяют дистиллированной водой при 20 °C в мерной колбе вместимостью 1 дм3. Раствор уксусной кислоты хранят в закрытой стеклянной посуде при 20 °C в течение четырех недель.
4.3.1.2. Приготовление раствора 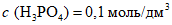 (раствор B)
(раствор B)
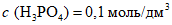 (раствор B)
(раствор B)6,45 см3 ортофосфорной кислоты растворяют дистиллированной водой при 20 °C в мерной колбе вместимостью 1 дм3. Раствор ортофосфорной кислоты хранят в закрытой стеклянной посуде при 20 °C в течение четырех недель.
4.3.1.3. Приготовление раствора 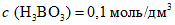 (раствор C)
(раствор C)
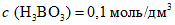 (раствор C)
(раствор C)Ортоборную кислоту массой (6,18 +/- 0,02) г растворяют дистиллированной водой при 20 °C в мерной колбе вместимостью 1 дм3. Раствор ортоборной кислоты хранят в закрытой стеклянной посуде при 20 °C в течение четырех недель.
4.3.1.4. Приготовление раствора c (NaOH) = 1,0 моль/дм3
Гидроокись натрия массой (40,00 +/- 0,01) г растворяют дистиллированной водой при 20 °C в мерной колбе вместимостью 1 дм3. Раствор гидроокиси натрия хранят в закрытой стеклянной посуде при 20 °C в течение двух недель.
При смешивании равных объемов растворов A, B и C получают универсальный буферный раствор с pH (2,0 +/- 0,2), который используют для приготовления субстрата при определении ферментативной активности кислых протеаз; для слабокислых протеаз - к 100 см3 универсального буферного раствора добавляют 6,0 см3 раствора гидроокиси натрия молярной концентрации 1 моль/дм3, получая буферный раствор с pH 4,7; для нейтральных протеаз - к 100 см3 универсального буферного раствора добавляют 10 см3 гидроокиси натрия, получая буферный раствор с pH 7,0; для щелочных протеаз - к 100 см3 универсального буферного раствора добавляют 14 см3 гидроокиси натрия, получая буферный раствор с pH 9,3.
Буферные растворы хранят в закрытой стеклянной посуде при 4 °C в течение четырех недель.
Небольшое количество гемоглобина предварительно растирают в фарфоровой ступке. Навеску растертого гемоглобина массой (2,00 +/- 0,01) г количественно переносят в стаканчик вместимостью 100 см3 и растворяют в 50 см3 буферного раствора с соответствующим значением pH по 4.3.1.5 (для этого навеску гемоглобина тщательно растирают в фарфоровой ступке в небольшом количестве необходимого буфера, затем добавляют остальное его количество). После этого для получения инкубационной смеси (ИС) к раствору гемоглобина добавляют (32,0 +/- 0,1) г мочевины, количественно переносят в мерную колбу вместимостью 100 см3, доводят объем ИС тем же буфером до метки и выдерживают в течение 1 ч при 30 °C для денатурации белка. Так как мочевина сдвигает значение pH буфера, особенно в кислой и слабокислой зонах pH, для создания необходимого pH ИС раствор гемоглобина готовят на буфере с более низким значением pH в соответствии с таблицей 1.
Таблица 1
pH буфера | pH субстрата (ИС) |
2,0 | 3,0 |
4,7 | 5,3 |
7,0 | 7,0 |
9,3 | 9,0 |
Раствор гемоглобина хранят в закрытой стеклянной посуде при температуре 4 °C в течение трех дней.
(в ред. Изменения N 1, утв. Приказом Росстандарта от 29.09.2015 N 1401-ст)
Навеску безводного углекислого натрия массой (53,00 +/- 0,01) г растворяют в 500 см3 дистиллированной воды в мерной колбе вместимостью 1 дм3. Объем доводят до метки дистиллированной водой при 20 °C и перемешивают. Раствор углекислого натрия хранят в закрытой стеклянной посуде при 20 °C в течение двух недель.
Навеску ТХУ массой (50,00 +/- 0,01) г растворяют в 500 см3 дистиллированной воды в мерной колбе вместимостью 1 дм3. Объем доводят до метки дистиллированной водой при 20 °C и перемешивают. Раствор ТХУ хранят в закрытой стеклянной посуде при 20 °C в течение четырех недель.
4.3.5. Приготовление реактива Фолина
4.3.5.1. Приготовление основного раствора реактива Фолина
Для приготовления основного раствора реактива Фолина в круглодонную колбу с пришлифованным обратным холодильником вместимостью 1 дм3 наливают 600 см3 дистиллированной воды, добавляют (100,00 +/- 0,01) г вольфрамовокислого натрия и (25,00 +/- 0,01) г молибденовокислого натрия. Затем приливают 50 см3 ортофосфорной кислоты с массовой долей 85% и 100 см3 концентрированной соляной кислоты и осторожно перемешивают. Смесь кипятят на слабом огне на асбестовой сетке в течение 10 ч. Кипячение допускается прерывать.
По окончании кипячения в охлажденную смесь добавляют (150,00 +/- 0,01) г сернокислого лития, 50 см3 дистиллированной воды и пять капель брома. Открытую колбу кипятят на слабом огне под тягой в течение 15 - 20 мин, чтобы удалить избыток паров брома. Раствор должен иметь желтую окраску. После охлаждения раствор доводят дистиллированной водой до 1 дм3 (при необходимости фильтруют через трубку Аллина, заполненную стеклянной ватой).
Приготовленный основной раствор реактива Фолина хранят в склянке из темного стекла в холодильнике. Через 2 - 3 мес хранения следует добавить в него одну-две капли брома и снова прокипятить в течение 15 - 20 мин. Показателем непригодности раствора считается его помутнение и изменение окраски из желтой в зеленую.
Концентрацию реактива Фолина проверяют титрованием разбавленного 1:10 реактива Фолина раствором гидроокиси натрия концентрации 0,1 моль/дм3 по фенолфталеину. Реактив Фолина должен быть концентрации 2,0 моль/дм3 по кислоте. Если кислотность реактива Фолина больше 2,0 моль/дм3, то его разбавляют дистиллированной водой, если меньше - реактив для работы не пригоден. Раствор реактива Фолина хранят в закрытой стеклянной посуде при температуре 20 °C в течение одной недели.
Рабочий раствор реактива Фолина готовят разведением основного раствора дистиллированной водой в соотношении 1:2 (одна часть реактива Фолина и две части дистиллированной воды). Рабочий раствор реактива Фолина хранят в закрытой стеклянной посуде при температуре 20 °C в течение одной недели.
Протеолитическую активность исследуемого образца вычисляют по тирозину. Для этого строят градуировочный график зависимости оптической плотности от концентрации тирозина и по нему вычисляют тирозиновый эквивалент (ТЭ), т.е. оптическую плотность, которую дает 1 мкмоль тирозина в 1 см3 градуировочного раствора.
4.3.6.1. Приготовление основного градуировочного раствора тирозина концентрации 10-3 моль/дм3
(в ред. Изменения N 1, утв. Приказом Росстандарта от 29.09.2015 N 1401-ст)
В мерную колбу вместимостью 100 см3 помещают навеску чистого тирозина массой (18,1 +/- 0,5) мг и растворяют в растворе соляной кислоты молярной концентрации 0,2 моль/дм3.
(в ред. Изменения N 1, утв. Приказом Росстандарта от 29.09.2015 N 1401-ст)
4.3.6.2. Приготовление рабочих градуировочных растворов тирозина
В мерную колбу вместимостью 50 см3 вносят различные количества основного раствора тирозина в соответствии с таблицей 2 и доводят до метки раствором соляной кислоты молярной концентрации 0,2 моль/дм3, получая различные концентрации тирозина в рабочих растворах.
Таблица 2
Объем градуировочного раствора тирозина молярной концентрации 10-3 моль/дм3, см3 | Молярная концентрация тирозина в рабочем растворе, мкмоль/см3 |
1,0 | 0,02 |
2,0 | 0,04 |
4,0 | 0,08 |
5,0 | 0,10 |
7,5 | 0,15 |
10,0 | 0,20 |
(в ред. Изменения N 1, утв. Приказом Росстандарта от 29.09.2015 N 1401-ст)
4.3.6.3. Построение градуировочного графика
В шесть пробирок (15 x 150 мм) вносят по 1 см3 рабочего раствора тирозина различной концентрации и добавляют при перемешивании по 5 см3 раствора реактива углекислого натрия концентрации 0,5 моль/дм3 и по 1 см3 рабочего раствора реактива Фолина. Контрольный опыт готовят также, но вместо раствора тирозина используют 1 см3 дистиллированной воды. Реакционную смесь выдерживают в течение 20 мин. Интенсивность окраски измеряют на фотоэлектроколориметре против контрольной пробы при длине волны  в кюветах с толщиной слоя, поглощающего свет, 10 мм.
в кюветах с толщиной слоя, поглощающего свет, 10 мм.
 в кюветах с толщиной слоя, поглощающего свет, 10 мм.
в кюветах с толщиной слоя, поглощающего свет, 10 мм.Для построения каждой точки градуировочного графика вычисляют среднеарифметическое значение оптической плотности трех параллельных измерений. По полученным значениям строят градуировочный график зависимости оптической плотности от концентрации тирозина (мкмоль/см3) (рисунок 1).
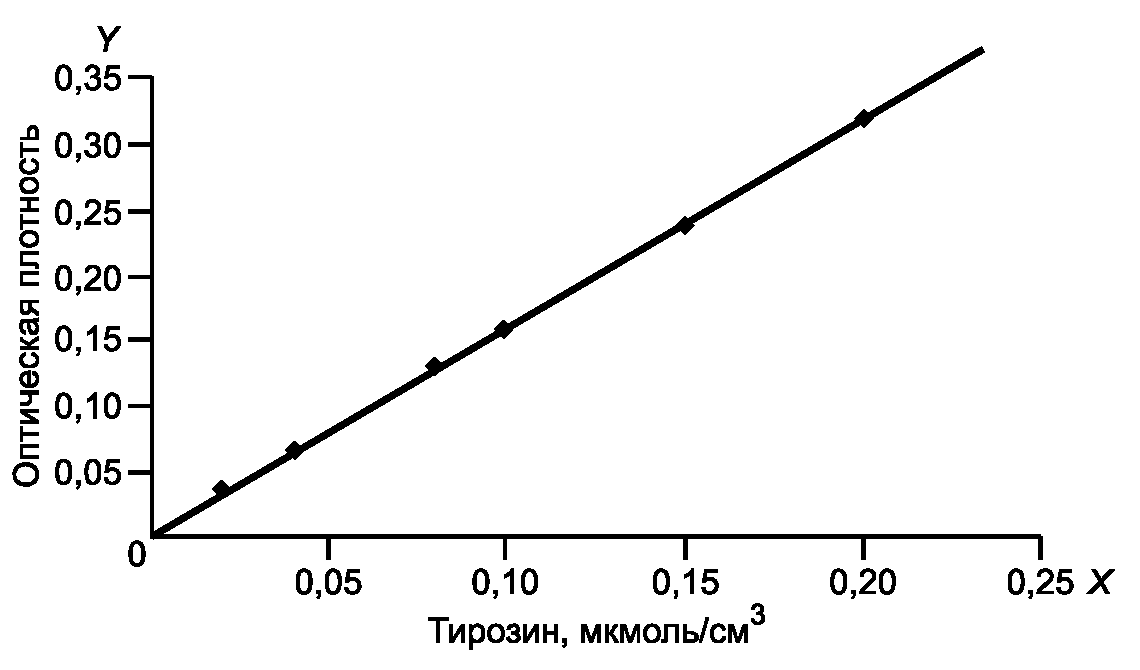
Рисунок 1
На оси абсцисс X откладывают значения концентрации тирозина c в мкмоль/см3, на оси ординат Y - соответствующие им значения оптической плотности D при 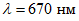 .
.
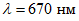 .
.По градуировочному графику находят ТЭ, соответствующий оптической плотности 1 мкмоль тирозина в 1 см3. В данном случае 0,1 мкмоль/см3 соответствует значению оптической плотности 0,16, тогда 1 мкмоль/см3 тирозина даст показание, равное 1,6. Следовательно, ТЭ равен 1,6.
ТЭ необходимо устанавливать для каждой новой партии приготовленного реактива Фолина и при смене прибора.
4.4. Подготовка пробы
ИС МЕГАНОРМ: примечание. ГОСТ 20264.0-74 утратил силу на территории Российской Федерации с 1 мая 2017 года в связи с введением в действие ГОСТ Р 57248-2016 (Приказ Росстандарта от 09.11.2016 N 1649-ст). |
4.4.1. Отбор проб проводят по ГОСТ 20264.0.
Анализируемые образцы ферментных препаратов в форме порошка или ультраконцентрата можно использовать без предварительной подготовки.
В стаканчик для взвешивания помещают сухой анализируемый образец ферментного препарата массой (0,1000 +/- 0,0005) г или жидкий ферментный препарат массой (1,00 +/- 0,02) г и суспендируют в небольшом количестве дистиллированной воды. Суспензию количественно переносят в мерную колбу вместимостью 100 см3, доводят объем до метки дистиллированной водой при температуре 20 °C и тщательно перемешивают. Приготовленный раствор ферментного препарата является основным раствором анализируемого образца.
(в ред. Изменения N 1, утв. Приказом Росстандарта от 29.09.2015 N 1401-ст)
Рабочий раствор анализируемого образца ферментного препарата готовят из основного раствора по 4.4.2 путем разведения его в дистиллированной воде.
Количество фермента, взятого на анализ, должно быть рассчитано так, чтобы в реакционной смеси по 4.5.2 присутствовал избыток субстрата и чтобы измеряемые величины оптической плотности по 4.5.3 при колориметрировании в кювете с толщиной поглощающего свет слоя 10 мм лежали в диапазоне значений 0,1 - 0,21.
При отклонении оптической плотности от указанных значений необходимо подобрать разведение препарата таким образом, чтобы оптическая плотность окрашенных растворов реакционной смеси D по 4.5.3 соответствовала указанным пределам диапазона.
Каждое разведение испытуемого раствора анализируют в двух повторностях. Для испытания берут две параллельные навески препарата.
Раствор ферментного препарата готовят непосредственно перед определением.
4.5. Проведение испытания
4.5.1. В две опытные пробирки (16 x 150 мм) вносят по 1 см3 субстрата по 4.3.2, помещают их в ультратермостат при температуре (30,0 +/- 1,0) °C и выдерживают в течение 5 мин.
4.5.2. В пробирки с субстратом добавляют по 1 см3 рабочего раствора анализируемого образца ферментного препарата по 4.4.3, предварительно термостатированного при температуре (30,0 +/- 1,0) °C 3 - 4 мин; пробирки встряхивают и оставляют на гидролиз ровно на 10 мин при температуре (30,0 +/- 1,0) °C (с точностью, определяемой по секундомеру от начала ферментативной реакции).
4.5.3. По окончании реакции добавляют в обе пробирки по 2 см3 раствора ТХУ по 4.3.4, чтобы прервать ферментативную реакцию и осадить непрогидролизовавшийся белок, а также высокомолекулярные продукты гидролиза.
4.5.4. Смесь перемешивают и для обеспечения полного осаждения белка выдерживают пробирки со смесью в течение 10 мин. Затем смесь фильтруют в сухие пробирки. Фильтрат должен быть совершенно прозрачен. В чистые пробирки вносят по 1 см3 фильтрата, добавляют по 5 см3 раствора углекислого натрия по 4.3.3, перемешивают и приливают по 1 см3 рабочего раствора реактива Фолина по 4.3.5.2. Реакционную смесь выдерживают ровно 20 мин (по секундомеру). В процессе реакции растворы приобретают голубую окраску, интенсивность которой определяют на фотоэлектроколориметре при длине световой волны  в кюветах толщиной поглощающего свет слоя 10 мм в сравнении с контролем.
в кюветах толщиной поглощающего свет слоя 10 мм в сравнении с контролем.
 в кюветах толщиной поглощающего свет слоя 10 мм в сравнении с контролем.
в кюветах толщиной поглощающего свет слоя 10 мм в сравнении с контролем.4.5.5. Контрольный образец готовят, прибавляя реактивы в обратной последовательности. Для этого в контрольную пробирку вносят 1 см3 рабочего ферментного раствора того же разведения по 4.4.3, как и в опыте, добавляют 2 см3 ТХУ по 4.3.4, вносят 1 см3 субстрата по 4.3.2 и выдерживают в ультратермостате при температуре 30 °C в течение 10 мин. Дальнейшие операции осуществляют аналогично 4.5.2.
4.6. Обработка результатов
4.6.1. Протеолитическую активность, ед. ПС/г или ед. ПС/см3 испытуемого препарата, рассчитывают по формуле
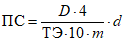 , (1)
, (1)где D - оптическая плотность исследуемого раствора;
4 - отношение объемов реакционной смеси и раствора фермента после добавления ТХУ;
ТЭ - тирозиновый эквивалент, определяемый по 4.3.6;
10 - время гидролиза субстрата, мин;
m - масса ферментного препарата, взятая на гидролиз (расчет ведется на 1 см3 рабочего раствора анализируемого образца ферментного препарата), г;
d - плотность ферментного препарата (для жидких препаратов), г/см3.
4.6.2. За окончательный результат принимают среднеарифметическое значение двух параллельных определений, выполненных в условиях повторяемости, если выполняется условие приемлемости (2).
Границы относительной погрешности 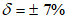 (соответствуют значению относительной расширенной неопределенности
(соответствуют значению относительной расширенной неопределенности 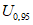 при коэффициенте охвата k = 2).
при коэффициенте охвата k = 2).
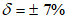 (соответствуют значению относительной расширенной неопределенности
(соответствуют значению относительной расширенной неопределенности Результат анализа представляют в виде
где 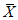 - среднеарифметическое значение двух параллельных измерений, признанных приемлемыми, ед. ПС/г (ед. ПС/см3);
- среднеарифметическое значение двух параллельных измерений, признанных приемлемыми, ед. ПС/г (ед. ПС/см3);
 или
или  .
.Наименьшие разряды числовых значений результата измерения и числовых показателей точности должны быть одинаковы.
Значащих цифр числовых показателей точности измерений должно быть не более двух.
4.7. Сходимость и воспроизводимость результатов
4.7.1. Результаты измерений, полученные в условиях повторяемости (сходимости), признаются удовлетворительными, если выполняется условие приемлемости
где  и
и  - результаты двух параллельных определений, полученные в условиях повторяемости, ед. ПС/г или ед. ПС/см3 испытуемого препарата;
- результаты двух параллельных определений, полученные в условиях повторяемости, ед. ПС/г или ед. ПС/см3 испытуемого препарата;
0,01 - коэффициент для пересчета процентов в абсолютные значения;
r - предел повторяемости (сходимости), равный 8%;
X - среднеарифметическое значение двух параллельных определений, ед. ПС/г или ед. ПС/см3 испытуемого препарата.
4.7.2. Результаты измерений, полученные в условиях воспроизводимости по ГОСТ Р ИСО 5725-1, признаются удовлетворительными, если выполняется условие приемлемости
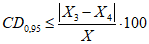 , (3)
, (3)где 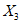 и
и 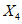 - результаты двух определений, полученные в условиях воспроизводимости, ед. ПС/г или ед. ПС/см3 испытуемого препарата;
- результаты двух определений, полученные в условиях воспроизводимости, ед. ПС/г или ед. ПС/см3 испытуемого препарата;
X - среднеарифметическое значение двух окончательных результатов определений, выполненных в разных лабораториях в условиях воспроизводимости, ед. ПС/г или ед. ПС/см3 испытуемого препарата;
(в ред. Изменения N 1, утв. Приказом Росстандарта от 29.09.2015 N 1401-ст)
100 - коэффициент для пересчета в проценты;
of the IUB // N.Y., Academic Press - 1984
[2] Позиция исключена с 1 января 2016 года. - Изменение N 1, утв.
Приказом Росстандарта от 29.09.2015 N 1401-ст