СПРАВКА
Источник публикации
В данном виде документ опубликован не был.
Первоначальный текст документа опубликован в издании
М.: Стандартинформ, 2011.
Информацию о публикации документов, создающих данную редакцию, см. в справке к этим документам.
Примечание к документу
Документ включен в Перечень стандартов, содержащих правила и методы исследований (испытаний) и измерений, в том числе правила отбора образцов, необходимые для применения и исполнения требований технического регламента "О безопасности пищевой продукции" (ТР ТС 021/2011) и осуществления оценки (подтверждения) соответствия продукции (Решение Комиссии Таможенного союза от 09.12.2011 N 880).
Текст данного документа приведен с учетом поправки, опубликованной в "ИУС", N 9, 2015.
Изменение N 1, утв. Приказом Росстандарта от 29.09.2015 N 1400-ст, введено в действие с 1 января 2016 года.
Название документа
"ГОСТ Р 53973-2010. Национальный стандарт Российской Федерации. Ферментные препараты для пищевой промышленности. Метод определения бета-глюконазной активности"
(утв. и введен в действие Приказом Росстандарта от 26.11.2010 N 541-ст)
(ред. от 29.09.2015)
"ГОСТ Р 53973-2010. Национальный стандарт Российской Федерации. Ферментные препараты для пищевой промышленности. Метод определения бета-глюконазной активности"
(утв. и введен в действие Приказом Росстандарта от 26.11.2010 N 541-ст)
(ред. от 29.09.2015)
Содержание
Приказом Федерального
агентства по техническому
регулированию и метрологии
от 26 ноября 2010 г. N 541-ст
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕРМЕНТНЫЕ ПРЕПАРАТЫ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
МЕТОД ОПРЕДЕЛЕНИЯ 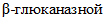 АКТИВНОСТИ
АКТИВНОСТИ
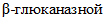 АКТИВНОСТИ
АКТИВНОСТИEnzyme preparations for food industry.
Method of determination of 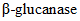 activity
activity
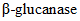 activity
activityГОСТ Р 53973-2010
Список изменяющих документов Росстандарта от 29.09.2015 N 1400-ст) |
ОКС 07.100.30
ОКСТУ 9291
Дата введения
1 января 2012 года
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения".
1. Разработан Государственным научным учреждением Всероссийским научно-исследовательским институтом пищевой биотехнологии Россельхозакадемии (ГНУ ВНИИПБТ Россельхозакадемии).
2. Внесен Техническим комитетом по стандартизации ТК 176 "Спиртовая, дрожжевая и ликеро-водочная продукция".
3. Утвержден и введен в действие Приказом Федерального агентства по техническому регулированию и метрологии от 26 ноября 2010 г. N 541-ст.
4. Введен впервые.
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет.
Настоящий стандарт устанавливает метод определения  активности ферментных препаратов. Метод может быть использован для определения
активности ферментных препаратов. Метод может быть использован для определения  активности ферментных препаратов и ферментсодержащих смесей, применяемых в пищевой промышленности.
активности ферментных препаратов и ферментсодержащих смесей, применяемых в пищевой промышленности.
 активности ферментных препаратов. Метод может быть использован для определения
активности ферментных препаратов. Метод может быть использован для определения  активности ферментных препаратов и ферментсодержащих смесей, применяемых в пищевой промышленности.
активности ферментных препаратов и ферментсодержащих смесей, применяемых в пищевой промышленности.Примечание.  активность исследуемых ферментных препаратов (ФП) обеспечивают ферменты
активность исследуемых ферментных препаратов (ФП) обеспечивают ферменты 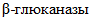 эндо- и экзо-действия.
эндо- и экзо-действия.
 активность исследуемых ферментных препаратов (ФП) обеспечивают ферменты
активность исследуемых ферментных препаратов (ФП) обеспечивают ферменты 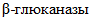 эндо- и экзо-действия.
эндо- и экзо-действия.В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ Р 53228-2008 Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
(ссылка введена Изменением N 1, утв. Приказом Росстандарта от 29.09.2015 N 1400-ст)
ГОСТ Р ИСО 5725-1-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 1. Основные положения и определения
ГОСТ 61-75 Реактивы. Кислота уксусная. Технические условия
ГОСТ 83-79 Реактивы. Натрий углекислый. Технические условия
ГОСТ 199-78 Реактивы. Натрий уксуснокислый 3-водный. Технические условия
ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 2603-79 Реактивы. Ацетон. Технические условия
ГОСТ 3765-78 Реактивы. Аммоний молибденовокислый. Технические условия
ГОСТ 4165-78 Реактивы. Медь (II) сернокислая 5-водная. Технические условия
ГОСТ 4166-76 Реактивы. Натрий сернокислый. Технические условия
ГОСТ 4201-79 Реактивы. Натрий углекислый кислый. Технические условия
ГОСТ 4204-77 Реактивы. Кислота серная. Технические условия
ГОСТ 5845-79 Реактивы. Калий-натрий виннокислый 4-водный. Технические условия
ГОСТ 6038-79 Реактивы. D-глюкоза. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 13867-68 Продукты химические. Обозначение чистоты
ГОСТ 18481-81 Ареометры и цилиндры стеклянные. Общие технические условия
ИС МЕГАНОРМ: примечание. ГОСТ 20264.0-74 утратил силу на территории Российской Федерации с 1 мая 2017 года в связи с введением в действие ГОСТ Р 57248-2016 (Приказ Росстандарта от 09.11.2016 N 1649-ст). |
ГОСТ 20264.0-74 Препараты ферментные. Правила приемки и методы отбора проб
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 28498-90 Термометры жидкостные стеклянные. Общие технические требования. Методы испытаний
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
Примечание. При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1. Гидролиз: расщепление исходного соединения на более простые в присутствии молекул воды.
3.2. Ферментативный гидролиз: расщепление высокомолекулярных соединений при участии катализаторов белковой природы - гидролитических ферментов (гидролаз, класс 3 [1]).
3.3. Субстрат: соединение или вещество, на которое воздействует данный фермент.
3.4.  : высокомолекулярное соединение, полимер, в котором остатки глюкозы соединены гликозидными связями; с водой образует коллоидные растворы.
: высокомолекулярное соединение, полимер, в котором остатки глюкозы соединены гликозидными связями; с водой образует коллоидные растворы.
 : высокомолекулярное соединение, полимер, в котором остатки глюкозы соединены гликозидными связями; с водой образует коллоидные растворы.
: высокомолекулярное соединение, полимер, в котором остатки глюкозы соединены гликозидными связями; с водой образует коллоидные растворы.3.5. Системные названия ферментов: названия, указывающие природу химической реакции, катализируемой данным ферментом, в соответствии с современной классификацией (КФ), принятой Международной комиссией по ферментам.
Примечание. Системные названия ферментов.
В группу 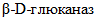 эндодействия, катализирующих расщепление
эндодействия, катализирующих расщепление 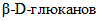 , входит 6 ферментов:
, входит 6 ферментов:
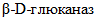 эндодействия, катализирующих расщепление
эндодействия, катализирующих расщепление 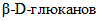 , входит 6 ферментов:
, входит 6 ферментов:- 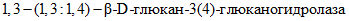 (КФ 3.2.1.6) -
(КФ 3.2.1.6) -  (ламинариназа) - катализирует расщепление внутренних
(ламинариназа) - катализирует расщепление внутренних  или
или  в
в 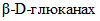 ;
;
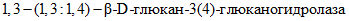 (КФ 3.2.1.6) -
(КФ 3.2.1.6) -  (ламинариназа) - катализирует расщепление внутренних
(ламинариназа) - катализирует расщепление внутренних  в
в 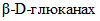 ;
;- 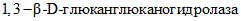 (КФ 3.2.1.39) -
(КФ 3.2.1.39) - 
 - гидролизует преимущественно внутренние
- гидролизует преимущественно внутренние 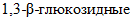 связи);
связи);
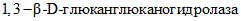 (КФ 3.2.1.39) -
(КФ 3.2.1.39) - 
 - гидролизует преимущественно внутренние
- гидролизует преимущественно внутренние 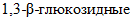 связи);
связи);-  (КФ 3.2.1.73) - лихеназа - гидролизует
(КФ 3.2.1.73) - лихеназа - гидролизует  связи в
связи в 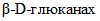 , имеющих
, имеющих 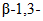 и
и 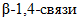 ;
;
 (КФ 3.2.1.73) - лихеназа - гидролизует
(КФ 3.2.1.73) - лихеназа - гидролизует  связи в
связи в 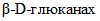 , имеющих
, имеющих 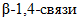 ;
;-  (КФ 3.2.1.75) -
(КФ 3.2.1.75) - 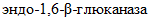 - гидролизует
- гидролизует 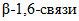 внутри
внутри 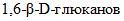 ;
;
 (КФ 3.2.1.75) -
(КФ 3.2.1.75) - 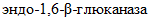 - гидролизует
- гидролизует 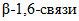 внутри
внутри 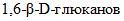 ;
;- 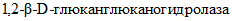 (КФ 3.2.1.71) -
(КФ 3.2.1.71) -  - гидролизует внутренние
- гидролизует внутренние 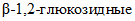 связи глюкана.
связи глюкана.
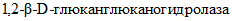 (КФ 3.2.1.71) -
(КФ 3.2.1.71) -  - гидролизует внутренние
- гидролизует внутренние 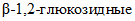 связи глюкана.
связи глюкана.В группу  экзодействия входят ферменты
экзодействия входят ферменты  (КФ 3.22.1.21) -
(КФ 3.22.1.21) -  ; целлобиоза, расщепляют последнюю с нередуцирующего конца
; целлобиоза, расщепляют последнюю с нередуцирующего конца 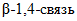 в
в  , высвобождая
, высвобождая  .
.
 экзодействия входят ферменты
экзодействия входят ферменты  (КФ 3.22.1.21) -
(КФ 3.22.1.21) -  ; целлобиоза, расщепляют последнюю с нередуцирующего конца
; целлобиоза, расщепляют последнюю с нередуцирующего конца 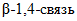 в
в  , высвобождая
, высвобождая  .
. с субстратом
с субстратом 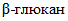
4.1.1. Метод основан на количественном определении редуцирующих (восстанавливающих) сахаров, образующихся в результате действия фермента 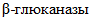 на
на  при температуре 50 °C.
при температуре 50 °C.
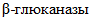 на
на  при температуре 50 °C.
при температуре 50 °C.4.1.2. За единицу  активности
активности  принимают количество фермента, действующего на
принимают количество фермента, действующего на  , из ячменя с высвобождением 1 мкмоля восстанавливающих сахаров (в глюкозном эквиваленте), образующихся за 1 мин при стандартных условиях (температура 50 °C и значение pH 5,0).
, из ячменя с высвобождением 1 мкмоля восстанавливающих сахаров (в глюкозном эквиваленте), образующихся за 1 мин при стандартных условиях (температура 50 °C и значение pH 5,0).
 активности
активности  принимают количество фермента, действующего на
принимают количество фермента, действующего на  , из ячменя с высвобождением 1 мкмоля восстанавливающих сахаров (в глюкозном эквиваленте), образующихся за 1 мин при стандартных условиях (температура 50 °C и значение pH 5,0).
, из ячменя с высвобождением 1 мкмоля восстанавливающих сахаров (в глюкозном эквиваленте), образующихся за 1 мин при стандартных условиях (температура 50 °C и значение pH 5,0).4.1.3. Содержание редуцирующих сахаров, образующихся в результате ферментативной реакции, определяют колориметрическим методом, основанным на взаимодействии сахаров с реактивом Шомоди - Нельсона [2]. В результате этой реакции образуется соединение голубого цвета, интенсивность окраски которого пропорциональна содержанию редуцирующих сахаров, образовавшихся в процессе ферментативной реакции. Интенсивность окраски полученных растворов измеряют на фотоэлектроколориметре при длине световой волны 610 нм; активность выражается в  или см3 испытуемого препарата.
или см3 испытуемого препарата.
 или см3 испытуемого препарата.
или см3 испытуемого препарата.4.2.1. Для определения  активности используют следующие средства измерений, вспомогательное оборудование, лабораторную посуду, реактивы, материалы:
активности используют следующие средства измерений, вспомогательное оборудование, лабораторную посуду, реактивы, материалы:
 активности используют следующие средства измерений, вспомогательное оборудование, лабораторную посуду, реактивы, материалы:
активности используют следующие средства измерений, вспомогательное оборудование, лабораторную посуду, реактивы, материалы:- весы неавтоматического действия по ГОСТ Р 53228, с пределами абсолютной допускаемой погрешности +/- 0,5 мг;
(в ред. Изменения N 1, утв. Приказом Росстандарта от 29.09.2015 N 1400-ст)
- фотоэлектроколориметр (КФК-3) или спектрофотометр (СФ) любого типа, которые обеспечивают измерения при длине световой волны 610 нм с погрешностью измерения коэффициента пропускания не более 1% (не более 0,01 единицы оптической плотности);
- холодильник бытовой;
- pH-метр любого типа для измерения в диапазоне от 0 до 14 pH с пределом допускаемой погрешности в эксплуатации +/- 0,1 единицы pH;
- магнитную мешалку любой марки, которая обеспечивает скорость вращения до 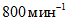 ;
;
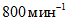 ;
;- ультратермостат или водяной термостат с точностью регулирования температуры +/- 1 °C;
- лабораторную центрифугу любого типа, которая обеспечивает скорость вращения не менее  ;
;
 ;
;- водяную баню любого типа, которая обеспечивает поддержание температуры (100 +/- 1) °C;
- секундомер с емкостью шкалы счетчика 1 мин, ценой деления 1 с и погрешностью +/- 1,5 с;
- пипетки автоматические вместимостью от 0,1 до 1,0 см3, 1,0 см3 и от 0,2 до 5,0 см3 с наконечниками;
- встряхиватель V-3 типа Вортекс или аналогичный для перемешивания жидкости;
- термометры ртутные стеклянные лабораторные от 0 °C до 50 °C и от 0 °C до 100 °C с ценой деления 0,1 °C или 0,5 °C по ГОСТ 28498;
- ареометры общего назначения по ГОСТ 18481;
- стаканы и колбы стеклянные лабораторные В-1-150 ТС, В-1-800 ТС, Кн-1-100-14/23 ТС по ГОСТ 25336;
- стаканчики для взвешивания (бюксы) СВ-19/9 по ГОСТ 25336;
- воронки В-75-140 ХС по ГОСТ 25336;
- пробирки П1-14-120ХС или П1-16-150ХС по ГОСТ 25336;
- колбы мерные 1-25-2, 1-50-2, 1-100-2, 1-200-2, 1-250-2, 2-1000-2 по ГОСТ 1770;
- цилиндры 1-25-2, 1-50-2, 1-100-2, 1-250-2 по ГОСТ 1770;
- пипетки стеклянные 1-2-2-1, 1-2-2-2, 1-2-2-5, 1-2-2-10 по ГОСТ 29227;
- бумагу фильтровальную лабораторную по ГОСТ 12026;
-  из ячменя, содержание основного вещества не менее 95%;
из ячменя, содержание основного вещества не менее 95%;
 из ячменя, содержание основного вещества не менее 95%;
из ячменя, содержание основного вещества не менее 95%;- натрий уксуснокислый по ГОСТ 199;
- кислоту уксусную ледяную по ГОСТ 61;
- ацетон по ГОСТ 2603;
- натрий углекислый по ГОСТ 83;
- калий-натрий виннокислый 4-водный по ГОСТ 5845;
- медь сернокислую 5-водную по ГОСТ 4165;
- натрий углекислый кислый по ГОСТ 4201;
- аммоний молибденовокислый 4-водный по ГОСТ 3765;
- натрий сернокислый по ГОСТ 4166;
- кислоту серную концентрированную для пробы Саваля по ГОСТ 4204;
- натрий кислый мышьяковокислый, содержание основного вещества 98%;
- D(+)-глюкозу по ГОСТ 6038;
- воду дистиллированную по ГОСТ 6709.
4.2.2. Все реактивы должны относиться к подгруппе чистоты 2 (х.ч.) или 3 (ч.д.а.) по ГОСТ 13867.
4.2.3. Допускается применение средств измерений, вспомогательного оборудования с аналогичными метрологическими и техническими характеристиками, а также реактивов по качеству не хуже вышеуказанных.
4.3.1. Приготовление ацетатного буферного раствора молярной концентрации 0,1 моль/дм3 с pH 5,0 из растворов уксуснокислого натрия и уксусной кислоты
4.3.1.1. Приготовление раствора  (раствор А)
(раствор А)
 (раствор А)
(раствор А)В мерную колбу вместимостью 1 дм3 помещают навеску безводного уксуснокислого натрия массой (8,20 +/- 0,01) г или (13,60 +/- 0,01) г 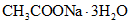 и растворяют приблизительно в 300 см3 дистиллированной воды. Затем доводят до метки дистиллированной водой при 20 °C и перемешивают.
и растворяют приблизительно в 300 см3 дистиллированной воды. Затем доводят до метки дистиллированной водой при 20 °C и перемешивают.
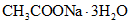 и растворяют приблизительно в 300 см3 дистиллированной воды. Затем доводят до метки дистиллированной водой при 20 °C и перемешивают.
и растворяют приблизительно в 300 см3 дистиллированной воды. Затем доводят до метки дистиллированной водой при 20 °C и перемешивают.4.3.1.2. Приготовление раствора 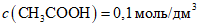 (раствор Б)
(раствор Б)
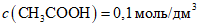 (раствор Б)
(раствор Б)В мерную колбу вместимостью 1 дм3 вносят 5,72 см3 ледяной уксусной кислоты, разводят приблизительно 300 см3 дистиллированной воды. Объем доводят до метки дистиллированной водой при 20 °C и перемешивают.
4.3.1.3. Для приготовления ацетатного буферного раствора в колбе смешивают растворы уксуснокислого натрия (раствор А) и уксусной кислоты (раствор Б) в соотношении 2:1, создавая значение pH смеси, равное 5,0. При необходимости доводят pH раствора до 5,0 одним из исходных растворов. Буферный раствор хранят в закрытой стеклянной посуде при 4 °C в течение четырех недель.
4.3.2.1. Приготовление раствора А
Безводный углекислый натрий массой (24,00 +/- 0,01) г и виннокислый калий-натрий 4-водный массой (12,00 +/- 0,01) г растворяют в стакане в 250 см3 дистиллированной воды. К этому раствору добавляют при перемешивании раствор сернокислой меди 5-водной, для чего навеску 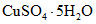 массой (4,00 +/- 0,01) г растворяют в 40 см3 дистиллированной воды при 20 °C. Затем в полученную смесь вносят безводный кислый углекислый натрий массой (16,00 +/- 0,01) г и содержимое стакана вновь перемешивают. Получают раствор А.
массой (4,00 +/- 0,01) г растворяют в 40 см3 дистиллированной воды при 20 °C. Затем в полученную смесь вносят безводный кислый углекислый натрий массой (16,00 +/- 0,01) г и содержимое стакана вновь перемешивают. Получают раствор А.
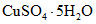 массой (4,00 +/- 0,01) г растворяют в 40 см3 дистиллированной воды при 20 °C. Затем в полученную смесь вносят безводный кислый углекислый натрий массой (16,00 +/- 0,01) г и содержимое стакана вновь перемешивают. Получают раствор А.
массой (4,00 +/- 0,01) г растворяют в 40 см3 дистиллированной воды при 20 °C. Затем в полученную смесь вносят безводный кислый углекислый натрий массой (16,00 +/- 0,01) г и содержимое стакана вновь перемешивают. Получают раствор А.4.3.2.2. Приготовление раствора Б
В другом стакане растворяют безводный сернокислый натрий массой (18,00 +/- 0,01) г в 500 см3 горячей (~ 80 °C) дистиллированной воды и кипятят раствор на слабом огне 40 мин, после чего остужают. Получают раствор Б.
4.3.2.3. В мерной колбе вместимостью 1 дм3 смешивают приготовленные растворы А и Б, доводят объем смеси до метки дистиллированной водой. Полученный реактив Шомоди стабилен в течение 2 - 3 мес при хранении его в стеклянной темной посуде при комнатной температуре.
4.3.3.1. Приготовление раствора А
Навеску безводного молибденовокислого аммония массой (50,00 +/- 0,01) г или (68,40 +/- 0,01) г 4-водного растворяют в стакане в 800 см3 горячей (~ 60 °C) дистиллированной воды. Раствор охлаждают до 5 °C - 10 °C.
4.3.3.2. Приготовление раствора Б
В навеску концентрированной серной кислоты массой (42,00 +/- 0,02) г вносят навеску безводного кислого мышьяковокислого натрия массой (6,00 +/- 0,01) г (или 10 г  ).
).
 ).
).4.3.3.3. Раствор А переносят в мерную колбу вместимостью 1 дм3. К раствору А при перемешивании осторожно добавляют раствор Б. Объем смеси доводят до метки дистиллированной водой. Полученную смесь инкубируют в течение 48 ч при температуре 40 °C, после чего при наличии осадка фильтруют через стеклянный фильтр. Полученный реактив Нельсона стабилен в течение 2 - 3 мес при хранении его в темном месте при температуре (20,0 +/- 0,2) °C.
Субстратом является  ячменный.
ячменный.  массовой доли 1,0% готовят в 0,1 моль/дм3 ацетатном буфере (pH 5,0). В стакан вместимостью 100 см3 вносят 0,5 г
массовой доли 1,0% готовят в 0,1 моль/дм3 ацетатном буфере (pH 5,0). В стакан вместимостью 100 см3 вносят 0,5 г  , добавляют 49,5 см3 ацетатного буферного раствора по 4.3.1 и непрерывно перемешивают около 1 ч на магнитной мешалке при комнатной температуре. Затем раствор
, добавляют 49,5 см3 ацетатного буферного раствора по 4.3.1 и непрерывно перемешивают около 1 ч на магнитной мешалке при комнатной температуре. Затем раствор  помещают в кипящую водяную баню на 2 - 3 мин, периодически перемешивая, после чего содержимое охлаждают. Полученный раствор
помещают в кипящую водяную баню на 2 - 3 мин, периодически перемешивая, после чего содержимое охлаждают. Полученный раствор  при необходимости центрифугируют в течение 7 мин при
при необходимости центрифугируют в течение 7 мин при  . Хранят в закрытой стеклянной посуде. Раствор стабилен в течение 1 сут.
. Хранят в закрытой стеклянной посуде. Раствор стабилен в течение 1 сут.
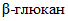 ячменный.
ячменный.  массовой доли 1,0% готовят в 0,1 моль/дм3 ацетатном буфере (pH 5,0). В стакан вместимостью 100 см3 вносят 0,5 г
массовой доли 1,0% готовят в 0,1 моль/дм3 ацетатном буфере (pH 5,0). В стакан вместимостью 100 см3 вносят 0,5 г  , добавляют 49,5 см3 ацетатного буферного раствора по 4.3.1 и непрерывно перемешивают около 1 ч на магнитной мешалке при комнатной температуре. Затем раствор
, добавляют 49,5 см3 ацетатного буферного раствора по 4.3.1 и непрерывно перемешивают около 1 ч на магнитной мешалке при комнатной температуре. Затем раствор 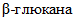 помещают в кипящую водяную баню на 2 - 3 мин, периодически перемешивая, после чего содержимое охлаждают. Полученный раствор
помещают в кипящую водяную баню на 2 - 3 мин, периодически перемешивая, после чего содержимое охлаждают. Полученный раствор  при необходимости центрифугируют в течение 7 мин при
при необходимости центрифугируют в течение 7 мин при  . Хранят в закрытой стеклянной посуде. Раствор стабилен в течение 1 сут.
. Хранят в закрытой стеклянной посуде. Раствор стабилен в течение 1 сут.4.3.5. Приготовление градуировочных растворов глюкозы
В мерную колбу вместимостью 100 см3 помещают (0,1000 +/- 0,0005) г глюкозы, растворяют в небольшом количестве ацетатного буферного раствора с pH 5,0 молярной концентрации 0,05 моль/дм3, получая его путем разведения ацетатного буферного раствора по 4.3.1 дистиллированной водой в соотношении 1:1. Раствор тщательно перемешивают и доводят объем до метки буферным раствором концентрации 0,05 моль/дм3.
(в ред. Изменения N 1, утв. Приказом Росстандарта от 29.09.2015 N 1400-ст)
4.3.5.2. Приготовление рабочих градуировочных растворов глюкозы
Из основного градуировочного раствора глюкозы по 4.3.5.1 готовят серию разведений в соответствии с таблицей 1.
Объем градуировочного раствора глюкозы массовой концентрации 1 мг/см3, см3 | Объем буферного раствора молярной концентрации 0,05 моль/дм3, см3 | Массовая концентрация глюкозы в рабочем растворе, мг/см3 |
0,10 | 4,90 | 0,02 |
0,20 | 4,80 | 0,04 |
0,30 | 4,70 | 0,06 |
0,40 | 4,60 | 0,08 |
0,50 | 4,50 | 0,10 |
Рабочие градуировочные растворы глюкозы готовят в день построения градуировочного графика, при этом берут по три параллельных разведения для приготовления каждой концентрации раствора глюкозы.
В каждую из параллелей, состоящей из пяти пробирок (16 x 150 мм), вносят в по 1 см3 рабочих градуировочных растворов глюкозы различных концентраций в соответствии с таблицей 1, добавляют в каждую пробирку по 1 см3 реактива Шомоди, приготовленного по 4.3.2, перемешивают и помещают пробирки в кипящую водяную баню на 20 мин.
Пробирки охлаждают в холодной воде до температуры (20,0 +/- 0,2) °C, добавляют по 1 см3 реактива Нельсона, приготовленного по 4.3.3, содержимое перемешивают, инкубируют 10 мин при температуре (20,0 +/- 0,2) °C и вносят по 7 см3 дистиллированной воды, доводя объем содержимого пробирки до 10 см3.
Одновременно готовят контрольную пробу на реактивы по 4.5.2. Оптические плотности растворов глюкозы измеряют на фотоэлектроколориметре или спектрофотометре при длине световой волны  в кюветах с толщиной поглощающего светового слоя 10 мм в сравнении с контролем на реактивы.
в кюветах с толщиной поглощающего светового слоя 10 мм в сравнении с контролем на реактивы.
 в кюветах с толщиной поглощающего светового слоя 10 мм в сравнении с контролем на реактивы.
в кюветах с толщиной поглощающего светового слоя 10 мм в сравнении с контролем на реактивы.Для построения каждой точки градуировочного графика вычисляют среднеарифметическое значение оптической плотности трех параллельных измерений.
По полученным среднеарифметическим значениям строят градуировочный график зависимости оптической плотности (поглощения) от концентрации глюкозы (мг/см3). Рабочая зона градуировочного графика лежит в пределах от 0,10 до 1,1 единицы оптической плотности.
На оси абсцисс X откладывают массовую концентрацию глюкозы C в мг/см3; на оси ординат Y - соответствующие значения оптической плотности D при 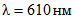 . На рисунке 1 приведен пример градуировочного графика. Величина, характеризующая наклон градуировочной прямой и обратная ее тангенсу угла наклона, составляет, например 0,098 (1/tg = 0,098), что является коэффициентом K, входящим в формулу расчета
. На рисунке 1 приведен пример градуировочного графика. Величина, характеризующая наклон градуировочной прямой и обратная ее тангенсу угла наклона, составляет, например 0,098 (1/tg = 0,098), что является коэффициентом K, входящим в формулу расчета 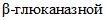 активности. Величина коэффициента может меняться в зависимости от приготовленных реактивов Шомоди и Нельсона. Таким образом, эта величина равна массовой концентрации глюкозы на оси X при оптической плотности на оси Y, равной 1,0.
активности. Величина коэффициента может меняться в зависимости от приготовленных реактивов Шомоди и Нельсона. Таким образом, эта величина равна массовой концентрации глюкозы на оси X при оптической плотности на оси Y, равной 1,0.
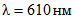 . На рисунке 1 приведен пример градуировочного графика. Величина, характеризующая наклон градуировочной прямой и обратная ее тангенсу угла наклона, составляет, например 0,098 (1/tg = 0,098), что является коэффициентом K, входящим в формулу расчета
. На рисунке 1 приведен пример градуировочного графика. Величина, характеризующая наклон градуировочной прямой и обратная ее тангенсу угла наклона, составляет, например 0,098 (1/tg = 0,098), что является коэффициентом K, входящим в формулу расчета 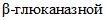 активности. Величина коэффициента может меняться в зависимости от приготовленных реактивов Шомоди и Нельсона. Таким образом, эта величина равна массовой концентрации глюкозы на оси X при оптической плотности на оси Y, равной 1,0.
активности. Величина коэффициента может меняться в зависимости от приготовленных реактивов Шомоди и Нельсона. Таким образом, эта величина равна массовой концентрации глюкозы на оси X при оптической плотности на оси Y, равной 1,0.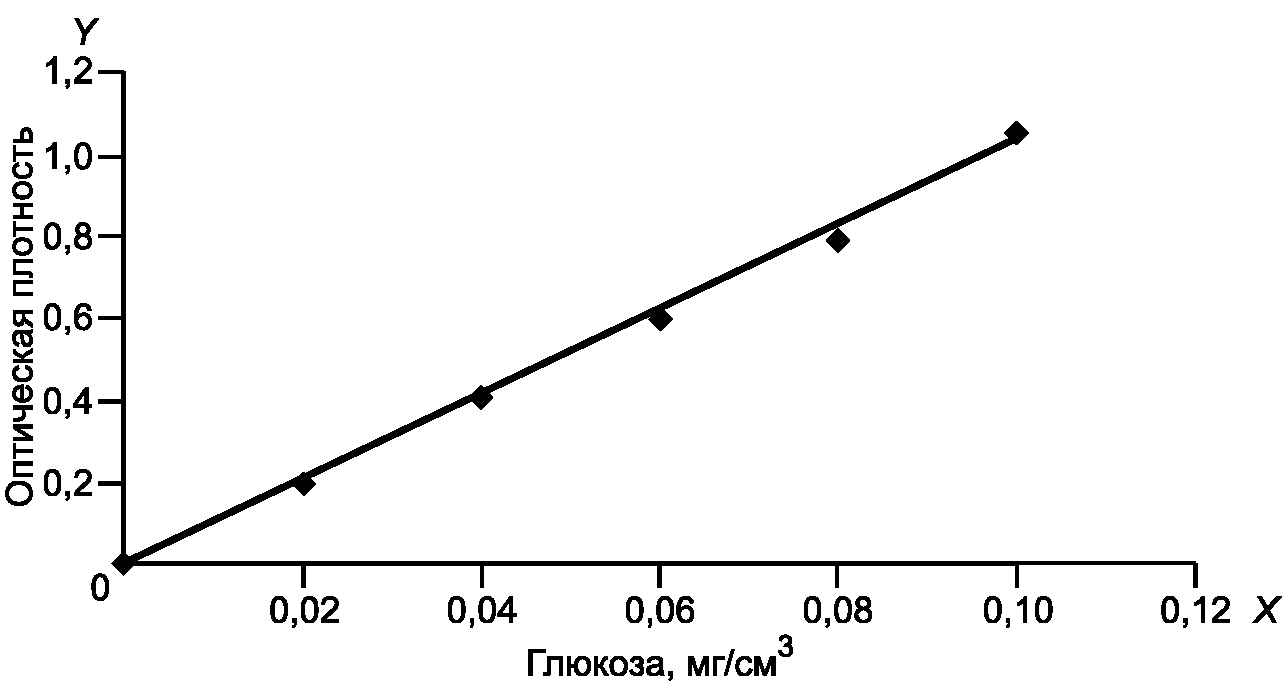
Рисунок 1
Градуировочный график строят каждый раз при приготовлении новых реактивов Шомоди и Нельсона, а также при замене прибора.
ИС МЕГАНОРМ: примечание. ГОСТ 20264.0-74 утратил силу на территории Российской Федерации с 1 мая 2017 года в связи с введением в действие ГОСТ Р 57248-2016 (Приказ Росстандарта от 09.11.2016 N 1649-ст). |
4.4.1. Отбор проб проводят по ГОСТ 20264.0.
Анализируемые образцы ферментных препаратов в форме порошка или жидком виде можно использовать без предварительной подготовки.
В стаканчик для взвешивания помещают сухой анализируемый образец ферментного препарата массой (0,1000 +/- 0,0005) г или жидкий ферментный препарат массой (1,00 +/- 0,02) г и суспендируют в небольшом количестве дистиллированной воды. Суспензию количественно переносят в мерную колбу вместимостью 100 см3, доводят объем до метки дистиллированной водой при 20 °C и тщательно перемешивают. Приготовленный раствор ферментного препарата является основным раствором анализируемого образца.
(в ред. Изменения N 1, утв. Приказом Росстандарта от 29.09.2015 N 1400-ст)
Рабочий раствор анализируемого ферментного препарата готовят из основного раствора по 4.4.2 путем дальнейшего разведения его дистиллированной водой таким образом, чтобы при определении активности оптические плотности опытного и контрольного растворов находились в пределах рабочей зоны градуировочного графика по 4.3.6.
Количество фермента, взятого на анализ, должно быть рассчитано так, чтобы в реакционной смеси по 4.5.1.2 присутствовал избыток субстрата и чтобы измеряемые величины оптической плотности 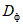 по 4.5.1.5 при колориметрировании в кювете с толщиной поглощающего свет слоя 10 мм лежали в диапазоне значений 0,8 - 1,1.
по 4.5.1.5 при колориметрировании в кювете с толщиной поглощающего свет слоя 10 мм лежали в диапазоне значений 0,8 - 1,1.
При отклонении оптической плотности от указанных значений необходимо подобрать разведение препарата таким образом, чтобы оптическая плотность окрашенных растворов 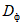 по 4.5.1.5 соответствовала указанным пределам диапазона.
по 4.5.1.5 соответствовала указанным пределам диапазона.
Каждое разведение испытуемого раствора анализируют в двух повторностях. Для анализа берут две параллельные навески препарата.
Рабочий раствор ферментного препарата готовят непосредственно перед определением.
4.5.1. Проведение ферментативной реакции
4.5.1.1. В две опытные пробирки (16 x 150 мм) вносят по 0,5 см3 субстрата  по 4.3.4. В пробирки добавляют по 0,3 см3 дистиллированной воды. Содержимое пробирок перемешивают и прогревают в ультратермостате с температурой (50 +/- 1) °C в течение 5 мин.
по 4.3.4. В пробирки добавляют по 0,3 см3 дистиллированной воды. Содержимое пробирок перемешивают и прогревают в ультратермостате с температурой (50 +/- 1) °C в течение 5 мин.
 по 4.3.4. В пробирки добавляют по 0,3 см3 дистиллированной воды. Содержимое пробирок перемешивают и прогревают в ультратермостате с температурой (50 +/- 1) °C в течение 5 мин.
по 4.3.4. В пробирки добавляют по 0,3 см3 дистиллированной воды. Содержимое пробирок перемешивают и прогревают в ультратермостате с температурой (50 +/- 1) °C в течение 5 мин.4.5.1.2. В пробирки добавляют по 0,2 см3 рабочего раствора анализируемого образца ферментного препарата по 4.4.3, предварительно прогретого до температуры (50 +/- 1) °C, и тщательно перемешивают. Реакционную смесь инкубируют при температуре (50 +/- 1) °C в течение 10 мин, ведя отсчет с момента начала ферментативной реакции.
4.5.1.3. По окончании реакции в пробирки вносят по 1 см3 реактива Шомоди по 4.3.2, тщательно перемешивают, закрывают стеклянными пробками, помещают в кипящую водяную баню на 20 мин.
4.5.1.4. Пробирки охлаждают в холодной воде, добавляют 1,0 см3 реактива Нельсона по 4.3.3, перемешивают и инкубируют 10 мин при (20,0 +/- 0,2) °C, периодически тщательно перемешивая. При образовании осадка или мути в пробирки добавляют по 1 см3 ацетона и перемешивают до полного их исчезновения. В этом случае ацетон добавляют в контрольные пробирки "фона" реактивов по 4.5.2 и "фона" субстрата по 4.5.3.
4.5.1.5. Содержимое пробирок доводят до общего объема 10 см3 дистиллированной водой и измеряют оптическую плотность 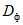 на фотоэлектроколориметре или спектрофотометре при длине световой волны 610 нм в кюветах с толщиной поглощающего свет слоя 10 мм против "фона" реактивов по 4.5.2. Значение оптической плотности должно быть в диапазоне 0,8 - 1,1.
на фотоэлектроколориметре или спектрофотометре при длине световой волны 610 нм в кюветах с толщиной поглощающего свет слоя 10 мм против "фона" реактивов по 4.5.2. Значение оптической плотности должно быть в диапазоне 0,8 - 1,1.
4.5.1.6. Если значение оптической плотности опытной пробы 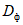 находится за пределами рабочей зоны градуировочного графика и не укладывается в диапазон ее значения, определение активности следует повторить с рабочим раствором анализируемого образца, содержащим большее или меньшее количество фермента соответственно.
находится за пределами рабочей зоны градуировочного графика и не укладывается в диапазон ее значения, определение активности следует повторить с рабочим раствором анализируемого образца, содержащим большее или меньшее количество фермента соответственно.
Контрольным раствором при колориметрировании исследуемых растворов является "фон" реактивов. Против него производят измерение оптической плотности опытной пробы  , "фона" субстрата
, "фона" субстрата 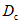 и "фона" фермента
и "фона" фермента  . Контрольную пробу на реактивы осуществляют, внося в пробирку 0,5 см3 ацетатного буферного раствора по 4.3.1, 0,5 см3 дистиллированной воды и 1 см3 реактива Шомоди по 4.3.2. Содержимое пробирки перемешивают и инкубируют в кипящей водяной бане 20 мин. Дальнейшие операции осуществляют аналогично 4.5.1.4 - 4.5.1.5.
. Контрольную пробу на реактивы осуществляют, внося в пробирку 0,5 см3 ацетатного буферного раствора по 4.3.1, 0,5 см3 дистиллированной воды и 1 см3 реактива Шомоди по 4.3.2. Содержимое пробирки перемешивают и инкубируют в кипящей водяной бане 20 мин. Дальнейшие операции осуществляют аналогично 4.5.1.4 - 4.5.1.5.
(в ред. Изменения N 1, утв. Приказом Росстандарта от 29.09.2015 N 1400-ст)
В пробирку вносят по 0,5 см3 субстрата 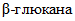 по 4.3.4, добавляют 0,5 см3 дистиллированной воды и 1 см3 реактива Шомоди по 4.3.2. Содержимое пробирки перемешивают и инкубируют в кипящей водяной бане 20 мин. Дальнейшие операции осуществляют аналогично 4.5.1.4 - 4.5.1.5. Показания оптической плотности на субстрат обозначают
по 4.3.4, добавляют 0,5 см3 дистиллированной воды и 1 см3 реактива Шомоди по 4.3.2. Содержимое пробирки перемешивают и инкубируют в кипящей водяной бане 20 мин. Дальнейшие операции осуществляют аналогично 4.5.1.4 - 4.5.1.5. Показания оптической плотности на субстрат обозначают  .
.
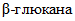 по 4.3.4, добавляют 0,5 см3 дистиллированной воды и 1 см3 реактива Шомоди по 4.3.2. Содержимое пробирки перемешивают и инкубируют в кипящей водяной бане 20 мин. Дальнейшие операции осуществляют аналогично 4.5.1.4 - 4.5.1.5. Показания оптической плотности на субстрат обозначают
по 4.3.4, добавляют 0,5 см3 дистиллированной воды и 1 см3 реактива Шомоди по 4.3.2. Содержимое пробирки перемешивают и инкубируют в кипящей водяной бане 20 мин. Дальнейшие операции осуществляют аналогично 4.5.1.4 - 4.5.1.5. Показания оптической плотности на субстрат обозначают 4.5.4. Определение оптической плотности "фона" фермента
В пробирку вносят 0,5 см3 ацетатного буфера по 4.3.1, 0,2 см3 рабочего раствора ферментного препарата по 4.4.3 и 0,3 см3 дистиллированной воды, затем добавляют 1 см3 реактива Шомоди по 4.3.2. Содержимое пробирки инкубируют в кипящей водяной бане 20 мин. Дальнейшие операции осуществляют аналогично 4.5.1.4 - 4.5.1.5. Показания оптической плотности на "фон" фермента обозначают как 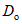 .
.
(в ред. Изменения N 1, утв. Приказом Росстандарта от 29.09.2015 N 1400-ст)
4.6.1. Ферментативную активность  в анализируемом образце в
в анализируемом образце в  или
или 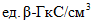 вычисляют по формуле
вычисляют по формуле
 в анализируемом образце в
в анализируемом образце в  или
или 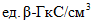 вычисляют по формуле
вычисляют по формуле , (1)
, (1)где K - коэффициент по 4.3.6;
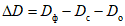 ,
,Dф - величина оптической плотности опытной пробы;
Dс - величина оптической плотности "фона" субстрата;
Dо - величина оптической плотности "фона" фермента;
2,78 - коэффициент, учитывающий пятикратное разбавление рабочего раствора ферментного препарата непосредственно в реакционной смеси, время проведения ферментативной реакции (10 мин) и молекулярный вес глюкозы (0,18016 мг/мкмоль), т.е. 5/10·0,18016 = 2,78;
d - плотность ферментного препарата (для жидких препаратов) по ГОСТ 18481, г/см3;
n - масса ферментного препарата, взятая на гидролиз (расчет ведется на 1 см3 рабочего раствора анализируемого образца ферментного препарата), г.
(формула (1) в ред. Изменения N 1, утв. Приказом Росстандарта от 29.09.2015 N 1400-ст)
4.6.2. За окончательный результат принимают среднеарифметическое значение двух параллельных определений, выполненных в условиях повторяемости, если выполняется условие приемлемости (2).
Границы относительной погрешности 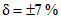 (соответствуют значению относительной расширенной неопределенности
(соответствуют значению относительной расширенной неопределенности  при коэффициенте охвата k = 2).
при коэффициенте охвата k = 2).
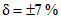 (соответствуют значению относительной расширенной неопределенности
(соответствуют значению относительной расширенной неопределенности Результат анализа представляют в виде
где 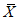 - среднеарифметическое значение двух параллельных измерений, признанных приемлемыми,
- среднеарифметическое значение двух параллельных измерений, признанных приемлемыми, 
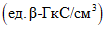 ;
;

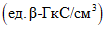 ;
;
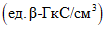 , вычисляют по формуле
, вычисляют по формуле или
или  .
.Наименьшие разряды числовых значений результата измерения и численных показателей точности должны быть одинаковы.
Значащих цифр численных показателей точности измерений должно быть не более двух.
4.7.1. Результаты измерений, полученные в условиях повторяемости (сходимости), признаются удовлетворительными, если выполняется условие приемлемости
где 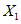 и
и  - результаты двух параллельных определений, полученные в условиях повторяемости,
- результаты двух параллельных определений, полученные в условиях повторяемости,  или
или 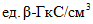 ;
;
 или
или 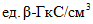 ;
;0,01 - коэффициент для пересчета процентов в абсолютные значения;
r - предел повторяемости (сходимости), равный 8%;
X - среднеарифметическое значение двух параллельных определений,  или
или 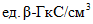 анализируемого препарата.
анализируемого препарата.
 или
или 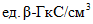 анализируемого препарата.
анализируемого препарата.4.7.2. Результаты измерений, полученные в условиях воспроизводимости по ГОСТ Р ИСО 5725-1, признаются удовлетворительными, если выполняется условие приемлемости
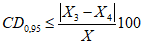 , (3)
, (3)где  и
и 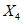 - результаты двух определений, полученные в условиях воспроизводимости,
- результаты двух определений, полученные в условиях воспроизводимости, 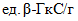 или
или 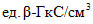 анализируемого препарата;
анализируемого препарата;
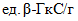 или
или 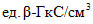 анализируемого препарата;
анализируемого препарата;X - среднеарифметическое значение двух определений, выполненных в разных лабораториях в условиях воспроизводимости,  или
или 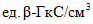 анализируемого препарата;
анализируемого препарата;
 или
или 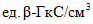 анализируемого препарата;
анализируемого препарата;100 - коэффициент для пересчета в проценты;
Committee of the IUB//N.Y., Academic Press - 1984
Определение активности ферментов: Справочник. М.: ДеЛи принт,
2003. 372 с.
 (КФ 3.2.1.4)
(КФ 3.2.1.4)  (целлюлаза) - гидролизует
(целлюлаза) - гидролизует 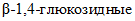 связи в целлюлозе,
связи в целлюлозе, 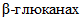 зерна;
зерна; с массовой долей 1,0% (субстрат)
с массовой долей 1,0% (субстрат)