Государственное санитарно-эпидемиологическое нормирование
Российской Федерации
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Измерение концентраций действующих
веществ пестицидов в воде, почве, зеленой
массе, зерне и соломе зерновых культур,
семенах и масле рапса, зерне гороха,
семенах и масле льна
Сборник
методических указаний
по методам контроля
МУК
4.1.3020-12; 4.1.3022-12;
4.1.3042-12; 4.1.3045-12
Москва 2013
1. Разработаны сотрудниками ГНУ «Всероссийский НИИ защиты растений» Россельхозакадемии, ФГУП «Всероссийский научно-исследовательский институт метрологии им. Д.И. Менделеева».
2. Введены в действие с момента утверждения.
3. Введены впервые.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Руководитель Федеральной службы Главный государственный санитарный врач Российской Федерации Г.Г. Онищенко 8 октября 2012 г. Дата введения: с момента утверждения |
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Измерение остаточных количеств имазалила
в зерне гороха методом капиллярной
газожидкостной хроматографии
Методические
указания
МУК 4.1.3042-12
Свидетельство о метрологической аттестации № 01.5.04.083/01.00043/2012.
Настоящие методические указания устанавливают метод капиллярной газожидкостной хроматографии для определения в зерне гороха массовой концентрации имазалила в диапазоне концентраций 0,02 - 0,2 мг/кг.
Название действующего вещества по ИСО: имазалил.
Название действующего вещества по ИЮПАК: (±)-1-(β-аллилокси-2,4-дихлорфенилэтил) имидазол.
Структурная формула:
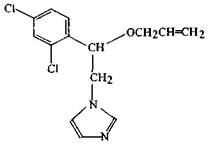
Эмпирическая формула: C14H14Cl2N2O.
Молекулярная масса: 297,2.
Химически чистый имазалил представляет собой кристаллическую массу от светло-желтого до коричневого цвета с температурой плавления 52,7 °С, давлением паров 0,158 мРа (20 °С).
Коэффициент распределения в системе н-окганол-вода Kow log P = 3,82 (рН 9,2 буфер).
Растворимость при 20 °С (г/л): в воде - 0,18 (рН 7,6, 20 °С), в гексане - 19 г/л, ацетоне, дихлорметане, этаноле, метаноле, изопропаноле, бензоле, толуоле, ксилоле - более 500 г/л, растворим в гептане, петролейном эфире.
Стабилен к гидролизу в разбавленных кислотах и щелочах при комнатной температуре в отсутствие света. Стабилен к свету при нормальных условиях хранения. Стабилен при нагревании до 285 °С. В почве DT50 4 - 5 дней, DT90 54 - 68 дней.
Краткая токсикологическая характеристика
Острая пероральная токсичность для крыс LD50 227 - 343 мг/кг. Дермальная токсичность для крыс LD50 4200 - 4880 мг/кг. Класс токсичности по ВОЗ и ЕРА - II.
Область применения
Системный фунгицид с защитным и лечебным действием.
Гигиенические нормативы: МДУ в семенах подсолнечника, сои и рапса 0,02 мг/кг, в горохе не установлен.
1. Погрешность измерений
При соблюдении всех регламентированных условий проведения анализа в точном соответствии с данной методикой погрешность (и ее составляющие) результатов измерений при доверительной вероятности Р = 0,95 не превышает значений, приведенных в табл. 1 для соответствующих диапазонов концентраций.
Таблица 1
Метрологические параметры
|
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости), σr |
Показатель промежуточной прецизионности (относительное среднеквадратическое отклонение в условиях вариации факторов «время», «оператор» в одной лаборатории), σRл, % |
Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости), σR, % |
Показатель точности* (границы относительной погрешности при вероятности P = 0,95), ± δ, % |
|
|
Зерно гороха от 0,02 до 0,1 вкл. |
7 |
9 |
12 |
25 |
|
Зерно гороха от 0,1 до 0,2 вкл. |
8 |
9 |
11 |
22 |
|
* Соответствует расширенной неопределенности Uотн. при коэффициенте охвата k = 2 |
||||
Таблица 2
Полнота извлечения имазалила, стандартное отклонение, доверительный интервал среднего результата для п = 20, Р = 0,95
|
Анализируемый объект |
Предел обнаружения, мг/кг |
Диапазон определяемых концентраций, мг/кг |
Среднее значение определения, % |
Стандартное отклонение, S, % |
Доверительный интервал среднего результата, ±, % |
|
Зерно гороха |
0,02 |
0,02 - 0,2 |
80,8 |
5,2 |
4,7 |
2. Метод измерений
Методика основана на определении имазалила методом капиллярной ГЖХ с использованием термоионного детектора после его извлечения из образцов гороха органическими растворителями с последующей очисткой перераспределением между двумя несмешивающимися жидкими фазами и на колонке с силикагелем.
Идентификация имазалила проводится по времени удерживания, количественное определение - методом абсолютной калибровки.
Избирательность метода обеспечивается сочетанием условий подготовки проб и хроматографирования.
3. Средства измерений, реактивы, вспомогательные устройства и материалы
3.1. Средства измерений
|
Хроматограф газовый «Кристалл 2000М» с термоионным детектором |
|
|
Весы аналитические типа ВЛА-200 |
|
|
Весы лабораторные типа ВЖТ-500 |
|
|
Колбы мерные со шлифом емкостью 50, 100 см3 |
|
|
Микрошприц МШ-10 |
ТУ 2-833-106 |
|
Пипетки мерные емкостью 1, 2, 5 и 10 см3 |
|
|
Пробирки мерные со шлифом емкостью 10,0 см3 |
|
|
Цилиндры мерные емкостью 50 и 100 см3 |
Примечание. Допускается использование средств измерения иных производителей с аналогичными или лучшими характеристиками.
3.2. Реактивы
|
Аналитический стандарт имазалила с массовой долей основного вещества 97,5 % |
|
|
Азот газообразный, вч |
ТУ 301-07-25-89 |
|
Ацетон, осч |
ТУ 2633-004-11291058-94 |
|
Вода дистиллированная |
ГОСТ 7602-76 |
|
н-Гексан, хч |
ТУ 6-09-3375-78 |
|
Дихлорметан, хч |
ТУ 6-09-2662-77 |
|
Натрии сернокислый б/в (сульфат), ч.д.а |
|
|
Натрий хлористый, ч.д.а |
|
|
Элюенты для колоночной хроматографии: |
|
|
- элюент № 1 - гексан; |
|
|
- элюент № 2 - гексан-ацетон 19:1 (по объему); |
|
|
- элюент № 3 - гексан-ацетон 4:1 (по объему); |
|
|
- элюент № 4 - ацетон |
Примечание. Допускается использование реактивов иных производителей с более высокой квалификацией, не требующих дополнительной очистки растворителей.
3.3. Вспомогательные устройства и материалы
|
Ванна ультразвуковая УЗВ/100 ТН |
|
|
Воронка Бюхнера |
|
|
Воронки делительные емкостью 250 и 500 см3 |
|
|
Воронки химические конусные |
|
|
Колбы-концентраторы емкостью 100, 250 и 500 см3 |
|
|
Колбы плоскодонные емкостью 100 и 300 см3 |
|
|
Колонка капиллярная кварцевая 30 м, внутренним диаметром 0,25 мм с НР-1 (0,25 мкм) |
|
|
Колонка стеклянная для колоночной хроматографии длиной 25 см, диаметром 10 мм |
|
|
Мельница электрическая лабораторная |
ТУ 46-22-236-79 |
|
Насос водоструйный |
ГОСТ 10696-75 |
|
Ротационный вакуумный испаритель Büchi R-200/205 (Швейцария) |
|
|
Силикагель 60 (230 - 400 меш.) (Мерк, Германия) |
|
|
Стекловата |
|
|
Стаканы химические на 100, 200 и 500 см3 |
|
|
Установка для упаривания растворителей в токе азота |
|
|
Фильтры бумажные, «красная лента» |
ТУ 2642-001-42624157-98 |
|
Фильтры бумажные, «белая лента» |
ТУ 2642-001-42624157-98 |
Примечание. Допускается применение оборудования иных производителей с аналогичными или лучшими техническими характеристиками.
4. Требования безопасности
4.1. При проведении работы необходимо соблюдать требования безопасности, установленные для работ с токсичными, едкими, легковоспламеняющимися веществами (ГОСТ 12.1.007-76).
При выполнении измерений с использованием газового хроматографа и работе с электроустановками соблюдать правила электробезопасности в соответствии с ГОСТ 12.1.019-2009 и инструкциями по эксплуатации приборов.
4.2. Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004-91 и иметь средства пожаротушения по ГОСТ 12.4.009-83. Содержание вредных веществ в воздухе не должно превышать ПДК (ОБУВ), установленных ГН 2.2.5.1313-03 и 2.2.5.2308-07. Организация обучения работников безопасности труда - по ГОСТ 12.0.004-90.
4.3. При работе с газами, находящимися в баллонах под давлением до 15 мПа (150 кгс/см2) необходимо соблюдать «Правила устройства и безопасной эксплуатации стационарных компрессорных установок, воздуховодов и газопроводов под давлением» ПБ-03-576-03. Запрещается открывать вентиль баллона, не установив на нем понижающий редуктор.
5. Требования к квалификации операторов
Измерения в соответствии с настоящей методикой может выполнять специалист-химик, имеющий опыт работы методом капиллярной газожидкостной хроматографии, ознакомленный с руководством по эксплуатации хроматографа, освоивший данную методику и подтвердивший экспериментально соответствие получаемых результатов нормативам контроля погрешности измерений по п. 12.
6. Условия измерений
При выполнении измерений выполняют следующие условия:
· процессы приготовления растворов и подготовки проб к анализу проводят при температуре воздуха (20 ± 5) °С и относительной влажности не более 80 %;
· выполнение измерений на газовом хроматографе проводят в условиях, рекомендованных технической документацией к прибору.
7. Отбор и хранение проб
Отбор проб зерна гороха проводят в соответствии с ГОСТ 28674-90 «Горох. Требования по заготовке и поставке». Для длительного хранения аналитические пробы зерна гороха помещают в герметично закрытый двойной полиэтиленовый пакет и хранят в морозильной камере с температурой -18 °С.
8. Подготовка к определению
8.1. Подготовка и очистка реактивов и растворителей
Перед началом работы рекомендуется проверить чистоту применяемых органических растворителей. Для этого 100 мл растворителя упаривают в ротационном вакуумном испарителе при температуре 40 °С до объема 1 см3 и хроматографируют. При обнаружении мешающих определению примесей очистку растворителей производят в соответствии с общепринятыми методиками.
8.2. Кондиционирование колонки
Перед началом анализа капиллярную колонку, не присоединяя к детектору, кондиционируют в токе инертного газа (азот) при температуре 250 °С до получения стабильной нулевой линии.
8.3. Приготовление растворов для очистки экстрактов
8.3.1. Элюент № 2 для колоночной хроматографии: в мерной колбе объемом 100 см3 смешивают 95 см3 н-гексана и 5 см3 ацетона.
8.3.2. Элюента № 3 для колоночной хроматографии: в мерной колбе объемом 100 см3 смешивают 80 см3 н-гексана и 20 см3 ацетона.
8.4. Приготовление градуировочных растворов
8.4.1. Основной раствор с концентрацией 0,5 мг/см3: точную навеску имазалила (50 ± 0,1) мг помещают в мерную колбу на 100 см3, растворяют в ацетоне и доводят до метки тем же растворителем.
Градуировочные растворы с концентрациями 0,2, 0,5, 1,0, 2,0 мкг/см3 готовят методом последовательного разбавления основного раствора по объему, используя ацетон.
8.4.2. Раствор № 1 с концентрацией имазалила 2 мкг/см3: в мерную колбу вместимостью 100 см3 вносят 0,4 см3 основного раствора и доводят объем до метки ацетоном.
8.4.3. Раствор № 2 с концентрацией имазалила 1 мкг/см3: в мерную пробирку вместимостью 10 см3 вносят 5 см3 раствора № 1 и доводят объем до метки ацетоном.
8.4.4. Раствор № 3 с концентрацией имазалила 0,5 мкг/см3: в мерную пробирку вместимостью 10 см3 вносят 5 см3 раствора № 2 и доводят объем до метки ацетоном.
8.4.5. Раствор № 4 с концентрацией имазалила 0,2 мкг/см3: в мерную пробирку вместимостью 10 см3 вносят 4 см3 раствора № 3 и доводят объем до метки ацетоном.
Основной раствор можно хранить в холодильнике при температуре 0 - 4 °С в течение 6 месяцев, градуировочные растворы - в течение 2 недель.
Для определения полноты извлечения имазалила из образцов гороха используют градуировочные растворы в ацетоне.
8.5. Построение градуировочного графика
Для построения градуировочного графика (площадь пика - концентрация имазалила в растворе) в хроматограф вводят по 1 мм3 градуировочных растворов (не менее 3 параллельных измерений для каждой концентрации, не менее 4 точек по диапазону измеряемых концентраций), измеряют площади пиков и строят график зависимости среднего значения площади пика (мв ∙ с) от концентрации имазалила в градуировочном растворе (мкг/см3).
Методом наименьших квадратов рассчитывают градуировочный коэффициент (К) в уравнении линейной регрессии:
С = KS, где
S - площадь пика в градуировочном растворе.
Градуировку признают удовлетворительной, если значение коэффициента линейной корреляции оказывается не ниже 0,99.
Градуировочную характеристику необходимо проверять при замене реактивов, хроматографической колонки или элементов хроматографической системы, а также при отрицательном результате контроля градуировочного коэффициента.
Градуировочную зависимость признают стабильной при выполнении следующего условия:
![]()
С - аттестованное значение массовой концентрации имазалила в градуировочном растворе;
Ск - результат контрольного измерения массовой концентрации имазалила в градуировочном растворе;
λконтр. - норматив контроля градуировочного коэффициента, % (λконтр. = 10 % при Р = 0,95).
8.6. Подготовка колонки с силикагелем для очистки экстракта
Силикагель не менее 5 ч прокаливают при 130 °С, охлаждают и хранят в эксикаторе. Навеску силикагеля 98,5 г помещают в круглодонную колбу и добавляют 1,5 г дистиллированной воды. Колбу плотно закрывают и интенсивно встряхивают в течение 5 мин. Затем колбу присоединяют к ротационному испарителю при атмосферном давлении и медленно вращают 2 ч. Деактивированный таким образом силикагель используют в течение 5 дней.
На дно стеклянной колонки помещают тампон из стекловаты, слой 0,5 см безводного сульфата натрия и заполняют суспензией 2 г силикагеля в 5 см3 гексана при открытом кране, сверху вносят слой 0,5 см безводного сульфата натрия и промывают колонку 10 см3 гексана. Когда уровень растворителя достигнет верхнего слоя в колонке, кран закрывают. Колонка готова к работе.
8.7. Проверка хроматографического поведения имазалила на колонке с силикагелем
На роторном испарителе при температуре не выше 40 °С упаривают досуха 5 см3 градуировочного раствора с известной концентрацией имазалила.
В колбу с сухим остатком вносят 2 см3 элюента № 1 и помещают колбу в ультразвуковую ванну на 5 мин. Затем пипеткой переносят раствор на колонку. Открывают кран и дают раствору впитаться. Когда уровень растворителя достигнет верхнего края колонки, кран закрывают. Колбу дважды ополаскивают 2 см3 элюента № 1 и пипеткой переносят раствор на колонку. Начинают элюирование в градуированную пробирку с притертой пробкой на 10 см3. После завершения пробирку закрывают и встряхивают. Таким образом, получена фракция с элюентом № 1.
Ту же колбу, где был сухой остаток, ополаскивают 2 см3 элюента № 2 и помещают колбу в ультразвуковую ванну на 5 мин. Затем пипеткой переносят раствор на колонку, колбу ополаскивают 2 см3 элюента № 2 и переносят на колонку. Таким образом, получена фракция с элюентом № 2.
Эту процедуру повторяют с элюентами № 3 и № 4 и, таким образом, готовят фракции с соответствующими элюентами.
Элюаты упаривают, сухой остаток растворяют в 1 см3 ацетона и хроматографируют. Фракции, содержащие имазалил, объединяют, упаривают, сухой остаток растворяют в 1 см3 ацетона и хроматографируют. Рассчитывают содержание имазалила в суммарном элюате, определяя полноту извлечения из колонки и необходимый для этого объем элюента.
Примечание. Профиль вымывания имазалила может изменяться при использовании силикагеля другой партии или марки.
8.8. Подготовка приборов и средств измерения
Установка и подготовка всех приборов и средств измерения проводится в соответствии с требованиями технической документации.
9. Проведение определения
9.1. Экстракция имазалила из зерна гороха
Навеску зерна гороха массой (10 ± 0,1) г размолотого на лабораторной мельнице помещают в коническую колбу объемом 300 см3, добавляют 50 см3 теплой дистиллированной воды и оставляют на 30 мин для набухания. Затем добавляют 50 см3 ацетона и экстрагируют имазалил в ультразвуковой ванне в течение 5 мин.
Экстракт фильтруют через складчатый фильтр «белая лента» на воронке Бюхнера в коническую колбу на 300 см3. Экстракцию повторяют дважды по 50 см3 ацетона.
Объединенный экстракт помещают в морозильную камеру с температурой 18 °С на 2 - 3 ч. После этого экстракт фильтруют через бумажный фильтр «красная лента» в колбу-концентратор на 500 см3, фильтр и колбу ополаскивают 10 см3 охлажденного ацетона. Водно-ацетоновый экстракт упаривают до водного остатка при температуре не выше 40 °С на роторном испарителе. Водный остаток переносят в делительную воронку на 250 см3, добавляют 10 см3 насыщенного раствора хлористого натрия и 50 см3 дихлорметана, встряхивают в течение 2 мин и оставляют до полного расслоения. После разделения фаз дихлорметановый слой фильтруют в колбу-концентратор через слой безводного сернокислого натрия, а водный слой возвращают в делительную воронку и повторяют экстракцию еще 2 - 3 раза порциями дихлорметана по 30 см3.
Объединенный фильтрат упаривают на ротационном испарителе до объема 2 см3 при температуре не выше 40 °С. Остатки растворителя удаляют в токе азота. Сухой остаток растворяют в 1 см3 ацетона и хроматографируют. При наличии мешающих примесей дополнительную очистку проводят на колонке с силикагелем по п. 9.2.
9.2. Очистка экстрактов на колонке с силикагелем
В колбу с сухим остатком вносят 2 см3 элюента № 1 и растворяют его в ультразвуковой ванне в течение 5 мин. Пипеткой полностью переносят раствор на колонку. Открывают кран и дают пробе впитаться. Когда уровень растворителя достигнет верхнего края колонки, кран закрывают. Колбу ополаскивают 2 см3 элюента № 1, пипеткой переносят раствор на колонку и открывают кран. Элюат отбрасывают.
Продолжают элюирование, как описано в п. 8.7 элюентами № 2 и № 3. Элюаты отбрасывают.
Продолжают элюирование элюентом № 4. Собранную фракцию упаривают, сухой остаток растворяют в 1 см3 ацетона и хроматографируют.
9.3. Условия хроматографирования
Газовый хроматограф «Кристалл 2000 М» с ТИД, колонка кварцевая капиллярная длиной 30 м, диаметром 0,25 мм, неподвижная фаза НР-1, толщина слоя 0,25 мкм. Температура колонки программируется от 150 °С (15 с) до 240 °С со скоростью 15 °С/мин. Температура термостата детектора 350 °С, испарителя 240 °С. Расход газа-носителя 1 (азот) - 1,7 см3/мин (деление потока 1:2,8), водорода - 14,4 см3/мин, воздуха - 200 см3/мин. Расход газа 3 (азот) - 10 см3/мин. Дозируемый объем - 2 мм3. Анализируемый объем - 1 см3. Время удерживания имазалила - 6 мин (54 ± 5) с.
9.4. Обработка результатов анализа
Содержание имазалила в пробе рассчитывают методом внешнего стандарта по формуле:
![]() где
где
X - массовая концентрация имазалила в пробе, мг/кг;
H - высота (площадь) пика анализируемого вещества, мм (мв ∙ с);
Нст - высота (площадь) пика аналитического стандарта, мм (мв ∙ с);
А - концентрация градуировочного раствора имазалила, мкг/см3;
V - объем экстракта, подготовленного для хроматографирования, см3;
т - навеска аналитической пробы, г.
Содержание остаточных количеств имазалила в анализируемом образце вычисляют как среднее из 2 параллельных определений.
Образцы, дающие пики большие, чем стандартный раствор имазалила 2 мкг/см3, разбавляют ацетоном.
10. Проверка приемлемости результатов параллельных определений
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, расхождение между которыми не превышает предел повторяемости:
![]() где (1)
где (1)
Х1, Х2 - результаты параллельных определений, мг/кг;
r - значение предела повторяемости (r = 2,8σr).
При невыполнении условия (1) выясняют причины превышения предела повторяемости, устраняют их и вновь выполняют анализ.
11. Оформление результатов
Результат анализа представляют в виде:
![]() мг/кг при вероятности Р = 0,95, где
мг/кг при вероятности Р = 0,95, где
![]() - среднее арифметическое результатов определений, признанных
приемлемыми, мг/кг;
- среднее арифметическое результатов определений, признанных
приемлемыми, мг/кг;
Δ - граница абсолютной погрешности, мг/кг:
![]() где
где
δ - граница относительной погрешности методики (показатель точности в соответствии с диапазоном концентраций), %.
В случае, если содержание компонента менее нижней границы диапазона определяемых концентраций, результат анализа представляют в виде:
«содержание вещества в пробе «менее нижней границы определения» (например: менее 0,02 мг/кг*, где «*» - 0,02 мг/кг - предел обнаружения имазалила в зерне гороха).
12. Контроль качества результатов измерений
Оперативный контроль погрешности и воспроизводимости измерений осуществляется в соответствии с ГОСТ Р ИСО 5725-1 - 6-2002 «Точность (правильность и прецизионность) методов и результатов измерений».
12.1. Стабильность результатов измерений контролируют перед проведением измерений, анализируя один из градуировочных растворов.
12.2. Плановый внутрилабораторный оперативный контроль процедуры выполнения анализа проводится с применением метода добавок.
Величина добавки Сд должна удовлетворять условию:
![]() где
где
![]() - характеристика погрешности
(абсолютная погрешность) результатов анализа, соответствующая содержанию
компонента в испытуемом образце (расчетному значению содержания компонента в
образце с добавкой соответственно), мг/кг, при этом:
- характеристика погрешности
(абсолютная погрешность) результатов анализа, соответствующая содержанию
компонента в испытуемом образце (расчетному значению содержания компонента в
образце с добавкой соответственно), мг/кг, при этом:
Δл = ± 0,84Δ, где
Δ - граница абсолютной погрешности, мг/кг:
![]() где
где
δ - граница относительной погрешности методики (показатель точности в соответствии с диапазоном концентраций), %.
Результат контроля процедуры Кк рассчитывают по формуле:
Кк = Х' - Х - Сд, где
X', X, Сд - среднее арифметическое результатов параллельных определений (признанных приемлемыми по п. 4) содержания компонента в образце с добавкой, испытуемом образце, концентрация добавки соответственно, мг/кг.
Норматив контроля К рассчитывают по формуле:
![]()
Проводят сопоставление результата контроля процедуры (Кк) с нормативом контроля (К).
Если результат контроля процедуры удовлетворяет условию
|Кк| ≤ К, (2)
процедуру анализа признают удовлетворительной.
При невыполнении условия (2) процедуру контроля повторяют. При повторном невыполнении условия (2) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры к их устранению.
12.3. Проверка приемлемости результатов измерений, полученных в условиях воспроизводимости.
Расхождение между результатами измерений, выполненных в двух разных лабораториях, не должно превышать предел воспроизводимости (R):
![]() где (3)
где (3)
X1, X2 - результаты измерений в двух разных лабораториях, мг/кг;
R - предел воспроизводимости (в соответствии с диапазоном концентраций), %.
13. Разработчики
Долженко В.И., Цибульская И.А., Карпова Л.М. (ГНУ «Всероссийский научно-исследовательский институт защиты растений» Россельхозакадемии, Санкт-Петербург, Пушкин).