СПРАВКА
Источник публикации
М.: ФГБУ "Институт стандартизации", 2025
Примечание к документу
Документ вводится в действие с 01.03.2026.
Название документа
"ГОСТ 35263-2025. Межгосударственный стандарт. Ферментные препараты микробного происхождения для пищевой промышленности. Определение подострой пероральной токсичности"
(введен в действие Приказом Росстандарта от 03.10.2025 N 1155-ст)
"ГОСТ 35263-2025. Межгосударственный стандарт. Ферментные препараты микробного происхождения для пищевой промышленности. Определение подострой пероральной токсичности"
(введен в действие Приказом Росстандарта от 03.10.2025 N 1155-ст)
Содержание
Приказом Федерального агентства
по техническому регулированию
и метрологии
от 3 октября 2025 г. N 1155-ст
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ФЕРМЕНТНЫЕ ПРЕПАРАТЫ МИКРОБНОГО ПРОИСХОЖДЕНИЯ
ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
ОПРЕДЕЛЕНИЕ ПОДОСТРОЙ ПЕРОРАЛЬНОЙ ТОКСИЧНОСТИ
Enzyme preparations for the food industry of microbial
origin. Subcute oral toxicity test
ГОСТ 35263-2025
МКС 07.080
Дата введения
1 марта 2026 года
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
1 РАЗРАБОТАН Ассоциацией "Технологическая платформа БиоТех2030" совместно с Федеральным государственным бюджетным учреждением науки Федеральным исследовательским центром питания, биотехнологии и безопасности пищи (ФГБУН "ФИЦ питания и биотехнологии")
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 30 мая 2025 г. N 185-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Армения | AM | ЗАО "Национальный орган по стандартизации и метрологии" Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Узбекистан | UZ | Узбекское агентство по техническому регулированию |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 3 октября 2025 г. N 1155-ст межгосударственный стандарт ГОСТ 35263-2025 введен в действие в качестве национального стандарта Российской Федерации с 1 марта 2026 г.
5 ВВЕДЕН ВПЕРВЫЕ
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Настоящий стандарт распространяется на ферментные препараты микробного происхождения, применяемые в пищевой промышленности в качестве технологических вспомогательных средств, получаемых с использованием микроорганизмов (штаммов-продуцентов): природных, полученных методами традиционной селекции и мутагенеза, а также генетически модифицированных (рекомбинантных, трансгенных) штаммов, таксономически принадлежащих как к прокариотам (бактерии, микроводоросли, стрептомицеты), так и эукариотам (микроскопические дрожжеподобные и плесневые грибы), и устанавливает общие требования к определению подострой пероральной токсичности указанных видов продукции в тестах на лабораторных животных.
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 12.1.008 Система стандартов безопасности труда. Биологическая безопасность. Общие требования
ГОСТ 10444.12 Микробиология пищевых продуктов и кормов для животных. Методы выявления и подсчета количества дрожжей и плесневых грибов
ГОСТ 10444.15 Продукты пищевые. Методы определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов
ГОСТ 13867 Продукты химические. Обозначение чистоты
ГОСТ 15113.8 Концентраты пищевые. Методы определения золы
ГОСТ 20264.1 Препараты ферментные. Методы определения органолептических, физико-химических и микробиологических показателей
ГОСТ 20264.2 Препараты ферментные. Методы определения протеолитической активности
ГОСТ 20264.4 Препараты ферментные. Методы определения амилолитической активности
ГОСТ 22967 Шприцы медицинские инъекционные многократного применения. Общие технические требования и методы испытаний
ГОСТ 26669 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
ГОСТ 26929 Сырье и продукты пищевые. Подготовка проб. Минерализация для определения содержания токсичных элементов
ГОСТ 30178 Сырье и продукты пищевые. Атомно-абсорбционный метод определения токсичных элементов
ГОСТ 30726 Продукты пищевые. Методы выявления и определения количества бактерий вида Escherichia coli
ГОСТ 31487 Препараты ферментные. Методы определения ферментативной активности фитазы
ГОСТ 31488 Препараты ферментные. Методы определения ферментативной активности ксиланазы
ГОСТ 31659 Продукты пищевые. Метод выявления бактерий рода Salmonella
ГОСТ 31662 Препараты ферментные. Методы определения ферментативной активности целлюлазы
ГОСТ 31747 Продукты пищевые. Методы выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий)
ГОСТ 31886 Принципы надлежащей лабораторной практики (GLP). Применение принципов GLP к краткосрочным исследованиям
ГОСТ 31890 Принципы надлежащей лабораторной практики (GLP). Организация и управление исследованиями, проводимыми на нескольких испытательных площадках
ГОСТ 31904 Продукты пищевые. Методы отбора проб для микробиологических испытаний
ГОСТ 32637 Методы испытания по воздействию химической продукции на организм человека. Повторное исследование пероральной токсичности на грызунах: 90-дневное
ГОСТ 32641 Методы испытания по воздействию химической продукции на организм человека. Определение токсичности при повторном/многократном пероральном поступлении вещества на грызунах. 28-дневный тест
ГОСТ 32891 Сычуги телят, ягнят, козлят-молочников для молокосвертывающих ферментных препаратов. Технические условия
ГОСТ 33044 Принципы надлежащей лабораторной практики
ГОСТ 33215 Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур
ГОСТ 33216 Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами
ГОСТ 34140 Продукты пищевые, корма, продовольственное сырье. Метод определения микотоксинов с помощью высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием
ГОСТ 34176 Препараты ферментные. Методы определения ферментативной активности 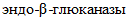
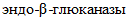
ГОСТ 34353 Препараты ферментные молокосвертывающие животного происхождения сухие. Технические условия
ГОСТ 34430 Ферментные препараты для пищевой промышленности. Метод определения протеолитической активности
ГОСТ 34566 Комбикорма полнорационные для лабораторных животных. Технические условия
ГОСТ ISO 7886-1 Шприцы инъекционные однократного применения стерильные. Часть 1. Шприцы для ручного использования
ГОСТ ISO 11815 Молоко. Определение общей молокосвертывающей активности говяжьего сычужного фермента
ГОСТ ISO 15163 Молоко и молочные продукты. Сычужный фермент из сычугов телят и ферментный препарат из сычугов крупного рогатого скота. Определение содержания химозина и говяжьего пепсина методом хроматографии
ГОСТ ISO/IEC 17025 Общие требования к компетентности испытательных и калибровочных лабораторий
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов и классификаторов на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации (www.easc.by) или по указателям национальных стандартов, издаваемым в государствах, указанных в предисловии, или на официальных сайтах соответствующих национальных органов по стандартизации. Если на документ дана недатированная ссылка, то следует использовать документ, действующий на текущий момент, с учетом всех внесенных в него изменений. Если заменен ссылочный документ, на который дана датированная ссылка, то следует использовать указанную версию этого документа. Если после принятия настоящего стандарта в ссылочный документ, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение применяется без учета данного изменения. Если документ отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 генетически модифицированные микроорганизмы; ГММ: Микроорганизмы, генетический материал которых изменен с использованием методов генной инженерии (рекомбинирования и/или трансгенеза).
3.2
доза: Количество вводимого тестируемого вещества. Доза указывается как масса (г, мг), или как масса тестируемого вещества на единицу массы подопытного животного (например, мг/кг). [ГОСТ 32637-2020, пункт 2.1.7, модифицировано] |
3.3
дозировка: Общий термин, включающий в себя дозу, частоту и продолжительность ее ввода. [ГОСТ 32641-2014, пункт 2.7] |
3.4 зависимость "доза - ответ": Зависимость, количественно характеризующая связь между вводимой дозой вещества и проявлением вредного эффекта в экспонируемой популяции.
3.5 мутантные микроорганизмы: Наследственно измененная форма микроорганизмов, генетический материал которых изменен при помощи методов индуцированного (направленного) мутагенеза с использованием физических или химических факторов.
3.6 общие органические вещества; ООВ: Вещества, входящие в состав ферментного препарата, за вычетом содержания в нем влаги, золы и добавляемых при производстве вспомогательных органических веществ - носителей.
3.7 отчет об исследовании: Документ, содержащий результаты исследования и их анализ в соответствии с требованиями правил надлежащей лабораторной практики, включая любые изменения и (или) отклонения, их причины и обоснования, и соответствующее результатам исследования заключение об исследуемом продукте.
3.8
план исследования: Документ, описывающий цели и методологию эксперимента для проведения исследования, а также включающий в себя все поправки, внесенные в эксперимент. [ГОСТ 33044-2014, пункт 2.3.3] |
3.9 подострая пероральная токсичность: Эффекты, проявляющиеся в результате многократного ежедневного перорального введения дозы вещества на протяжении 28 - 90 суток.
3.10 стандартные операционные процедуры; СОП: Подробные письменные инструкции, содержащие описание процессов проведения испытаний или другой деятельности, как правило, не представленные детально в планах исследования или руководствах по проведению испытаний и предназначенные для достижения единообразия при осуществлении определенной деятельности.
3.11 ферментные препараты: Очищенные и концентрированные продукты, содержащие определенные ферменты или комплекс ферментов, растительного, животного и микробного (продуцент) происхождения, необходимых для осуществления биохимических процессов, происходящих при производстве продуктов.
3.12
максимальная недействующая доза (перорально); NOAEL: Уровень отсутствия наблюдаемого вредного воздействия после введения вещества, который является максимальной дозой, не вызывающей обнаруживаемого вредного воздействия на здоровье. [Адаптировано из ГОСТ 32641-2014, пункт 2.11] |
Примечание - Информация о технических регламентах и нормативных правовых актах приведена в приложении А.
4.1 Определение подострой пероральной токсичности ферментных препаратов микробного происхождения, используемых в качестве технологических вспомогательных средств, проводят с целью оценки их возможного неблагоприятного действия на организм человека при длительном поступлении в организм в составе пищевой продукции, в которой ингредиенты ферментных препаратов не элиминируются, а производится только инактивация ферментативной активности. Результаты определения подострой пероральной токсичности учитываются в ходе государственной регистрации ферментных препаратов, полученных из ранее не применявшихся в пищевой промышленности микроорганизмов (штаммов-продуцентов), и рассматриваемых в качестве пищевой продукции нового вида в соответствии с требованиями законодательных и нормативных актов государства, на территории которого продукция находится в обращении.
Примечание - Информация о технических регламентах приведена в приложении А.
4.2 Определение подострой пероральной токсичности ферментных препаратов проводят в специализированных лабораториях, оснащенных подразделениями по работе с лабораторными животными (вивариями) в соответствии с принципами надлежащей лабораторной практики и правилами по уходу за лабораторными животными и их содержанию по ГОСТ 31886, ГОСТ 31890, ГОСТ 33044, ГОСТ 33215, ГОСТ 33216, а также в соответствии с требованиями законодательных и нормативных актов государства, на территории которого продукция находится в обращении.
Лаборатории для проведения испытаний должны соответствовать критериям компетентности по ГОСТ ISO/IEC 17025. На все операции, выполняемые в ходе исследований (испытаний) подострой токсичности, должны быть установлены СОП.
Сотрудники, проводящие исследования на животных, должны обладать необходимыми для этого компетенциями (наличие базового медицинского, ветеринарного или биологического образования).
4.3 Ввиду возможного наличия в ферментных препаратах микробного происхождения живых клеток штаммов-продуцентов и их ДНК, то есть компонентов, представляющих биологическую опасность, в ходе работы с ферментными препаратами обязательным является соблюдение правил биологической безопасности по ГОСТ 12.1.008 и в соответствии с требованиями нормативных и законодательных актов, действующих на территории государства, принявшего стандарт (микроорганизмы III и IV групп патогенности).
4.4 Ферментные препараты, подлежащие определению подострой пероральной токсичности, должны быть охарактеризованы и иметь прослеживаемое происхождение и сопровождаться нормативно-техническими документами изготовителя (технологической инструкцией или технологическим регламентом, технологической картой или спецификацией и другими нормативными документами), раскрывающими наличие определенного(ых) вида(ов) ферментативной активности, наличие примесей химического и биологического происхождения, ограничиваемых (нормируемых) согласно требованиям; данные о стабильности в течение срока годности; информацию об активности (в единицах активности); условия, необходимые для проявления активности ферментного препарата (оптимум pH и температуры и др.); условия инактивации ферментного препарата (условия отсутствия остаточной активности фермента в пищевой продукции), данные об отсутствии антибиотической активности, характеристику второстепенной ферментативной активности (при наличии); описание метода определения активности фермента в ферментном препарате; наименование и количественное содержание вносимого органического вещества - носителя и/или иммобилизующего агента.
При обоснованной необходимости показатели, характеризующие ферментный препарат, включая требования безопасности, в соответствии с нормативными и законодательными документами государства, на территории которого продукция находится в обращении, могут быть определены в аккредитованной лаборатории, проводящей исследования (испытания), перед определением подострой токсичности на лабораторных животных, в частности:
- содержание свинца по ГОСТ 26929, ГОСТ 30178;
- микробиологические показатели (содержание КМАФАнМ, БГКП, E. coli, патогенных микроорганизмов, в том числе сальмонелл), по ГОСТ 10444.15, ГОСТ 31904, ГОСТ 26669, ГОСТ 31747, ГОСТ 31659, ГОСТ 30726;
- содержание микотоксинов по ГОСТ 34140;
- наличие антибиотической активности - в соответствии с нормативными документами, действующими на территории государства, принявшего стандарт;
- наличие жизнеспособных клеток продуцентов - плесневых и дрожжевых грибов по ГОСТ 10444.12;
- наличие жизнеспособных клеток продуцентов микроорганизмов других таксономических групп (не принадлежащих к плесневым и дрожжевым грибам) - по нормативным документам, действующим на территории государства, принявшего стандарт;
- ферментативная протеолитическая активность по ГОСТ 20264.2, ГОСТ 34430;
- ферментативная амилолитическая (амилазная) активность по ГОСТ 20264.4;
- ферментативная активность ксиланазы по ГОСТ 31488;
- ферментативная активность фитазы по ГОСТ 31487;
- ферментативная активность целлюлазы по ГОСТ 31662;
- ферментативная активность 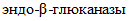 по ГОСТ 34176;
по ГОСТ 34176;
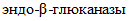 по ГОСТ 34176;
по ГОСТ 34176;- ферментативная активность молокосвертывающих ферментных препаратов по ГОСТ 32891;
- ферментативная активность сухих ферментных препаратов молокосвертывающих животного происхождения по ГОСТ 34353;
- молокосвертывающая активность говяжьего сычужного фермента по ГОСТ ISO 11815;
- содержание химозина и говяжьего пепсина по ГОСТ ISO 15163;
- другие виды ферментативной активности - при наличии стандартизованных методов их определения.
Примечания
1 Выбор метода анализа активности ферментного препарата, продуцируемого ГММ, осуществляется с учетом данных о встроенной в ДНК последовательности нуклеотидов (генов животного, растительного или синтетического происхождения) на основании технической спецификации на ферментный препарат (указанных единиц активности, нормативного документа на метод анализа). При анализе активности ферментного препарата, его качества и безопасности могут быть использованы другие методы контроля, установленные нормативными документами государства, на территории которого продукция находится в обращении.
2 Определение ферментативной активности ферментных препаратов животного и растительного происхождения проводится в случае испытаний рекомбинантных форм ферментных препаратов, продуцируемых ГММ со встроенными генами животного или растительного происхождения, соответственно.
4.5 В случае если ферментный препарат получен из генетически модифицированных штаммов, в лабораторию кроме документов на ферментный препарат предоставляют сведения о штамме-продуценте, включающие данные:
- о таксономической принадлежности штамма, установленной до уровня рода (вида, штамма) по фенотипическим и генотипическим свойствам, подтвержденной с использованием воспроизводимых молекулярно-генетических методов, источнике выделения штамма или штамма, полученного с использованием синтетических генов;
- об индивидуальном номере (коде) штамма-продуцента, присвоенном изготовителем;
- о депонировании в официальных коллекциях микробных культур национального или международного уровня (на условиях контрольного хранения);
- об отсутствии патогенности, токсигенности, антибиотикорезистентности, аллергенных свойств у штаммов-продуцентов (при наличии);
- о виде целевого использования штамма-продуцента и характеристике основного метаболита - ингредиента (компонента);
- для мутантных микроорганизмов (в случае получения дополнительной мутации) - сведения о характере мутации, безопасности и стабильности генотипических и фенотипических характеристик;
- для генетически модифицированных микроорганизмов: описание генетической модификации ДНК (сведения о трансформационном событии), нуклеотидной последовательности встроенного (сконструированного) локуса ДНК в виде однобуквенных кодов по номенклатуре IUPAC; сведения о его регуляторных элементах (при наличии), цели модификации; сведения о происхождении штамма-реципиента и штамма-донора, их таксономическом положении на уровне рода (вида, штамма) и описание их свойств; данные о векторных последовательностях, использовании транспозонов при конструировании ГММ-продуцентов, средствах доставки целевого гена в клетки реципиента, селективных маркерах ГММ-штаммов, стабильности генотипических и фенотипических характеристик; сведения о профиле внехромосомных элементов (плазмид, транспозонов, бактериофагов и др.) штаммов-продуцентов (при наличии внехромосомных элементов функциональная роль последних должна быть охарактеризована и доказана их неспособность к генному трансферу); сведения о стабильности технологических характеристик;
- для ферментных препаратов, полученных с использованием мутантных и (или) ГММ-штаммов микроорганизмов, в соответствии с нормативными и законодательными требованиями государства, на территории которого данная продукция находится в обращении, могут быть потребованы дополнительные данные о наличии изменений в их молекулярной структуре.
4.6 Ферментный препарат передается в подразделение лаборатории, выполняющей исследование на животных, в обезличенном (закодированном) виде с присвоением внутрилабораторного номера (шифра). Отбор проб ферментного препарата на исследование - по нормативным документам, действующим на территории государства, принявшего стандарт. По окончании исследования (испытания) на лабораторных животных данные о ферментном препарате декодируются при составлении отчета о проведенном исследовании (испытании).
4.7 При проведении испытаний ферментных препаратов на подострую пероральную токсичность соблюдаются принципы гуманного обращения с лабораторными животными, утвержденные в соответствии с нормативными актами государства, принявшего стандарт. Для этого необходимо сведение к минимуму общего числа лабораторных животных, используемых в исследованиях (испытаниях), в том числе путем использования метода предельной дозы по 5.6, когда это может быть оправдано целью проводимого исследования. При проведении исследований (испытаний) следует прилагать все возможные усилия к тому, чтобы в ходе выполнения экспериментальных процедур избегать действий, способных привести к долговременным повреждениям, боли, страданиям или тревоге, а в случае их неизбежности, следует стремиться к тому, чтобы такие последствия были сведены к минимуму. При выведении животных из исследования (испытания) следует использовать гуманные методы эвтаназии в соответствии с рекомендациями, утвержденными нормативными актами государства, принявшего стандарт.
В целях сокращения общего числа животных, используемых в определении подострой пероральной токсичности ферментных препаратов, при составлении плана исследования (испытания) допускается руководствоваться подходом, исходящим из использования предельной дозы по ГОСТ 32641.
4.8 Определение подострой пероральной токсичности ферментных препаратов микробного происхождения проводят с использованием лабораторных грызунов: мышей (Mus musculus, Mus domesticus) или крыс (Rattus rattus, Rattus norvegicus). Допускается использование лабораторных животных указанных видов, принадлежащих к стандартизованным линиям или породам, поступающим из авторизованных питомников или содержащихся в лабораторной колонии и являющихся прослеживаемыми. Линии лабораторных животных, применяемые в определении подострой токсичности, могут быть как инбредными (генетически гомогенными), так и аутбредными. Для проведения исследований (испытаний) подострой пероральной токсичности следует использовать здоровых молодых половозрелых животных в возрасте от 6 до 8 недель. Предпочтительным является проведение испытаний подострой токсичности на двух полах животных указанных видов (самцах и самках), ввиду возможных различий в ответе мужской и женской репродуктивных систем на токсические воздействия. Самки животных должны быть не беременными и не рожавшими. Животные, вводимые в исследования (испытания) по определению подострой пероральной токсичности, в составе одной экспериментальной группы, получающей определенную дозу ферментного препарата, должны принадлежать к одному и тому же полу и линии. Масса тела животных, получающих различные дозы ферментного препарата, должна различаться в пределах не более +/- 20% внутри группы и не более +/- 20% (для средних по группе значений) между группами. Численность экспериментальной группы животных одного пола, получающих одну дозу ферментного препарата, должна составлять не менее 10 особей. При включении в план испытаний тестов поведенческих реакций предпочтительная численность групп животных составляет 12 - 16 особей.
4.9 Животных в ходе определения подострой пероральной токсичности содержат в специализированных вивариях (клиниках лабораторных животных). Размещение, содержание и уход за лабораторными животными должны соответствовать ГОСТ 33215, ГОСТ 33216. В помещении, где содержатся животные, следует поддерживать физиологически оптимальные условия внешней среды (для крыс и мышей большинства линий - это температура от 21 °C до 23 °C и относительная влажность от 45% до 65%). Животные должны содержаться в клетках из нетоксичного биологически инертного материала на нетоксичной подстилке из натуральных (природных) материалов по две - четыре особи или индивидуально (по одному). Минимальная площадь, приходящаяся на одно животное в клетке (крысу, мышь), устанавливается в соответствии с ГОСТ 33216. Агрессивных животных (в частности, самцов мышей некоторых линий) содержат по одному в клетке. Режим освещенности в помещении, где находятся животные, должен соответствовать 12/12 часовому чередованию светлых и темных периодов. Обогащение среды обитания по ГОСТ 33216, включающее устройство укрытий для животных из визуально непрозрачных материалов, является желательным (рекомендуемым).
4.10 Кормление животных следует осуществлять рационами, сбалансированными по содержанию всех основных питательных веществ (макро- и микронутриентов) и энергетической ценности в соответствии с физиологическими потребностями организма животного. Допускается использование готовых гранулированных сухих кормов по ГОСТ 34566 или полусинтетического рациона на основе казеина в соответствии с приложением Б. На протяжении всего периода исследований (испытаний) по определению подострой токсичности животные получают рацион в режиме неограниченного свободного доступа, за исключением периодов, указанных в 5.11, и тех случаев, когда токсическое действие ферментного препарата вызывает выраженное снижение поедаемости корма животными. В этом случае применяют режим парного кормления, при котором животных ограничивают в количестве потребляемого корма на уровне наименее потребляющей группы.
4.11 Качество воды, предоставляемой лабораторным животным, должно соответствовать гигиеническим требованиям. Для животных используют воду, полученную методом обратного осмоса, сбалансированную по минеральному составу, или бутилированную питьевую столовую воду, соответствующую требованиям нормативных и законодательных актов, действующих на территории государства, принявшего стандарт. Для питья животных не допускается использовать дистиллированную, деионизованную воду, а также воду из централизованных источников водоснабжения без дополнительной подготовки (очистки). Питьевая вода на протяжении всего периода исследований (испытаний) по определению подострой пероральной токсичности предоставляется животным в режиме неограниченного доступа.
5.1 Принцип метода определения подострой пероральной токсичности ферментных препаратов состоит в том, что тестируемый ферментный препарат вводится ежедневно перорально, в определенных дозах, нескольким группам подопытных животных, при этом каждой группе вводится одна и та же доза вещества в течение 28 - 90 суток. На протяжении периода введения ферментного препарата животные находятся под тщательным наблюдением с целью выявления признаков токсического воздействия, а также могут в соответствии с планом исследования подвергаться тестированию поведенческих реакций и прижизненному забору биосубстратов (крови, мочи). Животные, умершие или умерщвленные в ходе тестирования, подлежат вскрытию. По окончании периода введения ферментного препарата выживших животных выводят из эксперимента гуманным способом и подвергают аутопсии с забором биосубстратов, подлежащих лабораторному исследованию. По результатам проведенного исследования для каждого изученного показателя строится зависимость "доза - ответ", на основании которой определяется максимальная недействующая доза ферментного препарата (NOAEL).
Примечания
1 При проведении испытаний подострой токсичности ферментного препарата допускается использование метода предельной дозы по 5.6.
2 Результаты 28-дневного перорального введения ферментного препарата являются ориентировочным. Они могут служить основанием для проведения более длительных испытаний, и используются при подборе доз для более долгосрочного исследования.
5.2 Дозу ферментного препарата, вводимого животным, выражают в мг/кг массы тела в расчете на количество ООВ в препарате. Содержание ООВ, выраженное в процентах, рассчитывается как 100% минус влажность препарата (содержание воды) в процентах, минус содержание золы в процентах, минус содержание добавленных при производстве ферментного препарата органических веществ - носителей в процентах. Отбор проб ферментного препарата на определение ООВ проводят, как указано в 4.6. Определение влажности ферментных препаратов проводят термогравиметрическим методом по ГОСТ 20264.1. Проведение определения содержания золы в ферментном препарате - путем минерализации (прокаливания) образца ферментного препарата в муфельной печи гравиметрическим методом по ГОСТ 15113.8. Количество добавленных при производстве ферментного препарата органических веществ - носителей устанавливают в соответствии со спецификацией на ферментный препарат.
Примечание - Для ферментных препаратов, в зависимости от состава добавляемого при производстве носителя, допускается использование также других стандартизованных и валидированных методов определения влажности и золы, в соответствии с нормативными и законодательными актами, действующими на территории государства, принявшего стандарт.
5.3 Ферментные препараты поступают на определение подострой токсичности в виде сухих продуктов (порошков) или в виде водных растворов. В первом случае ферментный препарат перед введением животным растворяют или диспергируют в питьевой воде, соответствующей 4.11; количество растворителя подбирают с учетом влажности используемого порошка для достижения требуемой фиксированной дозы ферментного препарата по ООВ. Во втором случае ферментный препарат вводят животным непосредственно в объеме, соответствующем необходимой вводимой дозе в расчете на ООВ. В случае недостаточного содержания ООВ в предоставленном растворе ферментного препарата для обеспечения требуемой дозы в расчете на ООВ ферментный препарат может быть сконцентрирован (обезвожен) одним из способов, исключающих его физико-химические изменения или снижение ферментативной активности.
Примечание - Для концентрирования ферментных препаратов допускается использование процессов вакуумного концентрирования (упаривания при пониженном атмосферном давлении) при температуре не выше 37 °C и лиофильной (сублимационной) сушки.
5.4 В случае плохой растворимости или диспергируемости ферментного препарата в питьевой воде допускается использование при его растворении физиологического раствора (0,15 М NaCl) или фосфатно-солевого буфера (0,01 М фосфат натрия или калия pH 7,3 +/- 0,2 с 0,15 М NaCl). Не допускается при введении ферментного препарата его растворение в концентрированных растворах солей, щелочах, кислотах (в том числе органических), а также в органических растворителях (включая этиловый спирт).
5.5 Дозирование ферментного препарата животным осуществляют с использованием, как правило, не менее трех уровней доз вещества, за исключением случаев, когда проводят испытания предельной дозы по 5.6. Выбор уровней доз может быть основан на данных ранее проведенных испытаний ферментного препарата, включая определение острой токсичности и исследования при многократном введении меньшей продолжительности, и с учетом всех существующих токсикологических и токсикокинетических данных, имеющихся по тестируемому ферментному препарату. За исключением случаев ограничений, обусловленных физико-химическими свойствами или биологическим воздействием ферментного препарата, его максимальную дозу следует подбирать с целью инициации интоксикации, а не смерти или жестоких страданий животного. Остальные дозы выбирают в убывающей последовательности, предпочтительно с 10-кратным интервалом, с намерением продемонстрировать реакцию на вводимую дозу и отсутствие наблюдаемого вредного воздействия (NOAEL) при минимальной дозе. Контрольная группа получает носитель ферментного препарата, если он применяется для введения, или питьевую воду во всех остальных случаях. С животными контрольной группы следует обращаться так же, как и с животными опытных групп.
5.6 При наличии обоснованных предположений о низкой токсичности ферментного препарата, либо отсутствии токсичности, возможно проведение испытаний методом предельной дозы по ГОСТ 32641. В этом случае при проведении испытаний используют по две группы животных (опыт, контроль) каждого пола. Одной группе животных вводят максимально возможную по условиям эксперимента дозу ферментного препарата. Вторая группа животных является контрольной (введение носителя). В случае отсутствия заболеваемости и летальности животных, а также статистически значимых отличий изученных показателей животных опытной группы от контроля, исследование считается завершенным, и ферментный препарат признается нетоксичным (NOAEL больше предельной дозы). В противном случае исследования продолжают с уменьшенными дозами ферментного препарата.
5.7 При введении ферментных препаратов животным используется шприц объемом 1 - 10 см3 по ГОСТ ISO 7886-1 или по ГОСТ 22967, оснащенный внутрижелудочным зондом (трубкой с оливой на конце). Геометрические размеры зонда должны соответствовать анатомическим параметрам животного данного вида, пола и возраста и должны исключать, с одной стороны, травматизацию животного, а с другой - обеспечивать количественное внутрижелудочное поступление дозы ферментного препарата. При введении ферментного препарата крысам длина зонда не должна превышать 90 - 100 мм, диаметр оливы - 4 мм; при введении мышам - 30 - 40 мм и 1 мм, соответственно. Максимально допустимый однократно вводимый объем водного раствора ферментного препарата животным не должен превышать 10 см3/кг массы тела.
Примечания
1 В процессе введения раствора ферментного препарата животным особое внимание следует уделять недопустимости его попадания в дыхательные пути (аспирации). Это связано с тем, что многие ферментные препараты (главным образом, обладающие протеолитической активностью) обладают выраженным повреждающим действием на эпителий верхних и нижних дыхательных путей, что может значительно исказить результаты исследований (испытаний). Для исключения аспирации ферментного препарата следует тщательно фиксировать (удерживать) животное в вертикальном положении и обеспечивать плавное введение препарата, убедившись, что зонд находится в желудке.
2 При исследовании подострой пероральной токсичности не допускается введение ферментных препаратов в составе потребляемого животными рациона, поскольку в последнем случае возможно изменение как свойств ферментного препарата, так и физико-химических и органолептических свойств потребляемого рациона.
5.8 Показатель pH перорально вводимого водного раствора или суспензии ферментного препарата должен составлять pH 6,0 +/- 2,0. При значительном отклонении pH ферментного препарата за пределы указанного интервала величина pH может быть отрегулирована путем добавления разбавленных водных растворов кислоты (HCl) или щелочи (NaOH) квалификации не ниже "х.ч.".
5.9 Внутрижелудочное введение дозы ферментного препарата следует осуществлять ежедневно в одно и то же время, корректируя вводимое количество по мере необходимости для поддержания постоянного уровня дозы в пересчете на массу тела.
ИС МЕГАНОРМ: примечание. В официальном тексте документа, видимо, допущены опечатки: имеются в виду таблицы В.1 и В.2, а не 1 и 2 соответственно. |
5.10 Наблюдения за состоянием животных следует проводить не реже одного раза в день, желательно в одно и то же время, с учетом пикового периода предполагаемого воздействия после введения ферментного препарата (при наличии данных). Результаты наблюдения за состоянием животных следует фиксировать документально в протоколе исследования при возможности с использованием количественных (балльных оценок). Отмечаемые признаки должны включать гибель (летальность) животных, наличие изменений кожи, шерстяного покрова, слизистых оболочек полости рта и носа, наружных половых органов, глаз (наличие выделений, слезотечение, пилоаррекция, изменения размера зрачков), повышенная или необычная дыхательная деятельность, изменения стула (диарея), мочи (повышенное количество, изменение цвета, необычный запах), поведения [изменение походки, положения тела и реакции на внешние раздражители, наличие клонических или тонических движений, повторяющееся движение по кругу, учащенный грумминг (чистка шерсти), нанесение себе увечий, хождение, пятясь задом]. Павших животных и животных, преждевременно выведенных из эксперимента по причине видимого предсмертного состояния или наличия непереносимых страданий, подвергают обзорному патологоанатомическому исследованию согласно приложению В (таблицы 1 и 2).
5.10.1 Масса тела и потребление пищи/воды
Все животные подлежат взвешиванию не реже одного раза в неделю. Замеры потребляемой пищи проводят не реже одного раза в трое суток. Потребление воды может также учитываться при наличии обоснованных предположений о влиянии ферментного препарата на интенсивность питья и водно-солевой обмен.
5.10.2 Оценка нейромоторики и поведенческих реакций
В случаях, предусмотренных планом исследования, не реже одного раза за период эксперимента у животных проводят определение состояния нейромоторики в тесте силы хватки, уровня тревожно-подобных функций и моторно-двигательной активности в тесте "приподнятый крестообразный лабиринт", когнитивной функции в тесте условного рефлекса пассивного избегания (УРПИ). Исследования нейромоторики и поведенческих реакций включаются в план исследования при обоснованных предположениях о наличии в составе ферментного препарата нейротропных или обладающих нейротоксичностью веществ, включая биологически-активные пептиды. Допускается проведение нескольких повторов одного теста и нескольких тестов для учета динамики показателей на одном животном на протяжении периода введения ферментного препарата. График проведения тестов указывают в плане исследований (испытаний) и составляют таким образом, чтобы стресс, вызываемый тестами у животных, не оказывал воздействия на результаты других тестов.
5.10.3 Прижизненный отбор биосубстратов
В соответствии с планом исследований (испытаний) допускается прижизненный отбор биосубстратов (кровь, моча) один или несколько раз на протяжении периода введения ферментного препарата в целях оценки изменения показателей животных в динамике. Прижизненный отбор биосубстратов должен осуществляться одним из способов, не вызывающих у животных стресс и не создающих дополнительные риски для их здоровья.
5.11 Выведение животных из эксперимента осуществляется по окончании периода введения ферментного препарата одним из гуманных методов эвтаназии согласно 4.7. За 16 ч до выведения животных из эксперимента их лишают корма, воду предоставляют без ограничений. Немедленно после выведения животных из эксперимента осуществляется отбор биологического материала (проб органов и тканей) животных.
5.11.1 В целях исключения влияния внешних факторов на качественные и количественные характеристики отбираемых проб биологического материала отбор проб от животных опытных и контрольных групп осуществляют в случайной последовательности, в соответствии с методами, утвержденными нормативными актами государства, принявшего стандарт <1>.
--------------------------------
<1> В Российской Федерации действует ГОСТ Р ИСО 24153-2012 "Статистические методы. Процедуры рандомизации и отбора случайной выборки".
5.11.2 Для исключения влияний циркадных и более длительных биоритмов организмов животных на результаты испытаний отбор проб проводят одновременно в опытной и контрольной группах в одно и то же время суток на протяжении не более 2 - 3 ч (предпочтительно между 9:00 и 12:00). Если число групп животных или число животных в каждой группе не позволяет выполнить отбор проб в указанном интервале времени, животных опытных и контрольных групп следует выводить из исследования равными группами на протяжении не более 2 - 3 сут после завершения испытания в одно и то же время суток.
5.11.3 Перечень отбираемых органов и тканей устанавливают в соответствии с целью исследований (испытаний) и включают в план исследования.
5.11.4 После взятия проб определяют массу (объем) пробы и выполняют анализ соответствующими методами, установленными в стандарте/методике на конкретный метод испытания, или консервируют. Применяемый метод консервации не должен приводить к изменениям определяемых физико-химических и биологических (включая микробиологические) показателей отобранной пробы на протяжении всего периода хранения до проведения анализа. Метод консервации проб биологического материала установлен в методике на конкретный метод испытания.
5.11.5 Отобранные пробы биологического материала помещают в контейнеры (пробирки или флаконы) и маркируют. Маркировка должна обеспечивать прослеживаемость проб биологического материала на протяжении всего периода испытаний. Не допускается нанесение номеров и иных идентифицирующих надписей на пробки (крышки) контейнеров и иные элементы тары, удаляемые до начала анализа проб.
5.12 Перечень исследуемых показателей в пробах биологического материала, отобранных у животных, устанавливается в соответствии с планом исследований (испытаний), и должен учитывать все обоснованные предположения о наличии у ферментного препарата свойств токсичности и биологической активности. Перечень показателей, рекомендуемых при исследованиях (испытаниях) подострой пероральной токсичности ферментных препаратов, устанавливают в соответствии с требованиями нормативных и законодательных документов государства, на территории которого продукция находится в обращении. Рекомендуемый перечень исследуемых показателей представлен в приложении В.
5.13 При проведении исследований (испытаний) подострой пероральной токсичности ферментных препаратов необходимо учитывать информацию, приведенную в 5.13.1 - 5.13.3.
5.13.1 Методы, применяемые при отборе биологического материала животных (включая тип используемой анестезии), отборе, хранении и консервации биологических образцов, не должны приводить к неконтролируемым изменениям изучаемых показателей.
5.13.2 Количество отбираемых биологических образцов должно быть достаточным для проведения всех необходимых анализов с учетом указанного числа повторностей анализируемых проб (как правило, не менее двух).
5.13.3 Не допускается проводить объединение проб биологического материала от разных животных одной группы, так как данный подход может замаскировать биологическую вариабельность данных и привести к ложному завышению статистической значимости результата.
5.13.4 При определении исследуемых показателей в пробах биологического материала следует применять сертифицированное лабораторное оборудование, средства измерений, внесенные в реестр средств измерений и поверенные в установленном порядке.
5.14 Методы статистического анализа
Результаты количественных определений показателей животных, включая данные анализа проб биологического материала, должны быть статистически обработаны в целях установления их значимых различий с соответствующими контрольными величинами. Статистическую обработку результатов исследований (испытаний) подострой пероральной токсичности ферментных препаратов проводят по единому плану, включающему следующие стадии:
5.14.1 построение вариационного ряда для каждого показателя с определением числа значимых значений (N), выборочного среднего (M), стандартного отклонения (SD), стандартной ошибки среднего (s.e.m), медианы (m); дополнительно может определяться интервал изменений (min-max), квартильный и децильный размах;
5.14.2 тест на нормальность распределения показателя в исследуемых группах с помощью критериев Шапиро-Уилка или Колмогорова-Смирнова;
5.14.3 анализ вариационного ряда с целью исключения грубо выпадающих значений (инструментальных ошибок) с помощью критерия Граббса;
5.14.4 однофакторный дисперсионный анализ (ANOVA) распределений в сравниваемых группах;
5.14.5 определение достоверности различия средних значений между группами с использованием двустороннего t-теста Стьюдента для несвязанных показателей. При расчете величины t-критерия вносят поправку на различие величины дисперсий сравниваемых групп, оцененную в тесте Ливина на остаточную дисперсию, и поправку Бенджамини-Хохберг на множественность сравнения.
Тесты по 5.14.3 - 5.14.5 выполняют при условии статистически подтвержденного нормального закона распределения по 5.14.2. При достоверном (p < 0,05) отличии распределения показателей в группах от нормального дополнительно проводят следующие тесты:
5.14.6 тест на однородность распределения исследуемого показателя с помощью непараметрического рангового критерия Краскалла-Уоллеса;
5.14.7 определение достоверности различия распределения в сравниваемых группах с помощью непараметрического рангового критерия Манна-Уитни;
5.14.8 непараметрические (долевые) показатели, такие как летальность, частота развития патологических изменений, степень сохранения краткосрочной и долгосрочной памяти, сравнивают с использованием многомерного критерия 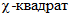 Пирсона или точного U-теста Фишера.
Пирсона или точного U-теста Фишера.
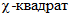 Пирсона или точного U-теста Фишера.
Пирсона или точного U-теста Фишера.При проведении анализа по 5.1 - 5.13 сравнивают группу животных, не получающую ферментный препарат (контроль), со всеми опытными группами.
Различия принимают за достоверные при вероятности принятия нуль-гипотезы (уровне значимости) p < 0,05.
Статистическую обработку проводят с использованием лицензионного профессионального программного обеспечения.
Данные проведенных испытаний должны быть представлены в отчете как индивидуально по каждому животному, так и в статистически обработанной форме по каждой группе животных. При этом для каждого показателя в каждой группе животных необходимо указать статистический уровень значимости различия с контролем либо отсутствие такого различия (вероятность принятия нуль-гипотезы на уровне p > 0,05). Все данные должны быть представлены в табличной форме с указанием количества животных в каждой экспериментальной группе на дату начала исследований, количества животных, умерших во время проведения исследования или умерщвленных по причине гуманности, и времени смерти или умерщвления, количества проб, обоснованно исключенных из статистического анализа.
Во всех случаях выявления признаков токсичности ферментного препарата при статистически значимом отличии изучаемого показателя от контроля, необходимо указать:
а) наименование признака токсичности и используемого показателя;
б) описание наблюдавшихся признаков токсичности, включая время начала проявления, продолжительность и серьезность всех признаков токсичности, количества животных, у которых проявились поражения, типа поражения, и процентного соотношения животных, у которых проявились поражения каждого типа;
в) количественную меру изменения параметрических показателей (в долях или процентах от контроля), статистическую значимость различия с контролем, дозу, при которой статистически значимое различие с контролем отсутствует;
г) зависимость степени проявления признака токсичности от дозы индивидуально для каждого показателя;
д) максимальную недействующую дозу (NOAEL) ферментного препарата как наименьшее среди всех определенных доз ферментного препарата, не вызывающих возникновение признаков токсичности по изученным показателям.
Примечание - В случае, когда зависимость "доза - ответ" для отдельного показателя, свидетельствующего о токсичности ферментного препарата, не может быть однозначно установлена (отсутствует или является немонотонной, то есть эффект не подтверждается при больших дозах ферментного препарата по сравнению с меньшими), данный показатель должен быть исключен из определения NOAEL, или при обоснованной необходимости исследование должно быть повторено.
6.2 Отчет о проведении исследования подострой пероральной токсичности ферментного препарата должен содержать следующую информацию:
а) наименование заказчика исследования, его адрес;
б) наименование лаборатории, проводящей исследования, ее адрес, сведения об аккредитации (при наличии);
в) даты начала и окончания проведения исследования;
г) наименование ферментного препарата, характеристика ферментного препарата и штамма-продуцента согласно 4.4 - 4.6, данные, позволяющие установить прослеживаемость образца ферментного препарата;
д) цель исследования;
е) вид, линию, пол и возраст экспериментальных животных;
ж) сведения об одобрении плана исследования локальной этической комиссией (комитетом);
и) дозировку ферментного препарата, способ и длительность введения ферментного препарата животным;
к) методы исследования проб биологического материала;
л) методы статистической обработки результатов исследований (испытаний);
м) данные исследований согласно 6.1, демонстрирующие для каждой группы: число используемых животных; число животных с определенными признаками патологии; число животных, найденных мертвыми во время испытания или умерщвленных из гуманных соображений; индивидуальное время смерти животных; описание и временной ход развития патологических эффектов, их обратимость; результаты аутопсии и анализа проб биологического материала;
н) величину NOAEL ферментного препарата с указанием органов и систем, критически затронутых при проявлении токсического действия;
п) выводы, содержащие мотивированное заключение о достижении поставленной цели исследования; другие положения, имеющие значение для интерпретации полученных данных.
6.2.1 Интерпретацию полученных в соответствии с разделом 5 данных экспериментальных исследований токсического действия ферментного препарата проводят в соответствии с критериями по ГОСТ 32637.
(справочное)
И НОРМАТИВНЫХ ПРАВОВЫХ АКТАХ В ГОСУДАРСТВАХ - УЧАСТНИКАХ СНГ
Технический регламент или нормативный правовой акт | Государство - участник СНГ |
Технический регламент Таможенного союза ТР ТС 021/2011 "О безопасности пищевой продукции" | AM, BY, KZ, KG, RU |
Технический регламент Таможенного союза ТР ТС 029/2012 "Требования безопасности пищевых добавок, ароматизаторов и технологических вспомогательных средств" | AM, BY, KZ, KG, RU |
Технический регламент Таможенного союза ТР ЕАЭС 044/2017 "О безопасности упакованной питьевой воды, включая природную минеральную воду" | AM, BY, KZ, KG, RU |
Общий технический регламент "О безопасности питьевой воды, расфасованной в емкости" (UzTR.861-032:2019) | UZ |
(рекомендуемое)
ДЛЯ ЛАБОРАТОРНЫХ ГРЫЗУНОВ (КРЫС И МЫШЕЙ)
Таблица Б.1
Состав основных ингредиентов рациона для крыс и мышей
из расчета на 100 г массы сухого рациона
Ингредиент, г | Количество на 100 г |
1 Казеин | 20,0 |
2 Крахмал кукурузный | 60,05 |
3 Целлюлоза микрокристаллическая | 5,0 |
4 Солевая смесь | 3,5 |
5 Холин хлорид (60% холина) | 0,25 |
6 L-цистеин | 0,2 |
7 Витаминная смесь | 1,0 |
8 Масло подсолнечное | 5,0 |
9 Лярд (свиной жир) | 5,0 |
Итого | 100,0 |
Таблица Б.2
Состав витаминной смеси
Витамин <*> | Содержание в 100 г рациона | Содержание, г на кг смеси |
1 Никотиновая кислота (B3) | - | 3 |
2 Пантотенат кальция (B5) | - | 1,6 |
3 Пиридоксина гидрохлорид (B6) | - | 0,7 |
4 Тиамина гидрохлорид (B1) | - | 0,6 |
5 Рибофлавин (B2) | - | 0,6 |
6 Фолиевая кислота (B9) | - | 0,2 |
7 D-биотин (B7) | - | 0,02 |
8 Цианкобаламин (B12) | - | 0,0025 |
9 Менадион (витамин K1) | - | 0,075 |
10 Витамин A (порошок на носителе или масляный раствор) | 400 МЕ <**> | 0,8 |
11 Витамин D3 (порошок на носителе или масляный раствор) | 100 МЕ <**> | 1,0 |
12 Витамин E (порошок на носителе или масляный раствор) | 4 МЕ <**> | 8,0 |
13 Сахароза | До 1000,00 | |
Таблица Б.3
Состав солевой смеси
Наименование соли <*> | Брутто-формула | Содержание, г на кг смеси |
1 Кальций углекислый, безводный | CaCO3 | 357 |
2 Калий фосфорнокислый, одноосновный | KH2PO4 | 250 |
3 Натрий хлористый | NaCl | 74 |
4 Калий сернокислый | K2SO4 | 46,6 |
5 Калий лимоннокислый, моногидрат | K2C6H5O7·H2O | 28 |
6 Магния оксид | MgO | 24 |
7 Железо лимоннокислое | C6H5FeO7·H2O | 6,06 |
8 Цинк углекислый | ZnCO3 | 1,65 |
9 Марганец углекислый | MnCO3 | 0,63 |
10 Медь углекислая | CuCO3·Cu(OH)2 | 0,3 |
11 Калия йодат | KIO3 | 0,01 |
12 Натрия селенат, безводный | Na2SeO4 | 0,01025 |
13 Аммония парамолибдат, 4-водный | (NH4)6Mo7O24·4H2O | 0,00795 |
14 Натрия метасиликат | Na2SiO3 | 0,63 |
15 Хромокалиевые квасцы, 12-водные | CrK(SO4)2·12H2O | 0,275 |
16 Борная кислота | H3BO3 | 0,0815 |
17 Натрий фтористый | NaF | 0,0635 |
18 Никель углекислый | NiCO3·2Ni(OH)2·x H2O | 0,0318 |
19 Литий хлористый | LiCl | 0,0174 |
20 Аммония ванадат | NH4VO3 | 0,0066 |
21 Сахароза | C12H22O11 | 210,626 |
<*> При составлении смеси следует использовать чистые химические реактивы минеральных солей с квалификацией чистоты не менее ч.д.а. по ГОСТ 13867. | ||
(справочное)
ПРИ ИССЛЕДОВАНИЯХ (ИСПЫТАНИЯХ) ПОДОСТРОЙ ПЕРОРАЛЬНОЙ
ТОКСИЧНОСТИ ФЕРМЕНТНЫХ ПРЕПАРАТОВ
Таблица В.1
Показатель | Исследуемый материал | Метод | Источник |
Масса тела | Животное в целом | Гравиметрический | - |
Масса внутренних органов | Печень. Почки. Поджелудочная железа. Надпочечники. Селезенка. Гонады. Легкие. Тимус (вилочковая железа). Щитовидная железа. Сердце. Головной мозг | Гравиметрический | - |
Состав тела: доля тощей массы; доля жировой массы; содержание общей воды; содержание свободной воды | Животное в целом | Биоимпедансометрия | |
Таблица В.2
Показатель | Исследуемый материал | Метод | Источник |
Обзорное патологоанатомическое исследование внутренних органов | Пищевод Желудок. Тонкая кишка. Толстая кишка (включая слепую кишку). Поджелудочная железа. Печень. Селезенка. Тимус (вилочковая железа). Почки. Мочевой пузырь. Надпочечники. Щитовидная железа. Гонады. Матка (у самок). Легкие. Сердце. Головной мозг | Визуальный Светооптическая микроскопия (с использованием бинокулярного микроскопа) | - |
Гистопатологическое исследование внутренних органов | Печень. Почки. Селезенка. Тонкая кишка. Толстая кишка. Надпочечники. Головной мозг. Гонады | Светооптическая микроскопия с использованием методов гистохимии и иммуногистохимии <*>. Трансмиссионная электронная микроскопия. Морфометрия | |
Таблица В.3
Показатели липидного обмена
Показатель | Исследуемый биосубстрат | Метод | Примечания |
Общие липиды | Печень | Гравиметрический | |
Жирнокислотный состав клеточных мембран | Печень, эритроциты | Газовая хроматография | |
Триглицериды (ТГ) | Плазма крови | Спектрофотометрия | |
Общий холестерин (ХС) | Плазма крови | Спектрофотометрия | |
Холестерин ЛПВП (ХС ЛПВП) | Плазма крови | Спектрофотометрия | |
Холестерин ПНП (ХС ЛПНП) | Плазма крови | Расчетный метод | |
Липаза | Плазма крови | Потенциометрия | |
Таблица В.4
Методы исследования показателей белкового
и азотистого обмена
Показатель | Исследуемый биосубстрат | Метод <*> |
Общий белок | Сыворотка крови | Спектрофотометрия |
Альбумин | Сыворотка крови | Спектрофотометрия |
Глобулины | Сыворотка крови | Спектрофотометрия, 1D-электрофорез |
Креатинин | Сыворотка, плазма крови (после депротеинизации) | Спектрофотометрия |
Мочевина | Сыворотка, плазма крови | Спектрофотометрия |
Мочевая кислота | Сыворотка, плазма крови | Спектрофотометрия |
Таблица В.5
Методы исследования показателей углеводного обмена
Показатель | Исследуемый биосубстрат | Метод |
Глюкоза | Сыворотка, плазма крови | Энзиматический глюкозооксидазный метод |
Гликированный гемоглобин | Кровь | Спектрофотометрия |
<*> Согласно инструкциям фирм - производителей наборов и средств измерений. | ||
Таблица В.6
Методы исследования показателей минерального обмена
Показатель | Исследуемый биосубстрат | Метод | Примечание |
Натрий | Плазма крови | Пламенная фотометрия | |
Калий | Плазма крови | Пламенная фотометрия | |
Магний | Плазма крови | Пламенная фотометрия | |
Кальций | Плазма крови | Пламенная фотометрия | |
Фосфор | Плазма крови | Спектрофотометрия | |
Цинк | Костная ткань | Атомно-абсорбционная спектрофотометрия | По ГОСТ 30178, <*> |
Щелочная фосфатаза | Плазма крови | Спектрофотометрия | |
Железо | Плазма крови | Атомно-абсорбционная спектрофотометрия | По ГОСТ 30178, <*> |
Железосвязывающая активность | Плазма крови | Спектрофотометрия | |
Трансферрин | Плазма крови | Иммуноферментный анализ | |
Ферритин | Плазма крови | Иммуноферментный анализ | |
Гемоглобин | Кровь, эритроциты | Спектрофотометрия | |
Селен | Плазма крови | Спектрофлуориметрия | |
Глутатионпероксидаза | Эритроциты | Спектрофотометрия | |
Содержание эссенциальных и токсичных микроэлементов | Печень, почки, селезенка, легкие, головной мозг | Масс-спектрометрия с индуктивно связанной плазмой, атомно-эмиссионная спектрометрия с индуктивно связанной плазмой | |
Таблица В.7
Методы исследования энзимологических показателей
Активность ферментов | Исследуемый биосубстрат | Метод <*> |
Аланинаминотрансфераза (КФ 2.6.1.2) | Сыворотка крови | Спектрофотометрия |
Аспартатаминотрансфераза (КФ 2.6.1.1) | Сыворотка крови | Спектрофотометрия |
Щелочная фосфатаза (КФ 3.1.3.1) | Сыворотка крови | Спектрофотометрия |
Гамма-глутамилтранспептидаза | Сыворотка крови | Спектрофотометрия |
Креатинфосфокиназа | Сыворотка крови | Спектрофотометрия |
Таблица В.8
Методы исследования иммунологических показателей
Показатель | Исследуемый биосубстрат | Метод | Примечание |
Цитокины: | Плазма крови, жировая ткань, селезенка | Мультиплексный иммуноанализ, ИФА | |
Хемокины и ростовые факторы: Eotaxin, G-CSF, GM-CSF, EPO, GM-CSF, GRO/KC, M-CSF, MCP-1, 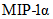 , , 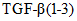 , , 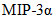 , RANTES, VEGF , RANTES, VEGF | Плазма крови, жировая ткань, селезенка | Мультиплексный иммуноанализ, ИФА | |
Маркеры диабета: инсулин, GLP-1, Glucagon, PAI-1, GIP, resistin, IGF-1 | Плазма крови | Мультиплексный иммуноанализ, ИФА | |
Содержание клеточных субпопуляций лимфоцитов CD3+, CD4+, CD8+, CD161+, CD 45RA+ | Цельная кровь | Проточная цитофлуориметрия | |
Таблица В.9
Методы исследования показателей окислительного стресса
Показатель | Исследуемый биосубстрат | Метод <*> |
Малоновый диальдегид (ТБК-реактивные вещества) | Плазма крови, печень (гомогенат) | Спектрофотометрия |
Диеновые конъюгаты ПНЖК | Плазма крови, печень (гомогенат) | Спектрофотометрия |
Каталаза (КФ 1.11.1.6) | Печень (цитозоль) | Спектрофотометрия |
Супероксиддисмутаза (КФ 1.15.1.1) | Печень (цитозоль) | Спектрофотометрия |
Глутатионредуктаза (КФ 1.8.1.7) | Печень (цитозоль) | Спектрофотометрия |
Таблица В.10
Методы исследования показателей микробиома
Показатель | Исследуемый биосубстрат | Метод |
Бифидобактерии | Содержимое слепой кишки крыс | Микробиологические методы, светооптическая микроскопия |
Лактобактерии | Содержимое слепой кишки крыс | Микробиологические методы, светооптическая микроскопия |
Бактероиды | Содержимое слепой кишки крыс | Микробиологические методы, светооптическая микроскопия |
Энтерококки | Содержимое слепой кишки крыс | Микробиологические методы, светооптическая микроскопия |
Клостридии | Содержимое слепой кишки крыс | Микробиологические методы, светооптическая микроскопия |
E. coli типичные | Содержимое слепой кишки крыс | Микробиологические методы, светооптическая микроскопия |
E. coli лактозонегативные | Содержимое слепой кишки крыс | Микробиологические методы, светооптическая микроскопия |
E. coli гемолитические | Содержимое слепой кишки крыс | Микробиологические методы, светооптическая микроскопия |
Другие условно-патогенные энтеробактерии <*> | Содержимое слепой кишки крыс | Микробиологические методы, светооптическая микроскопия |
Стафилококк золотистый | Содержимое слепой кишки крыс | Микробиологические методы, светооптическая микроскопия |
Стафилококки (сапрофитный, эпидермальный) | Содержимое слепой кишки крыс | Микробиологические методы, светооптическая микроскопия |
Дрожжеподобные грибы рода Candida | Содержимое слепой кишки крыс | Микробиологические методы, светооптическая микроскопия |
Неферментирующие бактерии <**> | Содержимое слепой кишки крыс | Микробиологические методы, светооптическая микроскопия |
<*> Представители родов Klebsiella, Enterobacter, Hafnia, Serratia, Proteus, Morganella, Providecia, Citrobacter и др. Примечание - Анализ состава микробиома может быть проведен при помощи аккредитованного в утвержденном порядке метода ПЦР анализа микрофлоры кишечника. | ||
Микробиологические показатели изучают путем посева содержимого слепой кишки на специфические питательные среды. Содержание бифидобактерий определяют на среде ГМК (или желчно-эскулиновый агар для бактероидов; лактобацилл - на MRS-агаре; энтеробактерий - на среде Эндо, сульфит-редуцирующих клостридий - на железосульфитной среде, Enterococcus spp. - на азидном агаре с канамицином и эскулином; Bacteroides spp. - на желчно-эскулиновом агаре для бактероидов; дрожжей и плесневых грибов - на среде Сабуро с хлорамфениколом (0,1 г/л), Pseudomonas, Acinetobacter - на мясо-пептонном агаре (МПА), гемолитические микроорганизмы - на кровяном агаре. Инкубирование анаэробных микроорганизмов осуществляется с использованием пакетов для химического связывания кислорода или в анаэростате. Исследования осуществляют в соответствии с руководствами на применяемые методы анализа.
Для культивирования микроорганизмов можно использовать другие виды питательных сред, разрешенные для использования нормативными документами, действующими на территории государства, на территории которого продукция находится в обращении.
Количество микроорганизмов выражают в lg КОЕ/г сырой массы содержимого слепой кишки.
Таблица В.11
Схема посева содержимого слепой кишки
Группа микроорганизмов | Наименование среды | Номер разведения | Количество засеваемого материала, см3 | Время инкубации, ч |
Бифидобактерии/Bifidobacterium spp. | Среда ГМК | 5; 7; 9 | 1,0 | 24 - 72 |
Лактобактерии/Lactobacterium spp. | МРС-4 | 5; 7; 9 | 0,05 | 24 - 48 |
Бактероиды/Bacteroides spp. | Среда ГМК | 5; 7; 9 | 0,05 | 24 |
Клостридии/Clostridium spp. | Железосульфитная среда | 1; 3; 5 | 1,0 | 24 - 72 |
Энтеробактерии/Enterobacteriaceae | Среда Эндо | 5; 7; 9 | 0,05 | 24 |
Энтерококки/Enterococcus spp. | Азидный агар с канамицином и эскулином | 1; 3; 5 | 0,05 | 24 - 72 |
Дрожжеподобные и плесневые грибы | Среда Сабуро с хлорамфениколом (0,1 г/л) | 1; 3; 5 | 0,05 | 2 - 5 сут |
УДК 57.044:57.084.1:577.15:613.2:616-092.9:006.354 | МКС 07.080 |
Ключевые слова: ферментные препараты, технологические вспомогательные средства, доклинические испытания, подострая токсичность, лабораторные животные | |