СПРАВКА
Источник публикации
СПб.: Издательство "Лань", 2015
Примечание к документу
Название документа
"Методика по исследованию спермы крупного рогатого скота на контаминацию вирусом инфекционного ринотрахеита - пустулезного вульвовагинита (ИРТ-ИПВ)"
(утв. Минсельхозом СССР 08.02.1983)
"Методика по исследованию спермы крупного рогатого скота на контаминацию вирусом инфекционного ринотрахеита - пустулезного вульвовагинита (ИРТ-ИПВ)"
(утв. Минсельхозом СССР 08.02.1983)
Утверждена
8 февраля 1983 года
МЕТОДИКА
ПО ИССЛЕДОВАНИЮ СПЕРМЫ КРУПНОГО РОГАТОГО СКОТА
НА КОНТАМИНАЦИЮ ВИРУСОМ ИНФЕКЦИОННОГО
РИНОТРАХЕИТА - ПУСТУЛЕЗНОГО ВУЛЬВОВАГИНИТА (ИРТ-ИПВ)
ИРТ-ИПВ - остро протекающая контагиозная болезнь, характеризующаяся катарально-некротическими поражениями органов дыхания, лихорадкой, общим угнетением и конъюнктивитом, а также развитием пустулезного вульвовагинита и появлением абортов у коров, а также баланопаститами у быков.
Возбудителем болезни является ДНК-содержащий вирус из группы герпесвирусов. Вирус культивируется в культуре первично-трипсинизированных и перевиваемых клеток почек и семенников телят, не обладает гемадсорбирующими и гемагглютинирующими свойствами, чувствителен к эфиру, хлороформу, инактивируется при 56 °C в течение 20 мин, при 37 °C - через 4...10 дней, быстро теряет активность в кислой среде, но длительно сохраняется при pH 6...9 и температуре 40 °C или в замороженном состоянии.
Метод обнаружения вирусных контаминантов в сперме основан на выделении вируса в культуре клеток и идентификации его в реакции нейтрализации или методом флуоресцирующих антител.
Исследованию подлежит неразбавленная сперма, а также сперма, разбавленная и сохраненная при 2...5 °C или в замороженном виде при температуре -190 °C.
Выделение вируса проводят путем заражения первично-трипсинизированной культуры клеток почек эмбрионов коровы (ПЭК) или тестикул бычков (ТБ).
Для проведения исследований применяют следующее оборудование и реактивы:
- автоклав;
- центрифуга на 8 тыс. об/мин;
- шкаф сушильный;
- термостат;
- магнитная мешалка;
- микроскоп биологический;
- микроскоп люминесцентный;
- ножницы;
- пипетки мерные 1,0, 2,0, 5,0, 10,0 мл;
- колбы мерные;
- чашки бактериологические ГОСТ 10515-63;
- пробки резиновые N 12, 14, 24;
- фильтры марлевые;
- раствор Хенкса pH 7,2...7,4;
- 0,5% раствор гидролизата лактальбумина;
- сыворотку крупного рогатого скота;
- специфическую сыворотку против вируса ИРТ и отрицательную сыворотку;
- флуоресцирующую сыворотку против вируса ИРТ;
- масло нефлуоресцирующее;
- антибиотики: пенициллин натриевая соль, стрептомицин хлоркальциевый комплекс, полимиксин, сульфат M, микостатин (нистатин);
- спирт этиловый-ректификат ГОСТ 5962-67.
Подготовка к исследованию спермы. Неразбавленную сперму перед инокуляцией в культуру клеток разводят 1:10 раствором Хенкса, содержащем пенициллин, стрептомицин 750...1000 мкг/мл, полимиксин - по 750...1000 ЕД/мл и микостатин (нистатин) - 50 ЕД/мл. Сохраненную (замороженно-оттаянную) сперму разводят с учетом разбавления, сделанного перед замораживанием, и доводят разведение до 1:10. Если исследованию подвергается сперма, разбавленная 1:10 или более, то к такой сперме, если она не санирована, добавляют только антибиотики в указанной концентрации. Подготовленную сперму замораживают два-три раза при -15...-40 °C и оттаивают при комнатной температуре.
Приготовление культур клеток. Культуру клеток ПЭК или ТБ готовят по методике, изложенной в "Методических указаниях по приготовлению первично-трипсинизированных культур клеток крупного рогатого скота", рекомендованных ГУВ МСХ СССР в 1976 г. Клетки культивируют в среде, состоящей из 0,5% гидролизата лактальбумина в растворе Хенкса, 10% сыворотки крупного рогатого скота и антибиотиков: пенициллина - 100 ЕД/мл, стрептомицина - 100 мкг/мл, микостатина (нистатина) - 20 ЕД/мл. В качестве поддерживающей среды используют 0,5%-ный гидролизат лактальбумина без сыворотки.
Выделение вируса. Для выделения вируса используют 3...4-суточную культуру клеток ПЭК или ТБ. Каждой серией спермы (партией) заражают не менее 4 пробирок или один 100 мл матрац с культурой клеток. Серии спермы от одного быка, полученные в течение трех месяцев, смешивают и исследуют как одну пробу.
Клетки перед инокуляцией материала дважды отмывают раствором Хенкса или питательной средой, после чего в каждую пробирку вносят 0,1...0,2 мл подготовленной спермы. Матрацы заражают по 1,0...2,0 мл. Адсорбируют в течение 30 мин при 37 °C или одного часа при комнатной температуре. Затем инокулят удаляют, а монослой отмывают два раза раствором Хенкса или питательной средой. В пробирки добавляют по 1,0 мл, а в матрацы по 10...12 мл поддерживающей среды и культивируют при 37 °C в течение 5...7 дней.
Для контроля оставляют не менее 5 пробирок с незараженной культурой клеток. Зараженные и контрольные пробирки ежедневно смотрят под микроскопом (об. 8,10 x ок. 7) на наличие цитопатических изменений (ЦПД). Через 5...7 дней проводят второй пассаж исследуемого материала. Для этого культуру инфицированных клеток замораживает при -15...-40 °C и оттаивают при комнатной температуре. Суспензию тщательно перемешивают и вносят по 0,1...0,2 мл в пробирки с монослоем клеток. Через 5...7 дней учитывают результаты заражения и при отсутствии ЦПД проводят третий пассаж. При отсутствии цитопатических изменений в четырех пассажах сперму считают свободной от вируса ИРТ-ИПВ. При наличии цитопатических изменений в первом пассаже для исключения цитотоксического действия спермы проводят второй пассаж. Цитопатический агент второго или последующего пассажей идентифицируют в реакции нейтрализации (РН) или методом флуоресцирующих антител (МФА).
Идентификация вируса в реакции нейтрализации (РН).
Реакцию ставят в культуре клеток ПЭК или ТБ со специфической и отрицательной сыворотками. Сыворотки каждую в отдельности прогревают при 56 °C в течение 30 мин, разводят средой 1:10 и разливают по 1,0 мл в 7 стерильных пробирок. Затем готовят десятикратные разведения вируса на питательной среде в объеме 5 мл, начиная с 10-1 до 10-7 и по 1,0 мл каждого разведения вносят в пробирки с сыворотками, встряхивают и инкубируют в течение часа при температуре 37 °C и используют для заражения культуры клеток. Каждой смесью заражают по 0,2 мл 4 пробирки с культурой клеток. Через 30...40 мин инкубирования в пробирки добавляют по 0,8 мл питательной среды. Параллельно готовят контроль специфической и отрицательной сывороток на токсичность. Для этого сыворотки (каждую в отдельности) в разведении 1:10 смешивают с равным объемом питательной среда и вносят по 0,2 мл в 4 пробирки с культурой клеток. Для контроля культуры клеток 4 пробирки оставляют незараженными. В них ростовая среда меняется на поддерживающую.
Опытные и контрольные пробирки инкубируют в течение 7 сут, проводя микроскопию со 2-го дня. Учет реакции проводят при условии отсутствия цитопатических изменений в контрольных пробирках.
Реакцию учитывают по индексу нейтрализации (ИН). ИН - это отношение титра вируса в смеси с отрицательной сывороткой к титру вируса в смеси со специфической сывороткой. Его рассчитывают по формуле
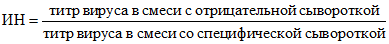 .
.Титр вируса определяют методом Рида и Менча по формуле
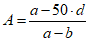 ,
,где A - показатель логарифма дозы, поражающей более 50% пробирок; a - процент эффекта дозы, поражающей более 50% пробирок; b - процент эффекта дозы, поражающей менее 50% пробирок; d - разность показателей логарифмов доз, поражающих менее и более 50% пробирок.
Положительным считают индекс нейтрализации, равный 2 и более десятичным логарифмам (lg 2). Вирус ИРТ-ИПВ считают идентифицированным, если он нейтрализуется специфической сывороткой с положительным индексом.
Идентификация вируса методом флуоресцирующих антител основана на обнаружении вирусного антигена в культуре клеток, обработанных флуоресцирующим иммуноглобулином. Для этого культуру клеток выращивают в пробирках на полосках покровных стекол или слюдинках и заражают вирусом. Через 24 ч инкубации стекла извлекают, дважды промывают фосфатным буфером и подсушивают на воздухе. Затем фиксируют 10...12 мин в ацетоне и после повторного подсушивания препараты хранят при -20 °C или окрашивают флуоресцирующей сывороткой.
Препараты обрабатывают флуоресцирующей сывороткой в рабочем разведении в течение 30 мин во влажной камере (чашка Петри с увлажненной фильтровальной бумагой) при температуре 37 °C, затем двукратно промывают фосфатным буфером pH 7,2...7,4 и споласкивают дистиллированной водой. На высушенный препарат наносят каплю смеси, состоящей из 9 частей глицерина и 1 части фосфатного буфера pH 7,2...7,4, покрывают покровным стеклом и просматривают в фиолетово-синем свете при использовании иммерсионного объектива. На ранней стадии инфицирования клеток специфический антиген выявляется в перинуклеарной зоне, а позднее в ядре и в цитоплазме инфицированных клеток. Специфичность флуоресценции контролируют следующим образом: обрабатывают флуоресцирующей сывороткой клетки, незараженные вирусом; окрашивают специфической флуоресцирующей сывороткой инфицированные клетки, предварительно обработанные специфической немаркированной сывороткой.
Положительной считается реакция, при которой отмечают специфическую флуоресценцию в зараженной культуре клеток, при отсутствии флуоресценции в контрольных препаратах.
В случае отрицательных результатов исследования в реакциях нейтрализации и иммунофлуоресценции со специфической и флуоресцирующей сыворотками против вируса ИРТ-ИПВ цитопатический агент исследуют сыворотками против вирусов парагриппа-3, диареи и аденовирусов. Идентификацию изолята проводят методами, изложенными в "Методических указаниях по лабораторной диагностике вирусных респираторно-кишечных инфекций крупного рогатого скота", утвержденных ГУВ МСХ СССР 25.07.1978.
При обнаружении в сперме вируса ИРТ-ИПВ сперму бракуют.
Методические указания подготовлены Всесоюзным государственным научно-контрольным институтом ветпрепаратов МСХ СССР.
Зав. лабораторией контроля и стандартизации препаратов, применяемых при искусственном осеменении с/х животных, Н.Г. Балашов;
Зав. лабораторией контроля и стандартизации препаратов против оспенных и респираторных инфекций, доцент В.В. Гуненков;
Ст. научный сотрудник, кандидат биологических наук Н.В. Изотова;
Младший научный сотрудник Г.Э. Фарботко.