СПРАВКА
Источник публикации
Документ опубликован не был
Примечание к документу
Взамен Методических указаний по бактериологической диагностике смешанной кишечной инфекции молодняка животных, вызываемой патогенными энтеробактериями, утв. ГУВ Минсельхозпрода СССР 12.11.1991.
Название документа
"Методические указания по ускоренной индикации морганелл, сальмонелл и энтеропатогенных эшерихий с адгезивными антигенами в патологическом материале, кормах, объектах внешней среды в реакции коагглютинации"
(утв. Минсельхозпродом России 11.10.1999 N 13-7-2/1758)
"Методические указания по ускоренной индикации морганелл, сальмонелл и энтеропатогенных эшерихий с адгезивными антигенами в патологическом материале, кормах, объектах внешней среды в реакции коагглютинации"
(утв. Минсельхозпродом России 11.10.1999 N 13-7-2/1758)
Содержание
Утверждаю
Зам. руководителя
Департамента ветеринарии
В.В.СЕЛИВЕРСТОВ
11 октября 1999 г. N 13-7-2/1758
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО УСКОРЕННОЙ ИНДИКАЦИИ МОРГАНЕЛЛ, САЛЬМОНЕЛЛ
И ЭНТЕРОПАТОГЕННЫХ ЭШЕРИХИЙ С АДГЕЗИВНЫМИ АНТИГЕНАМИ
В ПАТОЛОГИЧЕСКОМ МАТЕРИАЛЕ, КОРМАХ, ОБЪЕКТАХ ВНЕШНЕЙ СРЕДЫ
В РЕАКЦИИ КОАГГЛЮТИНАЦИИ
Методические указания разработаны Л.С. Кавруком, С.В. Бритовой, А.Б. Кононенко (ВНИИ ветсанитарии, гигиены и экологии), В.А. Седовым, Л.А. Тарановой (Центральная научно-методическая ветлаборатория Минсельхозпрода РФ).
С утверждением настоящих Методических указаний утрачивают силу "Методические указания по бактериологической диагностике смешанной кишечной инфекции молодняка животных, вызываемой патогенными энтеробактериями", утвержденные ГУВ Министерства сельского хозяйства и продовольствия СССР 12 ноября 1991 г.
1.1. Настоящие методические указания предназначены для ускоренной индикации бактерий родов salmonella и morganella, а также энтеропатогенных эшерихий с адгезивными антигенами K88, K99, 987P, f41, f18, A20 в патологическом материале от больных и павших животных, кормах, объектах внешней среды, а также для серогрупповой идентификации культур указанных бактерий, выделенных из разных источников, в реакции коагглютинации.
1.2. Реакция коагглютинации (РКОА) основана на взаимодействии золотистого стафилококка штамма cowan-1, предварительно сенсибилизированного антителами специфической О-сыворотки или антиадгезивных сывороток, с О-антигенами сальмонелл и морганелл и адгезивными антигенами эшерихий, что приводит к образованию хорошо технологических и ветеринарно-санитарных требований воспроизводства стада, а также нарушением режимов содержания и кормления молодняка.
1.3. Смешанная кишечная инфекция может протекать в кишечной (энтеритной) и септической формах. При кишечной форме возбудители болезни локализуются только в желудочно-кишечном тракте и брыжеечных лимфоузлах, регионарных пораженным участкам кишечника; при септической форме - в паренхиматозных органах, различных тканях, а также в кишечнике и брыжеечных лимфоузлах. Основными клиническими признаками болезни являются: потеря аппетита, понос, переходящий в профузный, нарастающая слабость, депрессия, учащенное дыхание и сердцебиение, обезвоживание организма (при затяжном течении); нередко наблюдается поражение центральной нервной системы (возбуждение, судороги), иногда пневмония, артриты; температура тела в пределах нормы, в отдельных случаях повышена на 0,5 - 1 °C, в предагональном состоянии она снижается ниже нормы.
1.4. Патологоанатомические изменения у погибших животных имеют картину катарального или катарально-геморрагического гастроэнтерита, на слизистой желудка, тонкого отдела кишечника и слепой кишки могут встречаться язвы, нередко отмечаются множественные точечные, полосчатые и пятнистые кровоизлияния на слизистой желудка, толстого и тонкого отделов кишечника, под капсулой селезенки, эпи- и эндокарде (клапанах); иногда отмечается очаговая катаральная пневмония и отек легких, дистрофия печени; регионарные брыжеечные лимфатические узлы как правило увеличены, отечны, на разрезе розового или красно-вишневого цвета; при вскрытии черепной коробки - гиперемия кровеносных сосудов и отек ткани головного мозга. Указанные изменения могут быть в отдельных или одновременно в нескольких органах.
1.5. Диагноз на смешанную кишечную инфекцию в хозяйствах устанавливают на основании совокупности эпизоотологических данных (возраст заболевших животных, массовость поражения, стационарность и др.), клинических признаков болезни, патологоанатомической картины и результатов бактериологического (при необходимости еще и вирусологического) исследования патологического материала от больных или погибших животных.
2.1. Для посмертной бактериологической диагностики в лабораторию направляют 2 - 4 свежих трупа погибших или убитых с диагностической целью больных животных (желательно не подвергавшихся лечению антибактериальными препаратами). В случае невозможности доставки целого трупа посылают следующий патологический материал: голову, трубчатую кость, сердце, перевязанное лигатурой вблизи разреза сосудов и аорты, селезенку, долю печени с желчным пузырем, брыжеечные лимфатические узлы, регионарные воспаленному участку кишечника, а также пораженный отрезок тонкого отдела кишечника, перевязанный с двух концов лигатурой (в отдельной таре или полиэтиленовом пакете). Указанный патологический материал исследуют в день поступления его в лабораторию.
ИС МЕГАНОРМ: примечание. В официальном тексте документа, видимо, допущена опечатка: приложение отсутствует. |
2.2. Для прижизненной бактериологической диагностики в лабораторию направляют фекалии больных диареей животных, не подвергавшихся лечению антибактериальными препаратами. Пробы фекалий берут от 5 - 6 больных животных одной фермы в стерильные пробирки по 2 - 3 г непосредственно из прямой кишки с помощью прокипяченного резинового катетера. Пробирки вместе с сопроводительной запиской упаковывают в полиэтиленовый пакет или картонную коробку. При невозможности быстрой доставки проб фекалий в лабораторию (через 3 - 4 часа после взятия) их консервируют стерильным 30%-ным глицериновым раствором в соотношении 1:2 (см. приложение).
2.3. Пробы фекалий и содержимого тонкого отдела кишечника (в количестве не более 0,5 г) разводят в 10 см3 стерильного 0,85%-ного раствора хлорида натрия, тщательно размешивают и затем выдерживают 10 - 15 минут при комнатной температуре для осаждения крупных частиц. Надосадочную жидкость используют для посева на питательные среды не позднее 1 - 2 часов после приготовления взвесей. При исследовании консервированных фекалий, их тщательно размешивают, после чего разводят физиологическим раствором в 5 - 10 раз.
3. Выделение культур энтеробактерий, изучение их морфологических, культуральных и ферментативных свойств
3.1. Патологический материал (за исключением содержимого тонкого отдела кишечника и фекалий) засевают в пробирки с МПБ и на плотные дифференциально-диагностические среды в чашках: Эндо (или Левина) и среду Плоскирева (или висмут-сульфит агар). Содержимое тонкого отдела кишечника и фекалий засевают только на указанные выше плотные среды в чашках. Кроме того для выделения из фекалий сальмонелл неразведенные пробы фекалий засевают еще в одну из сред обогащения (селенитовый бульон, магниевую, Мюллера или др.) в соотношении 1:5.
3.1.1. Посев материала в МПБ проводят пастеровской пипеткой. Посевы на плотные среды в чашках из внутренних органов и тканей, указанных в п. 2.3, делают путем отпечатков разрезанной поверхностью кусочка органа из предварительно профламбированного участка на подсушенную питательную среду или вносят материал пастеровской пипеткой на поверхность среды, а затем равномерно растирают его стеклянным шпателем.
3.1.2. Содержимое тонкого отдела кишечника, взятое путем соскоба с пораженного участка слизистой оболочки, суспендируют в 10 куб. см стерильного 0,85%-ного раствора хлорида натрия, затем засевают суспензию бактериологической петлей на подсушенные в термостате плотные дифференциально-диагностические среды в чашках широким частым штрихом по всей поверхности среды. Аналогичным образом проводят посев разведенных фекалий.
3.2. Пробирки с посевами в МПБ из внутренних органов и тканей инкубируют при температуре 37 - 38 °C в течение 18 - 24 часов. При наличии в МПБ помутнения среды культуру микроскопируют и в случае обнаружения мелких грамотрицательных палочек пересевают ее на агар Эндо (или Левина) и среду Плоскирева (или висмут-сульфит агар) в чашках, которые помещают в термостат (37 - 38 °C) на 18 - 24 часа.
Пересев культур, полученных в МПБ, на плотные селективные среды проводят в том случае, если отсутствует рост колоний на этих средах в первичных посевах из соответствующих органов и тканей.
3.3. Чашки с посевами на агаре Эндо (или Левина) из внутренних органов, тканей или фекалий инкубируют при температуре 37 - 38 °C в течение 18 - 24 часов. После просмотра культур пересевают колонии лактозоположительных бактерий (круглые, средних размеров s-формы, красно-малинового цвета на агаре Эндо и темно-фиолетового цвета на агаре Левина с наличием или отсутствием металлического блеска) в чашки с МПА и средой Минка в соответствии с рекомендациями, изложенными в действующих "Методических указаниях по бактериологической диагностике колибактериоза (эшерихиоза) животных".
При наличии на агаре Эндо (или Левина) роящегося налета, характерного для протея, пересевают его на скошенный МПА (культуры из двух-трех внутренних органов, тканей или фекалий). Чашки и пробирки с посевами инкубируют 18 - 20 часов при той же температуре.
СХЕМА
БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ ПАТОЛОГИЧЕСКОГО
МАТЕРИАЛА НА СМЕШАННУЮ КИШЕЧНУЮ ИНФЕКЦИЮ
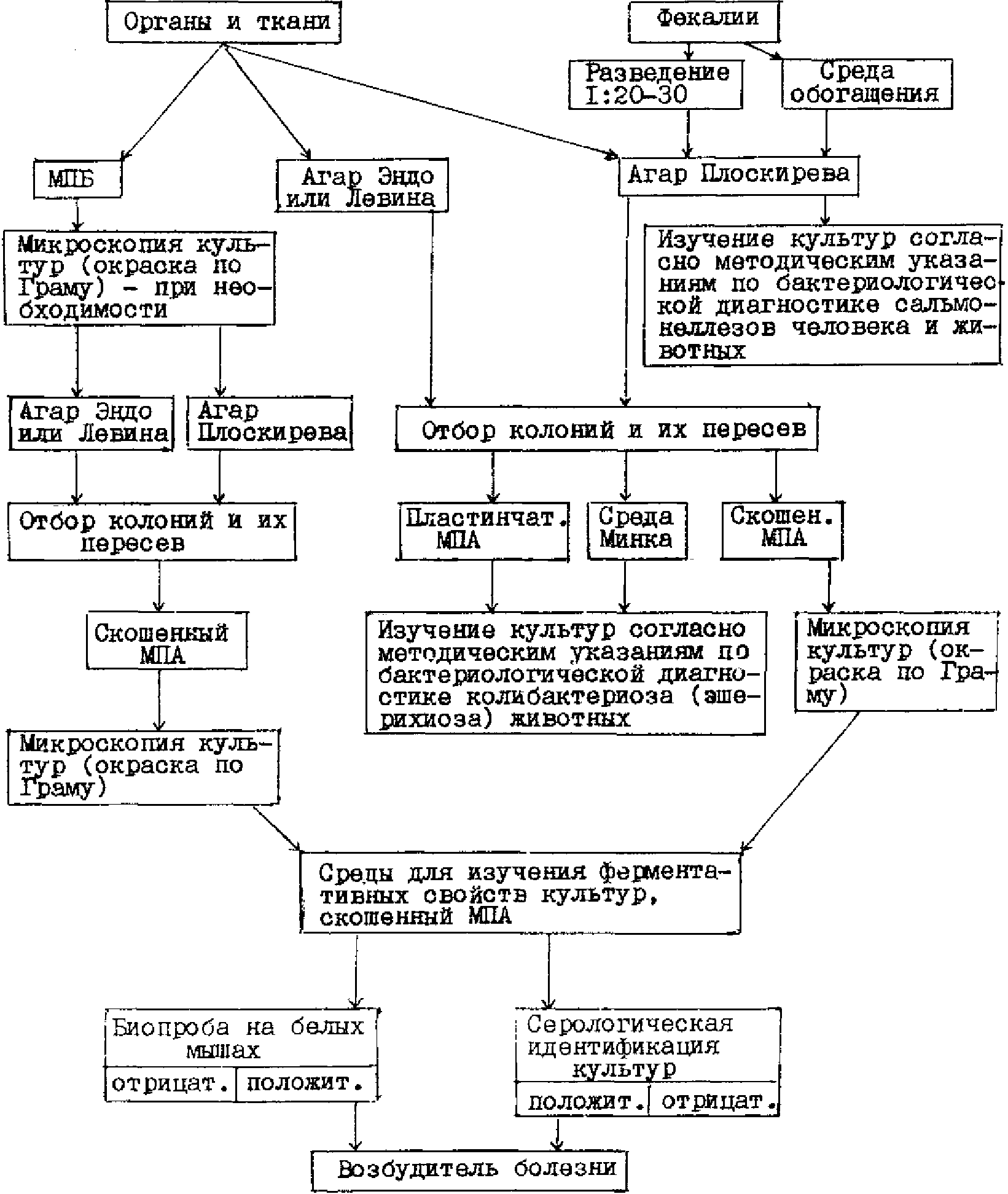
3.4. Чашки с первичными посевами на агаре Плоскирева инкубируют при температуре 37 - 38 °C в течение 24 - 36 часов. После просмотра культур пересевают мелкие круглые колонии s-формы полупрозрачные, сероватого цвета с голубым оттенком в пробирки со скошенным МПА (по 1 - 2 колонии с культур из двух-трех внутренних органов, тканей или фекалий, каждую колонию в отдельную пробирку), которые помещают в термостат на 18 - 24 часа.
В том случае, если пересев проводят на комбинированную среду (Олькеницкого, Клиглера), то каждую колонию пересевают в одну пробирку с этой средой и в одну пробирку со скошенным МПА.
3.5. Суточные культуры бактерий на скошенном МПА или комбинированной среде, выделенные из внутренних органов, тканей или фекалий, микроскопируют (окраска по Граму) и при наличии в мазках однородных мелких грамотрицательных палочек, не образующих спор и капсул (бактерии вида klebsiella pneumoniae образуют капсулу), используют для изучения ферментативных, патогенных, антигенных свойств, а также (при необходимости) определения подвижности в полужидком МПА. Для выявления у культур клебсиелл капсулы окраску мазков проводят по методу Гинса (тушью).
3.6. Ферментативные свойства изучают у 2 - 6 агаровых (в порядке исключения у бульонных) культур бактерий, выделенных из одного патологического материала, на наборе сред с углеводами и индикатором Андреде или полужидких средах с индикатором ВР, куда входят среды с глюкозой, лактозой, сахарозой, маннитом, мальтозой, а также на средах с мочевиной, сернокислым железом (определение сероводорода), агаре Симонса, в бульоне Хоттингера или МПБ (определение индола), мясо-пептонной желатине, среде с фенилаланином.
При использовании комбинированной среды Олькеницкого или Клиглера учитывают изменения, вызываемые представителями разных родов энтеробактерий в этой среде, после чего данную культуру изучают по другим необходимым биохимическим тестам.
Засеянные пробирки инкубируют при температуре 37 - 38 °C. Предварительные результаты изучения ферментативных свойств культур учитывают через 24 часа, окончательные результаты - через 48 часов. Изучение ферментативных свойств культур энтеробактерий можно проводить также с помощью тест-системы для биохимической идентификации энтеробактерий. Родовую и видовую принадлежность культур устанавливают по показателям таблицы.
Следует учитывать, что у бактерий рода proteus встречаются нероящиеся штаммы, образующие при росте на плотных питательных средах мелкие круглые колонии s-формы сероватого цвета. Важными признаками родовой идентификации таких штаммов является их способность дезаминировать фенилаланин и разжижать желатин.
При наличии у культур отклонений от основных показателей таблицы используют дополнительные тесты: реакции с метилротом и Фогес-Проскауэра, наличия образования оксидазы, определение подвижности и др.
4.1. Серологическую идентификацию культур эшерихий и сальмонелл проводят в соответствии с действующими "Методическими указаниями по бактериологической диагностике колибактериоза (эшерихиоза) животных" и "Методическими указаниями по лабораторной диагностике сальмонеллезов человека и животных, обнаружению сальмонелл в кормах, продуктах питания и объектах внешней среды".
Дифференциальные признаки энтеробактерий
по ферментативным свойствам
N п/п | Тесты | РОДЫ И ВИДЫ БАКТЕРИЙ | |||||||||||
escherichia coli | citrobacter | enterobacter | klebsiella pneumoniae | salmonella (подрод 1) | proteus | morganella morganii | yersinia enterocolitica (t0 22-25 гр. C) | ||||||
freundii | diversus | aerogenes | cloacae | vulgaris | mirabilis | myxofaciens | |||||||
ОСНОВНЫЕ | |||||||||||||
1. | Глюкоза | + | + | + | + | + | + | + | + | + | + | + | + (k) |
2. | Лактоза | (+/-) | (+/-) | (+/-) | (+/-) | (+/-) | + | - | - | - | - | - | - |
3. | Сахароза | +/- | +/- | +/- | + | +/- | + | - | + | +/- | + | - | + |
4. | Маннит | + | + | + | + | + | + | + | - | - | - | - | + |
5. | Мальтоза | +/- | + | + | + | + | + | + | + | - | + | - | + |
6. | Рост на агаре Симонса | - | + | + | + | + | + | (+/-) | +/- | + | +/- | - | - |
7. | Образование индола | +/- | - | + | - | - | +/- | - | + | - | - | + | +/- |
8. | Образование сероводорода | - | + | - | - | - | - | (+/-) | + | + | - | - | - |
9. | Расщепление мочевины | - | +/- | + | - | + | + | - | + | + | + | + | + |
10. | Разжижение желатины | - | - | - | +/- | - (+) | - | - | + | + | + | - | - |
11. | Дезаминирование фенилаланина | - | - | - | - | - | - | - | + | + | + | + | - |
ДОПОЛНИТЕЛЬНЫЕ | |||||||||||||
1. | Реакция с метилротом | + | + | + | - | - | +/- | + | + | + | + | + | - |
2. | Реакция Фогес-Проскауэра | - | - | - | + | + | +/- | - | - | +/- | + | - | + |
3. | Подвижность | +/- | (+/-) | (+/-) | + | + | - | (+/-) | + | + | + | (+/-) | + |
Обозначения: "+" - ферментация сахара (КГ), образование индола, расщепление мочевины и т.д.
"-" - отсутствие ферментации сахара, образования индола, расщепления мочевины и т.д.
"+/-" - различные показатели
"(-)" - отдельные штаммы не вызывают ферментации сахара, образования индола и т.д.
"(+)" - замедленное разжижение желатины
Культуры названных бактерий относят к возбудителям болезни на основании показателей, указанных в этих методических указаниях.
4.2. Для серотипирования культур морганелл, выделенных из патологического материала, применяют набор нативных морганеллезных агглютинирующих серогрупповых сывороток. Серологическую типизацию культур осуществляют в соответствии с наставлением по применению указанных сывороток, утвержденным Департаментом ветеринарии МСХиП РФ 28.04.1997 г. При выделении культур морганелл патогенной серологической группы их относят к возбудителям болезни и у таких культур патогенные свойства в биопробе на белых мышах не определяют.
4.3. Ускоренное обнаружение эпизоотических штаммов морганелл в первичных смешанных культурах, полученных после посева патологического материала на среду Плоскирева, с одновременной серологической типизацией их осуществляют в реакции нейтрализации антител (РНАт) в соответствии с "Методическими указаниями по ускоренной индикации эпизоотических штаммов морганелл в реакции нейтрализации антител", утвержденными Департаментом ветеринарии МСХиП РФ 24.03.1999 г. Для постановки РНАт применяют набор агглютинирующих морганеллезных серогрупповых сывороток, указанный в п. 4.2, и набор морганеллезных эритроцитарных диагностикумов, которые используют в соответствии с "Наставлением по применению набора диагностикумов морганеллезных эритроцитарных", утвержденному Департаментом ветеринарии МСХиП РФ 24.03.1999 г. При обнаружении в реакции нейтрализации антител эпизоотических штаммов морганелл серогрупп О1, О16, О26, О29, О33, О45, О49, "13" выделение чистых культур дачных бактерий и изучение их морфологических, культурально-биохимических и патогенных свойств не проводят.
5.1. Патогенные свойства определяют у культур бактерий, относящихся к родам proteus, citrobacter, klebsiella, а также родам escherichia и morganella, не имеющих адгезивные антигены и не типируемых по О-антигену, в биопробе на белых мышах.
5.2. Для определения патогенных свойств бактерий используют агаровые культуры вышеуказанных микроорганизмов, выделенные из двух внутренних органов и тканей погибших или фекалий больных животных. С каждой из двух культур одного вида бактерий готовят смывы стерильным физиологическим раствором, устанавливают взвесь бактерий в концентрации 1 млрд. микробных клеток/куб. см (10 единиц по оптическому стандарту мутности), после чего их смешивают в равной пропорции.
5.3. Взвесями культур каждого вида бактерий заражают по три белые мыши массой 14 - 15 г внутрибрюшинно в дозе 0,5 млрд микробных клеток. Культуру признают патогенной в случае гибели двух и более мышей в течение трех суток после заражения и относят ее к возбудителю болезни.
5.4. При выделении культур энтеробактерий, относящихся к одному виду того или иного рода, указанного в п. 1.1, из селезенки, крови сердца, костного, головного мозга (не менее, чем из двух перечисленных органов и тканей) свежего трупа животного патогенные свойства этих культур в биопробе на белых мышах не определяют и их серологическую типизацию не проводят; такие культуры относят к возбудителю болезни.
6.1. Бактериологический диагноз на смешанную кишечную инфекцию молодняка сельскохозяйственных животных устанавливают на основании выделения из патологического материала культур, принадлежащим к двум и более родам энтеробактерий, указанных в п. 1.1, и относящихся к возбудителям болезни по одному из показателей, изложенных в пп. 4.1, 4.2, 5.3, 5.4.
6.2. Результаты бактериологического исследования формулируют: "Из присланного патологического материала (указать какого) выделены возбудители смешанной кишечной инфекции (указать какие виды бактерий, типы адгезивных антигенов у энтеропатогенных эшерихий, серогруппу в случае серотипирования культур эшерихий и морганелл)".
6.3. При необходимости определяют антибиотикочувствительность каждого вида выделенной культуры возбудителя кишечной инфекции в соответствии с действующими "Методическими указаниями по определению чувствительности к антибиотикам возбудителей инфекционных болезней сельскохозяйственных животных".
6.4. Общий срок бактериологического исследования патологического материала до 7 суток.