СПРАВКА
Источник публикации
М., 1972
Примечание к документу
Название документа
"Методические указания по определению чувствительности к антибиотикам возбудителей инфекционных болезней сельскохозяйственных животных"
(утв. Минсельхозом СССР 30.10.1971)
"Методические указания по определению чувствительности к антибиотикам возбудителей инфекционных болезней сельскохозяйственных животных"
(утв. Минсельхозом СССР 30.10.1971)
Содержание
Главным управлением ветеринарии
Министерства сельского хозяйства СССР
30 октября 1971 года
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ОПРЕДЕЛЕНИЮ ЧУВСТВИТЕЛЬНОСТИ К АНТИБИОТИКАМ
ВОЗБУДИТЕЛЕЙ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
Методические указания разработаны Всесоюзным ордена Ленина институтом экспериментальной ветеринарии на основе работ лаборатории антибиотиков и микологии ВИЭВ и данных отечественных и зарубежных исследователей. Методические указания рассмотрены и одобрены Научно-техническим Советом Министерства сельского хозяйства СССР 25 февраля 1971 года и доработаны с учетом поступивших замечаний и предложений комиссией в составе: тт. Грезина В.Ф., Колякова Я.Е., Окунькова П.С., Тришкиной Е.Т., Фортушного В.А.
1. Одним из основных элементов рационального применения антибиотиков в ветеринарии при инфекционных болезнях является определение чувствительности возбудителя болезни к этим препаратам. Это необходимо для того, чтобы избрать наиболее эффективный препарат из числа рекомендованных при данном заболевании и для своевременной замены длительно применяемого в животноводстве антибиотика другим, если установлена резистентность к нему патогенных микроорганизмов.
Систематическое определение уровня чувствительности возбудителей инфекционных болезней к антибиотикам позволяет прогнозировать результативность антибиотикотерапии в конкретных хозяйствах и зонах.
2. Установленная лабораторией чувствительность патогенных микроорганизмов к антибиотику позволяет применять этот препарат для лечения животных в течение 1 - 2 месяцев. При отсутствии терапевтического эффекта определение чувствительности культур возбудителя болезни следует повторить независимо от длительности применения антибиотика в хозяйстве.
3. Чувствительность микроорганизмов к антибиотику дает основание использовать для лечения другие антибиотики одноименной группы. Возбудитель болезни, чувствительный к окситетрациклину, будет чувствителен и к хлортетрациклину, тетрациклину, биоветину и другим тетрациклиновым препаратам.
4. Среди микроорганизмов отмечают перекрестную устойчивость к антибиотикам, родственным по химической структуре. Возбудитель болезни, устойчивый к пенициллину, будет резистентен и к бициллину, феноксиметилпенициллину и другим препаратам этой группы, за исключением полусинтетических пенициллинов.
5. Чувствительность микроорганизмов определяют минимальной концентрацией антибиотика (мкг, ЕД/мл), которая задерживает рост или убивает их в течение 16 - 18 часов. Для этой цели используют два наиболее распространенных метода:
- метод серийных разведений на жидкой или плотной питательной среде;
- метод диффузии в агар с применением дисков, содержащих антибиотики.
6. При определении чувствительности патогенных микроорганизмов к антибиотикам необходимо соблюдать следующие основные условия:
- определять чувствительность возбудителя болезни к тем антибиотикам, которые рекомендованы при этом заболевании методическими указаниями по применению антибиотиков в ветеринарии;
- использовать 5 - 10 колоний чистой культуры каждого вида микроорганизмов в отдельности, выделенных из патологического материала;
- применять питательные среды, одинаковые по составу, проценту агара, аминного азота, pH;
- антибиотики, диски, количество посевного материала (микробных клеток), контрольные тест-культуры должны отвечать определенным стандартам;
- не применять метод дисков и метод серийных разведений на плотной питательной среде для исследования микроорганизмов, дающий скудный или обильный, быстро распространяющийся на поверхности агара рост;
- плотно закрывать и парафинировать вскрытые ампулы и флаконы после извлечения части антибиотиков или дисков;
- для контроля определения чувствительности испытуемых микробов и проверки новых партий питательных сред параллельные исследования вести с соответствующими для каждого антибиотика тест-микробами, чувствительность которых указана в приложении 1;
- при выявлении устойчивых штаммов методом диффузии в агар с применением дисков заключительное исследование проводить методом серийных разведений.
Основные элементы метода:
выбор питательных сред;
приготовление растворов антибиотиков;
подготовка культур для исследования;
учет результатов.
7. Выбор питательных сред
Состав питательной среды выбирают в зависимости от вида испытуемых микроорганизмов и метода, используемого при определении чувствительности. Среда должна обеспечивать оптимальный рост культуры. В основном следует применять следующие питательные среды:
а) Жидкие питательные среды для аэробных бактерий:
- мясо-пептонный бульон (pH 7,2 - 7,4);
- бульон Хоттингера с содержанием 180 - 200 мг% аминного азота (pH 7,4 - 7,6).
б) Плотные питательные среды для аэробных бактерий:
2%-ный агар на мясо-пептонном бульоне;
2%-ный агар на переваре Хоттингера с содержанием 120 - 140 мг% аминного азота;
2%-ный мясо-пептонный агар с добавлением 5% крови или сыворотки крови.
Питательные среды готовят с pH 7,2 - 7,4.
в) Питательная среда для анаэробных бактерий. Среда Китт-Тароцци без кусочков печени с добавлением 0,5% глюкозы (pH 7,4 - 7,6), которую перед исследованием следует прокипятить 5 - 10 минут и быстро охладить.
Для каждого штамма микроорганизмов, при определении чувствительности к одному антибиотику, необходимо: 6 пробирок с питательной средой по 2 мл (для анаэробов по 9 мл) для серийного разведения антибиотика, две пробирки по 9 - 10 мл питательной среды для разведения культуры и питательная среда в колбе для приготовления рабочего раствора антибиотика.
8. Приготовление растворов антибиотиков. Применяют два раствора - основной и рабочий. Для приготовления их используют стандарты антибиотиков с определенной активностью. Стандарты выпускает Государственный научно-контрольный институт ветеринарных препаратов расфасованными в ампулы. Срок годности 2 - 3 года при температуре хранения 2 - 8°.
Основной раствор готовят из расчета 1000 мкг (ЕД) антибиотика в 1 мл растворителя. При определении чувствительности анаэробных микроорганизмов или при использовании в работе агаровой среды основной раствор готовят из расчета 10 000 ЕД/мл.
Навеску стандарта антибиотика (не менее 10 мг) взвешивают в стерильных бюксах на аналитических весах и растворяют. В таблице указаны растворители и сроки хранения основных растворов антибиотиков.
Стандарты | Растворители | Срок хранения (дней) | |
Хлортетрациклин | 0,01 н. раствор соляной кислоты | 7 | |
Окситетрациклин | То же | 7 | |
Тетрациклин | " | 7 | |
Олеандомицин | Фосфатный буфер | pH 6,0 - 6,2 | 7 |
Стрептомицин сернокислый | То же | pH 6,0 - 6,2 | 30 |
Левомицетин | " | pH 6,0 - 6,2 | 30 |
Полимиксин сульфат | " | pH 6,0 - 6,2 | 30 |
Пенициллины | " | pH 6,8 - 7,0 | 3 |
Эритромицин основание | " | pH 7,8 - 8,0 | 7 |
Неомицин (мицерин, колимицин), мономицин | Дистиллированная вода | pH 6,0 - 6,2 | 15 |
Приготовление фосфатных буферных растворов приведено в приложении 2.
Примечания: 1. Навески стандартов эритромицина и левомицетина предварительно растворяют в 96° этиловом спирте из расчета 10 мг антибиотика на 1 мл спирта, затем добавляют соответствующий фосфатный буфер до нужного объема.
2. Основные растворы можно готовить и на дистиллированной воде, которые хранят в стеклянной посуде с притертой пробкой при температуре 2 - 8° и используют не более 3 - 15 дней.
Пример: приготовление основного раствора эритромицина с концентрацией 1000 мкг/мл.
Навеска стандарта эритромицина составила 18,5 мг. Зная активность антибиотика (940 ЕД в 1 мг), определяем общее количество действующего начала в навеске (ЕД или мкг): 940 ЕД x 18,5 = 17 390 ЕД. Для получения раствора с содержанием 1000 мкг/мл растворителя необходимо - 17390 : 1000 = 17,4 мл. Вначале в бюкс наливают 2 мл этилового спирта. После растворения эритромицина добавляют 15,4 мл фосфатного буфера.
Рабочие растворы по активности должны быть приближены к ожидаемой чувствительности исследуемых культур. Их готовят из основного раствора непосредственно перед опытом, применяя для разведения питательную среду. При этом необходимо учитывать используемый метод, количество штаммов, подлежащих исследованию, и предполагаемую чувствительность микроорганизмов. В таблице приложения 3 приведены показатели чувствительности к 9 антибиотикам 19 видов патогенных для животных микроорганизмов.
чувствительности аэробных микроорганизмов
на жидкой питательной среде
Растворы антибиотиков готовят в пробирках методом последовательных серийных разведений с таким расчетом, чтобы предполагаемая чувствительность культуры приходилась на середину ряда. С этой целью исходный рабочий раствор готовят в объеме достаточном, чтобы добавить по 2 мл в первую пробирку каждого ряда, взятых по числу исследуемых культур. Концентрация антибиотика в этом растворе должна быть в два раза выше концентрации, намеченной для первой пробирки ряда. В случае, если чувствительность культур, взятых для определения, находится в пределах 0,01 - 0,1 мкг/мл, для получения необходимой концентрации антибиотика вначале в пробирках и колбе готовят стерильный рабочий раствор с активностью 0,5 мкг/мл.
В первую пробирку ряда, в котором предварительно была разлита питательная среда по 2 мл, вносят из колбы 2 мл рабочего раствора антибиотика с концентрацией 0,5 мкг/мл. Содержимое пробирки тщательно перемешивают. Из первой пробирки 2 мл среды с антибиотиком переносят во вторую, из второй 2 мл в третью и так до последней пробирки ряда. Таким образом будет получена питательная среда с концентрацией 0,25; 0,12; 0,06; 0,03; 0,015; 0,007 мкг антибиотика в 1 мл.
Рабочие растворы антибиотиков готовят для определения чувствительности салмонелл и кишечных палочек на мясо-пептонном бульоне; для возбудителей рожи, пастереллеза, листериоза - на бульоне Хоттингера.
чувствительности аэробных микроорганизмов
на плотной питательной среде
Для получения соответствующих рабочих разведений одного антибиотика берут 6 стерильных пробирок и 6 бактериологических чашек. Предполагаемая чувствительность штаммов 2 - 4 мкг/мл. В этом случае следует взять 6 чашек, содержащих 20; 10; 5; 2,5; 1,25; 0,6 мкг/мл антибиотика. Учитывая, что общий объем питательной среды в чашке будет составлять 20 мл, в первую чашку нужно добавить 1 мл МПБ, содержащего 400 мкг/мл антибиотика.
Для приготовления рабочих растворов берут одну пробирку с 2,4 мл и пять пробирок, содержащих по 2 мл МПБ или дистиллированной воды.
Из основного раствора активностью 1000 мкг/мл отмеряют 1,6 мл (1600 мкг) и вносят в первую пробирку с 2,4 мл растворителя, в которой, таким образом, концентрация будет доведена до 400 мкг/мл. Из этой пробирки 2 мл переносят во вторую, 2 мл из второй в третью и так далее. Количество антибиотика в пробирках будет составлять 400, 200, 100, 50, 25, 12,5 мкг/мл. Из каждой пробирки, начиная с меньшего разведения, берут по 1 мл, вносят в соответствующую чашку и добавляют из колбы 19 мл расплавленной (55 - 65°) агаровой среды. Содержимое вращательным движением смешивают и оставляют остывать. Концентрация антибиотика в бактериологических чашках будет в 20 раз ниже, чем в МПБ пробирок, в которых предварительно разводили антибиотик.
чувствительности анаэробных микроорганизмов
Рабочие растворы антибиотиков готовят на среде Китт-Тароцци без кусочков печени и масла в пробирках или небольших колбах, число которых должно соответствовать числу пробирок ряда, взятого для каждого штамма.
После разведения антибиотика из этих пробирок или колб по 1 мл среды вносят в соответствующие пробирки опыта, начиная с меньших концентраций препарата, и содержимое перемешивают.
9. Подготовка культур для исследования. В зависимости от вида микроорганизма для посева используют 16 - 18-часовую бульонную или агаровую культуру. В ряды пробирок или бактериологических чашек с питательной средой, содержащей соответствующие разведения антибиотиков, испытуемую культуру засевают мерной пипеткой или бактериологической петлей.
а) При определении чувствительности методом серийных разведений на жидкой питательной среде салмонелл, кишечных палочек, стафилококков, стрептококков и ряда других микроорганизмов используют агаровые культуры, которые смывают стерильным 0,9%-ным водным раствором натрия хлорида (изотонический раствор). По стандарту мутности определяют концентрацию микробных клеток в 1 мл, затем методом последовательных разведений получают концентрацию 1 млн. микробных клеток в 1 мл. Для этой цели разведение культур проводят в двух пробирках с питательной средой. В первую пробирку, содержащую 10 мл, вносят 0,1 мл культуры с концентрацией 1 млрд. микробных клеток в 1 мл, содержимое перемешивают и 1 мл переносят во вторую пробирку с 9 мл питательной среды, из которой по 0,2 мл высевают в каждую пробирку ряда и дополнительно на МПА без антибиотика для контроля чистоты культуры. Пробирку, из которой проводили посев, используют для контроля качества питательной среды. В рабочих пробирках концентрация культуры будет составлять 100 тыс. микробных клеток в 1 мл среды.
Примечание. При определении спектра действия новых антибиотиков используют концентрацию культуры 1000 микробных клеток в 1 мл питательной среды. Для выявления устойчивых штаммов берут 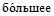 количество микробных клеток (100 тыс.), что увеличивает вероятность внесения в среду резистентных особей.
количество микробных клеток (100 тыс.), что увеличивает вероятность внесения в среду резистентных особей.
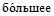 количество микробных клеток (100 тыс.), что увеличивает вероятность внесения в среду резистентных особей.
количество микробных клеток (100 тыс.), что увеличивает вероятность внесения в среду резистентных особей.б) При определении этим методом чувствительности возбудителей рожи, пастереллеза, листериоза используют культуры, выращенные на бульоне Хоттингера, которые перед посевом разводят 1:10 000. Это разведение получают последовательно в двух пробирках, содержащих по 10 мл питательной среды. В первую пробирку вносят 0,1 мл бульонной культуры, содержимое перемешивают и 0,1 мл переносят во вторую пробирку, из которой высевают по 0,2 мл в каждую пробирку ряда.
в) Определение чувствительности аэробных микроорганизмов в агаровой среде проводят в бактериологических чашках, дно которых предварительно делят на сегменты и номеруют по числу исследуемых культур (до 10 штаммов).
Испытуемые культуры засевают петлей - агаровые смывают и разводят до концентрации 500 млн. микробных клеток в 1 мл, бульонные культуры возбудителей рожи, пастереллеза и др. наносят на агар неразведенными. Перед посевом чашки подсушивают в термостате в течение 30 минут.
г) При определении чувствительности анаэробных микроорганизмов для засева среды с антибиотиком используют неразведенную суточную культуру, выращенную на обычной среде Китт-Тароцци с кусочками печени, которую вносят в количестве 0,2 мл на пробирку. Штаммы Клостридиум перфрингенс перед посевом разводят 1:100 в питательной среде.
10. Результаты определения чувствительности к антибиотикам аэробных и анаэробных бактерий учитывают визуально через 16 - 18 часов инкубации при 37°. Отмечают пробирку или чашку, в которой отсутствует рост. Показатель концентрации антибиотика в ней складывают с количеством антибиотика в последующей пробирке, где отмечен рост культуры, и выводят среднее арифметическое число, которое показывает чувствительность испытуемого штамма к антибиотику. Так, в пробирке с содержанием антибиотика 2,5 мкг 1 мл нет роста, а в следующей, где концентрация препарата 1,25 мкг/мл, установлен рост культуры, в этом случае бактериостатическая концентрация будет соответствовать 1,8 мкг/мл.
Если среда помутнела во всех пробирках, то это указывает, что испытуемый микроб устойчив к максимально взятой концентрации антибиотика. Отсутствие роста во всех пробирках свидетельствует о том, что чувствительность микроба выше использованной в опыте минимальной концентрации. Исследование повторяют с другими концентрациями антибиотика.
Примечание. Если рост культур отдельных видов микробов появляется в более поздние сроки (бруцеллы, туберкулезные палочки, вибрионы и др.), то и результаты по чувствительности учитывают в соответствии с особенностями их роста.
При оценке результатов определения чувствительности микробов к антибиотикам следует учитывать материал, из которого выделена культура.
Антибиотики | Концентрация (мкг, ЕД/мл) |
Пенициллин | Более 10 |
Эритромицин | " 10 |
Окситетрациклин | " 20 |
Хлортетрациклин | " 20 |
Тетрациклин | " 20 |
Неомицин (мицерин, колимицин) | " 20 |
Мономицин | " 50 |
Левомицетин | " 20 |
Стрептомицин | " 50 |
Полимиксин | " 50 |
В настоящее время патогенные микроорганизмы, выделенные из крови и паренхиматозных органов, считают резистентными в том случае, если рост их не подавляется антибиотиками в концентрациях, указанных в таблице.
Примечание. Чувствительность к антибиотикам микроорганизмов, выделенных из материала, взятого из ран, вымени, мочеполового тракта, может быть ниже, чем указано в таблице, поэтому выбор лекарственных форм антибиотиков должен соответствовать полученным показателям чувствительности.
11. Метод диффузии в агар с применением дисков, содержащих антибиотики.
а) Питательные среды:
2%-ный агар на мясо-пептонном бульоне;
2%-ный агар на переваре Хоттингера с содержанием 120 - 140 мг% аминного азота;
2%-ный МПА с добавлением 5% крови или сыворотки крови;
pH питательных сред 7,2 - 7,4.
Среду разливают по 20 мл в стерильные бактериологические чашки.
б) Исследуемые культуры, выращенные на агаровой среде, смывают стерильным 0,9%-ным водным раствором натрия хлорида и по бактериальному стандарту готовят одномиллиардную взвесь. На поверхность застывшей среды наливают 1 мл взвеси культуры и покачиванием чашки равномерно распределяют ее по всей поверхности. Излишек жидкости отсасывают пипеткой. Чашки подсушивают при 37° в течение 15 - 30 минут.
в) Диски раскладывают стерильным пинцетом на расстоянии 2 см от края чашки и слегка прижимают к агару. После окончания наложения дисков с одним антибиотиком пинцет протирают тампоном, смоченным этиловым спиртом, обжигают и приступают к раскладыванию дисков с другим антибиотиком. Каждая чашка может служить для испытания активности 4 - 5 антибиотиков.
Нельзя допускать длительные интервалы (более 45 минут) между посевом культуры и наложением дисков.
Чашки с дисками для лучшей диффузии антибиотика в агар выдерживают в течение 2 часов при комнатной температуре (не выше 20°), а затем помещают в термостат при температуре 37° вверх дном.
Стандартные диски с антибиотиками, выпускаемые заводами медицинской промышленности, хранят в закрытых флаконах, в сухом месте при комнатной температуре, срок годности указан на этикетке.
г) Результаты учитывают через 16 - 18 часов с помощью линейки или миллиметровой бумаги. Определяют диаметр зон задержки роста микробов вокруг бумажных дисков, включая и диаметр дисков. При диаметре зон в 15 - 25 мм микробы следует считать чувствительными к антибиотикам. При зонах величиной до 15 мм - микробы малочувствительны. Отсутствие зон задержки роста указывает на то, что исследуемая культура не чувствительна к данному антибиотику.
12. При установлении резистентных культур возбудителей инфекционных болезней животных к применяемым в хозяйстве антибиотикам следует немедленно эти препараты заменять другими лечебными средствами.
В МПБ (pH 7,2 - 7,4)
Антибиотики | Чувствительность мкг, ЕД/мл | |
Staph. aureus 209 P | Пенициллин | 0,02 - 0,04 |
" " | Эритромицин | 0,03 - 0,06 |
" " | Олеандомицин | 0,04 - 0,09 |
" " | Тетрациклины | 0,2 - 0,6 |
" " | Стрептомицин | 0,2 - 0,4 |
Bac. subtilis | Тетрациклины | 0,02 - 0,04 |
" " | Левомицетин | 0,2 - 0,9 |
" " | Мономицин | 0,05 - 0,1 |
" " | Стрептомицин | 0,04 - 0,08 |
" " | Неомицин | 0,02 - 0,04 |
Примечание. Иные результаты по чувствительности эталонных штаммов указывают на нарушения, допущенные в работе.
Готовят два исходных раствора из перекристаллизованных солей: однозамещенного фосфата калия (KH2PO4) и двузамещенного фосфата калия (K2HPO4).
Соответствующие навески солей (каждой отдельно) растворяют в 1000 мл прокипяченной или стерильной дистиллированной воды. Для получения pH буфера приготовленные исходные растворы соединяют в определенных объемных отношениях, указанных в таблице.
pH фосфатного буфера | Количество соли в 1 л исходного раствора в г | Соотношение объемов (мл) смешиваемых исходных растворов | ||
K2HPO4 | KH2PO4 | K2HPO4 | KH2PO4 | |
6,0 - 6,2 | 4 | 16 | 1 | 1 |
6,8 - 7,0 | 11,612 | 9,073 | 6,1 | 3,9 |
7,8 - 8,0 | 11,612 | 9,073 | 9,5 | 0,5 |
Буферные растворы стерилизуют в автоклаве при давлении 0,5 атм. (110 - 112°) в течение 30 минут.
ПО ЧУВСТВИТЕЛЬНОСТИ К АНТИБИОТИКАМ МИКРООРГАНИЗМОВ,
ПАТОГЕННЫХ ДЛЯ ЖИВОТНЫХ И ПТИЦ НА 1971 Г. (ЕД, МКГ/МЛ)
Микробы | Пенициллин | Эритромицин | Олеандомицин | Тетрациклины | Левомицетин | Стрептомицин | Неомицин, мицерин, колимицин | Мономицин | Полимиксин |
Erysipeloth. insidiosa | 0,01 - 0,1 | 0,02 - 0,04 | 0,1 - 0,4 | 0,04 - 3,0 | 0,4 - 5,0 | 0,2 - 7,5 | 0,4 - 2,0 | 2,0 - 50 | > 750 |
Past. multocida | 0,02 - 0,2 | 0,07 - 3,0 | 2,0 - 10 | 0,06 - 0,8 | 0,1 - 0,9 | 1,8 - 10 | 0,9 - 5,0 | 0,4 - 4,6 | 1,5 - 5,0 |
Listeria monocytogenes | 0,1 - 0,9 | 0,02 - 0,5 | 0,5 - 1,0 | 0,2 - 5,0 | 1,0 - 5,0 | 0,5 - 15 | 0,5 - 2,5 | 0,7 - 3,0 | 37 - > 50 |
Streptococcus equi | 0,01 - 0,03 | 0,02 - 0,03 | 0,1 - 2,5 | 0,5 - 0,8 | 1,0 - 5,0 | 1,2 - 3,0 | 0,4 - 2,5 | 0,8 - 10 | 9,0 - 18 |
Bac. anthracis | 0,1 - 1,0 | 0,1 - 5,0 | 0,5 - 5,0 | 0,2 - 5,0 | 0,5 - 5,0 | 0,2 - 7,5 | 0,1 - 5,0 | > 100 | > 50 |
Brucella abortus | 0,15 - 6,0 | 0,3 - 2,5 | 1,5 - > 100 | 0,1 - 7,0 | 1,0 - 7,0 | 0,5 - 5,0 | 0,5 - 10 | 1,3 - 3,0 | 0,5 - 5,0 |
Vibrio fetus | 0,1 - 3,0 | 0,2 - 5,0 | 2,0 - 9,0 | 0,02 - 0,5 | 0,3 - 3,0 | 1,5 - 10 | 1,0 - 10 | 2,0 - 10 | 30 - 150 |
Salm. pullorum | 2,3 - 18,6 | 50 - 200 | > 100 | 0,2 - 3,7 | 0,3 - 5,0 | 2,5 - 18 | 0,5 - 4,0 | 0,5 - 2,3 | 0,2 - 3,7 |
S. cholerae suis | 4,6 - 50 | 50 - 200 | > 100 | 0,4 - 15 | 0,9 - 7,5 | 9,0 - 75 | 1,0 - 4,0 | 2,3 - 9,3 | 0,6 - 3,7 |
S. dublin | 4,6 - 50 | 50 - 200 | > 100 | 0,4 - 7,5 | 0,9 - 7,5 | 9,0 - 37 | 0,1 - 5,0 | 4,7 - 9,3 | 0,4 - 3,7 |
S. typhi murium | 9,3 - 50 | 50 - 200 | > 100 | 0,4 - 15 | 0,9 - 7,5 | 9,0 - 37 | 1,0 - 4,0 | 2,3 - 9,3 | 0,2 - 3,7 |
S. abortus ovis | 4,7 - 18 | 50 - 200 | > 100 | 0,4 - 3,7 | 0,5 - 5,0 | 9,0 - 20 | 0,5 - 2,0 | 2,3 - 9,3 | 0,2 - 0,9 |
E. coli | 10 - 100 | 25 - 100 | > 100 | 0,4 - 5,0 | 0,5 - 10 | 3,0 - 25 | 1,0 - 15 | 3,0 - 18 | 0,5 - 5,0 |
Proteus vulgaris | 2,5 - > 100 | > 100 | > 100 | > 450 | 8 - > 250 | 1,0 - 50 | 5,0 - 15 | 3,0 - 25 | > 700 |
Cl. perfringens | 0,07 - 1,0 | 0,4 - 4,0 | 0,5 - 6,0 | 0,2 - 10 | 1,0 - 10 | 50 - 500 | 50 - 500 | > 500 | > 50 тыс. |
Cl. septicum | 0,02 - 0,2 | 0,04 - 0,3 | 0,01 - 2,0 | 0,1 - 0,8 | 0,4 - 10 | 10 - 100 | 10 - 100 | 10 - 150 | > 50 тыс. |
Cl. chauvoei | 0,01 - 0,2 | 0,01 - 0,2 | 0,03 - 0,4 | 0,02 - 0,5 | 0,1 - 5,0 | 4 - 50 | 4 - 20 | 4 - 50 | > 50 тыс. |
Cl. oedematiens | 0,01 - 0,1 | 0,02 - 0,2 | 0,1 - 0,9 | 0,09 - 0,5 | 0,4 - 7,5 | 7 - 100 | 7 - 100 | 10 - 150 | >= 50 тыс. |
B. necrophorus | 0,02 - 0,1 | 0,02 - 2,0 | 0,2 - 5,0 | 0,02 - 1,0 | 0,2 - 5,0 | 18 - 35 | 18 - 100 | 20 - 120 | - |