Скачать ГОСТ ISO 10993-11-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 11. Исследования общетоксического действия
Дата актуализации: 01.01.2021

 ГОСТ ISO 10993-11-2011
ГОСТ ISO 10993-11-2011
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 11. Исследования общетоксического действия
| Обозначение: |  ГОСТ ISO 10993-11-2011 ГОСТ ISO 10993-11-2011 |
| Обозначение англ: |  10993-11-2011 10993-11-2011 |
| Статус: | введен впервые |
| Название рус.: | Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 11. Исследования общетоксического действия |
| Название англ.: | Medical devices. Biological evaluation of medical devices. Part 11. Tests for systemic toxicity |
| Дата добавления в базу: | 01.10.2014 |
| Дата актуализации: | 01.01.2021 |
| Дата введения: | 01.01.2013 |
| Область применения: | Стандарт устанавливает требования и дает рекомендации по процедурам, необходимым для оценки потенциального общетоксического действия химических компонентов, мигрирующих в организм из медицинских изделий. Стандарт распространяется на оценку конечного продукта и компонентов его вымывания. Исследования экстрактов из изделия или продуктов вымывания следует проводить с использованием модельной среды, которая обеспечивает максимальную экстракцию продуктов вымывания для дальнейшего биологического исследования. |
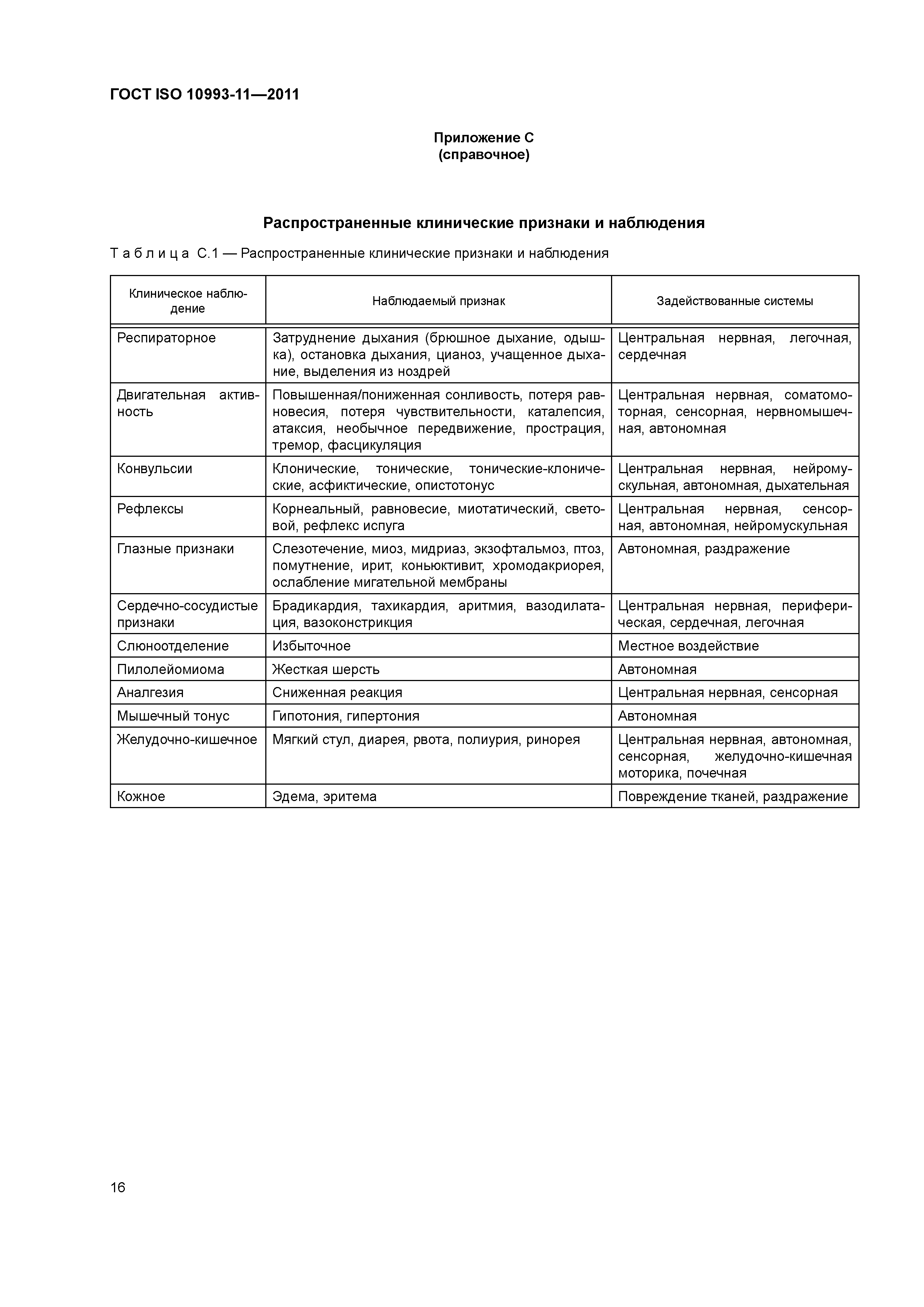
| Оглавление: | 1 Область применения 2 Нормативные ссылки 3 Термины и определения 4 Основные требования 4.1 Общие положения 4.2 Выбор вида животных 4.3 Статус животных 4.4 Уход и содержание животных 4.5 Размер и число групп 4.6 Путь введения 4.7 Подготовка образца 4.8 Дозирование 4.9 Масса тела и потребление пищи/воды 4.10 Клинические наблюдения 4.11 Клиническая патология 4.12 Патологоанатомические исследования 4.13 Планирование исследований 4.14 Качество исследований 5 Острая системная токсичность 5.1 Общие положения 5.2 Планирование исследования 5.3 Критерии оценки 5.4 Заключительный отчет 6 Системная токсичность многократного введения (подострая, субхроническая и хроническая системная токсичность 6.1 Общие положения 6.2 Планирование исследования 6.3 Критерии оценки 6.4 Заключительный отчет Приложение А (справочное) Пути введения Приложение В (справочное) Объемы дозирования Приложение С (справочное) Распространенные клинические признаки и наблюдения Приложение D (справочное) Рекомендуемые параметры гематологии, клинической химии и анализа мочи Приложение Е (справочное) Список рекомендуемых органов для гистопатологической оценки Приложение F (справочное) Информация по пирогенам, опосредованным материалом Приложение ДА (справочное) Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам Библиография |
| Разработан: | ФГУП ВНИИНМАШ |
| Утверждён: | 29.11.2011 Межгосударственный Совет по стандартизации, метрологии и сертификации (Inter-Governmental Council on Standardization, Metrology, and Certification 40) 13.12.2011 Федеральное агентство по техническому регулированию и метрологии (1327-ст) |
| Издан: | Стандартинформ (2014 г. ) |
| Нормативные ссылки: |



























 ГОСТ ISO 10993-12-2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и контрольные образцы»
ГОСТ ISO 10993-12-2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и контрольные образцы»