Скачать ГОСТ ISO 11135-2017 Стерилизация медицинской продукции. Этиленоксид. Требования к разработке, валидации и текущему управлению процессом стерилизации медицинских изделий
Дата актуализации: 01.01.2021

 ГОСТ ISO 11135-2017
ГОСТ ISO 11135-2017
Стерилизация медицинской продукции. Этиленоксид. Требования к разработке, валидации и текущему управлению процессом стерилизации медицинских изделий
| Обозначение: |  ГОСТ ISO 11135-2017 ГОСТ ISO 11135-2017 |
| Обозначение англ: |  11135-2017 11135-2017 |
| Статус: | взамен |
| Название рус.: | Стерилизация медицинской продукции. Этиленоксид. Требования к разработке, валидации и текущему управлению процессом стерилизации медицинских изделий |
| Название англ.: | Sterilization of health-care products. Ethylene oxide. Requirements for the development, validation and routine control of a sterilization process for medical devices |
| Дата добавления в базу: | 01.01.2018 |
| Дата актуализации: | 01.01.2021 |
| Дата введения: | 01.09.2018 |
| Область применения: | Стандарт устанавливает требования к разработке, валидации и текущему контролю процесса этиленоксидной стерилизации медицинских изделий как в промышленности, так и в учреждениях здравоохранения и учитывает сходные и различающиеся черты этих двух областей применения. Стандарт не устанавливает требования к разработке, валидации и рутинному контролю процесса инактивации возбудителей спонгиоформных энцефалопатий, таких как cкрепи, коровья губчатая энцефалопатия и болезнь Крейтцфельда - Якоба. Конкретные рекомендации были разработаны в отдельных странах для обработки материалов, потенциально загрязненных такими возбудителями. Стандарт не детализирует специфическое требование к обозначению медицинского изделия как «стерильного». Стандарт не устанавливает систему менеджмента качества для управления всех стадий производства медицинских изделий. Стандарт не устанавливает требования к охране труда, связанные с проектированием и эксплуатацией предприятий, занимающихся ЭО-стерилизацией. Стандарт не распространяется на стерилизацию инжекцией ЭО или его смесей непосредственно в упаковки или в гибкие камеры. Стандарт не рассматривает аналитические методы для определения уровней остаточного ЭО и/или продуктов его реакции. |
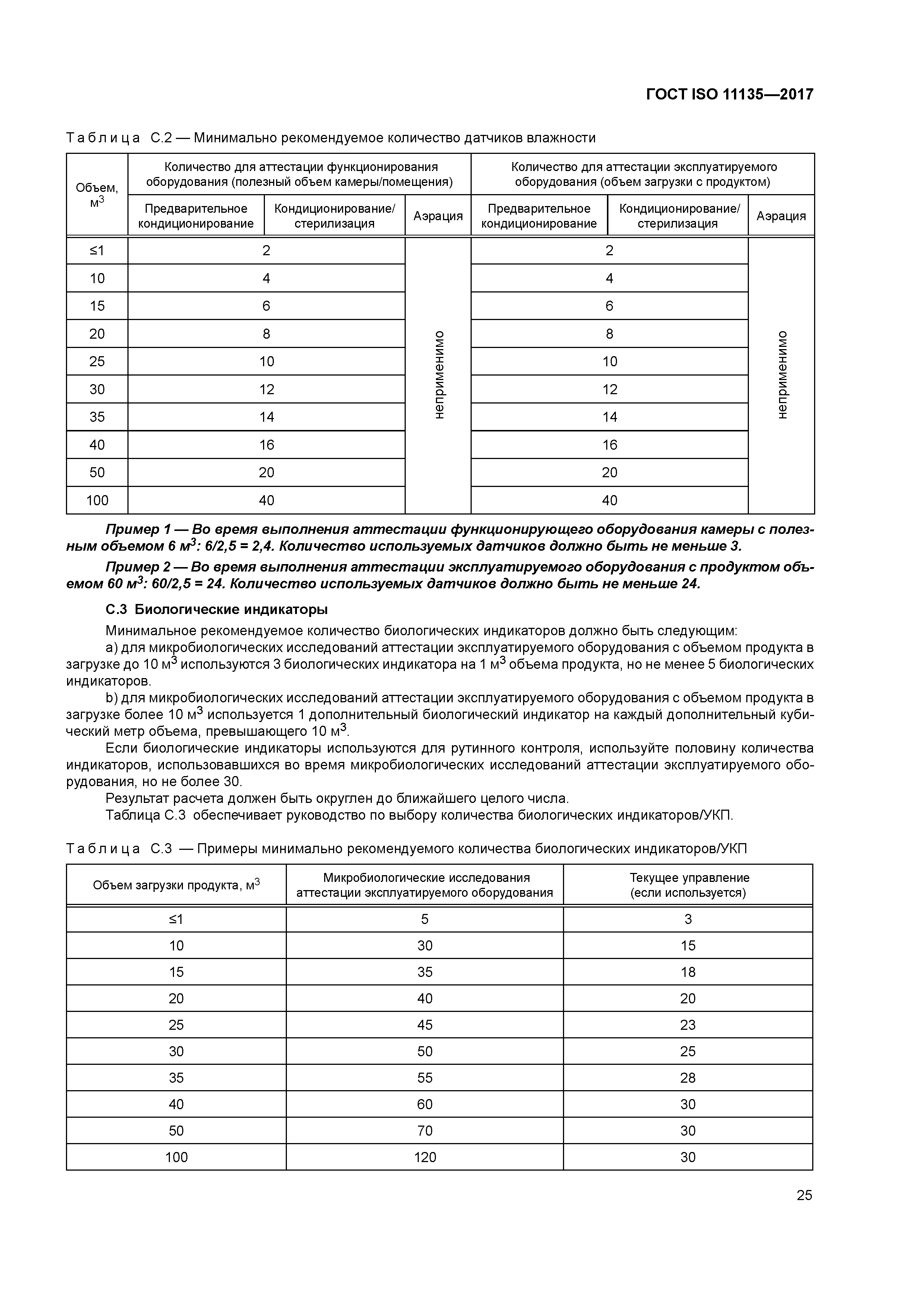
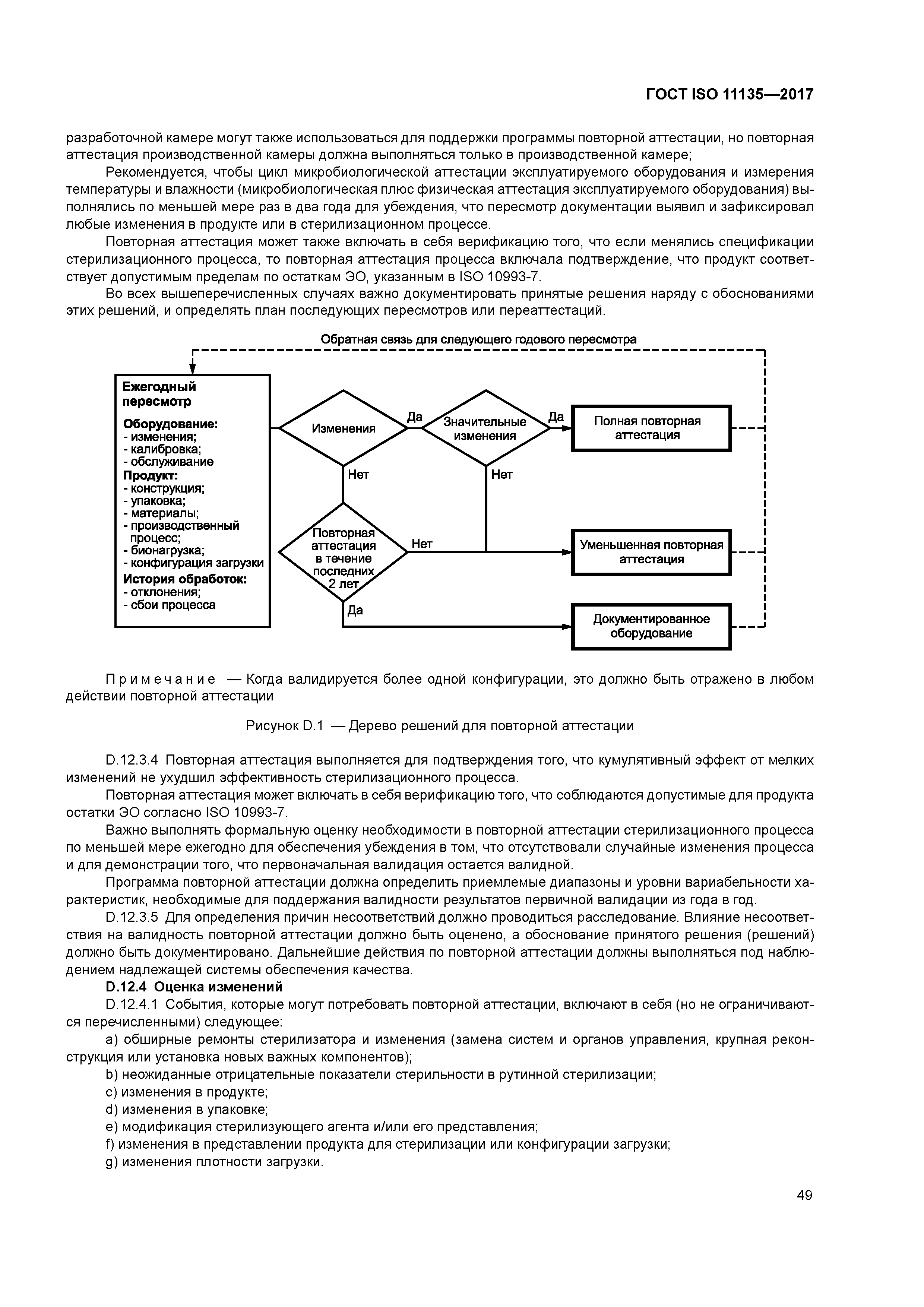
| Оглавление: | 1 Область применения 1.1 Охват 1.2 Исключения 2 Нормативные ссылки 3 Термины и определения 4 Системы менеджмента качества 4.1 документирование 4.2 Ответственность руководства 4.3 Выпуск продукции 4.4 Измерение, анализ и улучшение. Управление несоответствующей продукцией 5 Характеризация стерилизующего агента 5.1 Общие требования 5.2 Стерилизующий агент 5.3 Микробоцидная эффективность 5.4 Воздействие на материалы 5.5 Безопасность и окружающая среда 6 Характеризация процесса и оборудования 6.1 Общие требования 6.2 Характеризация процесса 6.3 Характеризация оборудования 7 Определение продукта 7.1 Общая информация 7.2 Безопасность продукта, качество и характеристики 7.3 Микробиологическое качество 7.4 Документирование 8 Определение процесса 9 Валидация 9.1 Общая информация 9.2 Аттестация установленного оборудования (IQ) 9.3 Аттестация функционирующего оборудования (OQ) 9.4 Аттестация эксплуатируемого оборудования (PQ) 9.5 Рассмотрение (анализ) и утверждение результатов валидации 10 Рутинный мониторинг и управление 11 Выпуск продукта после стерилизации 12 Поддержание эффективности процесса 12.1 Общая информация 12.2 Обслуживание оборудования 12.3 Повторная аттестация 12.4 Оценка изменений 12.5 Оценка эквивалентности процесса Приложение А (обязательное) Определение степени летальности стерилизационного процесса — подход с использованием биологического индикатора/биологической нагрузки Приложение В (обязательное) Консервативное определение уровня летальности стерилизационного процесса — подход «массовой гибели» Приложение С (справочное) Датчики температуры, относительной влажности и количество биологических индикаторов Приложение D (справочное) Руководство по применению нормативных требований Приложение Е (обязательное) Выпуск единичного лота Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов межгосударственным стандартам Библиография |
| Разработан: | ООО ФАРМСТЕР |
| Утверждён: | 01.06.2017 Межгосударственный Совет по стандартизации, метрологии и сертификации (Inter-Governmental Council on Standardization, Metrology, and Certification 51) 22.08.2017 Федеральное агентство по техническому регулированию и метрологии (938-ст) |
| Издан: | Стандартинформ (2017 г. ) |
| Заменяет собой: | |
| Нормативные ссылки: |
|



































































 ГОСТ ISO 11135-2012 «Медицинские изделия. Валидация и текущий контроль стерилизации оксидом этилена»
ГОСТ ISO 11135-2012 «Медицинские изделия. Валидация и текущий контроль стерилизации оксидом этилена»