Государственное
санитарно-эпидемиологическое нормирование
Российской Федерации
Федеральная служба по надзору в сфере защиты прав
потребителей
и благополучия человека
3.1. ЭПИДЕМИОЛОГИЯ. ПРОФИЛАКТИКА
ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
Порядок организации и проведения индикации
патогенных биологических агентов, в том числе
неустановленного систематического положения
Методические рекомендации
МР 3.1.0129-18
Москва 2019
1. Разработаны Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Е.Б. Ежлова, Ю.В. Демина, Н.Д. Пакскина, З.М. Омариев), Федеральным казенным учреждением здравоохранения «Российский научно-исследовательский противочумный институт «Микроб» Роспотребнадзора (И.Н. Шарова, Е.С. Казакова, С.А. Щербакова, Т.Ю. Красовская, В.Е. Куклев, С.А. Портенко, Н.А. Осина, А.С. Абдрашитова, И.А. Касьян, И.Г. Карнаухов, О.В. Кедрова, В.В. Кутырев), Федеральным казенным учреждением здравоохранения «Ставропольский научно-исследовательский противочумный институт» Роспотребнадзора (А.Н. Куличенко, О.В. Малецкая, А.Г. Рязанова, А.С. Волынкина), Федеральным казенным учреждением здравоохранения «Ростовский-на-Дону научно-исследовательский противочумный институт» Роспотребнадзора (С.В. Титова, О.С. Чемисова, Э.А. Москвитина, Л.Л. Трухачев, Н.В. Павлович, С.О. Водопьянов, А.С. Водопьянов, А.Б. Мазрухо, Р.В. Писанов), Федеральным казенным учреждением здравоохранения «Иркутский научно-исследовательский противочумный институт» Роспотребнадзора (С.В. Балахонов, О.Д. Захлебная, Л.В. Миронова, А.К. Носков, М.Ю. Шестопалов), Федеральным казенным учреждением здравоохранения «Волгоградский научно-исследовательский противочумный институт» Роспотребнадзора (Г.А. Ткаченко, Н.П. Храпова, И.Б. Захарова, Л.В. Лемасова, Ю.А. Кузютина, А.М. Маркин, Т.Н. Шаров, И.М. Шпак, Д.В. Викторов, А.В. Топорков), Федеральным бюджетным учреждением науки Государственный научный центр прикладной микробиологии и биотехнологии Роспотребнадзора (И.А. Дятлов, М.В. Храмов, Е.А. Тюрин, Л.В. Чекан, Г.А. Богун, A.А. Кисличкина), Федеральным бюджетным учреждением науки Государственный научный центр вирусологии и биотехнологии «Вектор» (Р.А. Максютов, О.В. Пьянков, С.А. Боднев, В.В. Золин, О.П. Оськина, В.А. Терновой, Е.В. Гаврилова, А.П. Агафонов), Федеральным казенным учреждением здравоохранения «Противочумный центр» Роспотребнадзора (А.А. Лопатин, С.М. Иванова, В.Е. Безсмертный), Федеральным бюджетным учреждением здравоохранения «Федеральный Центр гигиены и эпидемиологии» Роспотребнадзора (В.Ю. Ананьев, B.В. Мордвинова).
2. Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации А.Ю. Поповой 31 мая 2018 г.
3. Введены впервые.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Руководитель Федеральной службы _______________________ А.Ю. Попова 31 мая 2018 г. |
3.1.
ЭПИДЕМИОЛОГИЯ. ПРОФИЛАКТИКА
ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
Порядок организации и проведения индикации
патогенных биологических агентов, в том числе
неустановленного систематического положения
Методические рекомендации
МР 3.1.0129-18
I. Область применения
1.1. Настоящие методические рекомендации определяют порядок организации индикации патогенных биологических агентов, в том числе неустановленного систематического положения (неизвестного ПБА), в Центрах индикации возбудителей инфекционных болезней I - II групп патогенности и обеспечения противоэпидемической готовности на базе противочумных учреждений (далее - Центр индикации), Опорных баз Центров индикации возбудителей инфекционных болезней I - II групп патогенности ФБУЗ «Центр гигиены и эпидемиологии» в субъектах Российской Федерации (далее - Опорная база Центра индикации) и лабораториях мобильного комплекса специализированной противоэпидемической бригады (далее - МК СПЭБ) Роспотребнадзора, функционирующих на базе ФКУЗ «Противочумный институт» Роспотребнадзора.
1.2. Методические рекомендации определяют основные принципы индикации и лабораторной диагностики инфекционных болезней с тяжелым клиническим течением и (или) неясной клинической картиной, возбудителями которых могут быть в том числе и микроорганизмы неустановленного систематического положения (новые, ранее не известные, атипичные), схему лабораторной диагностики, номенклатуру и объем исследований, требования биологической безопасности при проведении работ.
1.3. Методические рекомендации предназначены для специалистов органов и учреждении Роспотребнадзора, научных и медицинских организаций.
II. Общие положения
2.1. Задачи и функции Центра индикации определены приказом Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека от 01.12.2017 № 1116 «О совершенствовании системы мониторинга, лабораторной диагностики инфекционных и паразитарных болезней и индикации ПБА в Российской Федерации», задачи и функции СПЭБ определены приказом Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека от 24.03.2015 № 231 «О деятельности специализированных противоэпидемических бригад, сформированных на базе противочумных институтов Роспотребнадзора».
Установление этиологических факторов опасных инфекционных болезней бактериальной, вирусной, микотической и риккетсиозной природы, болезней с тяжелым клиническим течением и (или) неясной клинической картиной, возбудителями которых могут быть микроорганизмы неустановленного систематического положения а также индикация ПБА в случае преднамеренного применения может осуществляется в лабораториях Центра индикации, Опорных баз Центра индикации и МК СПЭБ.
2.2. Для выявления и дифференциации этиологических факторов болезни используют подходы, изложенные в методических указаниях «Порядок эпидемиологической и лабораторной диагностики особо опасных, «новых» и «возвращающихся» инфекционных болезней».
Наличие одной из известных инфекционных болезней можно заподозрить на основании проведения клинико-эпидемиологической диагностики, алгоритм которой изложен в вышеуказанном методическом документе. Если предварительный диагноз поставить не удается, то проводится исследование материала на наличие ПБА неустановленного систематического положения. Поскольку в этом случае при проведении лабораторного исследования необходимо исключение всех известных на текущий момент возбудителей инфекционных болезней, то используют синдромный подход, предложенный ВОЗ (Руководство по сбору клинических образцов во время полевых расследований вспышек. WHO/CDS/CSR/EDC/2000.4).
Основными клиническими синдромами болезней являются: синдром острой диареи, синдром острой геморрагической лихорадки, острый желтушный синдром, острый неврологический синдром, острый респираторный синдром, острый дерматологический синдром, острый офтальмологический синдром, острый «системный» синдром. Для каждого из вышеуказанных острых синдромов существует перечень инфекционных болезней различной этиологии, для которых данный синдром может являться ведущим. В то же время, многие инфекционные болезни имеют не одну, а несколько клинических форм, каждая из которых характеризуется определенным синдромом. Наличие у больного одного из вышеуказанных синдромов при отсутствии известных предрасполагающих факторов служит основанием для проведения лабораторного исследования с целью подтверждения или исключения, прежде всего, возбудителей известных инфекционных болезней, которые характеризуются данным синдромом.
В случае отрицательных результатов лабораторных исследований на известные возбудители, требуется дальнейшее проведение исследований с целью выявления ПБА неустановленного систематического положения.
III. Порядок организации
и проведения работ в лабораториях
Центров индикации, Опорных баз Центров индикации и
лабораториях МК СПЭБ
3.1. Номенклатура и объем исследований
3.1.1. В лабораториях Центров индикации осуществляют индикацию возбудителей опасных инфекционных болезней бактериальной, вирусной, паразитарной, микотической и риккетсиозной природы I - IV групп патогенности, выделение и идентификацию культур микроорганизмов возбудителей инфекционных болезней бактериальной природы I - IV групп патогенности и вирусной природы II - IV групп патогенности для решения следующих задач:
- установления этиологического фактора инфекционного заболевания в целях предупреждения или ликвидации последствий чрезвычайных ситуаций, предупреждения завоза и распространения опасных инфекционных болезней на территории субъектов Российской Федерации;
- установления этиологического фактора опасных инфекционных болезней бактериальной и вирусной природы с тяжелым клиническим течением и (или) неясной клинической картиной, возбудителями которых могут быть микроорганизмы неустановленного систематического положения.
3.1.2. В лабораториях Опорных баз Центров индикации, а также лабораториях МК СПЭБ специалисты противочумных учреждений осуществляют индикацию возбудителей опасных инфекционных болезней бактериальной, вирусной, паразитарной, микотической и риккетсиозной природы I - IV групп патогенности, для установления этиологического фактора инфекционного заболевания в целях предупреждения или ликвидации последствий чрезвычайных ситуаций, предупреждения завоза и распространения опасных инфекционных болезней на территории субъектов Российской Федерации.
3.1.3. Для выделения вирусов I - II группы патогенности, специалисты Центра индикации, Опорной базы Центра индикации или СПЭБ обеспечивают (по согласованию с Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека) передачу материала в Референс-центры по мониторингу или лабораторной диагностике особо опасных вирусных инфекционных болезней (ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора, ФГУ «48 ЦНИИ МО РФ»). Для проведения вирусологических исследований с целью выделения культуры вирусов III - IV группы патогенности - в Референс-центры, определенные приказом Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека от 01.12.2017 № 1116 «О совершенствовании системы мониторинга, лабораторной диагностики инфекционных и паразитарных болезней и индикации ПБА в Российской Федерации». Транспортировку проб осуществляют в соответствии с действующими санитарно-эпидемиологическими правилами по порядку учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности.
3.2. Основные принципы индикации и лабораторной диагностики
3.2.1. Основным принципом индикации и лабораторной диагностики является использование единой комплексной схемы анализа (приложение 2), предусматривающей на первом этапе последовательное выявление или исключение маркеров:
- вирусов I - II группы патогенности;
- бактерий I - II групп патогенности;
- микромицетов II группы патогенности;
- известных возбудителей инфекционных болезней, обусловливающих определенный синдром.
На втором этапе - выделение и идентификацию культур возбудителей неустановленного систематического положения.
3.2.2. Использование единых методов исследования при проведении индикации ПБА и лабораторной диагностики инфекционных болезней.
3.2.3. Принцип двухэтапного исследования материала (нативного и после биологического накопления) после исключения наличия маркеров вирусов I - II группы патогенности с использованием методов экспресс-анализа, ускоренной диагностики.
3.2.4. Использование единой схемы передачи информации о результатах индикации.
3.2.5. Использование для проведения лабораторных исследований диагностических препаратов, разрешенных к применению в установленном порядке, при их отсутствии - коммерческие незарегистрированные препараты, экспериментальные производственные серии.
3.2.6. Целесообразно одновременное (параллельное) использование двух - трех методов (ПЦР и МФА; МФА и РИГА; МФА и ИФА и т.д.) для получения наиболее достоверных результатов.
3.2.7. При отсутствии возможности использования двух методов допускается подтверждение результатов индикации с использованием препаратов разных производителей (серий) или направленных на выявление различных мишеней.
3.3. Схема индикации и лабораторной диагностики
3.3.1. В соответствии с единой схемой индикации ПБА предусмотрены следующие этапы:
- прием, сортировка и регистрация проб;
- первичная обработка проб и подготовка их к исследованию;
- исследование проб нативного материала с помощью комплекса методов МФА, ПЦР, ИФА.
3.3.2. При обнаружении в исследуемом нативном материале маркеров вирусов I группы патогенности - ДНК/РНК, антигены, антитела класса М, дальнейшую работу с материалом прекращают. Все пробы упаковывают в строгом соответствии с требованиями в соответствии с действующими санитарно-эпидемиологическими правилами по порядку учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности.
3.3.3. Индикацию и идентификацию возбудителей опасных инфекционных болезней вирусной природы при исследовании проб клинического материала и объектов окружающей среды осуществляют с помощью следующих методов:
- экспресс-диагностика (МФА, ИХА);
- ускоренная диагностика (ПЦР, ИФА, серологические реакции);
- выделение вируса на чувствительной биологической модели (выделение вирусов I группы патогенности и неустановленного систематического положения проводят в учреждениях, имеющих разрешение на деятельность, связанную с накоплением возбудителей особо опасных вирусных инфекционных болезней (ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора, ФГУ «48 ЦНИИ МО РФ»),
3.3.3.1. При невозможности установления возбудителя заболевания с использованием существующих ПЦР тест-систем используют дополнительно электронную микроскопию и молекулярно-генетические методы (в том числе секвенирование отдельных фрагментов и полногеномное секвенирование).
3.3.3.2. Для выделения, идентификации возбудителя и определения его вирулентных свойств осуществляют заражение перевиваемых культур клеток (Vero, СПЭВ), РКЭ и биопробных животных (новорожденные белые мыши-сосунки).
3.3.3.3. При выделении вируса с неизвестными ранее свойствами и невозможности его систематизировать по результатам секвенирования (нуклеотидной последовательности генома) составляют паспорт штамма с указанием всех полученных характеристик.
3.3.4. При выявлении в материале генетических маркеров вирусов II - III группы патогенности (вирусов денге, желтой лихорадки и других флавивирусов, вируса лихорадки Рифт-Валли, ККГЛ, хантавирусов, вызывающих геморрагический синдром, и др.) аликвоты проб направляют по согласованию в Референс-центры по соответствующей нозологии для дальнейших вирусологических исследований.
3.3.5. При отсутствии в исследуемом материале маркеров вирусов I - II группы патогенности - ДНК/РНК, антигены, антитела класса М, проводят исследования с использованием бактериологического и биологического методов.
3.3.6. Биологическое накопление предусматривает посев исследуемого материала на питательные среды и заражение биопробных животных (возможно заражение биопробных животных с искусственно сниженной резистентностью).
3.3.7. С целью выделения культуры патогена проводят посев на комплекс питательных сред (дифференциально-диагностических и селективных).
3.3.8. После биологического обогащения проводят исследование проб методами МФА, ПЦР, ИФА, ИХА для детекции маркеров возбудителей инфекционных болезней бактериальной этиологии.
3.3.9. При необходимости осуществляют постановку биологической пробы на токсины - заражение белых мышей.
3.3.10. Идентификация выделенных культур:
- идентификацию культур возбудителей опасных бактериальных инфекционных болезней осуществляют в соответствии с нормативно-методическими документами для каждого вида возбудителя;
- идентификацию культур возбудителей неустановленного систематического положения осуществляют с использованием расширенного спектра методов, включая морфометрический, молекулярно-генетический, масс-спектрометрический и другие виды анализа;
- идентификация выделенных вирусов проводится электронно-микроскопическими, иммунологическими и молекулярно-генетическими методами.
3.3.11. При выделении культуры микроорганизма, предположительно являющегося этиологическим агентом Болезни или агентом при преднамеренном применении ПБА, определяют его чувствительность к антибактериальным препаратам, при необходимости проводят фрагментарное или полногеномное секвенирование.
3.4. Характеристика методов индикации и
идентификации,
используемых в лабораториях Центров индикации, Опорных баз
Центров индикации и лабораториях МК СПЭБ
3.4.1. Обязательными методами индикации являются МФА, ПЦР, ИФА и РИГА.
МФА - сочетает иммунологическое и морфологическое исследование с люминесцентным анализом. МФА отличается высокой специфичностью. Чувствительность составляет 5×105 м. к./мл пробы. В лабораториях Центров индикации и их Опорных баз, в том числе лабораториях МК СПЭБ при проведении индикации используют прямой метод флуоресцирующих антител с контрастированием неспецифического свечения альбумином, меченным производными родамина. Непрямые модификации используются для идентификации культур возбудителей.
3.4.2. ПЦР - метод многократного избирательного копирования определенного участка ДНК при помощи ферментов в условиях in vitro. ПЦР позволяет детектировать фрагменты генома бактериальных, микотических и вирусных патогенных биологических агентов, в том числе с измененными фенотипическими свойствами, труднокультивируемые, некультивируемые и др. ПЦР отличает высокая чувствительность 1×103 - 1×104 м. к./мл и специфичность. Для проведения анализа с помощью данного подхода не требуется предварительное культивирование исследуемого материала.
3.4.3. ИФА - метод позволяет выявлять как антигены, так и антитела к возбудителям инфекционных болезней, а также определять соотношение IgG и IgM, авидность IgG, что дает возможность дифференциации острой и хронической форм заболевания, характеризуется высокой чувствительностью (1×104 - 1×105 м. к./мл), специфичностью и экспрессностью.
3.4.4. РИГА - метод позволяет выявлять как антигены, так и антитела к возбудителям инфекционных болезней. Постановку реакции осуществляют с использованием эритроцитарных коммерческих иммуноглобулиновых диагностикумов. Чувствительность РНГА (РАО) 1×105 - 1×106 м. к./мл пробы (0,5 мкг токсинов).
3.4.5. ИХА - (экспресс-диагностика ПБА) основан на принципе вертикально направленной иммунохроматографии и предназначен для выявления специфических иммуноглобулинов или антигенов возбудителей.
3.4.6. Полный бактериологический анализ - выделение, идентификация культуры возбудителя с использованием всего комплекса методов (расширенная характеристика ПБА) включает определение:
- культуральных свойств;
- тинкториальных свойств;
- биохимической активности;
- антигенных свойств;
- вирулентности и токсигенности;
- чувствительности к антибактериальным препаратам.
Для выделения культур возбудителей инфекционных болезней используют: универсальные среды - для культивирования широкого спектра микроорганизмов и высокопитательные среды с витаминными добавками - для труднокультивируемых. Селективные среды применяют для выделения возбудителя из материала, содержащего сопутствующую микрофлору.
3.4.7. Масс-спектрометрия (МС) - метод идентификации микроорганизмов, основанный на получении информации о структуре и молекулярном весе биомолекул (рибосомальные и др. белки, пептиды, олигонуклеотиды), за счет измерения отношения массы заряженных частиц вещества к их заряду. МС-технологии, позволяющие получать уникальные для каждого вида ПБА масс-спектры, характеризуются высокой специфичностью, чувствительностью, скоростью анализа. Для идентификации микроорганизмов используют базы данных характеристических масс-спектров (действующие и/или постоянно обновляющиеся).
3.4.8. Фрагментарное секвенирование - метод определения нуклеотидной последовательности участков генома микроорганизмов. Для идентификации ПБА бактериальной природы можно использовать секвенирование фрагмента или полной последовательности гена 16S рРНК или других генов жизнеобеспечения, микозов - D2 сегмента гена большой субъединицы рибосом, вирусов - консервативные участки генома. Для проведения анализа, где в качестве ДНК-мишеней выбраны гены 16S рРНК и D2 сегмента рибосом, могут быть использованы коммерческие наборы реагентов и базы данных нуклеотидных последовательностей этих участков. Метод может быть использован для подтверждения положительных результатов исследований методом ПЦР. Метод характеризует высокая специфичность.
3.4.9. Полногеномное секвенирование и анализ результатов по международным и национальным базам данных нуклеотидных последовательностей позволяет идентифицировать ПБА на основании выявления уникальных генетических детерминант. Метод характеризует высокая специфичность.
3.4.10. Риботипирование - метод идентификации микроорганизмов на основании количества и расположения в геноме патогена рибосомальных оперонов. Для проведения анализа может быть использована автоматизированная система Riboprinter и база данных рибопринтов, специфичных для широкого круга микроорганизмов. Метод характеризует высокая специфичность.
3.5. Оценка и представление результатов индикации
и
идентификации
3.5.1. Предварительный положительный ответ может быть выдан на основании положительных результатов исследования (обнаружение маркеров ПБА) нативного материала с помощью экспресс- и ускоренных методов через 2 - 6 часов при использовании МФА, ИФА (РИГА), 6 - 8 часов - ПЦР с учетом результатов в режиме реального времени, 8 - 12 часов - ПЦР с электрофоретической детекцией результатов. Предварительный положительный ответ может быть дан как в случае положительных результатов по всем используемым методам, так и при получении положительных результатов в одном - двух методах.
3.5.2. При получении сомнительных результатов анализа предварительный ответ не выдают, проводят повторное исследование исходного нативного материала (для исключения ошибок на всех этапах исследования, включая подготовку проб) и, при необходимости, секвенирование полученных фрагментов ДНК/кДНК.
3.5.3. При получении несовпадающих результатов в случае использования разных методов индикации вопрос о выдаче предварительного ответа решается в каждом случае отдельно с учетом чувствительности метода и эпидемических предпосылок.
3.5.4. При получении отрицательных результатов исследований нативного материала методами экспресс- и ускоренной диагностики выдают предварительный отрицательный ответ, исследование продолжают.
3.5.5. Положительный ответ, полученный на основании методов индикации: ПЦР и/или комплекса иммунологических методов (МФА, ИФА, РИГА) - может служить основанием для проведения противоэпидемических мероприятий с учетом анализа эпидемиологической ситуации.
3.5.6. Окончательный ответ выдают после получения результатов полного микробиологического (вирусологического) анализа или, в случае невозможности выделения культуры, после подтверждения результатов экспресс- и ускоренной диагностики на базе Референс-центра по соответствующей нозологии или Центра верификации диагностической деятельности.
3.5.7. По результатам исследования материала оформляют протокол исследования, а в случае выделения культуры микроорганизма и проведенной идентификации возбудителя - паспорт штамма.
3.5.8. Выделенные штаммы направляют в Референс-центр по соответствующей нозологии и Центр верификации диагностической деятельности, осуществляющий функции Государственной коллекции Роспотребнадзора, которые проводят их изучение. Полученные результаты вносят в открытые экспертные базы данных микробиологических анализаторов, секвенированные нуклеотидные последовательности при необходимости депонируют в установленном порядке в международной базе данных GenBank (http://www.ncbi.nlm.nih.gov/genbank), риботипы, данные морфометрического анализа, масс-спектры вносят в учрежденческие и ведомственные базы данных.
3.5.9. Информация о результатах исследования передается в учреждение, направившее материал, в Управление Роспотребнадзора по субъекту Российской Федерации, Федеральную службу по надзору в сфере защиты прав потребителей и благополучия человека.
IV. Требования биологической безопасности при
проведении
исследований патогенных биологических агентов, в том числе
неустановленного систематического положения
4.1. Индикацию и идентификацию патогенных биологических агентов неустановленного систематического положения целесообразно организовать в учреждении на базе одного подразделения с соблюдением принципа поточности.
4.2. Все виды работ с необеззараженным материалом проводят в БМБ III или БМБ II класса защиты с использованием средств индивидуальной защиты в соответствии с действующими санитарно-эпидемиологическими правилами по безопасности работы с микроорганизмами I - IV групп патогенности.
4.3. Выделение ДНК/РНК из проб клинического материала, подозрительного на зараженность неизвестным ПБА, для проведения ПЦР осуществляют методом, предусмотренным для материала, инфицированного (подозрительного на инфицирование) вирусом натуральной оспы. При исследовании проб из объектов окружающей среды готовят две аликвоты. Из первой аликвоты выделение ДНК/РНК проводят методом, предусмотренным для обработки материала, инфицированного (подозрительного на инфицирование) вирусом оспы. После исключения наличия в материале вирусов I группы патогенности из второй аликвоты проводят выделение ДНК/РНК методом, предусмотренным для обработки материала, инфицированного (подозрительного на инфицирование) бактериями II - IV групп патогенности, образующими споры.
4.4. Дезинфицирующие средства используют в соответствии с требованиями санитарных правил «Безопасность работы с микроорганизмами I - II групп патогенности (опасности)», приложение 1 «Режимы обеззараживания различных объектов, зараженных патогенными микроорганизмами».
V. Порядок организации и проведения работ
по забору материала
5.1. Общие требования
5.1.1. Во всех случаях выявления больного (трупа) с подозрением на инфекционное заболевание информация должна быть направлена экстренно, в установленном порядке. В Центр индикации возбудителей инфекционных болезней I - II групп патогенности и обеспечения противоэпидемической готовности, курирующий данную территорию информацию о выявления больного (трупа) с подозрением на инфекционное заболевание передает Управление Роспотребнадзора в субъекте Российской Федерации.
5.1.2. В медицинской организации, куда госпитализирован больной с подозрением на болезнь или заражение возбудителем неизвестной Болезни, отбор проб клинического материала осуществляют медицинские работники стационара с соблюдением требований санитарно-эпидемиологических правил по безопасности работы с микроорганизмами I - II групп патогенности (опасности) и прошедшие подготовку по вопросам особо опасных инфекционных болезней:
- забор материала осуществляют с использованием укладки универсальной (комплекта медицинского для забора проб) в присутствии и под руководством специалистов, подготовленных по вопросам диагностики особо опасных инфекций, обученных правилам биологической безопасности при работе с материалом, подозрительным на заражение возбудителями инфекционных болезней I - II групп патогенности, окончивших соответствующие курсы профессиональной подготовки, или специалистов противочумных учреждений;
- используют следующие средства индивидуальной защиты: противочумный костюм I типа или его аналог, разрешенный к применению в установленном порядке, противопылевой респиратор с фильтрующими элементами, плотно прилегающие очки либо полнолицевая маска или фильтрующий противогаз с противоаэрозольной или комбинированной коробкой в соответствии с санитарно-эпидемиологическими требованиями, две пары латексных перчаток, резиновые сапоги или непромокаемые прорезиненные высокие бахилы;
- образцы клинического материала отбирают в герметично закрывающиеся промаркированные стерильные контейнеры или пробирки (при необходимости, с транспортными средами), соответствующие требованиям санитарных правил, с использованием стерильных одноразовых инструментов Емкости с образцами биологического материала, обрабатывают снаружи дезинфицирующим раствором, герметизируют парафинизированной пленкой (парафилмом), помещают в полиэтиленовый пакет с застежкой. Затем упаковывают с соблюдением принципа «тройной» упаковки. Для этого первичные контейнеры помещают внутрь дополнительного пластикового (металлического) контейнера с завинчивающейся крышкой (вторичный контейнер), в котором находится адсорбирующий влагу материал (марля, вата), в количестве, достаточном для впитывания всей жидкости в случае повреждения первичного контейнера. Вторичный контейнер помещают во внешний (третичный) контейнер - герметичный кейс, который используется для защиты вторичного контейнера. При необходимости упакованная проба может быть помещена в транспортную сумку с хладоэлементом.
Для фиксации контейнеров в кейсе используют при необходимости воздушно-пузырьковую пленку или вставку-штатив. В одном кейсе (третичном контейнере) допускается транспортировка образцов материала от разных пациентов предварительно дважды упакованных.
5.1.3. Образцы секционного материала отбирают медицинские работники патологоанатомических отделений (или БСМЭ), прошедшие подготовку по вопросам биологической безопасности, в присутствии и под руководством специалиста по особо опасным инфекциям, освоившим методы безопасной работы с ПБА I - II групп. Отбор и упаковку проб секционного материала осуществляют в соответствии с пунктом 5.3 настоящих методических рекомендаций.
5.1.4. Упаковку и транспортировку проб осуществляют в соответствии с действующими санитарно-эпидемиологическими правилами по порядку учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности.
5.2 Материал для исследования на наличие
возбудителей
неустановленного систематического положения,
при тяжелом течении Болезни и отсутствии известных
предрасполагающих факторов
5.2.1. Забор материала от больных людей должен производиться предпочтительно до начала антибактериальной (противовирусной) терапии.
5.2.2. При остром начале лихорадки, наличии любых двух из нижеперечисленных симптомов: геморрагическая или пурпурная сыпь, носовое кровотечение, кровохарканье, наличие крови в стуле, другой геморрагический симптом, а также отсутствии известных предрасполагающих факторов (синдром острой геморрагической лихорадки), лабораторному исследованию подлежат: кровь, смывы из носоглотки, содержимое везикул, пустул, язв, СМЖ, моча и секционный материал (головной мозг, мозговые оболочки, паренхиматозные органы).
5.2.3. При остром начале диареи, тяжелом течении болезни и отсутствии известных предрасполагающих факторов (синдроме острой диареи), лабораторному исследованию подлежат: испражнения, ректальные мазки, рвотные массы, промывные воды желудка, перитонеальный выпот (при наличии), желчь, кровь, сыворотка крови и секционный материл (фрагменты и содержимое кишечника, фрагменты печени, почки, селезенки, поджелудочной железы, мезентериальные лимфатические узлы).
5.2.4. При остром лихорадочном заболевании с сыпью, или другими кожными проявлениями, а также при отсутствии известных предрасполагающих факторов (острый дерматологический синдром), лабораторному исследованию подлежат: кровь, содержимое везикул, пустул, язв, смывы из носоглотки, СМЖ, моча, секционный материал (головной мозг, мозговые оболочки, паренхиматозные органы, лимфатические узлы).
5.2.5. При острой неврологической дисфункции с одним или более из нижеперечисленных симптомов - нарушение ментальной функции, острый паралич, судороги, признаки раздражения менингеальных оболочек, непроизвольные движения, другие неврологические симптомы, а также отсутствии известных предрасполагающих факторов (острый неврологический синдром), лабораторному исследованию подлежат кровь, СМЖ и секционный материал (головной мозг, спинной мозг, мозговые оболочки).
5.2.6. При остром начале респираторной дисфункции на фоне возникновения острого инфекционного заболевания, тяжелом течении болезни и отсутствии известных предрасполагающих факторов (острый респираторный синдром), лабораторному исследованию подлежат: смывы и мазки из полости носа и ротоглотки, мазки из полости носа и ротоглотки, носоглоточное отделяемое, мокрота, кровь, сыворотка крови, моча, целесообразно включать в исследование аспираты из трахеи, бронхоальвеолярный лаваж, плевральный выпот при возможности их забора; в случае летального исхода - секционный материал: ткань легких, фрагменты трахеи, бронхов, мазки со слизистой дыхательных путей, внутригрудные лимфатические узлы.
5.2.7. При остром начале желтухи, тяжелом течении болезни и отсутствии известных предрасполагающих факторов (острый желтушный синдром), лабораторному исследованию подлежат, кровь, моча, фекалии, биоптаты печени, а также секционный материал (печень, селезенка).
5.2.8. При остром лихорадочном заболевании, характеризующемся тремя или более симптомами, касающимися различных систем организма (потеря аппетита и веса, тошнота и рвота, дискомфорт в брюшной полости, потливость и озноб, головная боль и боль в мышцах, суставах, спине, сыпь), а также при отсутствии известных предрасполагающих факторов (острый «системный» синдром), лабораторному исследованию подлежат: кровь, СМЖ, моча, фекалии, рвотные массы и секционный материал (лимфатические узлы, печень, селезенка).
5.2.9. При остром начале конъюнктивита с субконъюнктивальными кровоизлияниями или без таковых, и отсутствии известных предрасполагающих факторов (острый офтальмологический синдром), лабораторному исследованию подлежат: кровь, соскобы и смывы с конъюнктивы, мазок из ротоглотки, СМЖ, отделяемое везикул.
5.2.10 От одного больного забирают не менее трех видов клинического материала (в обязательном порядке при всех синдромах забирают кровь) Отбирают не менее двух проб каждого вида материала: одну пробу для проведения первичного исследования методами индикации и бактериологического исследования, вторую - для проведения вирусологического исследования.
5.2.11. При невозможности доставки проб клинического материала в лабораторию в течение 2 часов, его забирают в транспортные среды для бактерий или вирусов (Кери-Блейр, Эймса, двухфазную среду или аналоги) с учетом вида материала, синдромов и предполагаемых методов исследования (приложение 1).
5.3. Отбор
проб для исследования из объектов окружающей среды и
от лиц, находившихся в зоне поражения
в случае преднамеренного применения ПБА
5.3.1. При подозрении на преднамеренное использование биологических агентов отбор, упаковку и транспортировку проб объектов окружающей среды с места чрезвычайной ситуации (ЧС) осуществляют специалисты Роспотребнадзора, а также других ведомств в соответствии с требованиями нормативно-методических документов по взаимодействию органов управления, учреждений и специализированных формирований при ликвидации последствий террористических актов с применением ПБА и опасных химических веществ. Отбор и транспортировка проб осуществляется в соответствии с требованиями действующих нормативных документов.
5.3.2. Для проведения лабораторных исследований с предполагаемого места ЧС отбирают следующие образцы: почва, воздух, вода, смывы с объектов окружающей среды, смывы с наружных поверхностей зданий, поверхностей и предметов помещений (полы, стены, система вентиляции, мебель и т.д.), транспортных средств, растительности, порошки неясного происхождения, жидкости неясного происхождения, элементы предполагаемого источника ПБА в местах его применения (осколки, оболочки и содержимое биологических боеприпасов, малогабаритного диверсионного снаряжения (контейнеры, пеналы и другие приспособления для заражения почвы и воды), пищевые продукты, продовольственное сырье, фураж и пр.
5.3.3. От лиц, находившихся в зоне поражения, мазки и смывы из полости носа и ротоглотки забирают работники медицинских организаций.
5.3.4. Упаковку и транспортировку проб осуществляют в соответствии с действующими санитарно-эпидемиологическими правилами по порядку учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности.
5.4. Условия транспортирования и хранения материала
5.4.1. Пробы клинического материала и объектов окружающей среды для исследования на наличие неизвестного ПБА в лабораторию Центра индикации (или его Опорной базы) или в лаборатории МК СПЭБ доставляются с участием специалистов по особо опасным инфекциям в соответствии с требованиями санитарных правил.
5.4.2. Пробы биологического материала транспортируют с соблюдением необходимого температурного режима (приложение 1).
5.4.3. Хранение биологического материала в лаборатории Опорной базы Центра индикации до приезда специалистов противочумных учреждений осуществляют в соответствии с требованиями санитарных правил по безопасности работы с микроорганизмами I - II групп патогенности с соблюдением необходимого температурного режима.
VI. Порядок исследования клинического материала
при синдроме острой геморрагической лихорадки
Причиной Болезни с синдромом острой геморрагической лихорадки, характеризующейся острым началом лихорадки, наличием таких симптомов как, геморрагическая или пурпурная сыпь, носовое кровотечение, кровохарканье, наличие крови в стуле, при отсутствии известных предрасполагающих факторов, могут являться вирусы I - II группы патогенности: Эболавирусы, Марбургвирус, вирус Ласса и другие аренавирусы, вирус лихорадки Рифт-Валли, ККГЛ, вирус денге, желтой лихорадки и другие флавивирусы, хантавирусы, а также возбудители особо опасных инфекционных болезней бактериальной природы: Y. pestis, F. tularensis, В. anthracis, энтерогеморрагическая Е. coli (ЭГКП).
Материалом для исследования при синдроме острой геморрагической лихорадки являются кровь, смывы из носоглотки, содержимое везикул, пустул, язв, СМЖ, моча и секционный материал (кусочки головного мозга, мозговых оболочек, паренхиматозных органов).
6.1. Индикация возбудителей, обусловливающих
синдром
острой геморрагической лихорадки
6.1.1. Световая микроскопия
Микроскопия мазков и мазков-отпечатков с использованием окраски по Граму и Романовскому-Гимзе (возбудители бактериальной природы).
6.1.2. Метод флуоресцирующих антител
МФА используют при индикации возбудителя чумы в исследуемом материале и после «подращивания» на средах обогащения, а также флавивирусов. Приготовление, окрашивание специфическими иммуноглобулинами, просмотр мазков и оценку результатов осуществляют в соответствии с инструкцией по применению препарата. НМФА используют и для обнаружения антител к возбудителям ГЛПС, КГЛ, флавивирусных инфекций.
6.1.3. Полимеразная цепная реакция
ПЦР используют для индикации вирусов: Эболавирусы, Марбург-вируса, вирус Ласса и другие аренавирусы, вирус лихорадки Рифт-Валли, ККГЛ, вирус денге, желтой лихорадки и другие флавивирусы, хантавирусы, а также возбудителей особо опасных инфекционных болезней бактериальной природы: Y. pestis, F. tularensis, В. anthracis, энтерогеморрагическая Е. coli (ЭГКП).
Исследования проводят в соответствии с требованиями действующих нормативно-методических документов и инструкций по применению препаратов по следующей схеме:
- выделение ДНК/РНК;
- проведение ОТ-ПЦР с использованием диагностических наборов для выявления РНК-содержащих вирусов I - II группы патогенности (приложение 2, приложение 3);
- постановка ПЦР для выявления ДНК возбудителей особо опасных инфекционных болезней бактериальной природы.
6.1.4. Иммуноферментный анализ и другие иммуносерологические реакции.
Сыворотку крови исследуют с целью выявления специфических антител классов М и G и/или антигенов к Эбблавирусам, вирусам II группы патогенности и возбудителям особо опасных инфекционных болезней бактериальной природы.
6.2. Бактериологический анализ
Бактериологический анализ проб клинического материала проводят с целью выделения, идентификации культуры возбудителя бактериальной природы, вызывающего острый геморрагический синдром, и определения его чувствительности к антибактериальным препаратам.
6.2.1. Для выделения культур возбудителей Болезни с синдромом острой геморрагической лихорадки используют следующие питательные среды:
- питательные среды для культивирования и выделения чумного микроба (сухая ЧПС);
- Ft-агар и (или) набор реагентов для культивирования и выделения туляремийного микроба сухой с глюкозо-витаминной и ингибиторной добавками к питательной среде;
- питательный бульон для культивирования микроорганизмов широкого спектра (мясо-пептонный бульон, Хоттингера и др.);
- питательный агар для культивирования микроорганизмов широкого спектра (мясо-пептонный агар, Хоттингера и др.);
- дифференциально-диагностические среды бульон и агар Мак-Конки или Левина, с добавлением антибиотиков (цефотаксим 25 мкг/мл и налидиксовая кислота 4 мкг/мл) и SDS-бульон или TSB-бульон для выделения и культивирования Е. coli О104:Н4;
- дифференциально-диагностическая среда Сорбитол - Е. coli O157:Н7 - агар, SDS-бульон или TSB-бульон для выделения и культивирования Е. coli O157:Н7;
- питательный агар с добавлением крови, витаминных добавок для труднокультивированных микроорганизмов (шоколадный агар с витаминными добавками).
6.2.2. Посевы инкубируют с использованием различных условий (температурный режим, уровень содержания кислорода, углекислого газа и др.).
6.3. Заражение биопробных животных
Для биологического обогащения проб используют метод подкожного (материал, загрязненный сопутствующей микрофлорой) или внутрибрюшинного заражения (чистый материал) белых мышей, морских свинок.
6.4. Идентификация возбудителей, обусловливающих
синдром
острой геморрагической лихорадки
6.4.1. Идентификация культур возбудителей особо опасных инфекционных болезней бактериальной природы.
Идентификацию осуществляют в соответствии требованиями нормативно-методических документов, регламентирующих лабораторную диагностику этих возбудителей, а также с использованием методов молекулярно-генетического, масс-спектрометрического и др. анализов.
6.4.2. Идентификация возбудителей неустановленного систематического положения, обусловливающих синдром острой геморрагической лихорадки.
При получении отрицательных результатов о наличии в исследуемом материале возбудителей особо опасных инфекционных болезней бактериальной природы, исследования продолжают до выявления других возбудителей, обусловливающих данный синдром, с использованием всего спектра средств диагностики:
- идентификация биохимической активности микроорганизмов с использованием автоматизированных микробиологических анализаторов, экспертных систем и баз данных;
- идентификация микроорганизмов методом MALDI-TOF (матричная активированная лазерная десорбционно/ионизационая времяпролетная масс-спектрометрия) на основе сопоставления полученного масс-спектра и известных масс-спектров ПБА из специализированных баз данных;
- идентификация микроорганизмов на основании определения нуклеотидной последовательности фрагмента или полной последовательности гена 16S рРНК или других генов жизнеобеспечения бактерий, консервативных участков генома вирусов с последующим анализом с помощью известных баз данных;
- идентификация микроорганизмов на основании определения риботипа с последующим анализом с помощью известных баз данных;
- идентификация вирусов III - IV групп патогенности.
6.4.3. По результатам идентификации составляют паспорт штамма, с указанием всех полученных характеристик. Передачу выделенных штаммов микроорганизмов, направление информации осуществляют в соответствии с пунктом 5.4 настоящих методических рекомендаций.
VII. Порядок исследования клинического материала
при синдроме острой диареи
Причиной синдрома острой диареи (гастроэнтерита, энтероколита, энтерогемоколита, геморрагического гастроэнтерита), характеризующегося острым началом, тяжелым течением при отсутствии известных предрасполагающих факторов, могут являться возбудители бактериальной V. cholerae, В. anthracis, F. tularensis, Е. coli О104:Н4, Е. coli O157:Н7, и вирусной природы (вирусы Ласса, Хунин, Мачупо, Себиа, Гуанарито, Марбургвирус и Эболавирусы), относящиеся к ПБА I - II групп патогенности, возбудители, относящиеся к III - IV группам патогенности: Y. pseudo tuberculosis, Y. enterocolitica, сальмонеллы, шигеллы, норо-, рео-, энтеро- адено-, ротавирусы и др., а также биологические токсины (ботулинический, стафилококковый).
Исследуемым материалом являются испражнения, ректальные мазки, рвотные массы, промывные воды желудка, перитонеальный выпот (при наличии), желчь, кровь, сыворотка крови и секционный материл (фрагменты и содержимое кишечника, фрагменты печени, почки, селезенки, поджелудочной железы, мезентериальные лимфатические узлы).
7.1. Индикация возбудителей, обусловливающих
синдром острой
диареи (геморрагические гастроэнтериты и энтероколиты)
7.1.1. Световая микроскопия.
Микроскопия мазков и мазков-отпечатков с использованием окраски по Граму и Романовскому-Гимзе (возбудители бактериальной природы), Ребигеру (визуализация капсулы возбудителя сибирской язвы).
7.1.2. Метод флуоресцирующих антител.
МФА используют при индикации возбудителей холеры, сибирской язвы, туляремии в исследуемом материале, а также после «подращивания» материала на средах обогащения. Приготовление, окрашивание специфическими иммуноглобулинами, просмотр мазков и оценку результатов осуществляют в соответствии с инструкцией по применению препарата.
При обнаружении специфического свечения в препаратах выдают предварительный ответ.
7.1.3. Полимеразная цепная реакция.
ПЦР используют для индикации возбудителей холеры, сибирской язвы, туляремии, энтерогеморрагических эшерихиозов, вирусов Ласса, Хунин, Мачупо, Марбургвируса и Эболавирусов и др. в исследуемом материале и на этапе идентификации культуры возбудителя. Исследования проводят в соответствии с требованиями действующих нормативно-методических документов и инструкций по применению препаратов по следующей схеме:
- выделение ДНК/РНК;
- проведение ОТ-ПЦР использованием диагностических наборов для выявления РНК-содержащих вирусов I - II группы патогенности (приложение 2, приложение 3);
- постановка ПЦР для выявления ДНК возбудителей V. cholerae, В. anthracis, F. tularensis, Е. coli О104:Н4, Е. coli O157:Н;
- постановка мультилокусной ПЦР для выявления и дифференциации ДНК (РНК) микроорганизмов рода Shigella spp. и энтероинвазивных Е. coli, Salmonella spp., Campylobacter spp., аденовирусов группы F, ротавирусов группы А, норовирусов, реовирусов, астровирусов, и ПЦР для выявления и дифференциации ДНК вирулентных и авирулентных штаммов Y. enterocolitica и штаммов Y. pseudotuberculosis.
7.1.4. Иммуносерологические исследования (ИФА, РИГА, ИХ-тест и др.) для выявления антигенов и антител к возбудителям холеры, туляремии, сибирской язвы, псевдотуберкулеза и др.
7.1.5. Индикация биологических токсинов.
Экспресс-индикацию токсинов проводят с помощью индикаторных иммунохроматографических элементов для определения ботулинического токсина типа А и В, холерного экзотоксина, стафилококкового энтеротоксина типа В, рицина или с использованием экспресс-наборов для определения токсинов методом обратной пассивной латексной агглютинации.
При необходимости использования биологического метода постановку биопробы осуществляют после исключения наличия в пробе вирусов 1 группы патогенности:
- на ботулинический токсин (заражение двух белых мышей);
- на стафилококковый токсин (заражение четырех белых мышей).
7.2. Бактериологический анализ
Бактериологический анализ проб клинического материала проводят с целью выделения, идентификации культуры возбудителя бактериальной природы, обусловливающего синдром острой диареи, и определения его чувствительности к антибактериальным препаратам.
7.2.1. Для выделения культур возбудителей инфекционных болезней используют следующие питательные среды:
- питательная среда для выделения и культивирования холерного вибриона (щелочной агар), щелочная пептонная вода pH 8,0 и среда TCBS для выделения и культивирования возбудителя холеры;
- питательная среда для выделения и культивирования сибиреязвенного микроба с селективными добавками;
- Ft-агар и (или) набор реагентов для культивирования и выделения туляремийного микроба сухой с глюкозо-витаминной и ингибиторной добавками к питательной среде;
- питательная среда для выделения возбудителей кишечного иерсиниоза и псевдотуберкулеза (Иерсиния-агар);
- дифференциально-диагностические среды бульон и агар Мак-Конки или агар Левина, с добавлением антибиотиков (цефотаксим 25 мкг/мл и налидиксовая кислота 4 мкг/мл), SDS-бульон или TSB-бульон для выделения и культивирования Е. coli О104:Н4;
- дифференциально-диагностическая среда Сорбитол - Е. coli O157:Н7 - агар, SDS-бульон или TSB-бульон для выделения и культивирования Е. coli O157:Н7;
- селенитовый бульон, RVS-бульон, агар Эндо, висмут-сульфит агар (ВСА), агар Плоскирева, SS-arap для накопления и культивирования патогенных энтеробактерий;
- полиуглеводные среды (агар Клиглера, агар Ресселя или агар Олькеницкого) для идентификации энтеробактерий;
- питательный бульон для культивирования микроорганизмов широкого спектра (мясо-пептонный бульон, Хоттингера и др.);
- питательный агар для культивирования микроорганизмов широкого спектра (мясо-пептонный агар, Хоттингера и др.);
- питательный агар с добавлением крови, витаминных добавок для труднокультивированных микроорганизмов (шоколадный агар с витаминными добавками).
7.2.2. Посевы инкубируют с использованием различных условий (температурный режим, уровень содержания кислорода, углекислого газа и др.).
7.3. Заражение биопробных животных
Для биологического обогащения проб используют метод подкожного (материал, загрязненный сопутствующей микрофлорой) или внутрибрюшинного заражения (чистый материал) белых мышей, морских свинок, серых хомячков, крольчат-сосунков.
7.4.
Идентификация возбудителей, обусловливающих
синдром острой диареи
7.4.1. Идентификацию культур В. anthracis, V. cholerae, F. tularensis, E. coli O104:H4, E. coli 0157:H7, Y. pseudotuberculosis, Y. enterocolitica осуществляют в соответствии с требованиями нормативно-методических документов для каждого вида возбудителя.
7.4.2. Для идентификации аденовирусов, ротавирусов, норовирусов, реовирусов, астровирусов может быть использовано фрагментное секвенирование.
7.4.3. Идентификация возбудителей неустановленного систематического положения, обусловливающих синдром острой диареи.
При получении отрицательных результатов о наличии в исследуемом материале V. cholerae, В. anthracis, F. tularensis, Е. coli О104:Н4, Е. coli 0157:Н7, Y. pseudotuberculosis, Y. enterocolitica исследования продолжают до выявления других возбудителей, обусловливающих данный синдром, с использованием всего спектра средств диагностики в соответствии с п. 6.3.
7.4.4. По результатам идентификации возбудителя инфекции составляют паспорт штамма, с указанием всех полученных характеристик. Передачу выделенных штаммов микроорганизмов и направление информации осуществляют в соответствии с пунктом 5.4 настоящих методических рекомендаций.
VIII. Порядок исследования клинического материала
при остром дерматологическом синдроме
Причиной острых лихорадочных заболеваний с сыпью или другими кожными проявлениями, а также при отсутствии известных предрасполагающих факторов (острый дерматологический синдром) могут являться возбудители бактериальной природы - чумы, туляремии, сибирской язвы, лептоспироза, сапа, мелиоидоза, псевдотуберкулеза, сыпного тифа, кокцидиоидомикоза, гистоплазмоза, бластомикоза, паракокцидиоидомикоза и вирусной природы - вирусы натуральной оспы, оспы обезьян, относящиеся к I группе патогенности, и вирусы кори, краснухи, оспы коров, ветряной оспы, вирус везикулярного стоматита, а также парвовирус В19 и др., относящиеся к III - IV группе патогенности.
Материалом для лабораторного исследования служат кровь, содержимое везикул, пустул, язв, бубонов, смывы из носоглотки, СМЖ, моча, секционный материал (кусочки головного мозга, мозговых оболочек, паренхиматозных органов, лимфатические узлы).
8.1. Индикация возбудителей, обусловливающих
острый дерматологический синдром
8.1.1. Световая микроскопия
Микроскопия мазков и мазков-отпечатков с использованием окраски по Граму и Романовскому-Гимзе (возбудители бактериальной и микотической природы), Ребигеру (визуализация капсулы возбудителя сибирской язвы).
8.1.2. Метод флуоресцирующих антител
МФА используют при индикации возбудителей чумы, туляремии, сибирской язвы, сапа, мелиоидоза, кокцидиоидомикоза в исследуемом материале и после «подращивания» материала на средах обогащения, а также вируса оспы. Приготовление, окрашивание специфическими иммуноглобулинами, просмотр мазков и оценку результатов осуществляют в соответствии с инструкцией по применению препарата.
При обнаружении специфического свечения в препаратах выдают предварительный положительный ответ.
8.1.3. Полимеразная цепная реакция
Исследования проводят в соответствии с требованиями действующих нормативно-методических документов по следующей схеме:
- выделение ДНК/РНК;
- проведение ОТ-ПЦР с использованием диагностических наборов для выявления РНК-содержащих вирусов I - II группы патогенности (приложение 2);
- постановка ПЦР для выявления ДНК/РНК возбудителей чумы, туляремии, сибирской язвы, сапа, мелиоидоза, псевдотуберкулеза, лептоспироза;
- постановка ПЦР для выявления ДНК возбудителей кокцидиоидомикоза, гистоплазмоза, бластомикоза;
- постановка ПЦР для выявления ДНК/РНК вирусов краснухи, кори, ветряной оспы, вирус везикулярного стоматита, парвовируса В19 (при необходимости).
8.1.4. Иммуносерологические исследования (ИФА, РИГА, ИХ-тест) для выявления антигенов и антител к возбудителям чумы, туляремии, сибирской язвы, сапа, мелиоидоза, псевдотуберкулеза, лептоспироза, оспы, краснухи, кори.
8.1.5. Темнопольная микроскопия для выявления возбудителя лептоспироза.
8.2. Бактериологический анализ
Бактериологический анализ проб клинического материала проводят с целью выделения, идентификации культуры возбудителя бактериальной и микотической природы, вызывающего острый дерматологический синдром, и определения его чувствительности к антибактериальным препаратам.
8.2.1. Перечень дифференциально-диагностических, элективных сред и сред обогащения для выделения культур Y. pestis, F. tularensis, В. anthracis, Burkholderia mallei, Burkholderia pseudomallei, Coccidioides immitis, Coccidioides posadasii, Histoplasma capsulatum, Blastomyces dermatitidis, Paracoccidioides brasiliensis, Y. pseudotuberculosis, Leptospira spp. и других возбудителей, обусловливающих острый дерматологический синдром:
- питательные среды для культивирования и выделения чумного микроба (сухая ЧПС);
- Ft-агар и (или) набор реагентов для культивирования и выделения туляремийного микроба сухой с глюкозо-витаминной и ингибиторной добавками к питательной среде;
- питательная среда для выделения и культивирования сибиреязвенного микроба с селективными добавками;
- плотная и жидкая питательная среда для выделения и культивирования В. pseudomallei и В. mallei;
- питательная среда для выделения возбудителей кишечного иерсиниоза и псевдотуберкулеза (Иерсиния-агар) или дифференциально-диагностические среды для энтеробактерий - агар МакКонки;
- плотная и жидкая питательная среда для выделения и культивирования мицелиальной фазы микромицетов;
- плотная и жидкая питательная среда для выделения и культивирования тканевой фазы микромицетов;
- плотная и жидкая питательная среда для выделения и культивирования лептоспир;
- питательный бульон для культивирования микроорганизмов широкого спектра (мясо-пептонный бульон, Хоттингера и др.);
- питательный агар для культивирования микроорганизмов широкого спектра (мясо-пептонный агар, Хоттингера и др.);
- питательный агар с добавлением крови, витаминных добавок для труднокультивированных микроорганизмов (шоколадный агар с витаминными добавками).
8.2.2. Посевы инкубируют с использованием различных условий (температурный режим, уровень содержания кислорода, углекислого газа и др.).
8.3. Заражение биопробных животных
Для биологического обогащения проб используют метод подкожного (материал, загрязненный сопутствующей микрофлорой) или внутрибрюшинного заражения (чистый материал) белых мышей, морских свинок, серых хомячков.
8.4. Идентификация возбудителей, обусловливающих
острый
дерматологический синдром
8.4.1. Идентификацию культур Y. pestis, F. tularensis, В. anthrасis, В. mallei, В. pseudomallei осуществляют в соответствии с требованиями нормативно-методических документов.
8.4.2. Идентификация возбудителей неустановленного систематического положения, обусловливающих острый дерматологический синдром.
При получении отрицательных результатов о наличии в исследуемом материале Y. pestis, F. tularensis, В. mallei, В. pseudomallei, Leptospira spp. исследования продолжают до выявления других возбудителей, обусловливающих данный синдром, с использованием всего спектра средств диагностики в соответствии с пунктом 5.3 настоящих методических рекомендаций.
8.4.3. По результатам идентификации возбудителей инфекционных болезней составляют паспорт штамма, с указанием всех полученных характеристик. Передачу выделенных штаммов микроорганизмов и направление информации осуществляют в соответствии с пунктом 5.4 настоящих методических рекомендаций.
IX. Порядок исследования клинического материала
при остром неврологическом синдроме
Причиной острой неврологической дисфункции с наличием одного или более таких симптомов, как нарушение ментальной функции, острый паралич, судороги, признаки раздражения менингеальных оболочек, непроизвольные движения или других неврологических симптомов (острый неврологический синдром), могут являться вирусы лошадиных энцефалитов (ВЭЛ, ВсЭЛ, ЗЭЛ), Западного Нила, комплекса Калифорнийского энцефалита, вирусы лимфоцитарного хориоменингита Такарибе, Пичинде, энтеровирусы, вирусы японского и клещевого энцефалитов, бешенства и других лиссавирусов, гриппа А, а также Neisseria meningitidis, Haemophilus influenzae и Streptococcus pneumoniae, возбудители чумы, сибирской язвы, лептоспироза, трипаносомоза, малярии и др.
Лабораторному исследованию подлежат кровь, СМЖ и секционный материал (кусочки головного мозга, спинного мозга, мозговых оболочек).
9.1. Индикация возбудителей, обусловливающих
острый неврологический синдром
9.1.1. Световая микроскопия.
Микроскопия мазков и мазков-отпечатков с использованием окраски по Граму и Романовскому-Гимзе (возбудители бактериальной природы), Ребигеру (визуализация капсулы возбудителя сибирской язвы).
9.1.2. Метод флуоресцирующих антител.
МФА используют при индикации возбудителей чумы, сибирской язвы, японского и клещевого энцефалита и малярии в исследуемом материале. Приготовление, окрашивание специфическими иммуноглобулинами, просмотр мазков и оценку результатов осуществляют в соответствии с инструкцией по применению препарата. НМФА используют и для обнаружения антител к возбудителям флавивирусных инфекций.
При обнаружении специфического свечения в препаратах выдают предварительный положительный ответ.
9.1.3. Полимеразная цепная реакция.
ПЦР используют для индикации Y. pestis, В. anrhracis, энтеровирусов, вируса клещевого энцефалита, N. meningitidis, Н. influenzae и S. pneumoniae, Leptospira spp., малярии.
Исследования проводят в соответствии с требованиями действующих нормативно-методических документов.
9.1.4. Иммуносерологические исследования.
ИФА, РИГА, РСК, РАР, ИХ-тест используют для выявления антигенов и/или антител к возбудителям чумы, сибирской язвы, малярии, японского энцефалита, клещевого энцефалита, N. meningitidis, S. pneumoniae, Leptospira spp.
9.1.5. Микроскопия:
- темнопольная микроскопия для выявления возбудителя лептос-пироза;
- исследование препаратов крови, приготовленных методом «тонкого мазка» и «толстой капли», окрашенных по Романовскому-Гимзе для выявления возбудителя малярии.
9.2. Бактериологический анализ
Бактериологический анализ проб клинического материала проводят с целью выделения, идентификации культуры возбудителя бактериальной природы, вызывающего острый неврологический синдром, и определения его чувствительности к антибактериальным препаратам.
9.2.1. Перечень дифференциально-диагностических, элективных сред и сред обогащения, используемых для бактериологического анализа:
- питательные среды для культивирования и выделения чумного микроба (сухая ЧПС);
- питательная среда для выделения и культивирования сибиреязвенного микроба с селективными добавками;
- питательные среды для выделения и культивирования возбудителей гнойных бактериальных менингитов: Менингоагар, Гемофилус агар, ГБМ-агар, Шоколадный агар;
- плотная и жидкая питательная среда для выделения и культивирования лептоспир;
- питательный бульон для культивирования микроорганизмов широкого спектра (мясо-пептонный бульон, Хоттингера и др.);
- питательный агар для культивирования микроорганизмов широкого спектра (мясо-пептонный агар, Хоттингера и др.);
- питательный агар с добавлением крови, витаминных добавок для труднокультивированных микроорганизмов (шоколадный агар с витаминными добавками).
9.2.2. Посевы инкубируют с использованием различных условий (температурный режим, уровень содержания кислорода, углекислого газа и др.).
9.3. Заражение биопробных животных
Для биологического обогащения проб используют метод внутрибрюшинного заражения (чистый материал) белых мышей, морских свинок, серых хомячков.
9.4. Идентификация возбудителей, обусловливающих острый неврологический синдром
9.4.1. Идентификацию культур Y. pestis, В. anrhracis, N. meningitidis, Н. influenzae и S. pneumoniae, Leptospira spp. осуществляют в соответствии с требованиями нормативно-методических документов.
9.4.2. Идентификация возбудителей неустановленного систематического положения, обусловливающих острый неврологический синдром.
При получении отрицательных результатов бактериологического анализа исследования продолжают до выявления других возбудителей, обусловливающих данный синдром, с использованием всего спектра средств диагностики в соответствии с пунктом 5.3 настоящих методических рекомендаций.
9.4.3. По результатам идентификации возбудителя инфекционной болезни составляют паспорт штамма с указанием всех полученных характеристик. Передачу, выделенных штаммов микроорганизмов, направление информации о них осуществляют в соответствии с пунктом 5.4 настоящих методических рекомендаций.
X. Порядок исследования клинического материала
при остром респираторном синдроме
Причиной общей интоксикации и лихорадки с поражением органов дыхания (озноб, боли в груди, кашель, часто с серозной или серозно-геморрагической мокротой, одышка, тахикардия), сопровождаемой отеком легких и гипоксией (острый респираторный синдром), могут являться возбудители чумы, сибирской язвы, туляремии, сапа, мелиоидоза, кокцидиоидомикоза, гистоплазмоза, бластомикоза, паракокцидиоидомикоза, дифтерии, микоплазмоза, легионеллеза, коклюша, скарлатины, лептоспироза, псевдотуберкулеза, хантавирусного пульмонального синдрома, гриппа, ТОРС, энтеро-, рино-, корона-, аденовирусной инфекций, заболеваний, вызванных бокавирусом, вирусами парагриппа человека 1 - 4 типов, метапневмовирусом, а также респираторно-синцитиальный вирусом и другими возбудителями острых респираторных вирусных инфекций человека.
Лабораторному исследованию подлежат смывы из полости носа и ротоглотки, мазки из полости носа и ротоглотки, носоглоточное отделяемое, мокрота, кровь, сыворотка крови, моча, целесообразно включать в исследование аспираты из трахеи, бронхоальвеолярный лаваж, плевральный выпот при возможности их забора; в случае летального исхода - секционный материал: ткань легких, фрагменты трахеи, бронхов, мазки со слизистой дыхательных путей, внутригрудные лимфатические узлы.
10.1. Индикация возбудителей, обусловливающих
острый респираторный синдром
10.1.1. Световая микроскопия.
Микроскопия мазков и мазков-отпечатков с использованием окраски по Граму (возбудители бактериальной и микотической природы), Ребигеру (визуализация капсулы возбудителя сибирской язвы), Романовскому-Гимзе (выявление возбудителей лептоспироза, туляремии).
10.1.2. Метод флуоресцирующих антител.
МФА используют для индикации возбудителей чумы, туляремии, сибирской язвы, сапа, мелиоидоза, кокцидиоидомикоза, псевдотуберкулеза в исследуемом материале и после подращивания материала на питательных средах, а также вирусов гриппа. НМФА используют и для обнаружения антител к вирусу SARS. Приготовление, окрашивание специфическими иммуноглобулинами и просмотр мазков осуществляют в соответствии с инструкцией по применению препарата.
10.1.3. Полимеразная цепная реакция.
ПЦР используют для индикации возбудителей чумы, сибирской язвы, туляремии, сапа, мелиоидоза, кокцидиоидомикоза, гистоплазмоза, бластомикоза, легионеллеза, возбудителей атипичных пневмоний, лептоспироза, псевдотуберкулеза, туберкулеза, хантавирусов, вирусов гриппа A, SARS/MERS, возбудителей других острых респираторных заболеваний в исследуемом материале и на этапе идентификации культуры возбудителя. Исследования проводят в соответствии с требованиями действующих нормативно-методических документов и инструкций по применению препаратов по следующей схеме:
- выделение ДНК/РНК;
- постановка ПЦР для выявления ДНК/РНК возбудителей чумы, сибирской язвы, туляремии, сапа, мелиоидоза, кокцидиоидомикоза, гистоплазмоза, бластомикоза, легионеллеза, лептоспироза, хантавирусов, вирусов гриппа A, SARS/MERS;
- постановка мультилокусной ПЦР для выявления возбудителей острых респираторных вирусных инфекций человека: респираторно-синцитиального вируса, метапневмовируса, вирусов парагриппа 1, 2, 3 и 4 типов, коронавирусов, риновирусов, аденовирусов групп В, С и Е и бокавируса;
- постановка мультилокусной ПЦР для выявления Mycoplasma pneumoniae и Chlamydophila pneumoniae;
- постановка мультилокусной ПЦР для выявления и дифференцирования микобактерий туберкулеза (Mycobacterium tuberculosis, М. bovis и М. bovis BCG) и ПЦР для выявления и дифференциации ДНК вирулентных и авирулентных штаммов Y enterocolitica и штаммов Y. pseudotuberculosis.
10.1.4. Иммуносерологические исследования.
ИФА, ИХ-тест, серологические реакции используют для выявления антигенов и/или антител классов М и G к возбудителям чумы, туляремии, сибирской язвы, сапа, мелиоидоза, легионеллеза, лептоспироза, псевдотуберкулеза, хантавирусов, вируса SARS.
10.1.5. Темнопольная микроскопия.
Выявление возбудителя лептоспироза с использованием препарата «раздавленная капля».
10.2. Бактериологический анализ
Бактериологический анализ проб клинического материала проводят с целью выделения, идентификации культуры возбудителя бактериальной и микотической природы, вызывающего респираторный синдром, и определения его чувствительности к антибактериальным препаратам.
10.2.1. Для выделения культуры возбудителя используют следующие питательные и дифференциально-диагностические среды:
- питательные среды для культивирования и выделения чумного микроба (сухая ЧПС);
- питательная среда для выделения и культивирования сибиреязвенного микроба с селективными добавками;
- Ft-агар, набор реагентов для культивирования и выделения туляремийного микроба сухой с глюкозо-витаминной и ингибиторной добавками к питательной среде;
- питательная среда для культивирования и выделения сапного и мелиоидозного микробов;
- плотная и жидкая питательная среда для выделения и культивирования мицелиальной фазы микромицетов;
- плотная и жидкая питательная среда для выделения и культивирования тканевой фазы микромицетов;
- питательная среда с ростовой и селективной добавками для выделения легионелл;
- питательная среда для выделения возбудителей кишечного иерсиниоза и псевдотуберкулеза (Иерсиния-агар) или дифференциально-диагностические среды;
- питательная среда, содержащая сыворотку, сывороточный альбумин для культивирования Leptospira spp.;
- питательная среда для выделения энтеробактерий (агар Эндо);
- питательные среды для выделения коринебактерий - коринебака-гар, среда Бунина, кровяно-теллуритовый агар;
- питательный бульон для культивирования микроорганизмов широкого спектра (мясо-пептонный бульон, Хоттингера и др.);
- питательный агар для культивирования микроорганизмов широкого спектра (мясо-пептонный агар, Хоттингера и др.);
- питательный агар с добавлением крови, витаминных добавок для труднокультивируемых микроорганизмов (шоколадный агар с витаминными добавками).
10.2.2. Посевы инкубируют с использованием различных условий (температурный режим, уровень содержания кислорода, углекислого газа и др.).
10.3. Заражение биопробных животных
Для биологического обогащения проб используют метод подкожного (материал, загрязненный сопутствующей микрофлорой) или внутрибрюшинного заражения (чистый материал) белых , мышей и морских свинок, серых хомячков.
10.4. Идентификация возбудителей, обусловливающих
острый респираторный синдром
10.4.1. Идентификацию культур возбудителей Болезней с острым респираторным синдромом осуществляют в соответствии с требованиями нормативно-методических документов для каждого вида возбудителя.
10.4.2. Идентификация возбудителей неустановленного систематического положения, обусловливающих острый респираторный синдром.
При получении отрицательных результатов о наличии в исследуемом материале Y pestis, В. anthtacis, F. tularensis, В. mallei, В. pseudomallei исследования продолжают до выявления других возбудителей респираторных инфекции с использованием всего спектра средств диагностики в соответствии с пунктом 5.3 настоящих методических рекомендаций.
10.4.3. По результатам идентификации возбудителя инфекционной болезни составляют паспорт штамма, с указанием всех полученных характеристик. Передачу выделенных штаммов микроорганизмов и направление информации о них осуществляют в соответствии с пунктом 5.4 настоящих методических рекомендаций.
XI. Порядок исследования клинического материала
при остром желтушном синдроме
Причиной острого начала желтухи с тяжелым течением болезни при отсутствии известных предрасполагающих факторов могут являться возбудители гепатитов А, В, С, Д, Е, желтой лихорадки, лептоспироза, псевдотуберкулеза, малярии и др.
Материалом для исследования при остром желтушном синдроме являются кровь, моча, фекалии, биоптаты печени, а также секционный материал: кусочки печени, селезенки.
11.1. Индикация возбудителей, обусловливающих острый желтушный синдром.
11.1.1. Световая микроскопия.
Микроскопия мазков и мазков-отпечатков с использованием окраски по Граму (возбудители бактериальной природы), Романовскому-Гимзе (выявление возбудителей лептоспироза).
11.1.2. Метод флуоресцирующих антител.
МФА используют для индикации возбудителей желтой лихорадки и псевдотуберкулеза в исследуемом материале. Приготовление, окрашивание специфическими иммуноглобулинами и просмотр мазков осуществляют в соответствии с инструкцией по применению препарата.
11.1.3. Полимеразная цепная реакция.
Осуществляют постановку ПЦР для выявления возбудителей вирусных гепатитов, желтой лихорадки, лептоспироза, псевдотуберкулеза, малярии и др.
11.1.4. Иммуносерологические исследования.
ИФА, ИХ-тест, серологические реакции используют для выявления антигенов и/или антител классов А, М и G к возбудителям желтой лихорадки, лептоспироза, псевдотуберкулеза.
11.1.5. Темнопольная микроскопия.
Выявление возбудителя лептоспироза с использованием препарата «раздавленная капля».
11.2. Бактериологический анализ
Бактериологический анализ проб клинического материала проводят с целью выделения, идентификации культуры возбудителя бактериальной природы, обусловливающего острый желтушный синдром, и определения его чувствительности к антибактериальным препаратам.
11.2.1. Для проведения исследований используют следующие питательные среды:
- питательные среды, содержащие сыворотку, сывороточный альбумин;
- питательный бульон для культивирования микроорганизмов широкого спектра (мясо-пептонный бульон, Хотгингера и др.);
- питательная среда для выделения возбудителей кишечного иерсиниоза и псевдотуберкулеза (Иерсиния-агар) или дифференциально-диагностические среды;
- питательный агар для культивирования микроорганизмов широкого спектра (мясо-пептонный агар, Хоттингера и др.);
- питательный агар с добавлением крови, витаминных добавок труднокультивируемых микроорганизмов (шоколадный агар с витаминными добавками).
11.2.2. Посевы инкубируют с использованием различных условий (температурный режим, уровень содержания кислорода, углекислого газа и др.).
11.3. Заражение биопробных животных
Для биологического обогащения проб используют метод подкожного (материал, загрязненный сопутствующей микрофлорой) или внутрибрюшинного заражения (чистый материал) белых мышей и морских свинок, серых хомячков.
11.4. Идентификация возбудителей, обусловливающих острый желтушный синдром.
11.4.1. Идентификацию культур возбудителей лептоспироза осуществляют в соответствии с нормативно-методическими документами, регламентирующими лабораторную диагностику лептоспироза.
11.4.2. Идентификация возбудителей неустановленного систематического положения, обусловливающих острый желтушный синдром.
При получении отрицательных результатов о наличии в исследуемом материале возбудителей лептоспироза исследования продолжают до выявления других возбудителей, обусловливающих острый желтушный синдром, с использованием всего спектра средств диагностики в соответствии с пунктом 5.3 настоящих методических рекомендаций.
11.4.3. По результатам идентификации возбудителя инфекционной болезни составляют паспорт штамма с указанием всех полученных характеристик. Передачу выделенных штаммов микроорганизмов и направление информации о них осуществляют в соответствии с пунктом 5.4 настоящих методических рекомендаций.
XII. Порядок исследования клинического материала
при остром «системном» синдроме
Причиной острого начала лихорадочного заболевания, характеризующегося тремя или более симптомами, касающимися различных систем организма (потеря аппетита и веса, тошнота и рвота, дискомфорт в брюшной полости, потливость и озноб, головная боль, боль в мышцах, суставах и спине, сыпь), при отсутствии известных предрасполагающих факторов (острый «системный» синдром) могут являться лихорадка денге, желтая лихорадка и другие арбовирусные лихорадки, хантавирусная инфекция, геморрагическая лихорадка Лаоса, иксодовый клещевой боррелиоз, возвратный тиф, лихорадка долины Рифт, а также возбудители чумы, сибирской язвы, мелиоидоза, бруцеллеза, брюшного тифа, псевдотуберкулез, лептоспироза, кокцидиоидомикоза, гистоплазмоза и бластомикоза и др.
Материалом для исследования при остром «системном» синдроме являются кровь, моча, фекалии, рвотные массы, биоптаты печени, а также секционный материал: лимфатические узлы, кусочки печени, селезенки.
12.1. Индикация возбудителей, обусловливающих
острый «системный» синдром
12.1.1. Световая микроскопия.
Микроскопия мазков и мазков-отпечатков с использованием окраски по Граму (возбудители бактериальной и микотической природы), Ребигеру (визуализация капсулы возбудителя сибирской язвы) Романовскому-Гимза (выявление возбудителей лептоспироза, возвратного тифа).
12.1.2. Метод флуоресцирующих антител.
МФА используют для индикации в исследуемом материале возбудителей чумы, сибирской язвы, бруцеллеза, флавивирусов. НМФА используют и для обнаружения антител к возбудителям ГЛПС. Приготовление, окрашивание специфическими иммуноглобулинами и просмотр мазков осуществляют в соответствии с инструкцией по применению препарата.
12.1.3. Полимеразная цепная реакция.
Осуществляют постановку ПЦР для выявления возбудителей арбовирусных лихорадок (ВЗН, ККГЛ, ВКЭ, лихорадки денге), хантавирусной инфекции, геморрагической лихорадки Ласса, иксодового клещевого боррелиоза, а также возбудителей чумы, сибирской язвы, бруцеллеза, мелиоидоза, псевдотуберкулез, лептоспироза, кокцидиоидомикоза, гистоплазмоза и бластомикоза.
12.1.4. Иммуносерологические исследования.
Иммуноферментный анализ, ИХ-тест, серологические реакции используют для выявления антигенов и/или антител классов М и G к возбудителям арбовирусных лихорадок (для выявления антител/антигенов Вunуа-, Toga-, Flaviviridae и др.), хантавирусной инфекции, иксодового клещевого боррелиоза, а также возбудителей чумы, сибирской язвы, бруцеллеза, псевдотуберкулез, лептоспироза.
12.1.5. Темнопольная микроскопия.
Выявление возбудителя лептоспироза, иксодового клещевого боррелиоза с использованием препарата «раздавленная капля».
12.2. Бактериологический анализ
Бактериологический анализ проб клинического материала проводят с целью выделения и идентификации культуры возбудителя бактериальной природы, обусловливающего острый «системный» синдром, и определения его чувствительности к антибактериальным препаратам.
12.2.1. Для проведения исследований используют питательные среды:
- питательные среды для культивирования и выделения чумного микроба (сухая ЧПС);
- питательная среда для выделения и культивирования сибиреязвенного микроба с селективными добавками;
- Ft-агар и (или) набор реагентов для культивирования и выделения туляремийного микроба сухой с глюкозо-витаминной и ингибиторной добавками к питательной среде;
- питательная среда для культивирования и выделения бруцелл сухая с глюкозо-витаминной и ингибиторной добавками;
- питательная среда для выделения и культивирования мелиоидозного микроба;
- питательные среды, содержащие сыворотку, сывороточный альбумин для выделения и культивирования Leptospira spp;
- плотная и жидкая питательная среда для выделения и культивирования мицелиальной фазы микромицетов;
- плотная и жидкая питательная среда для выделения и культивирования тканевой фазы микромицетов;
- питательная среда для выделения возбудителей кишечного иерсиниоза и псевдотуберкулеза (Иерсиния-агар) или дифференциально-диагностические среды;
- питательный агар для культивирования микроорганизмов (мясо-пептонный агар, Хоттингера и др.);
- питательный агар с добавлением крови, витаминных добавок (шоколадный агар с витаминными добавками).
12.2.2. Посевы инкубируют с использованием различных условий (температурный режим, уровень содержания кислорода, углекислого газа и др.).
12.3. Заражение биопробных животных
Для биологического обогащения проб используют метод подкожного (материал, загрязненный сопутствующей микрофлорой) или внутрибрюшинного заражения (чистый материал) белых мышей и морских свинок, серых хомячков.
12.4. Идентификация возбудителей, обусловливающих острый «системный» синдром.
12.4.1. Идентификацию культур возбудителей чумы, сибирской язвы, бруцеллеза, мелиоидоза, брюшного тифа, псевдотуберкулез, лептоспироза осуществляют в соответствии с нормативно-методическими документами для каждого вида возбудителя.
12.4.2. Идентификация возбудителей неустановленного систематического положения, обусловливающих острый «системный» синдром.
При получении отрицательных результатов о наличии в исследуемом материале выше указанных возбудителей исследования продолжают до выявления других возбудителей, обусловливающих острый «системный» синдром, с использованием всего спектра средств диагностики в соответствии пунктом 5.3 настоящих методических рекомендаций.
12.4.3. По результатам идентификации возбудителя инфекционной болезни составляют паспорт штамма, с указанием всех полученных характеристик. Передачу выделенных штаммов микроорганизмов и направление информации о нем осуществляют в соответствии с пунктом 7.4 настоящих методических рекомендаций.
ХIII. Порядок
исследования клинического материала
при остром офтальмологическом синдроме
Причиной острого начала-конъюнктивита с субконъюнктивальными кровоизлияниями, сопровождающегося отёком и гиперемией век, обильным слизисто-гнойным отделяемым из глаз, жжением и светобоязнью или без таковых при отсутствии известных предрасполагающих факторов (острый офтальмологический синдром) могут являться возбудитель туляремии, адено- и энтеровирусы, хламидии и др., редко псевдотуберкулеза.
Материалом для исследования при остром офтальмологическом синдроме являются кровь, соскобы с конъюнктивы, мазок из ротоглотки, СМЖ, фекалии, отделяемое везикул.
13.1. Индикация возбудителей, обусловливающих
острый офтальмологический синдром
13.1.1. Световая микроскопия.
Микроскопия мазков и мазков-отпечатков с использованием окраски по Граму, Романовскому-Гимзе.
13.1.2. Метод флуоресцирующих антител.
МФА используют для индикации в исследуемом материале F. tularensis, Y. pseudotuberculosis, адено- и энтеровирусов, хламидий. Приготовление, окрашивание специфическими иммуноглобулинами и просмотр мазков осуществляют в соответствии с инструкцией по применению препарата.
13.1.3. Полимеразная цепная реакция.
Осуществляют постановку ПЦР для выявления возбудителей туляремии, псевдотуберкулеза, эпидемического аденовирусного кератоконъюнктивита, геморрагического энтеровирусного кератоконъюнктивита, трахомы.
13.1.4. Иммуносерологические исследования.
ИФА, другие серологические реакции используют для выявления антигенов и/или антител классов М и G к возбудителям туляремии, эпидемического аденовирусного кератоконъюнктивита, геморрагического энтеровирусного кератоконъюнктивита, трахомы.
13.2. Бактериологический анализ
Бактериологический анализ проб клинического материала проводят с целью выделения, идентификации культуры возбудителя, обусловливающего острый офтальмологический сидром, и определения его чувствительности к антибактериальным препаратам.
13.2.1. Для проведения исследований используют следующие питательные среды:
- Ft-агар, набор реагентов для культивирования и выделения туляремийного микроба сухой с глюкозо-витаминной и ингибиторной добавками к питательной среде;
- питательный бульон для культивирования микроорганизмов широкого спектра (мясо-пептонный бульон, Хоттингера и др.);
- питательная среда для выделения возбудителей кишечного иерсиниоза и псевдотуберкулеза (Иерсиния-агар) или дифференциально-диагностические среды;
- питательный агар для культивирования микроорганизмов широкого спектра (мясо-пептонный агар, Хоттингера и др.);
- питательный агар с добавлением крови, витаминных добавок для труднокультивируемых микроорганизмов (шоколадный агар с витаминными добавками).
13.2.2. Посевы инкубируют с использованием различных условий (температурный режим, уровень содержания кислорода, углекислого газа и др.).
13.3. Заражение биопробных животных
Для биологического обогащения проб используют метод подкожного (материал, загрязненный сопутствующей микрофлорой) или внутрибрюшинного заражения (чистый материал) белых мышей и морских свинок, серых хомячков.
13.4. Идентификация возбудителей, обусловливающих острый офтальмологический синдром неустановленного систематического положения.
13.4.1. Идентификацию культур туляремии, псевдотуберкулеза осуществляют в соответствии с нормативно-методическими документами для каждого вида возбудителя.
13.4.2. При получении отрицательных результатов о наличии в исследуемом материале возбудителей туляремии, псевдотуберкулеза, эпидемического аденовирусного кератоконъюнктивита, геморрагического энтеровирусного кератоконъюнктивита, трахомы исследования продолжают до выявления других возбудителей, обусловливающих острый офтальмологический синдром с использованием всего спектра средств диагностики в соответствии с пунктом 5.3 настоящих методических рекомендаций.
13.4.3. По результатам идентификации возбудителя болезни составляют паспорт штамма, с указанием всех полученных характеристик. Передачу выделенных штаммов микроорганизмов и направление информации о них осуществляют в соответствии с пунктом 5.4 настоящих методических рекомендаций.
XIV. Порядок исследования проб из объектов
окружающей
среды и от лиц, находившихся в зоне поражения
в случае преднамеренного применения ПБА
14.1. Перечень патогенных биологических агентов,
представляющих наибольшую опасность
при преднамеренном применении
Категория А:
- Variola virus (возбудитель оспы);
- Bacillus anthracis (возбудитель сибирской язвы);
- Yersinia pestis (возбудитель чумы);
- Ботулинический токсин;
- Francisella tularensis (возбудитель туляремии);
- Аренавирусы (возбудители лихорадок Хунин, Мачупо, Себиа, Гуанарито, Ласса);
- Филовирусы (возбудители лихорадок Эбола, Марбург);
- ККГЛ (возбудитель крымской геморрагической лихорадки);
- ЛДР (возбудитель лихорадки Долины Рифт).
Категория В:
- Coxiella burnetti (возбудитель лихорадки Ку);
- Brucella species (возбудитель бруцеллеза);
- Burkholderia pseudomallei (возбудитель мелиоидоза);
- Burkholderia mallei (возбудитель сапа);
- Токсин Ricinus communis (рицин);
- Стафилококковый энтеротоксин В;
- Альфавирусы (возбудители Венесуэльского энцефалита лошадей, Восточного энцефалита лошадей, Западного энцефалита лошадей);
- Rickettsiaprowazekii (возбудитель сыпного тифа);
- энтерогеморрагические Е. coli (возбудитель энтерогеморрагического эшерихиоза);
- Salmonella species (возбудители сальмонеллеза);
- Vibrio cholerae (возбудитель холеры);
- Cryptosporidium parvum (возбудитель криптоспоридиоза).
Категория С:
- Возбудители новых инфекций, например, вирусного энцефалита Нипа, хантавирусного легочного синдрома, тяжелого острого респираторного синдрома (атипичная пневмония, вызванная ТОРС-корона-вирусом).
- грипп А субтипов Н5, Н7;
- MERS (возбудитель Ближневосточного Респираторного Синдрома);
- энтеровируса 71 (возбудитель энтеровирусной инфекции ЭВИ 71).
14.2. Материал для лабораторного исследования при
подозрении
на возможность преднамеренного использования
патогенных биологических агентов
При подозрении на возможность преднамеренного использования патогенных биологических агентов отбору для лабораторного исследования подлежит следующий материал:
14.2.1. Объекты окружающей среды:
- элементы предполагаемого источника ПБА в местах его применения (осколки, оболочки и содержимое биологических боеприпасов, малогабаритного диверсионного снаряжения (контейнеры, пеналы и другие приспособления для заражения воды);
- почва;
- воздух;
- вода водопроводная, поверхностных водоемов, подземных источников, емкостей и резервуаров, используемых для питьевых и хозяйственно-бытовых целей, вода питьевая, в том числе расфасованная в емкости;
- порошки неясного происхождения;
- жидкости неясного происхождения;
- смывы с объектов окружающей среды: наружных поверхностей зданий, поверхностей и предметов помещений (полы, стены, система вентиляции, мебель и т.д.), транспортных средств, растительности;
- соскобы с инвентаря, оборудования, тары и других объектов;
- пищевые продукты (пробы пищевых продуктов из незакрытых емкостей (контейнеров, бочек, ящиков), остатки пищи, употребленной заболевшими, продовольственное сырье, фураж;
14.2.2. Материал от лиц, находившихся в зоне применения ПБА, контактировавших с подозрительным объектом:
- мазок из полости носа, ротоглотки.
14.2.3. Отбор материала для исследования.
Пробы почвы с мест вероятного контаминирования возбудителем берут на глубине до 15 см. При отборе проб с больших участков обследуемую площадь разбивают на квадраты со стороной не более 4 м. В каждом квадрате намечают 5 точек: 4 точки по краям и одну посередине, откуда производят отбор проб. Каждую пробу весом около 100 - 200 г отбирают в стерильный контейнер с завинчивающейся крышкой.
Пробы воды из естественных и искусственных водоемов берут у поверхности (на глубине 10 - 15 см) и у дна при помощи батометра или специальной бутыли. Объем каждой пробы должен быть не менее 0,5 л, а общий объем - не менее 1 л. Кроме этого, отбирают пробы придонного осадка у береговой кромки, которые исследуют как пробы почвы.
Отбор проб воздуха осуществляют с использованием специальных приборов, снаряженных сорбирующей жидкостью или фильтрами (импакторы, импинжеры, мембранные фильтры, сепаратор-пробоотборник). Объем исследуемого воздуха должен составлять не менее 3 - 5 м3.
Смывы с объектов окружающей среды (незащищенных участков кожи, одежды, тары для пищевых продуктов) делают с мест наиболее вероятного контаминирования возбудителем с помощью стерильного тампона, смоченного стерильным 0,9 % раствором натрия хлорида, который затем помещают в пробирки с транспортной средой. Площадь смыва одним тампоном составляет около 100 см2.
Порошок отбирают стерильным совком и помещают в полипропиленовые контейнеры с завинчивающимися крышками, порошкообразный налет и капли жидкости осторожно собирают стерильным тампоном, смоченным 0,9 % раствором натрия хлорида, который затем помещают в пробирку с транспортной средой.
При наличии подозрительных капель или порошкообразных веществ на растениях с них делают смыв (как описано выше), либо срезают их скальпелем или ножницами и помещают в стерильную емкость.
При возникновении необходимости исследования пищевых продуктов, продовольственного сырья в местах их хранения производят отбор капель жидкости, порошкообразного налета как описано выше. Отбор проб пищевых продуктов из незакрытых емкостей (контейнеров, бочек, ящиков) проводят раздельно, небольшими порциями, по 50 - 100 г, из поверхностных слоев продуктов вне зависимости от их консистенции.
При необходимости отбора проб неупакованного фуража (овес, комбикорм) также обращают внимание на наличие косвенных признаков заражения. Пробы весом около 50 г отбирают из нескольких мест поверхностного слоя отдельно в стерильную посуду. Из брикетированного корма делают срезы поверхностного слоя весом около 50 г. Пробы прессованных кормов (сено, солома) берут с поверхности (на глубине 1 - 2 см) пинцетом или ножницами.
Отбор проб для исследования методом ПЦР из объектов окружающей среды, пищевых продуктов, продовольственного сырья осуществляют так же, как и для бактериологических исследований.
Мазки из полости носа берут сухими стерильными ватными тампонами. Тампон вводят по наружной стенке носа на глубину 2 - 3 см до нижней раковины, затем слегка опускают книзу, вводят в нижний носовой ход под нижнюю раковину, делают вращательное движение и удаляют вдоль наружной стенки носа. После забора материала рабочую часть зонда с ватным тампоном помещают в стерильную пробирку с транспортной средой (стержень аккуратно обламывают, оставляя рабочую часть зонда с материалом в транспортной среде, и закрывают пробирку). Для исследования методом ПЦР материал (рабочую часть зонда с ватным тампоном) помещают в микроцентрифужную пробирку объемом 1,5 - 2,0 мл с завинчивающейся или защелкивающейся крышкой с 500 мкл стерильного 0,9 % раствора натрия хлорида или раствора фосфатного буфера.
Мазки из ротоглотки берут сухими стерильными зондами с ватными тампонами вращательными движениями с поверхности миндалин, небных дужек и задней стенки ротоглотки. После взятия материала тампон (рабочую часть зонда с ватным тампоном) помещают в стерильную одноразовую пробирку с транспортной средой (стержень аккуратно обламывают, оставляя рабочую часть зонда с материалом в транспортной среде, и закрывают пробирку). Для исследования методом ПЦР материал (рабочую часть зонда с ватным тампоном) помещают в микроцентрифужную пробирку объемом 1,5 - 2,0 мл с завинчивающейся или защелкивающейся крышкой с 500 мкл стерильного 0,9 % раствора натрия хлорида или раствора фосфатного буфера.
14.3. Индикация неизвестных патогенных биологических агентов
14.3.1. Подготовка проб к исследованию:
- перевод в жидкую фазу;
- концентрация и деление на аликвоты.
14.3.2. Световая микроскопия.
Микроскопия мазков и мазков-отпечатков, окрашенных по Граму, Романовскому-Гимзе (возбудители бактериальной природы), Цилю-Нильсону (визуализация спор возбудителя сибирской язвы).
14.3.3. Метод флуоресцирующих антител.
МФА используют для индикации в исследуемом материале возбудителей чумы, сибирской язвы, бруцеллеза, туляремии, сапа, мелиоидоза, холеры, энтеропатогенных иерсиний, кокцидиоидомикоза, флави- и хантавирусов. Приготовление, окрашивание специфическими иммуноглобулинами и просмотр мазков осуществляют в соответствии с инструкцией по применению препарата.
14.3.4. Полимеразная цепная реакция.
Осуществляют постановку ПЦР для выявления возбудителен лихорадки денге и других арбовирусных лихорадок, хантавирусной инфекции, геморрагических лихорадок, вызванных вирусами Эбола, Марбург, Хунин, Мачупо, Себиа, Гуанарито, Ласса, лихорадки долины Рифт, ВЭЛ, ВсЭЛ, ЗЭЛ, Крымской геморрагической лихорадки, оспы, вирусного гепатита А, гриппа, а также возбудителей чумы, сибирской язвы, бруцеллеза, туляремии, сапа, мелиоидоза, холеры, энтерогеморрагических эшерихий, лептоспироза, кокцидиоидомикоза. Подтверждение полученных положительных результатов проводят с использование генодиагностических препаратов, основанных на выявлении других фрагментов генома патогенов, валидированных ПЦР-протоколов или с помощью секвенирования полученных ампликонов.
Исследования проводят в соответствии с требованиями действующих нормативно-методических документов и инструкций по применению препаратов по следующей схеме:
- выделение ДНК/РНК;
- проведение ОТ-ПЦР с семейство- и/или родо-, видоспецифичными праймерами для выявления вирусов I - II групп патогенности (приложение 2, 3);
- постановка ПЦР для выявления ДНК/РНК возбудителей чумы, сибирской язвы, бруцеллеза, туляремии, сапа, мелиоидоза, холеры, кокцидиоидомикоза, энтерогеморрагических эшерихий, лептоспироза.
14.3.5. Иммуносерологические исследования.
ИФА, ИХ-тест, серологические реакции используют для выявления антигенов возбудителей арбовирусных лихорадок, хантавирусной инфекции, вирусных гепатитов, а также возбудителей чумы, сибирской язвы, бруцеллеза, энтерогеморрагических эшерихий, брюшного тифа, лептоспироза.
14.3.6. Темнопольная микроскопия.
Выявление возбудителя лептоспироза, иксодового клещевого боррелиоза с использованием препарата «раздавленная капля».
14.4. Бактериологический анализ.
Бактериологический анализ проб окружающей среды проводят с целью выделения, идентификации возбудителей чумы, сибирской язвы, бруцеллеза, туляремии, холеры, энтеропатогенных иерсиний, энтерогеморрагических эшерихий, брюшного тифа, дизентерии, лептоспироза, сапа, мелиоидоза и определения чувствительности к антибактериальным препаратам.
14.4.1. Для проведения исследований используют широкий спектр дифференциально-диагностических, селективных питательных сред:
- питательные среды для культивирования и выделения чумного микроба (сухая ЧПС);
- питательная среда для выделения и культивирования сибиреязвенного микроба с селективными добавками;
- Ft-агар, набор реагентов для культивирования и выделения туляремийного микроба сухой с глюкозо-витаминной и ингибиторной добавками к питательной среде;
- питательная среда для культивирования и выделения бруцелл сухая с глюкозо-витаминной и ингибиторной добавками;
- питательная среда с ростовой и селективной добавкой для культивирования L. pneumophila;
- плотная и жидкая питательная среда для выделения и культивирования В. pseudomallei и В. mallei;
- питательная среда для выделения и культивирования холерного вибриона (щелочной агар), щелочная пептонная вода pH 8,0 и TCBS среда для выделения и культивирования возбудителя холеры;
- питательная среда, содержащая сыворотку, сывороточный альбумин для культивирования Leptospira spp.;
- питательные среды для накопления и культивирования энтеробактерий (среда № 3, бульон Мосселя, среда Экмана с лактозой селенитовый бульон, RVS-бульон;
- питательные среды для выделения энтеробактерий (агар Эндо, висмут-сульфит агар, агар Плоскирева);
- питательная среда для выделения возбудителей кишечного иерсиниоза и псевдотуберкулеза (Иерсиния-агар) или дифференциально-диагностические среды бульон и агар Мак Конки или Левина, с добавлением антибиотиков цефотаксим (25 мкг/мл) и налидиксовая кислота (4 мкг/мл) и SDS-бульон или TSB-бульон для выделения и культивирования Е. coli О104:Н4;
- плотная и жидкая питательная среда Сабуро с 1 - 1,5 % дрожжевого экстракта и 4 % глюкозы с добавлением левомицетина (хлорамфеникола) - 0,05 мг на 1 мл среды, актидиона (циклогексимида) - 0,1 - 1,0 мг на 1 мл среды для выделения и культивирования мицелиальной фазы С. immitis, С. posadasii;
- дифференциально-диагностическая среда Сорбитол - Е. coli 0157:Н7 - агар, SDS-бульон или TSB-бульон для выделения и культивирования Е. coli 0157:Н7;
- питательный бульон для культивирования микроорганизмов широкого спектра (мясо-пептонный бульон, Хоттингера и др.);
- питательный агар для культивирования микроорганизмов широкого спектра (мясо-пептонный агар, Хоттингера и др.);
- питательный агар с добавлением крови, витаминных добавок для труднокультивируемых микроорганизмов (шоколадный агар с витаминными добавками).
14.4.2. Посевы инкубируют с использованием различных условий (температурный режим, уровень содержания кислорода, углекислого газа и др.).
14.5. Заражение биопробных животных
Заражение биопробных животных осуществляют только после получения отрицательных результатов индикации на наличие в материале вирусов I группы патогенности.
Для биологического обогащения проб используют метод подкожного и накожного заражения белых мышей, морских свинок, серых хомячков.
14.6. Индикация биологических токсинов
Экспресс-индикация токсинов проводится с помощью индикаторных иммунохроматографических элементов для определения ботулинического токсина типа А и В, холерного экзотоксина, стафилококкового энтеротоксина типа В и рицина. Определение энтеротокеина Clostridium perfringens проводят с использованием метода обратной пассивной латексной агглютинации.
При необходимости использования биологического метода постановку биопробы осуществляют после исключения наличия в пробе вирусов I группы патогенности:
- на ботулинический токсин (заражение двух белых мышей);
- на стафилококковый токсин (заражение четырех белых мышей).
14.7. Идентификация патогенных биологических агентов
Идентификацию культур возбудителей чумы, сибирской язвы, бруцеллеза, туляремии, энтеропатогенных иерсиний, холеры, сапа, мелиоидоза, брюшного тифа, лептоспироза осуществляют в соответствии с требованиями нормативно-методических документов для каждого вида.
14.8. Идентификация возбудителей неустановленного
систематического положения
14.8.1. При получении отрицательных результатов о наличии в исследуемом материале возбудителей геморрагических лихорадок, вызванных вирусами Эбола, Марбург, Хунин, Мачупо, Себиа, Гуанарито, Ласса, лихорадки долины Рифт, ВЭЛ, ВсЭЛ, ЗЭЛ, Крымской-Конго геморрагической лихорадки, оспы, вирусного гепатита А и гриппа, возбудителей чумы, сибирской язвы, бруцеллеза, туляремии, холеры, сапа, мелиоидоза, брюшного тифа, лептоспироза исследования продолжают до выявления других возбудителей с использованием всего спектра средств диагностики в соответствии с пунктом 5.3 настоящих методических рекомендаций.
14.8.2. По результатам идентификации возбудителя инфекционной болезни составляют паспорт штамма, с указанием всех полученных характеристик. Передачу, выделенных штаммов микроорганизмов, направление информации о них осуществляют в соответствии с пунктом 5.4 настоящих методических рекомендаций.
Приложение 1
|
Вид материала |
Объем |
Транспортная система |
Условия транспортирования |
Условия хранения |
|
1 |
2 |
3 |
4 |
5 |
|
Кровь |
5 мл |
Посев на двухфазную среду |
при температуре 37 °С |
|
|
На тампоне |
В пробирку со средой Кери-Блейра |
при комнатной температуре (18 - 20 °С) в течение 48 - 72 ч |
||
|
На тампоне |
В пробирку со средой Эймса с углем |
при комнатной температуре (18 - 20 °С) в течение 48 - 72 ч |
||
|
5 мл |
В пробирку с антикоагулянтом (ЭДТА или цитратом натрия) |
при температуре 2 - 8 °С в течение 1 суток |
при температуре 2 - 8 °С в течение 5 суток |
|
|
5 мл |
В пробирку с активатором образования сгустка |
при температуре 2-8 °С в течение 1 суток |
||
|
2-5 мл |
В криопробирку - для вирусологических исследований |
при температуре 0 - 4 °С - не более суток при температуре минус 70 °С или в жидком азоте - длительно |
||
|
Мазки из полости носа Мазки из ротоглотки Содержимое везикул Содержимое пустул Содержимое язв Содержимое бубона |
|
Мазок на стекле |
при комнатной температуре (18 - 20 °С) |
|
|
На тампоне |
В пробирку со средой Кери-Блейра |
при комнатной температуре (18 - 20 °С) в течение 48 - 72 ч |
||
|
На тампоне |
В пробирку со средой Эймса с углем |
при комнатной температуре (18 - 20 °С) в течение 48 - 72 ч |
||
|
На тампоне |
В пробирку с 0,9 % раствором натрия хлорида - для ПЦР |
при температуре 2 - 8 °С - в течение 1 суток, при температуре минус 20 °С - в течение 1 недели, при температуре минус 70 °С, в жидком азоте - длительно |
||
|
На тампоне |
В пробирку с питательным бульоном - для бактериологических исследований |
при комнатной температуре (18 - 20 °С) в течение 48 - 72 ч |
||
|
На тампоне |
В криопробирку - для вирусологических исследований |
при температуре 0 - 4 °С - не более суток при температуре минус 70 °С или в жидком азоте - длительно |
||
|
Смывы из полости носа Смывы из ротоглотки Мокрота Рвотные массы Моча |
На тампоне |
В пробирку со средой Кери-Блейра |
при комнатной температуре (18 - 20 °С) в течение 48 - 72 ч |
|
|
На тампоне |
В пробирку со средой Эймса с углем |
при комнатной температуре (18 - 20 °С) в течение 48 - 72 ч |
||
|
0,3 мл |
В пробирку - для ПЦР |
с соблюдением «холодовой» цепи |
при температуре 2 - 8 °С - в течение 1 суток, при температуре минус 20 °С - в течение 1 недели, при температуре минус 70 °С, в жидком азоте - длительно |
|
|
5 - 10 мл |
В контейнер - для бактериологических исследований |
при комнатной температуре (18 - 20 °С) в течение 48 - 72 ч |
||
|
2 - 5 мл |
В криопробирку - для вирусологических исследований |
при температуре 0 - 4 °С - не более суток при температуре минус 70 °С или в жидком азоте - длительно |
||
|
Аспираты из трахеи Бронхоальвеолярный лаваж Плевральный выпот Желчь |
1 - 5 мл |
Посев на двухфазную среду |
при температуре 37 °С |
|
|
На тампоне |
В пробирку со средой Кери-Блейра |
при комнатной температуре (18 - 20 °С) в течение 48 - 72 ч |
||
|
На тампоне |
В пробирку со средой Эймса с углем |
при комнатной температуре (18 - 20 °С) в течение 48 - 72 ч |
||
|
0,3 мл |
В пробирку - для ПЦР |
с соблюдением «холодовой» цепи |
при температуре 2 - 8 °С - в течение 1 суток, при температуре минус 20 °С - в течение 1 недели, при температуре минус 70 °С, в жидком азоте - длительно |
|
|
2 - 10 мл |
В пробирку - для бактериологических исследований |
при комнатной температуре 18 - 20 °С в течение 48 - 72 ч |
||
|
5 ? |
2 - 5 мл |
В криопробирку - для вирусологических исследований |
при температуре 0 - 4 °С - не более суток при температуре минус 70 °С или в жидком азоте - длительно |
|
|
Фекалии |
На тампоне |
В пробирку со средой Кери-Блейра |
при комнатной Температуре (18 - 20 °С) в течение 48 - 72 ч |
|
|
На тампоне |
В пробирку - для ПЦР |
с соблюдением «холодовой» цепи |
при температуре 2 - 8 °С - в течение 1 суток, при температуре минус 20 °С - в течение 1 недели, при температуре минус 70 °С, в жидком азоте - длительно |
|
|
2 - 4 гр |
В контейнер - для бактериологических исследований |
с соблюдением «холодовой» цепи |
при температуре 2 - 8 °С |
|
|
2 - 5 мл |
В криопробирку - для вирусологических исследований |
при температуре 0 - 4 °С - не более суток при температуре минус 70 °С или в жидком азоте - длительно |
||
|
СМЖ |
1 мл |
Посев на двухфазную среду |
при температуре 37 °С (на грелке) |
|
|
На тампоне |
В пробирку со средой Кери-Блейра |
при комнатной температуре 18 - 20 °С в течение 48 - 72 ч |
||
|
На тампоне |
В пробирку со средой Эймса с углем |
при комнатной температуре 18- 20 °С в течение 48 - 72 ч |
||
|
0,3 |
В пробирку - для ПЦР |
с соблюдением «холодовой» цепи |
при температуре 2 - 8 °С - в течение 1 суток, при температуре минус 20 °С - в течение 1 недели, при температуре минус 70 °С, в жидком азоте - длительно |
|
|
1 мл |
В пробирку - для бактериологических исследований |
с соблюдением «холодовой» цепи |
при температуре 2- 8 °С |
|
|
1 мл |
В криопробирку - для вирусологических исследований |
при температуре 0 - 4 °С - не более суток при температуре минус 70 °С или в жидком азоте - длительно |
||
Приложение 2
Схема выявления и идентификации ПБА с неустановленным
систематическим положением
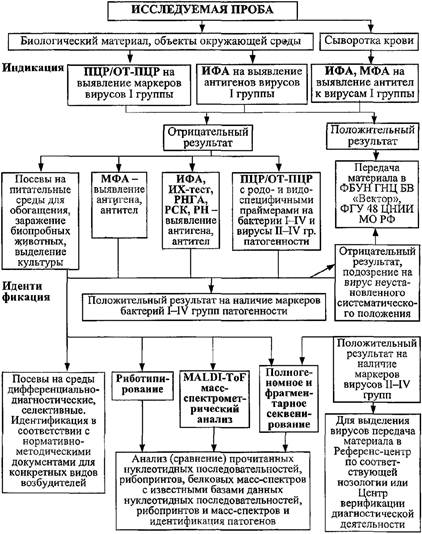
Перечень сокращений и определений
АБП - антибактериальные препараты.
Болезнь - инфекционная (паразитарная) болезнь, вызывающая чрезвычайную ситуацию в области санитарно-эпидемиологического благополучия населения, характеризующаяся тяжелым клиническим течением и (или) неясной клинической картиной, возбудителем которой могут быть микроорганизмы неустановленного систематического положения (новые, ранее не известные).
ACM - атомно-силовая микроскопия.
БМБ - бокс микробиологической безопасности.
БС - биологические средства.
БСМЭ - бюро судебно-медицинской экспертизы.
Вирус ККГЛ - вирус Крымской-Конгб геморрагической лихорадки.
ВЗН - вирус Западного Нила.
ВКЭ - вирус клещевого энцефалита.
ГЛПС - геморрагическая лихорадка с почечным синдромом.
ДНК - дезоксирибонуклеиновая кислота.
тИФА - твердофазный иммуноферментный анализ.
ИФА - иммуноферментный анализ.
ИХ-тест - иммунохроматографический тест.
КГЛ - Крымская геморрагическая лихорадка.
МО - медицинские организации.
МИБП - медицинские иммунобиологические препараты.
МКБ - международная классификация болезней.
МК СПЭБ - мобильный комплекс специализированной противоэпидемической бригады, функциональное формирование ФКУЗ «Противочумный институт» Роспотребнадзора.
МС - масс-спектрометрия.
МУ - методические указания.
МУК - методические указания по контролю.
МФА - метод флуоресцирующих антител.
НМФА - непрямой метод флуоресцирующих антител.
ООИ - особо опасные инфекции.
ПБА - патогенный биологический агент.
ПЦР - полимеразная цепная реакция.
ПЧС - противочумная станция.
СМЖ - спинномозговая жидкость.
РА - реакция агглютинации.
РАО - реакция агломерации объемная.
РКЭ - развивающиеся куриные эмбрионы.
РНК - рибонуклеиновая кислота.
РИГА - реакция непрямой гемагглютинации.
СП - санитарно-эпидемиологические правила.
ЧС - чрезвычайная ситуация.
Нормативные и методические документы
1. Федеральный закон от 21.12.1994 № 68-ФЗ «О защите населения и территорий от чрезвычайных ситуаций природного и техногенного характера».
2. Федеральный закон от 30.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения».
3. Указ Президента Российской Федерации от 28.08.2003 № 991 «О совершенствовании единой государственной системы предупреждения и ликвидации чрезвычайных ситуаций».
4. «Основы государственной политики в области обеспечения химической и биологической безопасности Российской Федерации на период. до 2025 года и дальнейшую перспективу» утверждены Президентом Российской Федерации 1 ноября 2013 г. № Пр-2573.
5. Указ Президента Российской Федерации от 15 февраля 2006 г. № 116 «О мерах по противодействию терроризму».
6. Постановление Правительства Российской Федерации от 30.12.2003 № 794 «О единой государственной системе предупреждения и ликвидации чрезвычайных ситуаций».
7. Постановление Правительства Российской Федерации от 30.06.2004 № 322 «Об утверждении Положения о Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека».
8. Распоряжение Правительства Российской Федерации от 17.01.2005 № 32-р «Перечень подведомственных Росздравнадзору федеральных государственных учреждений».
9. Постановление Правительства Российской Федерации от 16.05.2005 № 303 «О разграничении полномочий федеральных органов исполнительной власти в области обеспечения биологической и химической безопасности Российской Федерации».
10. Постановление Правительства Российской Федерации от 19.08.2005 № 529 «Об организации и контроле за введением и отменой ограничительных мероприятий (карантина) по предписанию территориального органа, осуществляющего государственный санитарно-эпидемиологический надзор».
11. Постановление Правительства Российской Федерации от 15.09.2005 № 569 «О Положении об осуществлении государственного санитарно-эпидемиологического надзора, в Российской Федерации».
12. Приказ Минздрава России от 05.02.2004 № 37 «О взаимодействии по вопросам обеспечения санитарной охраны территории Российской Федерации и проведения мероприятий по профилактике карантинных и других особо опасных инфекций».
13. Положение о взаимодействии Минздрава России, МВД России и ФСБ России при осуществлении контроля за санитарно-гигиеническим и противоэпидемическим состоянием объектов массового сосредоточения людей и действиях при чрезвычайных ситуациях, вызванных террористическими акциями от 25.01.2000 № 03-23/2-11.
14. Постановление Главного государственного санитарного врача Российской Федерации от 05.09.2005 № 21 «О совершенствовании государственного санитарно-эпидемиологического надзора по противодействию угрозе биотерроризма».
15. Положение о функциональной подсистеме надзора за санитарно-эпидемиологической обстановкой единой государственной системы предупреждения и ликвидации чрезвычайных ситуаций (утверждено Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации от 05.10.2005 № 01-12/176-05).
16. Приказ Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека от 1 декабря 2017 г. № 1116 «О совершенствовании системы мониторинга, лабораторной диагностики инфекционных и паразитарных болезней и индикации ПБА в Российской Федерации».
17. Приказ Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека от 01.04.2015 № 274 «Об организации деятельности системы противочумных учреждений Роспотребнадзора».
18. Приказ Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека от 06.03.2018 № 118 «О внесении изменений в перечни подведомственных Роспотребнадзору федеральных бюджетных и казенных учреждений здравоохранения и науки, утвержденного приказом Роспотребнадзора от 1 февраля 2011 г. № 27».
19. Постановление Главного государственного санитарного врача Российской Федерации от 04.02.2016 № 11 «О представлении внеочередных донесений о чрезвычайных ситуациях санитарно-эпидемиологического характера».
20. Постановление главного государственного санитарного врача Российской Федерации от 12.12.2016 № 180 «О дополнительных мероприятиях, направленных на профилактику сибирской язвы в Российской Федерации».
21. Постановление главного государственного санитарного врача Российской Федерации от 14.02.2017 № 22 «О дополнительных мероприятиях, направленных на профилактику туляремии в Российской Федерации».
22. СП 1.3.3118-13 «Безопасность работы с микроорганизмами I - II групп патогенности (опасности)».
23. СП 1.3.2322-08 «Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней».
24. Международные медико-санитарные правила (Женева, 2005 г.).
25. СП 1.2.1318-03 «Порядок выдачи санитарно-эпидемиологического заключения о возможности проведения работ с возбудителями инфекционных заболеваний человека I - IV групп патогенности (опасности), генно-инженерно-модифицированными микроорганизмами, ядами биологического происхождения».
26. СП 3.1.7.2627-10 «Профилактика бешенства среди людей: санитарно-эпидемиологические правила».
27. СП 3.1.7.2613-10 «Профилактика бруцеллеза: санитарно-эпидемиологические правила».
28. СП 3.1.1.3473-17 «Профилактика брюшного тифа и паратифов: санитарно-эпидемиологические правила».
29. СП 3.1.958-00 «Профилактика вирусных гепатитов. Общие требования к эпидемиологическому надзору за вирусными гепатитами».
30. СП 3.1.7.2614-10 «Профилактика геморрагической лихорадки с почечным синдромом».
31. СП 3.1.2.3117-13 «Профилактика гриппа и других острых респираторных вирусных инфекций».
32. СП 3.1.7.2615-10 «Профилактика иерсиниоза».
33. СП 3.1.3.2352-08 «Профилактика клещевого вирусного энцефалита».
34. СП 3.1.7.2811-10 «Профилактика коксиеллеза (лихорадка Ку)».
35. СП 3.1.7.2835-11 «Профилактика лептоспирозной инфекции у людей».
36. СП 3.1.7.2817-10 «Профилактика листериоза у людей».
37. СП 3.1.2.2512-09 «Профилактика менингококковой инфекции».
38. СП 3.1.1.3108-13 «Профилактика острых кишечных инфекций».
39. СП 3.1.7.2616-10 «Профилактика сальмонеллеза».
40. СП 3.1.7.2629-10 «Профилактика сибирской язвы».
41. СП 3.1.7.2642-10 «Профилактика туляремии».
42. СП 3.1.1.2521-09 «Профилактика холеры. Общие требования к эпидемиологическому надзору за холерой на территории Российской Федерации».
43. СП 3.1.7.3465-17 «Профилактика чумы».
44. СП 3.1.7.3107-13 «Профилактика лихорадки Западного Нила».
45. СП 3.4.2318-08 «Санитарная охрана территории Российской Федерации».
46. СП 3.4.2318-08 «Санитарная охрана территории Российской Федерации».
47. СанПиН 2.1.7.2790-10 «Санитарно-эпидемиологические требования к обращению с медицинскими отходами».
48. СП 3.1.3310-15 «Профилактика инфекций, передающихся иксодовыми клещами».
49. МУК 4.2.2217-07 «Выявление бактерий Legionella pneumophila в объектах окружающей среды».
50. МУК 4.2.2413-08 «Лабораторная диагностика и обнаружение возбудителя сибирской язвы».
51. МУК 4.2.2787-10 «Лабораторная диагностика мелиоидоза».
52. МУК 4.2.1887-04 «Лабораторная диагностика менингококковой инфекции и гнойных бактериальных менингитов».
53. МУ 1.3.2970-11 «Лабораторная диагностика натуральной оспы».
54. МУ 4.2.2723-10 «Лабораторная диагностика сальмонеллезов, обнаружение сальмонелл в пищевых продуктах и объектах окружающей среды».
55. МУК 4.2.2831-11 «Лабораторная диагностика сапа».
56. МУК 4.2.2218-07 «Лабораторная диагностика холеры».
57. МУ 3.1.3.2600-10 «Мероприятия по борьбе с лихорадкой Западного Нила на территории Российской Федерации».
58. МУК 4.2.2963-11 «Методические указания по лабораторной диагностике заболеваний, вызываемых Eschericha coli, продуцирующих шига-токсины (STEC - культуры), и обнаружению возбудителей STEC - инфекций в пищевых продуктах».
59. МУ № 04-723/3 «Методические указания по микробиологической диагностике заболеваний, вызываемых энтеробактериями» от 17.12.1984.
60. МУ «Методические указания по организации и проведению разведки для оценки медико-санитарных последствий чрезвычайных ситуаций», 1997.
61. МУК 4.2.992-00 «Методы выделения и идентификации энтерогеморрагической кишечной палочки Е. coli О157:Н7».
62. МУК 4.2.2495-09 «Определение чувствительности возбудителей опасных бактериальных инфекций (чумы, сибирской язвы, холеры, туляремии, бруцеллеза, сапа и мелиоидоза) к антибактериальным препаратам».
63. МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам».
64. МУК 4.2.2136-06 «Организация и проведение лабораторной диагностики заболеваний, вызванных высоковирулентными штаммами вируса гриппа птиц типа А (ВГПА), у людей».
65. МУ 3.4.2552-09 «Организация и проведение первичных противоэпидемических мероприятий в случаях выявления больного (трупа), подозрительного на заболевания инфекционными болезнями, вызывающими чрезвычайные ситуации в области санитарно-эпидемиологического благополучия населения».
66. МУ 3.1/3.5.2497-09 «Организация и проведение противоэпидемических и дезинфекционных мероприятий при натуральной оспе».
67. МУ 3.1.1.2488-09 «Организация и проведение профилактических и противоэпидемических мероприятий против Крымской геморрагической лихорадки».
68. МУ 3.1.3.2355-08 «Организация и проведение эпидемиологического надзора в природных очагах чумы на территории Российской Федерации».
69. МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности».
70. МУ 3.1.1755-03 «Организация эпидемиологического надзора за клещевым риккетсиозом».
71. МУК 4.2.3222-14 «Паразитологическая диагностика малярии».
72. МУК 4.2.2746-10 «Порядок применения молекулярно-генетических методов при обследовании очагов острых кишечных инфекций с групповой заболеваемостью».
73. МУК 4.2.3010-12 «Порядок организации и проведения лабораторной диагностики бруцеллеза для лабораторий территориального, регионального и федерального уровней».
74. МУК 4.2.3007-12 «Порядок организации и проведения лабораторной диагностики Крымской геморрагической лихорадки для лабораторий территориального, регионального и федерального уровней».
75. МУК 4.2.3009-12 «Порядок организации и проведения лабораторной диагностики лихорадки Западного Нила для лабораторий территориального, регионального и федерального уровней».
76. МУК 4.2.2941-11 «Порядок организации и проведения лабораторной диагностики сибирской язвы для лабораторий территориального, регионального и федерального уровней».
77. МУК 4.2.2939-11 «Порядок организации и проведения лабораторной диагностики туляремии для лабораторий территориального, регионального и федерального уровней».
78. МУК 4.2.2870-11 «Порядок организации и проведения лабораторной диагностики холеры для лабораторий территориального, регионального и федерального уровней».
79. МУК 4.2.2940-11 «Порядок организации и проведения лабораторной диагностики чумы для лабораторий территориального, регионального и федерального уровней».
80. МУК 4.2.3019-12 «Организация и проведение лабораторных исследований иерсиниозов на территориальном, региональном и федеральном уровнях».
81. МУК 1.3.1877-04 «Порядок сбора, упаковки, хранения, транспортирования и проведения лабораторного анализа биологического материала от больных (и умерших) пациентов с подозрением на тяжелый острый респираторный синдром (ТОРС)».
82. МУ 3.4.3008-12 «Порядок эпидемиологической и лабораторной диагностики особо опасных, «новых» и «возвращающихся» инфекционных болезней».
83. МУК 3.1.7.3402-16 «Эпидемиологический надзор и лабораторная диагностика бруцеллеза».
84. МУ 3.1.1.2232-07 «Профилактика холеры. Организационные мероприятия. Оценка готовности медицинских учреждений к проведению мероприятий на случай возникновения очага холеры».
85. МУ 3.1.3012-12 «Сбор, учет и подготовка к лабораторному исследованию кровососущих членистоногих в природных очагах опасных инфекционных болезней».
86. МУК 4.2.2218-07 «Серологические методы в диагностике холеры».
87. МУ 4.2.2039-05 «Техника сбора и транспортирования биоматериалов в микробиологические лаборатории».
88. МУ 3.1.1.2363-08 «Энтеровирусные заболевания: клиника, лабораторная диагностика, эпидемиология, профилактика».
89. МУ «Эпидемиологическая диагностика вспышки острых кишечных инфекций», 1998.
90. МУ 3.1.2007-05 «Эпидемиологический надзор за туляремией».
91. МУ 3.1.1.2438-09 «Эпидемиологический надзор и профилактика псевдотуберкулеза и кишечного иерсиниоза».
92. МУ 3.1.1.2969-11 «Эпидемиологический надзор, лабораторная диагностика и профилактика норовирусной инфекции».
93. МУК 4.2.2746-10 «Порядок применения молекулярно-генетических методов при обследовании очагов острых кишечных инфекций с групповой заболеваемостью».
94. МУК 4.2.2029-05 «Санитарно-вирусологический контроль водных объектов».
95. МУК 4.2.2872-11 «Методы выявления и идентификации патогенных бактерий - возбудителей инфекционных заболеваний с пищевым путем передачи в продуктах питания на основе ПЦР с гибридизационно-флуоресцентной детекцией».
96. МУ 3.1.3260-15 «Противоэпидемическое обеспечение населения в условиях чрезвычайных ситуаций, в том числе при формировании очагов опасных инфекционных заболеваний».
97. МР 0100/13745-07-34 от 29.12.2007 «Биологические и микробиологические факторы бактериологическая диагностика брюшного тифа и паратифов А, В и С».
98. МР 0100/4434-06-34 от 18.04.2006 «Быстрая диагностика гриппа и других ОРВИ иммунофлюоресцентным методом».
99. МР 0100/3556-04-34 «Взаимодействие органов управления, учреждений и специализированных формирований при ликвидации последствий террористических актов с применением патогенных биологических агентов и опасных химических веществ».
100. МР «Выявление циркуляции арбовирусов. Методы вирусологических и серологических исследований. Клинико-эпидемиологические характеристики малоизученных арбовирусных инфекций. Подходы к мониторингу природных очагов арбовирусов», Москва, 1991.
101. МР 01/7161-9-34 «Организация и проведение лабораторной диагностики заболеваний, вызванных высокопатогенными штаммами вируса гриппа A (H1N1), у людей».
102. МР 2510/11646-01-34 «Организация и проведение противоэпидемических мероприятий при террористических актах с применением биологических агентов».
103. МР 01/15701-8-34 «Организация мониторинга заносов и распространения гриппа птиц в природных условиях на территории Российской Федерации».
104. МР 4.2.0089-14 «Использование метода времяпролетной масс-спектрометрии с матрично-активированной лазерной десорбцией/ионизацией (MALDI-TOF MS) для индикации и идентификации возбудителей I - II групп патогенности».
105. МР 4.2.0079/1-13 «Организация лабораторной диагностики инфекционных болезней, лабораторного контроля объектов окружающей среды при проведении массовых мероприятий».
106. МР 4.2.0108-16 «Организация и проведение лабораторной диагностики лихорадки денге».
107. Руководство «Санитарно-противоэпидемическое обеспечение населения в чрезвычайных ситуациях». Москва, 2006.
108. Практическое руководство «Специфическая индикация патогенных биологических агентов», 2014.
109. ГОСТ 31904-2012 «Продукты пищевые. Методы отбора проб для микробиологических испытаний».
110. ГОСТ ISO 7218-2015 «Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям».
111. ГОСТ ISO 11133-1-2011 «Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 1. Общие руководящие указания по обеспечению качества приготовления культуральных сред в лаборатории».
112. ГОСТ 26670-91 «Продукты пищевые. Методы культивирования микроорганизмов».
113. ГОСТ 31659-2012 «Продукты пищевые. Методы выявления бактерий рода Salmonella».
114. ГОСТ 32031-2012 «Продукты пищевые. Методы выявления и определения бактерий Listeria monocytogenes».
115. ГОСТ Р 22.0.04-95/22.0.04-97 «Безопасность в чрезвычайных ситуациях. Биолого-социальные чрезвычайные ситуации. Термины и определения».