Скачать ГОСТ Р ИСО 14155-2014 Клинические исследования. Надлежащая клиническая практика
Дата актуализации: 01.01.2021

 ГОСТ Р ИСО 14155-2014
ГОСТ Р ИСО 14155-2014
Клинические исследования. Надлежащая клиническая практика
| Обозначение: |  ГОСТ Р ИСО 14155-2014 ГОСТ Р ИСО 14155-2014 |
| Обозначение англ: |  GOST R ISO 14155-2014 GOST R ISO 14155-2014 |
| Статус: | взамен |
| Название рус.: | Клинические исследования. Надлежащая клиническая практика |
| Название англ.: | Clinical investigations. Good clinical practice |
| Дата добавления в базу: | 21.05.2015 |
| Дата актуализации: | 01.01.2021 |
| Дата введения: | 01.06.2015 |
| Область применения: | В стандарте рассмотрена надлежащая клиническая практика планирования, проведения, документального оформления и представления результатов клинических исследований, проводимых с участием человека, для оценки безопасности или функциональных характеристик медицинских изделий в целях регулирования. Принципы, установленные в стандарте, также применимы ко всем прочим клиническим исследованиям, и их следует придерживаться, насколько это возможно, с учетом характера клинического исследования и национальных регулирующих требований. В стандарте определены общие требования, направленные: - на защиту прав и обеспечение безопасности и благополучия людей; - обеспечение использования научных подходов при проведении клинического исследования и обеспечение достоверности результатов клинического исследования; - определение ответственности спонсора и ответственного исполнителя; - содействие спонсорам, исследователям, этическим комитетам, регулирующим властям и другим органам, вовлеченным в оценку соответствия медицинских изделий. Стандарт не применим к медицинским изделиям для in vitro диагностики. |
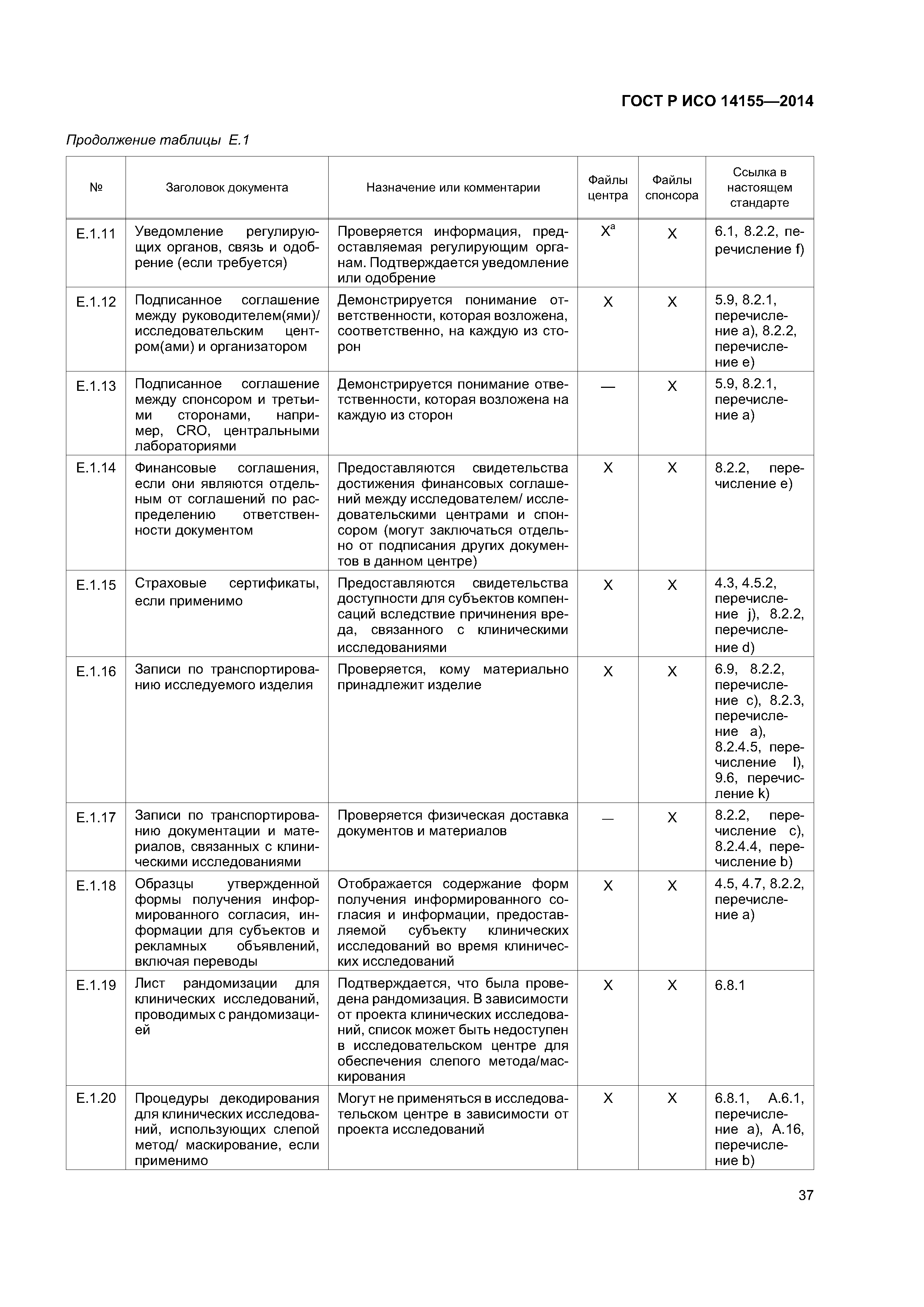
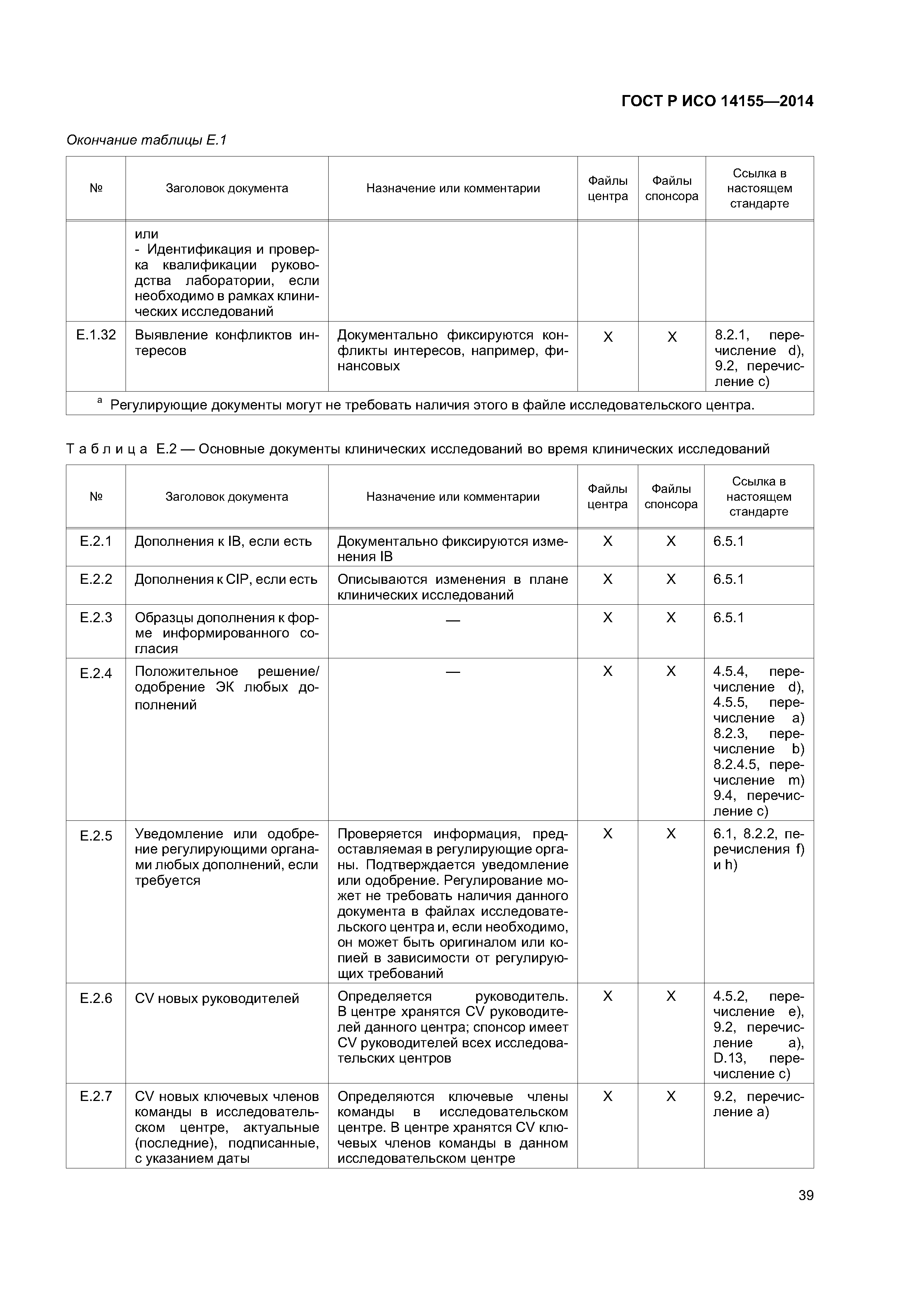
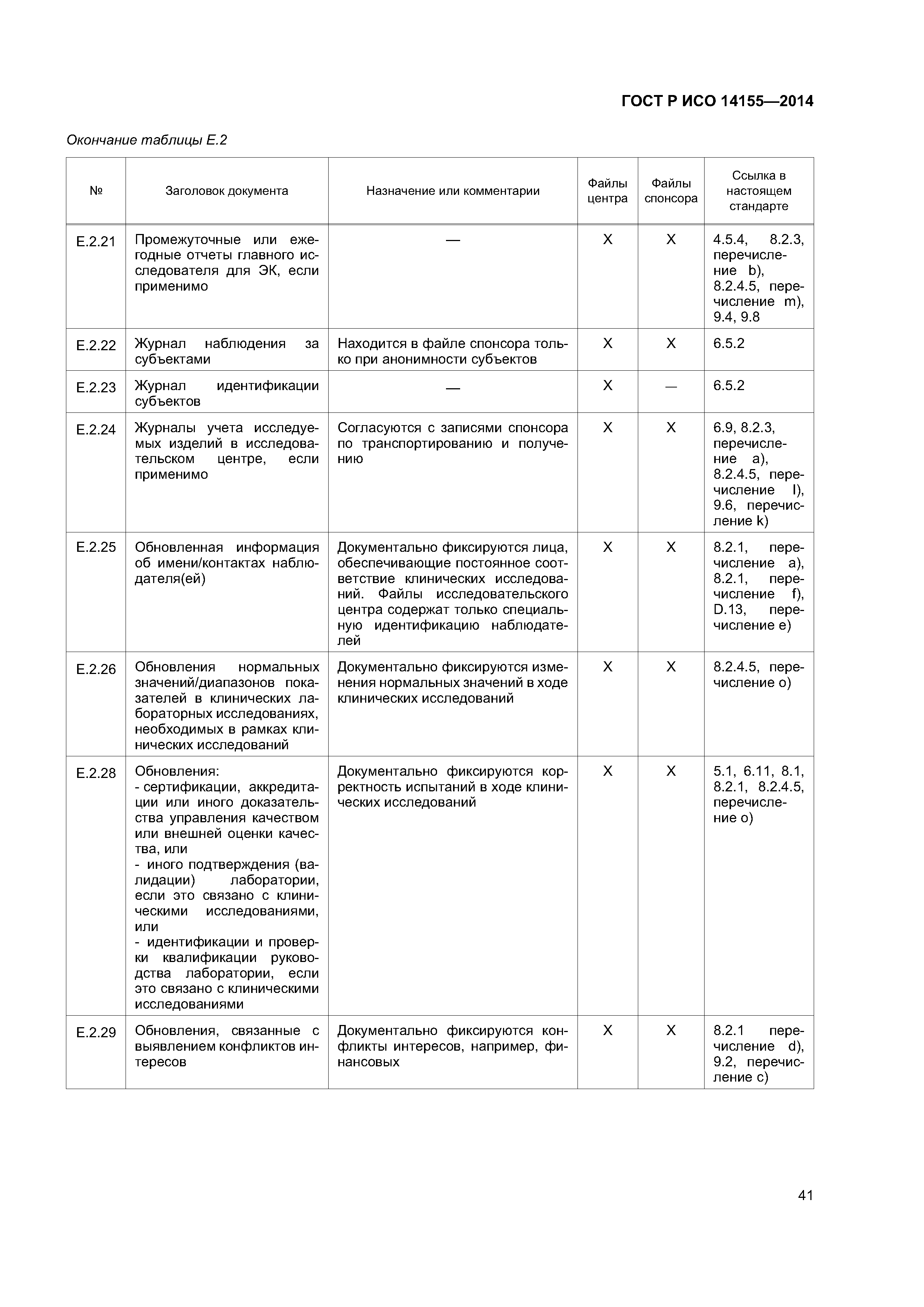
| Оглавление: | 1 Область применения 2 Нормативные ссылки 3 Термины и определения 4 Этические аспекты 4.1 Общие положения 4.2 Злоупотребление влиянием или мотивация 4.3 Компенсация и дополнительное медицинское обслуживание 4.4 Ответственность 4.5 Обмен информацией с этическим комитетом 4.6 Уязвимые группы субъектов 4.7 Информированное согласие 5 План клинического исследования 5.1 Общие положения 5.2 Оценивание риска 5.3 Обоснование проекта клинического исследования 5.4 План клинического исследования 5.5 Журнал (брошюра) исследователя 5.6 Индивидуальная регистрационная карта 5.7 План мониторинга 5.8 Выбор исследовательских центров 5.9 Соглашение (соглашения) 5.10 Маркировка 5.11 Комитет по мониторингу данных 6 Проведение клинического исследования 6.1 Общие положения 6.2 Подготовка исследовательских центров 6.3 Мониторинг исследовательских центров 6.4 Неблагоприятные события и недостатки изделия 6.5 Документы клинического исследования и документирование клинического исследования 6.6 Дополнительные члены исследовательской команды 6.7 Неприкосновенность частной жизни субъекта клинического исследования и конфиденциальность данных клинического исследования 6.8 Управление документами и данными 6.9 Учет исследуемых изделий 6.10 Учет субъектов 6.11 Аудит 7 Приостановка, прекращение и завершение клинического исследования 7.1 Приостановка или прекращение клинического исследования 7.2 Завершение 7.3 Отчет о клиническом исследовании 7.4 Хранение документов 8 Ответственность спонсора 8.1 Обеспечение качества и управление качеством клинического исследования 8.2 Планирование и проведение клинического исследования 8.3 Аутсорсинг обязанностей и функций 8.4 Связь с регулирующими органами 9 Ответственность главного исследователя 9.1 Общие положения 9.2 Квалификация главного исследователя 9.3 Квалификация исследовательского центра 9.4 Связь с этическим комитетом 9.5 Процесс получения информированного согласия 9.6 Соответствие СIР 9.7 Медицинское обслуживание субъектов клинических исследований 9.8 Отчетность по безопасности Приложение А (обязательное) План клинического исследования Приложение В (обязательное) Журнал (брошюра) исследователя Приложение С (справочное) Индивидуальная регистрационная карта Приложение D (справочное) Отчет о клиническом исследовании Приложение Е (справочное) Основные документы клинического исследования Приложение F (справочное) Категории неблагоприятных событий Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов национальным стандартам Российской Федерации и действующим в этом качестве межгосударственным стандартам Библиография |
| Разработан: | ЗАО МЕДИ-ТЕСТ |
| Утверждён: | 04.06.2014 Федеральное агентство по техническому регулированию и метрологии (497-ст) |
| Издан: | Стандартинформ (2015 г. ) |
| Заменяет собой: | |
| Нормативные ссылки: |
















































 ГОСТ Р ИСО 14155-1-2008 «Руководство по проведению клинических испытаний медицинских изделий. Часть 1. Общие требования»
ГОСТ Р ИСО 14155-1-2008 «Руководство по проведению клинических испытаний медицинских изделий. Часть 1. Общие требования»