СПРАВКА
Источник публикации
М.: ФГБУ "Институт стандартизации", 2025
Примечание к документу
Документ вводится в действие с 01.01.2026.
Название документа
"ГОСТ ISO 7405-2025. Межгосударственный стандарт. Стоматология. Оценка биологической совместимости медицинских изделий, применяемых в стоматологии"
(введен в действие Приказом Росстандарта от 16.06.2025 N 547-ст)
"ГОСТ ISO 7405-2025. Межгосударственный стандарт. Стоматология. Оценка биологической совместимости медицинских изделий, применяемых в стоматологии"
(введен в действие Приказом Росстандарта от 16.06.2025 N 547-ст)
Содержание
Приказом Федерального
агентства по техническому
регулированию и метрологии
от 16 июня 2025 г. N 547-ст
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
СТОМАТОЛОГИЯ
ОЦЕНКА БИОЛОГИЧЕСКОЙ СОВМЕСТИМОСТИ МЕДИЦИНСКИХ ИЗДЕЛИЙ,
ПРИМЕНЯЕМЫХ В СТОМАТОЛОГИИ
Dentistry. Evaluation of biocompatibility
of medical devices used in dentistry
(ISO 7405:2018, IDT)
ГОСТ ISO 7405-2025
МКС 11.060.10
Дата введения
1 января 2026 года
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
1 ПОДГОТОВЛЕН Автономной некоммерческой организацией "Институт медико-биологических исследований и технологий" (АНО "ИМБИИТ") на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 30 мая 2025 г. N 185-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Армения | AM | ЗАО "Национальный орган по стандартизации и метрологии" Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Россия | RU | Росстандарт |
Узбекистан | UZ | Узбекское агентство по техническому регулированию |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 16 июня 2025 г. N 547-ст межгосударственный стандарт ГОСТ ISO 7405-2025 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2026 г.
5 Настоящий стандарт идентичен международному стандарту ISO 7405:2018 "Стоматология. Оценка биологической совместимости медицинских изделий, применяемых в стоматологии" ("Dentistry - Evaluation of biocompatibility of medical devices used in dentistry", IDT).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
6 ВВЕДЕН ВПЕРВЫЕ
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
ISO (Международная организация по стандартизации) является федерацией национальных органов по стандартизации (органов - членов ISO). Работу по подготовке международных стандартов проводят под руководством технических комитетов ISO. Каждая организация-член, заинтересованная в области деятельности, для которой создан технический комитет, имеет право быть представленной в данном комитете. Международные правительственные и неправительственные организации также принимают участие в работе ISO. ISO тесно сотрудничает с Международной электротехнической комиссией (IEC) по вопросам стандартизации электротехнической продукции.
Процедуры, примененные при разработке настоящего стандарта, а также процедуры, предназначенные для его дальнейшей поддержки, приведены в Директиве ISO/IEC, часть 1. Следует отметить необходимость различных критериев утверждения для различных видов документов ISO. Настоящий стандарт подготовлен в соответствии с редакционными правилами Директив ISO/IEC, часть 2 (www.iso.org/directives).
Следует учитывать, что элементы настоящего стандарта могут быть предметом патентных прав. ISO не несет ответственности за идентификацию таких прав частично или полностью. Сведения о патентных правах, идентифицированных при разработке настоящего стандарта, указаны во введении и/или в перечне полученных ISO деклараций о патентном праве (см. www.iso.org/patents).
Любая информация о торговой марке продукции, указанной в настоящем стандарте, является информацией, приведенной для удобства пользования.
Разъяснения добровольного характера стандартов, значений конкретных терминов ISO и понятий, связанных с оценкой соответствия, а также информация о соблюдении ISO принципов Всемирной торговой организации (ВТО) по техническим барьерам в торговле (TBT), приведены на URL: www.iso.org/iso/foreword.html.
ISO 7405 был подготовлен Техническим комитетом ISO/TC 106 "Стоматология".
Третье издание отменяет и заменяет ISO 7405:2008 и ISO/TS 22911:2016, которое технически пересмотрено. В третье издание включена поправка ISO 7405:2008/Amd.1:2013.
Основные изменения по сравнению с предыдущим изданием заключаются в следующем:
- при оценке биологического действия в качестве первого ключевого шага перед проведением биологических испытаний требуется определение характеристик материала (см. 5.4.2);
- изменено содержание разделов "Испытание на пульпе и дентине" и "Испытание эндодонтического применения";
- удалено приложение C ("Испытание на острую токсичность");
- добавлен стандарт ISO/TS 22911 в качестве нового приложения C.
Отзывы и вопросы по настоящему стандарту должны быть направлены в национальные органы по стандартизации пользователя. Полный список данных органов приводится по адресу www.iso.org/members.html.
Настоящий стандарт описывает оценку биосовместимости медицинских изделий, применяемых в стоматологии. Настоящий стандарт применим в сочетании с серией стандартов ISO 10993. В настоящем стандарте изложены специальные методы испытаний, в проведении которых в стоматологии накоплен богатый опыт и которые учитывают специфику медицинских изделий для стоматологии.
Были включены только методы исследования, для которых, по мнению членов комитета, существует достаточно опубликованных данных. При рекомендации методов исследования приоритет отдавался необходимости сократить количество исследуемых животных и воздействие на них. Важно, чтобы решение о проведении исследований с использованием животных принималось только после полного и тщательного изучения доказательств, что аналогичный результат не может быть достигнут другими видами исследований.
Для сведения количества животных, требуемых для исследований, к абсолютному минимуму, необходимому для достижения обозначенной цели, может быть приемлемым одновременно проводить разные виды исследований на одном и том же животном, например исследование пульпарного и дентинного использования и испытание пульпарной прокладки. Тем не менее в соответствии с ISO 10993-2, таковые исследования проводят эффективным и гуманным способом. Во всех случаях проведения испытаний на животных таковые должны проводиться с эмпатией и в соответствии со стандартизованными процедурами, описанными для каждого испытания.
Настоящий стандарт не описывает методы испытания на производственные риски.
Приложение B включено для развития методов исследования in vitro и ex vivo, которые продолжат сокращать применение животных для оценки биосовместимости медицинских изделий, используемых в стоматологии.
Приложение C основывается на ISO/TS 22911 и заменяет его.
Настоящий стандарт устанавливает методы испытаний с целью оценки биологического действия медицинских изделий (МИ), применяемых в стоматологии. Настоящий стандарт включает испытание фармакологических веществ, являющихся неотъемлемой частью МИ.
Настоящий стандарт не распространяется на испытания материалов и МИ, которые не контактируют прямо или опосредованно с организмом пациента.
В настоящем стандарте использованы нормативные ссылки на следующие стандарты [для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных - последнее издание (включая все изменения)]:
ISO 1942, Dentistry - Vocabulary (Стоматология. Терминологический словарь)
ISO 6344-1, Coated abrasives - Grain size analysis - Part 1: Grain size distribution test (Шлифовальный материал с покрытием. Гранулометрический анализ. Часть 1. Определение гранулометрического состава)
ISO 10993-1, Biological evaluation of medical devices - Part 1: Evaluation and testing within a risk management process. (Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования в процессе менеджмента рисков)
ISO 10993-2, Biological evaluation of medical devices - Part 2: Animal welfare requirements (Оценка биологического действия медицинских изделий. Часть 2. Требования к обращению с животными)
ISO 10993-3, Biological evaluation of medical devices - Part 3: Tests for genotoxicity, carcinogenicity and reproductive toxicity (Оценка биологического действия медицинских изделий. Часть 3. Исследование генотоксичности, канцерогенности и токсического действия на репродуктивную функцию)
ISO 10993-5, Biological evaluation of medical devices - Part 5: Tests for in vitro cytotoxicity (Оценка биологического действия медицинских изделий. Часть 5. Испытания на цитотоксичность in vitro)
ISO 10993-6, Biological evaluation of medical devices - Part 6: Tests for local effects after implantation (Оценка биологического действия медицинских изделий. Часть 6. Исследования местного действия после имплантации)
ISO 10993-10, Biological evaluation of medical devices - Part 10: Tests for irritation and skin sensitization (Оценка биологического действия медицинских изделий. Часть 10. Исследования на кожную сенсибилизацию)
ISO 10993-11, Biological evaluation of medical devices - Part 11: Tests for systemic toxicity (Оценка биологического действия медицинских изделий. Часть 11. Исследования общетоксического действия)
ISO 10993-12, Biological evaluation of medical devices - Part 12: Sample preparation and reference materials (Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и контрольные образцы)
ISO 10993-18, Biological evaluation of medical devices - Part 18: Chemical characterization of materials (Оценка биологического действия медицинских изделий. Часть 18. Исследование химических свойств материалов в рамках процесса менеджмента риска)
ISO/TS 10993-19, Biological evaluation of medical devices - Part 19: Physico-chemical, morphological and topographical characterization of materials (Оценка биологического действия медицинских изделий. Часть 19. Исследования физико-химических, морфологических и топографических свойств материалов)
ISO 14971, Medical devices - Application of risk management to medical devices (Изделия медицинские. Применение менеджмента риска к медицинским изделиям)
ISO 16443, Dentistry - Vocabulary for dental implants systems and related procedure (Стоматология. Терминологический словарь по системам дентальных имплантатов и процедурам, связанным с ними)
В настоящем стандарте применены термины по ISO 10993-1, а также следующие термины с соответствующими определениями.
ISO и IEC поддерживают терминологические базы данных, используемые в целях стандартизации, по следующим адресам:
- Электропедия IEC: доступна по адресу: http://www.electropedia.org/;
- платформа онлайн-просмотра ISO: доступна по адресу: http://www.iso.org/obp.
3.1 стоматологический материал (dental material): Материал и/или вещество или сочетание материалов и/или веществ, специально разработанные и подготовленные для применения в стоматологической практике и/или связанных с ней процедурах.
3.2 конечный продукт (final product): МИ или его компонент, которые подверглись всем производственным процессам, применяемым для изделия категории "для продажи", включая упаковывание и стерилизацию, если применимо, и также процессам, предшествующим предусмотренному применению, таким как смешивание, предварительная обработка и подготовка.
3.3 положительный контрольный образец (positive control material): Любые достаточно охарактеризованные материал или вещество, которые, подвергаясь исследованию по описанной методике, показывают пригодность тест-системы для получения воспроизводимого, соответствующего положительного или реактивного ответа в тест-системе.
3.4 отрицательный контрольный образец (negative control material): Любые достаточно охарактеризованные материал или вещество, которые, подвергаясь исследованию по описанной методике, показывают пригодность тест-системы для получения воспроизводимого, соответствующего отрицательного, нереактивного или минимального ответа в тест-системе.
Примечание - На практике отрицательный контроль включает контроль экстрагента, экстрагенты/растворители и стандартные образцы (3.5).
3.5 стандартный образец (reference material): Образец материала с одной или несколькими характеристиками, которые установлены и воспроизводимы, что позволяет использовать этот материал или вещество для калибровки прибора, оценки метода измерения или для определения характеристик материала.
Примечание - В настоящем стандарте под стандартным образцом подразумевается любой достаточно охарактеризованный материал и/или вещество, которое при испытании описанным методом демонстрирует пригодность этого метода давать воспроизводимый и достоверный результат. Результат может быть отрицательным или положительным.
3.6 пульповая камера in vitro (in vitro pulp chamber): Оборудование, удерживающее тонкий слой дентина между двумя камерами и позволяющее жидкости и молекулам задерживаться или диффундировать через "дентинный барьер".
3.7 диффузия (diffusion): Пассивное перемещение растворенных веществ (солюбилизированных компонентов) за счет градиента диффузии через "дентинный барьер".
4.1.1 Общая часть
В настоящем стандарте классификация МИ, применяемых в стоматологии, приведена в соответствии с ISO 10993-1. Если изделия или материал могут быть отнесены к нескольким категориям, то должны применяться более строгие требования к испытаниям. При многократном воздействии изделия решение об отнесении изделия к какой-либо категории должно учитывать потенциальный совокупный эффект, принимая во внимание период времени, в течение которого происходит это воздействие.
Примечание - В данном контексте термин "стоматология" включает челюстно-лицевую область.
4.1.2 Изделия, не контактирующие с организмом человека
Эти МИ не контактируют с организмом пациента прямо или опосредованно и не входят в область применения ISO 10993-1.
4.1.3 Изделия, контактирующие с поверхностностью тела человека
Эта группа включает в себя МИ, контактирующие с поверхностью неповрежденной или поврежденной кожи или слизистой оболочки полости рта, и контактирующие с внешними поверхностями твердых тканей зуба, включая эмаль, дентин и цемент.
Примечание - При некоторых обстоятельствах дентин и цемент рассматривают как поверхности контакта, например после рецессии десны.
4.1.4 Изделия, присоединяемые извне
К таким МИ относятся стоматологические изделия, которые проникают и контактируют со слизистой оболочкой полости рта, твердыми тканями зуба, пульпой или костью, или любой их комбинацией, а также подвергаются воздействию окружающей среды полости рта.
Примечание - В эту группу также входят любые виды подкладочных материалов или основы, которые используются при реставрации.
4.1.5 Имплантируемые изделия, применяемые в стоматологии
Эти МИ включают в себя зубные имплантаты и другие стоматологические МИ, которые частично или полностью имплантируют в следующие ткани организма:
a) мягкие ткани, например поднадкостничные зубные и подкожные имплантаты;
b) кость, например внутрикостные имплантаты и заменители кости;
c) пульпо-дентиновый комплекс зуба, например эндодонтические материалы;
d) при любой комбинации тканей, например чрезкостные имплантаты.
4.2.1 Общая часть
В настоящем стандарте МИ, применяемые в стоматологии, классифицируют по длительности контакта в соответствии с ISO 10993-1, 4.2.2 - 4.2.4.
4.2.2 Изделия кратковременного контакта
Изделия, общее время однократного или многократного применения или контакта которых может составлять не более 24 ч.
4.2.3 Изделия длительного контакта
Изделия, общее время однократного, многократного или непрерывного применения или контакт которых может превысить 24 ч, но составит не более 30 сут.
4.2.4 Изделия долговременного контакта
Изделия, общее время однократного, многократного или непрерывного применения или контакт которых превышает 30 сут. При многократном воздействии изделия решение об отнесении изделия к какой-либо категории должно учитывать потенциальный совокупный эффект, принимая во внимание период времени, в течение которого происходит это воздействие.
Примечание - Определение термина "долговременный" предназначено для применения исключительно при использовании настоящего стандарта. Оно совпадает с определением, приведенным в ISO 10993-1.
Каждое МИ, применяемое в стоматологии, должно быть подвергнуто структурированной программе биологической оценки в рамках процесса менеджмента риска (см. ISO 10993-1). Руководство по реализации этой программы приведено в ISO 14971 и ISO 10993-1.
Программа биологической оценки должна включать анализ наборов данных, касающихся биологических свойств каждого МИ, применяемого в стоматологии. Если эта часть программы биологической оценки указывает на неполноту одного или нескольких наборов данных и необходимость дальнейшего исследования, то исследования должны проводиться с использованием методов, описанных в стандартах серии ISO 10993 или в настоящем документе, или в обоих стандартах. Если выбраны методы, не включенные в данные стандарты, то необходимо сделать обоснование выбора этих методов.
Для комбинированных продуктов конечный продукт должен быть оценен в соответствии с настоящим стандартом в сочетании с любыми применимыми стандартами.
Примечание 1 - В данном контексте комбинированными продуктами являются стоматологические МИ любого типа, которые содержат или включают в состав в качестве неотъемлемой части вещество, которое:
a) при самостоятельном применении является лекарственным средством или биологическим продуктом;
b) может оказывать вспомогательное воздействие на организм пациента.
Примером может служить изделие для наполнения/наращивания кости, содержащее фактор роста (т.е. биологический продукт).
Для комбинированных продуктов, когда изделие и фармакологические компоненты укомплектованы раздельно, может быть достаточным испытать только компоненты изделия.
Все испытания должны проводиться в соответствии с признанными современными/действующими надлежащими лабораторными практиками/правилами, где это применимо.
Примечание 2 - Примерами подходящих руководств являются GLP (надлежащая лабораторная практика, Good Laboratory Practice) или ISO/IEC 17025.
Выбор испытаний и общая оценка результатов должны быть проведены специалистом, обладающим соответствующими химическими, физическими и биологическими данными, касающимися изделия, и осведомленным о предполагаемых условиях использования.
Выбор методов испытаний должен основываться на учете следующих факторов:
a) предусмотренного применения МИ;
b) тканей, с которыми МИ может контактировать;
c) длительности контакта.
Если выбранное испытание не включено в международные стандарты, необходимо включить обоснование выбора методов в отчет об испытании для каждого изделия. Если стандарты рекомендуют более чем один метод испытания в той же категории, выбор одного испытания из нескольких должен быть обоснован.
5.4.1 Общая часть
В соответствии с классификацией МИ должны быть рассмотрены виды испытаний, указанные таблице A.1. В этой таблице указано, какие виды испытаний должны быть рассмотрены, но не отмечено, что они обязательно должны быть проведены. Решение не проводить испытания, указанные в таблице A.1, должно быть обосновано в отчете об испытании для каждого изделия. Приведенные виды испытаний рассматривают как основу для оценки биосовместимости МИ, применяемых в стоматологии. Для большинства видов испытаний определены конкретные методы, следует признать, что для некоторых изделий альтернативные методы, не включенные в международные стандарты, могут быть более приемлемыми.
Определение характеристик материала МИ или компонента (см. таблицу A.1) является ключевым первым шагом при оценке биологического действия. Определение характеристик материала, если оно проводится, должно выполняться в соответствии с ISO 10993-18 и ISO/TS 10993-19. Для наноматериалов см. ISO/TR 10993-22.
Для удобства виды испытаний разбиты на три группы.
5.4.3 Группа I
Данная группа включает в себя испытания МИ на цитотоксичность методами in vitro. Общие рекомендации по испытаниям на цитотоксичность методами in vitro приведены в ISO 10993-5 и должны соблюдаться. Подробные процедуры испытаний для методов диффузии в агар или агарозу и фильтрующей диффузии, подходящие для стоматологических материалов, включены в настоящий стандарт. Испытания на цитотоксичность методами in vitro включают:
a) испытание диффузией в агар (см. 6.2);
b) испытание диффузией через фильтр (см. 6.3);
c) испытания прямого контакта или экстракции в соответствии с ISO 10993-5;
d) испытание на цитотоксичность дентинного барьера (см. приложение B).
Примечание 1 - Последовательность списка не означает какого-либо предпочтения одного метода по сравнению с другими.
Примечание 2 - Данный список не означает, что все упомянутые испытания на цитотоксичность следует проводить для каждого рассматриваемого МИ.
Примечание 3 - Рекомендуется проведение испытаний на цитотоксичность с дентинным барьером, описание метода приведено в приложении B. Ссылки на этот метод приведены в библиографии.
5.4.4 Группа II
Данная группа включает в себя испытания МИ в соответствии с серией стандартов ISO 10993, и конкретные испытания идентифицированы, где это уместно:
a) острая системная токсичность - пероральное применение - в соответствии с ISO 10993-11;
b) острая системная токсичность - применение ингаляцией - в соответствии с ISO 10993-11;
c) подострая и субхроническая системная токсичность - пероральное применение - в соответствии с ISO 10993-11;
d) кожное раздражение и внутрикожная реактивность - в соответствии с ISO 10993-10;
e) гиперчувствительность замедленного типа - в соответствии с ISO 10993-10;
f) генотоксичность - в соответствии с ISO 10993-3;
g) местное действие после имплантации - в соответствии с ISO 10993-6.
Примечание 1 - Для осуществимости использования только самого последнего издания справочного документа возможна перекрестная ссылка без даты. Обозначение соответствующей статьи и раздела возможно только для датированных ссылок. Таким образом, пользователю настоящего стандарта предлагается обратиться к справочным материалам для соответствующего номера статьи.
При оценке материалов после имплантации с участием минерализованных тканей, в соответствии с ISO 10993-6, рекомендуется исследование недеминерализованных срезов в дополнение к обычным деминерализованным срезам.
Примечание 2 - При необходимости, местные эффекты после имплантации МИ оценивают в соответствии с методом исследования зубных имплантатов вместо стандарта ISO 10993-6 [см. 5.4.5, d)].
5.4.5 Группа III
Данная группа включает в себя испытания, специфичные для МИ, применяемых в стоматологии, не упомянутые в стандартах серии ISO 10993:
a) испытание пульпарного и дентинного использования (см. 6.4);
b) испытание пульпарной прокладки (см. 6.5);
c) испытание эндодонтического использования (см. 6.6);
d) испытание применения внутри костного имплантата (см. приложение C).
Испытание применения внутрикостного имплантата не является обязательным, но рекомендуется, если применимо.
При внесении изменений в состав, качество и/или эксплуатационные характеристики МИ в соответствии с ISO 10993-1 необходимо провести повторную оценку его биосовместимости, как описано в разделе 5.4.
Примечание - См. также ISO 10993-1:2018, B.4.5.1, где содержатся указания по повторной оценке.
6.1.1 Общие положения
Эти рекомендации предназначены для испытаний in vitro, но также могут быть использованы для других целей в случае применимости.
6.1.2 Общие рекомендации по подготовке образцов
При подготовке исследуемых образцов следует обратиться к стандартам на соответствующий продукт и/или к инструкциям изготовителя и следовать этим описаниям в максимально возможной степени. Любое отклонение от инструкции изготовителя должно быть обосновано. Подробное описание подготовки образцов должно быть включено в отчет об исследовании. Принимают во внимание следующие факторы (например, воздействие окружающей среды), с учетом применения МИ:
a) температуру;
b) влажность;
c) воздействие света: образцы светочувствительных материалов следует изготавливать в условиях, исключающих их активацию окружающим светом;
d) материал формы для изготовления образцов: следует убедиться, что материал формы для изготовления образцов и применяемая при необходимости смазка не препятствуют процессу отверждения материала.
Примечание - Приемлемыми материалами могут быть полупрозрачные или белые пластиковые материалы, такие как полиэтилен или политетрафторэтилен (PTFE);
e) воздействие кислорода: для материалов, которые в процессе отверждения образуют слой, препятствующий проникновению кислорода, следует убедиться, что форма для изготовления образцов во время отверждения должным образом герметизирована;
f) стерилизацию: образцы либо должны быть произведены в стерильных условиях, либо простерилизованы методом, пригодным для материала, если необходимо и возможно; следует убедиться, что стерилизация не влияет на материал (например, стерилизация не должна извлекать вещества из материала);
g) соотношение площади поверхности образцов и поверхности клеточного слоя или клеточной культуральной среды: следует отразить документально соотношение площади поверхности образцов и поверхности клеточного слоя или клеточной культуральной среды; обосновать выбор формы и площади поверхности образцов, а также использованного соотношения площади поверхности образцов и поверхности клеточного слоя или клеточной культуральной среды;
h) экстракты: если экстракты требуются для процедуры испытания, экстракты готовят в соответствии с ISO 10993-12, раздел 10.
6.1.3 Специальные рекомендации для светоотверждаемых материалов
Учитывают следующие факторы, принимая во внимание конечное использование светоотверждаемого материала:
a) материал формы для изготовления образцов: коэффициент отражения материалов, использованных для изготовления форм, должен быть как можно ближе к коэффициенту отражения дентина, чтобы имитировать клиническую ситуацию.
Примечание - Приемлемыми материалами могут быть полупрозрачные или белые пластиковые материалы, такие как полиэтилен или политетрафторэтилен (PTFE);
b) воздействие света: необходимо проводить светоотверждение, чтобы максимально полно моделировать клиническое применение. Необходимо следовать инструкциям изготовителя по применению для обеспечения того же уровня отверждения, как и при клиническом применении. Это часто требует отверждения только с одной стороны, но иногда включает и двустороннее отверждение. Метод отверждения зависит от материала и/или процесса. В случаях, когда для исследования требуются полностью отвержденные образцы, необходимо убедиться после удаления формы, что исследуемые образцы являются однородными;
c) воздействие кислорода: для материалов, производящих ингибированный кислородом слой во время светоотверждения, оба конца формы для изготовления образцов должны быть накрыты прозрачными материалами противокислородной защиты (например, полиэфирной пленкой) в течение светоотверждения. Если изготовитель рекомендует обработку поверхности материала после отверждения, поверхности образцов должны быть отшлифованы и отполированы с использованием рекомендуемых клинических процедур. Если таковых инструкций нет и если требуется для испытания, то образцы следует отшлифовать с обоих концов бумагой P2 000 в соответствии с ISO 6344-1, предварительно поместив их на прозрачный материал противокислородной защиты.
6.1.4 Особые рекомендации для химически отверждаемых материалов
Принимают во внимание следующие факторы, учитывая конечное использование химически отверждаемых материалов:
a) смешивание: смешивают достаточное количество материала, чтобы обеспечить приготовление каждого исследуемого образца из одного замеса. Готовят свежую смесь для каждого исследуемого образца. Смешивание следует проводить согласно соответствующим стандартам на продукт, если применимо;
b) воздействие кислорода: для материалов, производящих ингибированный кислородом слой во время химического отверждения, оба конца формы должны быть накрыты материалами противокислородной защиты (например, полиэфирной пленкой) в течение отверждения. Если изготовитель рекомендует обработку поверхности материала после отверждения, то поверхности образцов должны быть отшлифованы и отполированы с использованием рекомендуемых клинических процедур. Если таковых инструкций нет и если требуется для испытания, то образцы следует отшлифовать с обоих концов бумагой P2 000 в соответствии с ISO 6344-1, предварительно поместив их на материал противокислородной защиты.
6.1.5 Материал положительного контроля
Для испытаний in vitro и некоторых испытаний in vivo (например, испытание пульпарного и дентинного использования) рекомендуется включить стандартный материал положительного контроля, который обрабатывается и проходит через те же процессы, что и исследуемые материалы (т.е. пластичен после смешивания с последующим отверждением) и который основывается на свободно доступных химических веществах или материалах.
Такой материал положительного контроля для испытаний пластмассовых пломбировочных материалов in vitro описывается в приложении B, таблица B.1. Применение такого специфичного материала положительного контроля не является обязательным, и вместо него можно использовать другие материалы с подтвержденной историей, а также другие хорошо охарактеризованные материалы положительного контроля с воспроизводимыми данными о токсичности.
6.2.1 Цель
Данное испытание предназначено для демонстрации неспецифичной цитотоксичности исследуемых материалов после диффузии через агар или агарозу. Данный метод испытания не применим для вымываемых веществ, которые не диффундируют через агар или агарозу.
6.2.2 Линия клеток
Используют известную линию клеток фибробластов или эпителия, являющуюся общедоступной [например, из Американской коллекции типовых культур (ATCC), см. http://www.atcc.org] <1>. Обозначают в отчете идентификационный номер линии клеток, если применимо, описание и назначение использованной линии клеток и обоснование ее выбора.
--------------------------------
<1> Эта информация приведена для удобства пользователей настоящего стандарта и не является рекламой указанного изделия со стороны ISO. Возможно использование эквивалентных продуктов, если доказано, что они приведут к тем же результатам.
Используют культуральную среду, указанную для выбранной клеточной линии. Стерилизуют фильтрацией. Для приготовления агара готовят двойную концентрацию культуральной среды. Стерилизуют фильтрацией. Готовят либо 3%-ный агар, либо 3%-ную агарозу. Стерилизуют автоклавированием.
Готовят витальный краситель разведением основного 1%-ного водного раствора нейтрального красного (регистрируют источник) 1:100, используя 0,01 моль/л фосфатно-буферных физиологических растворов [например, фосфатно-буферного физиологического раствора Dulbecco <1>] сразу перед использованием. Хранят растворы нейтрального красного в темном месте. Используют 6-луночные планшеты для культуры тканей (диаметром 35 мм) или чашки Петри номинальным диаметром от 50 мм до 100 мм, пригодные для культивирования тканей.
--------------------------------
<1> Dulbecco является торговым наименованием. Эта информация приведена для удобства пользователей настоящего стандарта и не является рекламой указанного изделия со стороны ISO.
6.2.4 Приготовление образцов
Готовят образцы в соответствии с 6.1. Исследование проводят на экстракте материала и/или самом материале согласно руководству в ISO 10993-5.
a) Для твердых материалов готовят круглые исследуемые образцы диаметром примерно 5 мм с плоской поверхностью для обеспечения адекватного контакта с верхним слоем агара.
b) Для отверждаемых материалов вводят свежеприготовленный материал в кольца внутренним диаметром 5 мм и высотой 2 мм. Материал кольца должен быть указан в отчете об исследовании. При испытании материалов в свежеприготовленном состоянии помещают кольца на агар до введения материала. При испытании после различных сроков отверждения наполняют кольца так, чтобы материал находился вровень с кромкой, и дают ему затвердеть при температуре (37 +/- 2) °C и относительной влажности (90 +/- 10)% до готовности для испытания.
c) Для жидких исследуемых образцов или экстрактов наносят 0,01 мл жидкости на боросиликатный тонкостекольный фильтрующий (фильтровый) диск диаметром 5 мм, помещенный на агар.
Примечание 1 - Подходящими инертными материалами являются стекло или PTFE.
Примечание 2 - Подходящие диски могут быть приготовлены из предфильтров.
6.2.5 Контрольные образцы
Используют положительные контрольные образцы, отрицательные контрольные образцы и стандартные материалы.
Культивируют клетки, пока они не достигнут конца фазы логарифмического роста. Пипетируют надлежащий объем (например, 10 мл для 100-миллиметровой чашки Петри) клеточной суспензии 2,5·105 клетки/мл в достаточное число чашек Петри и инкубируют при температуре (37 +/- 2) °C в водонасыщенной атмосфере с 5% (объемная доля) углекислого газа в течение 24 ч. Если используют другие условия культивирования клеток, то необходимо предоставить обоснование.
Нагревают стерильный агар или агарозу до температуры 100 °C на водяной бане и дают остыть до температуры 48 °C. Смешивают одну часть агара или агарозы с одной частью свежеприготовленной культуральной среды двойной концентрации и нагревают до температуры 48 °C. Аспирируют жидкую культуральную среду из каждой чашки Петри и заменяют 10 мл свежеприготовленной смеси агара или агарозы и культуральной среды.
Дают смеси агара или агарозы и культуральной среды затвердеть при комнатной температуре (примерно 30 мин). Добавляют 10 мл раствора нейтрального красного и держат в темноте от 15 до 20 мин. Аспирируют избыточный раствор нейтрального красного. Защищают культуру от света в присутствии нейтрального красного, так как клетки могут быть повреждены.
Вносят в каждую чашку Петри необходимое число образцов исследуемого материала и контрольных образцов с адекватным расстоянием (больше 20 мм) между соседними образцами, если применимо. Инкубируют при температуре (37 +/- 2) °C в водонасыщенной атмосфере с 5% (объемная доля) углекислого газа в течение 24 ч. Оценивают каждый исследуемый образец по меньшей мере четыре раза (т.е. две чашки Петри на исследуемый образец).
6.2.7 Параметры оценки
Оценивают зону обесцвечивания вокруг исследуемых образцов и контрольных образцов, используя инвертированный микроскоп с калиброванным экраном, и определяют индекс обесцвечивания и индекс лизиса для каждого исследуемого образца в соответствии с критериями, приведенными в таблицах 1 и 2.
Таблица 1
Индекс обесцвечивания | Описание |
0 | Отсутствие заметной зоны обесцвечивания вокруг образца или под ним |
1 | Зона обесцвечивания ограничена областью под образцом |
2 | Зона обесцвечивания выходит за пределы образца меньше чем на 0,5 см |
3 | Зона обесцвечивания выходит за пределы образца от 0,5 см до 1,0 см |
4 | Зона обесцвечивания выходит за пределы образца более чем на 1,0 см, но не затрагивает всю чашку Петри |
5 | Зона обесцвечивания охватывает всю чашку Петри |
Таблица 2
Индекс лизиса | Описание обесцвеченной зоны |
0 | Отсутствие заметной цитотоксичности |
1 | Затронуто < 20% обесцвеченной зоны |
2 | Затронуто от 20% до < 40% обесцвеченной зоны |
3 | Затронуто от 40% до < 60% обесцвеченной зоны |
4 | Затронуто от 60% до 80% обесцвеченной зоны |
5 | Затронуто > 80% обесцвеченной зоны |
Вычисляют средний индекс обесцвечивания и индекс лизиса отдельно для каждого испытуемого материала. Если значения индекса для четырех повторов исследуемого вещества различаются более чем на 2 единицы в диапазоне 0 до 3, то повторяют испытание. При индексах 4 и 5 повторения не требуется. При испытании экстрактов следует вычесть средний индекс экстракционной среды отдельно из среднего индекса экстракционной среды, содержащей испытуемое вещество, для получения индекса только исследуемого вещества. Если средний индекс экстракционной среды, служащей контрольным образцом, больше одного, то повторяют испытание, используя другую экстракционную среду.
Для достоверного испытания под негативным контрольным образцом должен быть расположен неповрежденный клеточный слой.
6.2.8 Оценка результатов
При оценке результатов испытания необходимо учитывать всю информацию, полученную в течение испытания, особенно какие-либо различия в результатах опытной и контрольной групп. Клеточный ответ должен быть основан на среднем индексе обесцвечивания и индексе лизиса по меньшей мере четырех дублирующих испытаний. Клеточный ответ должен быть оценен отдельно по каждому параметру в соответствии с таблицей 3.
Таблица 3
и индекса лизиса) и интерпретация цитотоксичности
Шкала | Клеточный ответ | Интерпретация |
0 | 0 | Не цитотоксичный |
1 | 1 | Легкая цитотоксичность |
2 | 2 - 3 | Средняя цитотоксичность |
3 | 4 - 5 | Значительная цитотоксичность |
Включают результаты оценки в отчет об испытании. Необходимо учитывать, что интерпретация данных испытаний клеточной культуры должна принимать во внимание ограничения этой испытательной системы, т.е. цитотоксичный материал не является непригодным как таковой, но данные должны быть интерпретированы для каждого конкретного применения.
6.2.9 Отчет об испытании
Представляют результаты в отчете об испытании, который включает полное отражение всех проведенных процедур, полученных результатов и любых других данных, необходимых для оценки результатов. При необходимости указывают подробную информацию о подготовке и методах обращения с исследуемым материалом, а также номер партии материала.
6.3.1 Цель
Данное испытание предназначено для демонстрации неспецифичной цитотоксичности исследуемых материалов после диффузии через целлюлозоацетатный фильтр.
6.3.2 Линия клеток
Используют известную линию клеток фибробластов или эпителия, являющуюся общедоступной [например, из Американской коллекции типовых культур (ATCC), см. http://www.atcc.org]. Обозначают в отчете идентификационный номер линии клеток, если применимо, описание и назначение использованной линии клеток и обоснование ее выбора.
6.3.3 Культуральная среда, реагенты и оборудование
Готовят культуральную среду и агар или агарозу для использования в качестве верхнего слоя, как описано в 6.2.3. Готовят растворы либо для окрашивания сукцинатдегидрогеназой, либо для окрашивания неспецифичной гидролазой.
Для окрашивания сукцинатдегидрогеназой готовят следующие основные растворы:
a) раствор сукцината: 13,6 г сукцината натрия в 100 мл 0,2 моль/л фосфатного буфера, pH 7,6;
b) раствор хлорида нитросинего тетразолия: 100 мг хлорида нитросинего тетразолия на 100 мл 0,2 моль/л фосфатного буфера, pH 7,6;
c) раствор феназинметосульфата: 4 мг феназинметосульфата на 10 мл свежеприготовленной дистиллированной воды.
Готовят окрашивающий раствор: 1 мл раствора сукцината, 9 мл раствора хлорида нитросинего тетразолия и 1 мл раствора феназинметосульфата.
Для окрашивания неспецифичной гидролазой готовят основной раствор диацетата флуоресцина, состоящий из 5 мг диацетата флуоресцина в 1 мл ацетона. Для использования добавляют 20 мкл основного раствора к 100 мл фосфатно-буферного физраствора (например, фосфатно-буферного физиологического раствора Dulbecco). Используют чашки Петри диаметром 60 мм, пригодные для культуры тканей.
Используют фильтры, состоящие из смеси ацетатцеллюлозы и нитроцеллюлозы, диаметром 47 мм, размер пор - 0,45 мкм <1>.
--------------------------------
<1> Millipore HATF 04700 является примером пригодного, коммерчески доступного продукта. Эта информация приведена для удобства пользователей настоящего стандарта и не является рекламой указанного изделия со стороны ISO.
6.3.4 Приготовление образцов
Готовят образцы в соответствии с 6.1. Исследование должно быть проведено на экстракте материала и/или самом материале согласно руководству в ИСО 10993-5.
a) Для твердых материалов готовят круглые исследуемые образцы диаметром примерно 5 мм с плоской поверхностью для обеспечения адекватного контакта с фильтром. Масса исследуемых образцов не должна превышать 3,5 г.
b) Для отверждаемых материалов вводят свежеприготовленный материал в кольца внутренним диаметром 5 мм и высотой 2 мм. При испытании материалов в свежеприготовленном состоянии помещают кольца на фильтр до введения материала. При испытании после различных периодов отверждения наполняют кольца так, чтобы материал находился вровень с кромкой, и дают ему затвердеть при температуре (37 +/- 2) °C и относительной влажности (90 +/- 10)% до готовности для испытания. Масса исследуемых образцов не должна превышать 3,5 г.
Примечание - Подходящими инертными материалами являются стекло или PTFE.
c) Для жидких исследуемых образцов или экстрактов наносят 0,01 мл жидкости на фильтрующий диск из боросиликатного микростекла диаметром 5 мм, помещенный на агар.
Примечание - Подходящие диски могут быть приготовлены из предфильтров.
6.3.5 Контроли
Используют положительные контрольные образцы, отрицательные контрольные образцы и стандартные материалы.
6.3.6 Процедура испытания
Культивируют клетки, пока они не достигнут конца фазы логарифмического роста. Помещают целлюлозоацетатные фильтры на дно достаточного числа чашек Петри и пипетируют 6 мл клеточной суспензии (2,5·105 клетки/мл) в каждую. Инкубируют при температуре (37 +/- 2) °C в водонасыщенной атмосфере с 5% (объемная доля) углекислого газа в течение 24 ч. Если используют другие условия культивирования клеток, то необходимо предоставить обоснование. Пипетируют 5 мл свежеприготовленного агара или смеси агарозы и культуральной среды (см. 6.2.6), содержащейся при температуре 48 °C, в достаточное число чашек Петри и дают затвердеть при комнатной температуре. Аспирируют избыточную культуральную среду из чашек, содержащих целлюлозоацетатные фильтры, промывают фильтры фосфатно-буферным физиологическим раствором (например, фосфатно-буферным физиологическим раствором Dulbecco) при температуре (37 +/- 2) °C и помещают их поверх агара или агарозы клеточной стороной вниз. Наносят от трех до пяти исследуемых образцов поверх фильтра в каждую чашку и инкубируют еще 2 ч и 24 ч при температуре (37 +/- 2) °C во влажной атмосфере с 5% (объемная доля) углекислого газа. Следует убедиться, что исследуемые образцы находятся в тесном контакте с поверхностью фильтра.
Признаки цитотоксичности должны быть оценены после 2-часового и 24-часового воздействия.
В каждую чашку помещают один положительный контрольный образец и один отрицательный контрольный образец. Дополнительно используют добавочные контрольные образцы фильтра с клеточным монослоем, но без исследуемых образцов и фильтра без клеток, но с исследуемыми образцами. При испытании экстрактов необходимо также применить контрольный образец, используя только экстракционную среду. Осматривают каждый исследуемый образец по меньшей мере четыре раза.
После инкубации удаляют исследуемые образцы и осторожно высвобождают фильтр из агара или агарозы. Оценивают с цитохимической точки зрения область пониженной активности клеточных ферментов методом A или методом B.
Проявляют сукцинатдегидрогеназу (CE 1.3.99.1) согласно методу Барка и Андерсона [14]. Инкубационный период - 3 ч при температуре (37 +/- 2) °C. Необходимо избегать наличия углекислого газа при инкубации, потому что он может ингибировать активность сукцинатдегидрогеназы, приводя к блеклому окрашиванию фильтра. До измерения промывают фильтр дистиллированной водой и высушивают на воздухе.
Примечание - Удерживанию клеток может способствовать их фиксация с помощью 10%-ного нейтрального формалина на 15 мин до промывания в дистиллированной воде.
Проявляют неспецифичную гидролазу инкубацией с раствором диацетата флуоресцина в течение 30 мин при температуре 4 °C. Осматривают фильтр под ультрафиолетовым светом.
6.3.7 Оценка повреждения клеток
Оценивают повреждение клеток путем:
a) измерения зоны обесцвечивания (например, используя систему анализа изображений) или
b) использования шкалы, приведенной в таблице 4.
Таблица 4
Шкала | Определение оценки | Зона обесцвечивания |
0 | Разница в интенсивности окрашивания по всему фильтру отсутствует | Нет |
1 | Зона сниженной интенсивности окрашивания или неокрашенная зона диаметром менее диаметра (5 мм) исследуемого образца | < 20 мм2 |
2 | Неокрашенная зона диаметром от 5 до 7 мм | От 20 до 40 мм2 |
3 | Неокрашенная зона диаметром более чем 7 мм | > 40 мм2 |
Фильтры под отрицательными контрольными образцами и контрольные фильтры должны быть равномерно окрашены в темно-синий цвет (при использовании сукцинатдегидрогеназы) или светло-зеленый (при использовании неспецифичной гидролазы).
Контрольные фильтры без клеток позволяют определить возможный эффект исследуемого образца на фильтр.
6.3.8 Оценка результатов
При оценке результатов испытания необходимо учитывать всю информацию, полученную в течение испытания, особенно какие-либо различия в результатах опытной и контрольной групп. Удобный способ оценки исследуемых материалов приведен в таблице 5.
Таблица 5
Индекс клеточного повреждения | Описание обесцвеченной зоны |
0 | Не цитотоксичная |
1 | Легкая цитотоксичность |
2 | Средняя цитотоксичность |
3 | Значительная цитотоксичность |
Результаты оценки включают в отчет об испытании. Необходимо учитывать, что интерпретация данных испытаний клеточной культуры должна принимать во внимание ограниченность этой испытательной системы, т.е. цитотоксичный материал не является непригодным как таковой, но данные должны быть интерпретированы для каждого конкретного применения.
6.3.9 Отчет об испытании
Представляют результаты в отчете об испытании, который включает в себя полное отражение всех проведенных процедур, полученных результатов и любых других данных, необходимых для оценки результатов. Включают детали приготовления и методов применения испытуемого материала вместе с номером партии материала, где применимо.
6.4.1 Цель
Данное испытание предназначено для оценки биосовместимости стоматологических материалов относительно дентина и зубной пульпы.
Тот же формат может быть использован для исследования на зубах человека (предназначенных к удалению по ортодонтическим, периодонтальным или зубопротезным причинам), если такое исследование было должным образом утверждено в соответствии с надлежащими национальными и/или международными нормами.
Для гуманного обращения с животными необходимо выполнение требований ISO 10993-2.
Примечание - Существует вероятность, что имеются национальные нормативные требования касательно исследуемых животных.
Животные должны быть размещены согласно ISO 10993-2 со свободным доступом к пище и воде. Используют млекопитающих одного вида, не являющихся грызунами, такого возраста, что их зубной ряд содержит неповрежденные постоянные зубы с закрытыми зрелыми верхушками. Обезьяны, собаки, хорьки или миниатюрные свиньи являются подходящими видами. Для особых целей могут быть выбраны другие виды. Выбранные виды должны быть наиболее низкими в биологической цепи из требуемых для удовлетворения научных целей при наименьшем ущербе для животных. Выбор вида животного должен быть обоснован и отражен документально.
Примечание - Подходящими являются обезьяны, собаки и миниатюрные свиньи, у которых прорезались все постоянные зубы, кроме зубов мудрости. Подходящими являются хорьки, у которых прорезались четыре постоянных клыка, так как только эти зубы являются применимыми.
6.4.3 Процедура испытания
6.4.3.1 Подготовка животных
Выбирают достаточное число животных для предоставления по меньшей мере семи зубов, содержащих испытуемый материал, на каждый период времени.
Анестезируют животных и проводят процедуру, описанную в 6.4.3.2.
6.4.3.2.1 Удаляют налет и какие-либо инородные вещества с поверхностей зубов. Очищают и дезинфицируют поверхности используемых зубов тампоном с нанесенной 3%-ной (объемная доля) перекисью водорода, затем дезинфектантом, состоящим из повидон-йода или хлоргексидина. Готовят требуемое число буккальных или лабиальных полостей класса V, используя острые боры при адекватном водовоздушном распылении. Глубина полостей должна быть таковой, чтобы толщина остающегося дентина была менее 1,0 мм и предпочтительно менее чем 0,5 мм, но без обнажения пульпы. Промывают полости водой и высушивают их ватными шариками, кроме случаев, когда метод введения исследуемого материала требует другой процедуры. При выраженном гингивальном воспалении у животных может быть необходимым провести удаление налета и инородных веществ за несколько дней до подготовки полости, возможно, повторно, пока гингивальное воспаление не будет под контролем.
Примечание - Измерительные инструменты электрического сопротивления, такие как определители верхушки корня зуба, могут быть откалиброваны предварительно и использованы для оценки толщины остающегося дентина при подготовке полостей.
6.4.3.2.2 Если стоматологическое изделие будет использоваться как пломбировочный материал, то подготовка вкладки полости класса V должна быть проведена после полного удаления налета и каких-либо инородных веществ с поверхностей зубов. Для моделирования гидравлического давления во время цементирования коронки должны быть созданы вкладки из композитных материалов. Искусственная слюна может применяться в качестве смазки при подготовке полости и введении светоотверждаемого композитного материала. После светоотверждения и удаления композитной вкладки полость должна быть тщательно промыта и подготовлена к вкладке для окончательного цементирования.
Чрезмерное заполнение заготовки для инкрустации облегчает удаление вкладки, а излишки можно срезать после цементации после затвердевания материала для облицовки. Для предотвращения нежелательного нарушения целостности цемента рекомендуется использовать мелкозернистый алмазный бур с высокой скоростью и небольшим давлением при обильном водяном охлаждении.
Вкладки должны находиться под давлением в течение времени, необходимого для первоначального застывания цемента, таким образом моделируя гидравлические силы полного цементирования коронки. При испытаниях на небольших животных убедитесь, что полости достигают внутренней трети дентина без обнажения пульпы.
Примечание - Недопустимо замешивать пломбировочный материал до более высокой консистенции, чем необходимо, или испытывать его в качестве наполнителя.
При изготовлении полных коронок и для приемлемого доступа к пульпе (от 0,5 до 1,00 мм) рекомендуется сначала подготовить полость класса V, которая служит ориентиром для достижения желаемой близости к пульпе, после чего завершить подготовку коронки.
6.4.3.2.3 При приготовлении исследуемых образцов следуют инструкциям изготовителя. Если изготовитель исследуемого образца рекомендует его использование с материалом покрытия или агентом обработки полостей (например, дентинный адгезионный агент), то используют эти дополнительные процедуры согласно рекомендациям изготовителя.
6.4.3.2.4 На каждый период времени восстанавливают по меньшей мере семь полостей с исследуемым материалом и четыре полости с отрицательным контрольным образцом путем произвольного распределения. Если необходимо (см. примечание 1), на каждый период времени восстанавливают до четырех полостей положительным контрольным образцом.
Выбранные виды должны быть наиболее низкими в биологической цепи из требуемых для удовлетворения научных целей при наименьшем ущербе для животных. Выбор вида должен быть обоснован и отражен документально. При использовании обезьян, собак или миниатюрных свиней необходимо использовать одно животное на каждый период времени. При использовании хорьков необходимо использовать по меньшей мере трех животных на каждый период времени.
Отрицательный контроль. Быстросхватывающийся цинк-оксид-эвгеноловый цемент (ZOE) является подходящим материалом отрицательного контрольного образца при его размещении на приемлемой дистанции от пульпы, т.е. более 0,5 мм. Какие-либо зубы с толщиной дентина менее 0,5 мм должны быть исключены из оценки (чем ближе наполнитель к пульпе, тем большим раздражителем становится не вступивший в реакцию эвгенол). Для долгосрочной оценки цинк-оксид-эвгеноловый цемент должен быть защищен от вымывания. После сокращения обычный самоотверждающийся стеклянный иономер может обеспечить эффективное уплотнение.
Если состав исследуемого материала требует долгосрочного покрытия поверхности, цинк-оксид-эвгеноловый цемент противопоказан, так как не вступивший в реакцию эвгенол в материале (в большом количестве присутствующий после схватывания) будет проникать вместе с исследуемым материалом и достигать дна подготовки полости, таким образом перекрывая истинную реакцию исследуемого материала в эксперименте; вместо нее будет оцениваться гистологическая реакция эвгенола. В случаях, когда исследуемый материал должен быть защищен от вымывания, рекомендуется следующий метод. После консервативного сокращения исследуемого материала на 0,5 - 1,0 мм, с последующим протравливанием полей эмали, промыванием и легким просушиванием, применяются адгезивный связующий агент и легкий композиционный материал.
Положительный контроль. Восстанавливающий материал или метод, не включающий обнажения пульпы, последовательно приводящий к пульпарному ответу от умеренного до резкого, является подходящим положительным контролем. Так как силикатный цемент, традиционно применявшийся в качестве положительного контроля, теперь недоступен, сложно порекомендовать использование другого материала. "Мокрая" смесь цинк-фосфатного цемента, вероятно, является наиболее подходящим положительным контролем. "Мокрая" смесь определяется как смесь, имеющая слишком малое количество порошка в окончательной форме. Для лабораторий, обладающих банком положительных контрольных образцов от того же поставщика с той же системой моделей на животных, можно провести сравнение с предыдущим исследуемым материалом, который поступил на рынок, при условии наличия достоверных клинических данных.
6.4.3.2.5 Нужно использовать случайный отбор для определения, какие полости получат исследуемый наполняющий материал и материалы отрицательного и положительного контроля до подготовки полости. По объективной возможности сочетайте контрольные и исследуемые зубы анатомически, т.е. правый верхнечелюстной премоляр и левый верхнечелюстной премоляр, правый нижний премоляр и правый верхний премоляр и т.д. Путем случайной выборки один зуб становится исследуемым образцом, а контралатеральные и противоположные зубы становятся контролями.
В зависимости от вида животного и его доступности выбор зубов может быть изменен.
6.4.3.2.6 Состояние животных следует проверять и регистрировать по меньшей мере раз в день после операции. Должны быть внедрены меры для сведения к минимуму каких-либо болей или страданий, вызванных изменениями в режиме питания, воспалением или инфекцией. Анальгетики следует применять согласно послеоперационным требованиям.
6.4.3.3 Эвтаназия
После окончания периода исследования проводят эвтаназию животного передозировкой анестетика или другим приемлемым гуманным методом (см. ISO 10993-2 или последние рекомендации по эвтаназии национальных/международных руководств по этике благополучия животных).
6.4.3.4 Приготовление препаратов
После (5 +/- 2) сут, (25 +/- 5) сут и (70 +/- 5) сут проводят эвтаназию передозировкой анестетика или применением других общепринятых веществ достаточного числа животных для предоставления по меньшей мере семи зубов, содержащих испытуемый материал. Осматривают восстановления, зубы и их опорные ткани и регистрируют подробности каких-либо аномалий. Удаляют каждый обработанный зуб вместе с окружающими его твердыми и мягкими тканями и фиксируют в подходящем растворе.
6.4.3.5.1 Сосудистая перфузия тканей с фиксатором во время умерщвления предоставляет лучшую фиксацию. Методы перфузионной эвтаназии сохранят большинство тканей, но не зубную пульпу. Химические фиксаторы не проникают достаточно быстро (в течение 20 мин) в неповрежденный зуб для задержки автолиза. Макушечная треть корня должна быть удалена после отделения челюстей от головы. Приемлемым и эффективным методом является высокооборотный наконечник или алмазный или карбидный бор с обильным водоохлаждением для отрезания корня в 4 - 5 мм от макушки прорезанием сквозь кость и корень или сквозь макушечную треть при удалении зубов. Такой метод не влияет на коронковую пульпу и показан для непрямых и прямых исследований защитных покрытий пульпы. Тщательное промывание после доступа к тканям корня и пульпы удалит обломки разрезания, которые могут помешать фиксатору добраться до пульпы.
Красная точка, представляющая ткань пульпы, должна быть видна в апексе каждого корневого канала до помещения квадрантов челюсти в фиксатор.
При использовании зубов человека, предназначенных для удаления, применяется схожий метод. Удаляют по меньшей мере 3 - 4 мм от апекса, промывают и проверяют, видна ли пульпа, которая должна выглядеть как красная точка.
Если исследование нацелено на оценку макушечной части, то перфузионная эвтаназия является предпочтительным методом для достижения наилучшего сохранения тканей в макушечной области; тем не менее ткань пульпы неадекватно зафиксирована и требует доступа через кость и корень в шейной области с применением вышеописанной методики.
6.4.3.5.2 Оставляют блоки челюстей в химическом фиксаторе по меньшей мере на 24 часа, добавляют свежий фиксатор и оставляют еще на 24 - 48 часов до деминерализации (см. 6.4.3.5.4). Количество фиксатора должно превосходить объем образца в пять раз. После фиксации деминерализуют зубы в подходящем реагенте и используют стандартные методы для заливки парафином.
6.4.3.5.3 Признаки автолитических изменений включают цитоплазматическую вакуолизацию одонтобластов, ретикулярную атрофию, сморщенные эритроциты и большие расширенные пустые каналы, напоминающие лимфатические (иногда называемые варикозами), и общее перемещение одонтобластов в зубные канальцы. Вакуоли внутри цитоплазмы одонтобластов, видимые посредством световой микроскопии, так оперативно развиваются, что сами по себе они редко рассматриваются как имеющие какую-либо патологическую значимость даже в наиболее сохраненных образцах. Полное автолитическое разрушение пульпы до сих пор описывается во многих учебниках как классическая характеристика "ретикулярной атрофии", приписываемой воздействию старения, периодонтитов, многочисленных видов стоматологических материалов, оперативных вмешательств и даже общей анестезии.
6.4.3.5.4 Для деминерализации можно использовать многочисленные методы и вещества, и самыми распространенными агентами являются 10%-ная муравьиная кислота, этилендиаминтетрауксусная кислота (EDTA), азотная кислота или муравьиная кислота - цитрат натрия. Другим подходящим агентом является фиксатор/декальцификатор Cal-X II, состоящий из хлористоводородной кислоты, двунатриевой EDTA и фиксатора, предотвращающего потерю клеточных структур. Вне зависимости от метода персонал должен быть осведомлен о применяемом агенте для его эффективного использования. Например, с муравьиной кислотой (используя десятикратный объем размера образца) раствор следует менять каждые 4 - 5 дней, потому что вода накапливается по мере утилизации муравьиной кислоты. Также раствор необходимо механически взбалтывать для разрыва поверхности кислотно-водного раздела вокруг зуба при накоплении воды в зубе. Образцы также должны быть помещены в емкость для хранения в подвешенном состоянии, поскольку кислота не воздействует на поверхности зубов на дне контейнера.
6.4.3.5.5 При замене раствора кислоты медиальные и дистальные поверхности зубов могут быть обрезаны. Удаление лишней ткани ускоряет процесс деминерализации. Деминерализация обычно завершается в течение от 10 до 21 дня в зависимости от размера и минеральной плотности образца. Для определения конечной точки деминерализации используют рентгенографию. Также зубы надрезают острым лезвием. Достижение легкого усилия при надрезе означает чрезмерную деминерализацию. Тем не менее, это можно предотвратить при ежедневной оценке легкости надрезания.
6.4.3.5.6 Готовят серийные секции толщиной от 5 до 7 мкм сквозь каждую полость по продольной оси зуба. Окрашивают препараты, чередуя гематоксилин и эозин. Окрашивают промежуточные препараты (прилегающие к соответствующей ранке пульпы, предпочтительно следующей за секцией с наиболее узкой остающейся толщиной дентина) соответствующим бактериальным красителем (например, Браун-Бренн, McKay или Gram-Weigert) для оценки количества микроорганизмов в наличии и степени проницаемости. Такие методы окрашивания имеют свои недостатки: в большинстве случаев невозможно легко идентифицировать грамотрицательные бактерии и невозможно получить информацию о жизнеспособности или идентичности этих организмов. Во время обработки тканей может быть потеряно большое количество микроорганизмов, что затрудняет количественную оценку. Деминерализация значительно сокращает количество и окрашиваемость микроорганизмов. Наличие налета или микроорганизмов на полях, стенах и дне подготовки полости, а также в зубных канальцах должно быть отмечено как "да" и "нет" в каждом образце. Процент образцов с микроорганизмами должен быть зафиксирован в отчете об исследовании.
Осматривают срезы, не имея предварительной информации, является ли исследуемый образец опытным или контрольным. Для каждой серии срезов регистрируют полное описание всех гистологических признаков в дентине, пульпе и прикорневых тканях, включая те, которые могли образоваться в результате подготовки полостей. Из серии срезов выбирают по меньшей мере пять равноотстоящих в полости для последующего анализа воспаления. Оценивают отдельно воспалительный инфильтрат в поверхностных тканях (слой одонтобластов, бесклеточная зона и зона с высокой плотностью клеток) и в остальной части (более глубокие ткани) пульпы по шкале, указанной в таблице 6.
Таблица 6
и дентинного использования
Балл воспаления | Описание воспалительных изменений |
0 | Воспаление отсутствует: пульпарная ткань с нормальной структурой, прилегающая к дентину в канальцевом контакте с полостным дном |
1 | Легкое воспаление: рассеянные воспалительные клетки в пульпарной ткани с нормальной в других отношениях структурой, прилегающей к дентину в канальцевом контакте с полостным дном |
2 | Умеренное воспаление: воспалительные клетки с небольшими фокальными скоплениями в пульпарной ткани, все еще включающей структурно нормальные области, прилегающей к дентину в канальцевом контакте с полостным дном |
3 | Значительное воспаление: обширное проникновение воспалительных клеток с потерей нормальной структуры в пульпарной ткани, прилегающей к дентину в канальцевом контакте с полостным дном |
4 | Абсцедирование или расширенное проникновение воспалительных клеток, не ограничивающееся только пульпарной тканью, прилегающей к дентину в канальцевом контакте с полостным дном |
Для каждой оцененной секции регистрируют минимальную толщину остающегося дентина, измеряя как под прямыми углами от полостного дна к поверхности соприкосновения пульпы-(пре)дентина, так и по направлению дентинных канальцев. В последнем случае, когда плоскость секций не совсем совпадает с плоскостью дентинных канальцев, так что каждый каналец в интересующей области не простирается на все расстояние от дна полости до поверхности соприкосновения пульпы-(пре)дентина, проводят измерение вдоль линии общего направления дентинных канальцев. Вычисляют показатель воспалительного ответа на обоих участках для каждого интервала времени путем суммирования отдельных оценок, разделенных на общее число наблюдений.
Представляют данные отдельно для полостей, заполненных исследуемым образцом, включая материал покрытия или агент обработки полостей, если рекомендовано изготовителем, с отрицательным и положительным контрольными образцами. Для полостей, заполненных положительным контрольным образцом, данные могут быть использованы из предыдущих исследований с идентичными условиями испытания. Дополнительно регистрируют число полостей, содержащих бактерии на дне или стенке полости, для каждого временного интервала исследуемого образца и контрольных образцов. Индекс воспаления для каждого периода времени соответственно предоставляют для каждого материала, основываясь на вышеуказанной шкале, дополняя предоставлением диапазона измеренной минимальной остающейся толщины дентина и наблюдаемым количеством бактериальной проницаемости.
6.4.3.7 Анализ выживания одонтобластов (по выбору)
Для гистоморфометрического анализа выживания одонтобластов выбирают по меньшей мере пять секций, расположенных с равными интервалами на дне полости и окрашенных гематоксилином и эозином, и осматривают их с увеличением, позволяющим идентификацию отдельных клеток и предоставляющим поле обзора, включающее всю поверхность соприкосновения пульпы-(пре)дентина под полостью. Используя окулярную шкалу (масштабную сетку), подсчитывают число морфологически цельных одонтобластов на единицу длины предентинной поверхности по всей длине поверхности соприкосновения пульпы-(пре)дентина под полостью.
Поверхность соприкосновения определяют как такую, в которой дентинные канальцы сообщаются с полостным дном, как показано на рисунке 1.
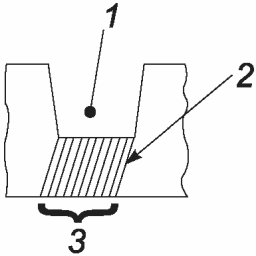
1 - полость; 2 - дентинные канальцы;
3 - поверхность соприкосновения пульпы-(пре)дентина
для подсчета одонтобластов
для подсчета одонтобластов
Проводят подсчет одонтобластов на единицу длины области поверхности соприкосновения пульпы-(пре)дентина под полостью для каждой из пяти секций от каждого исследуемого образца и выводят среднее количество клеток для этой полости. Затем определяют средние значения количества клеток для всех исследуемых полостей T и полостей отрицательного контрольного образца NC. Гибель клеток в % вычисляют по формуле
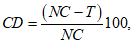 (1)
(1)где CD - гибель клеток в процентном соотношении;
NC - число клеток в полости отрицательного контроля;
T - число клеток в полости с испытуемым материалом.
Оценивают гибель одонтобластов по шкале, указанной в таблице 7.
Таблица 7
Шкала | Гибель одонтобластов |
0 | Нет |
1 | < 25% клеточной гибели |
2 | От 25% до 50% клеточной гибели |
3 | > 50% до 75% клеточной гибели |
4 | > 75% клеточной гибели |
Для каждой оцененной секции регистрируют минимальную остающуюся толщину дентина, как описано выше. Таким образом, показатель выживаемости одонтобластов предоставляют для каждого материала, основываясь на вышеуказанной шкале и дополняя предоставлением диапазона минимальной остающейся толщины дентина, измеренной для полостей в данной группе материалов. Представляют данные отдельно для полостей, заполненных исследуемым образцом, включая материал покрытия или агент обработки полостей, если рекомендовано изготовителем, и для полостей, используемых в качестве положительного контрольного образца. Выражают данные положительных контрольных образцов в виде процента отрицательного контрольного образца, как указано выше для опытных полостей. Где применимо, данные для положительного контрольного образца могут быть использованы из предыдущих исследований с идентичными условиями испытания.
6.4.4.1 Общая часть
При оценке результатов испытания необходимо учитывать всю информацию, полученную в течение испытания, особенно какие-либо различия в результатах опытной и контрольной групп. Регистрируют результаты оценки в отчете об испытании.
6.4.4.2 Статистический анализ остающейся толщины дентина
Данные по остающейся толщине дентина (RDT) отмечаются в миллиметрах и должны анализироваться параметрически, основываясь на предположении, что данные распределены равномерно и вариации равны. RDT не должна статистически различаться в опытных и сравнительных/контрольных группах.
Если результаты представлены в соответствии с оценочной шкалой (см. таблицу 7) по категориям, подобным тем, которые перечислены выше в разделе гистологические характеристики, то следует использовать непараметрический метод.
Представляют результаты в отчете об испытании, который включает полное отражение всех проведенных процедур, полученных результатов и любых других данных, необходимых для оценки результатов. Включают детали приготовления и методов применения испытуемого материала вместе с номером партии материала.
6.5.1 Цель
Испытание предназначено для оценки биосовместимости материалов пульпарной прокладки с зубной пульпой. В оценку должны быть включены методологические процедуры, необходимые для предполагаемого клинического использования материала.
Примечание - С некоторыми модификациями это испытание может быть использовано для испытания пульпотомии.
Испытание пульпарного и дентинного использования и испытание пульпарной прокладки могут быть проведены одновременно на одних и тех же животных с использованием разных зубов.
6.5.2 Животные и гуманное обращение с животными
Соблюдают требования по обращению с животными в соответствии с 6.4.2.
Используют как минимум двух млекопитающих одного вида, не являющихся грызунами, как описано в 6.4.2.
6.5.3 Процедура испытания
6.5.3.1 Подготовка животных
Выбирают достаточное число животных для предоставления по меньшей мере 10 зубов, содержащих испытуемый материал, на каждый период времени.
Анестезируют животных и проводят процедуру, описанную в 6.5.3.2.
6.5.3.2.1 Удаляют налет и какие-либо инородные вещества с поверхностей зубов. Для изоляции используемых зубов применяют резиновую прокладку. Очищают поверхность зуба и операционное поле и высушивают. Дезинфицируют тампоном с нанесенной 3%-ной (объемная доля) перекисью водорода, затем - дезинфектантом, состоящим из повидон-йода или хлоргексидина. Подготавливают требуемое число буккальных или лабиальных полостей класса V, используя острые боры при адекватном водовоздушном распылении. Препараты должны быть окаймлены эмалью, но внедряться в мезиальные и дистальные поверхности зуба и в одну внутреннюю треть дентина. В центре полости аккуратно делают пульпарное отверстие диаметром примерно от 0,5 до 1,0 мм под распылением стерильного физраствора [0,9%-ным (массовая доля)] без погружения бора в пульпарную ткань. Диаметр отверстия должен соответствовать десятым долям миллиметра. Диаметр отверстия может быть рассчитан с использованием известного диаметра бора. Тщательно промывают место отверстия стерильным физраствором до достижения гемостаза. Высушивают стерильными ватными шариками.
Примечание - При выраженном гингивальном воспалении у животных может быть необходимым провести удаление зубного камня и отслоений за несколько дней до подготовки полости, возможно повторно, пока гингивальное воспаление не будет под контролем.
6.5.3.2.2 При приготовлении исследуемых материалов следуют инструкциям изготовителя. Если изготовитель рекомендует другие промывающие растворы или реагенты для прекращения кровотечения либо особую предварительную обработку пульпарной раны, то следуют инструкциям изготовителя.
6.5.3.2.3 Следует использовать случайный отбор для определения, какие полости получат исследуемый наполняющий материал и материалы отрицательного и положительного контроля до подготовки полости. По объективной возможности, сочетают контрольные и исследуемые зубы анатомически, т.е. правый верхнечелюстной премоляр и левый верхнечелюстной премоляр, правый нижний премоляр и правый верхний премоляр и т.д. Путем случайной выборки один зуб становится исследуемым образцом, а контралатеральные и противоположные зубы становятся контролями.
В зависимости от вида животного и его доступности выбор зубов может быть изменен.
6.5.3.2.4 На каждый период времени заполняют по меньшей мере 10 полостей испытуемым материалом и пять полостей подходящим эталонным материалом путем произвольного распределения. Смешивают прокладочные и контрольные материалы на пластине (подкладке), избегая микробной контаминации. Наносят материалы на пульпарную рану без давления. Восстанавливают полость либо композиционным материалом, модифицированным поликислотой, либо стеклоиономерным цементом, модифицированным смолами. За этим должно следовать восстановление адгезивно связанным композиционным материалом.
6.5.3.2.5 Выбранные виды животных должны быть наиболее низкими в биологической цепи из требуемых для удовлетворения научных целей при наименьшем ущербе здоровью животных. Выбор вида животного должен быть обоснован и отражен документально. При использовании обезьян, собак или миниатюрных свиней необходимо использовать по меньшей мере одно животное на каждый период времени. При использовании хорьков необходимо использовать не менее четырех животных на каждый период времени, так как применимы только клыки.
Примечание 1 - Цемент на основе силиката кальция, такой как минеральный триоксид агрегат (МТА) или гидроокись кальция, свежеприготовленный на стерильном 0,9%-ном (массовая доля) физиологическом растворе до консистенции замазки, являются подходящим эталонным контролем.
Примечание 2 - Для предотвращения вымывания цемента на основе силиката кальция после его помещения наносят модифицированный композитом стеклоиономерный (RMGI) материал на цемент и 0,5 - 1,0 мм окружающего дентина. Восстанавливают до окончательного контура, используя кислотный травильный (или самопротравливающийся) связующий дентинный агент вместе с композиционным материалом.
Примечание 3 - Никакие материалы положительного или отрицательного контроля не нужны в дополнение к вышеозначенному эталонному контролю, так как стандартный материал является биологически активным.
Примечание 4 - При применении препарата гидроокиси кальция наносят тонкий слой либо поликарбоксилатного цемента, либо обычного (самоотверждающегося) стеклоиономерного цемента поверх препарата гидроокиси кальция, с последующим восстановлением с применением кислотного травильного (или самопротравливающегося) связующего дентинного агента вместе с композиционным материалом.
6.5.3.2.6 Наблюдают за животными и обращаются с ними, как описано в 6.4.3.2.6.
6.5.3.3 Приготовление препаратов
6.5.3.3.1 После (25 +/- 5) сут и (70 +/- 5) сут проводят эвтаназию передозировкой анестетика или применением других общепринятых веществ достаточного числа животных для предоставления по меньшей мере 10 зубов, содержащих исследуемый материал. Осматривают реставрированные зубы и окружающие их ткани, подробно регистрируют любые аномалии. Удаляют каждый реставрированный зуб вместе с окружающими его твердыми и мягкими тканями единым блоком и закрепляют в подходящем фиксирующем агенте.
Примечание - Сосудистая перфузия тканей с фиксирующим агентом во время эвтаназии до их удаления обеспечивает лучшую фиксацию.
6.5.3.3.2 После фиксации делают рентгенограмму каждого блока ткани для определения каких-либо рентгенографических изменений. Готовят секции для осмотра, как указано в 6.4.3.5.
6.5.3.4 Оценка пульпы зуба
Осматривают секции, описывают гистологические признаки, оценивают воспалительный инфильтрат и вычисляют индекс воспалительного ответа согласно протоколу, описанному в 6.4.3.6. Так как поверхностная пульпарная ткань будет разрушена в результате создания пульпарного отверстия, готовят отдельную оценку воспалительного инфильтрата, используя шкалу, приведенную в таблице 8.
Таблица 8
Балл воспаления | Описание воспалительных изменений |
0 | Нет воспаления |
1 | Легкое воспаление: рассеянные воспалительные клетки в пульпарной ткани, прилегающей к пульпарному отверстию |
2 | Умеренное воспаление: воспалительные клетки с небольшими фокальными скоплениями в пульпарной ткани, прилегающей к пульпарному отверстию |
3 | Значительное воспаление: обширное проникновение воспалительных клеток в пульпарную ткань, прилегающую к пульпарному отверстию |
4 | Абсцедирование или расширенное проникновение воспалительных клеток, не ограничивающееся только пульпарной тканью, прилегающей к пульпарному отверстию |
Дополнительно необходимо предоставить полное описание степени, распределения и характера какой-либо дентинной перемычки, обращая особое внимание на наличие тоннельных дефектов и клеточных включений, каковые могут препятствовать эффективности перемычки в качестве барьера. Оценивают степень образования перемычки отверстия третичным дентином по шкале: отсутствующая, частичная или полная. Рекомендации по интерпретации гистологических признаков образования дентинной перемычки приведены в примечании ниже.
Степень и распределение какой-либо дентинной перемычки должны быть рассмотрены исходя из того, покрывает ли перемычка полностью участок пульпарного отверстия, ее глубины или толщины, а также от ее распределения относительно участка отверстия. Неполная перемычка не предоставляет эффективной защиты открытой пульпы. Хотя адекватная глубина перемычки требуется для эффективной пульпарной защиты, неконтролируемый восстановительный дентиногенез для образования перемычки может вызвать окклюзию пульповой камеры и подвергнуть риску жизнеспособность пульпы. Широко распространенный восстановительный дентиногенез за местными пределами дентинной перемычки и ее канальцевого сообщения с материалом может предполагать клеточный ответ на травму (например, хирургическую травму), выходящий за границы прямого ответа на материал. Регулярность структуры канальцев в дентинной перемычке может свидетельствовать о степени дисплазии во время ее формирования с отсутствием или наличием нескольких канальцев, предполагающих дальнейшее формирование диспластической ткани. Наличие тоннельных дефектов и клеточных включений в дентинной перемычке также указывает на формирование диспластической ткани и может повлиять на проницаемость и степень закупоривания, предоставляемые перемычкой.
6.5.4 Оценка результатов
Оценивают результаты, как указано в 6.4.4, включая их статистический анализ. Когда результаты представлены по оценочной шкале (непараметрические данные), такие как те, которые перечислены выше в разделе гистологические характеристики, следует использовать непараметрический статистический анализ.
6.5.5 Отчет об испытании
Представляют результаты в отчете об испытании, как указано в 6.4.5.
6.6.1 Цель
Испытание предназначено для оценки биосовместимости эндодонтических материалов с оставшимися тканями апикальной пульпы (культи) и периапикальными тканями. В оценку должны быть включены процедуры, необходимые для предполагаемого клинического применения материала.
Испытание при эндодонтическом применении должно проводиться для биоактивных эндодонтических материалов, например материалов, заявленных как стимулирующие формирование верхушечных твердых тканей, предназначенных для ортоградного или ретроградного применения.
6.6.2 Животные и гуманное обращение с животными
Благополучие животных должно соответствовать положениям 6.4.2.
Используют как минимум четырех млекопитающих одного вида, не являющихся грызунами, как описано в 6.4.2, такого возраста, что их зубной ряд содержит неповрежденные постоянные зубы с закрытыми (зрелыми) верхушками; использование резцов, клыков и премоляров предпочтительно. Допустимо использование премоляров с наличием двух корней.
6.6.3 Процедура исследования
6.6.3.1 Подготовка животных
Выбирают достаточное число животных для предоставления по меньшей мере 10 зубов, содержащих исследуемый материал, на каждый период времени.
У собак некоторых пород морфология верхушечной части корневого канала может затруднить подготовку корня.
Анестезируют животных и проводят процедуру, описанную в 6.6.3.2.
6.6.3.2.1 Делают рентгенограммы, показывающие прикорневую область всех пломбируемых зубов. Очищают и изолируют зубы, как описано в 6.5.3.2.1.
Примечание - При выраженном гингивальном воспалении у животных следует провести удаление отложений и налета за несколько дней до подготовки полости, возможно повторно, пока гингивальное воспаление не будет под контролем.
Подготавливают требуемое число зубов для размещения пломб корневого канала. Просверливают соответствующее отверстие в пульповой камере, используя острые боры при стерильных условиях. Очищают открытую пульпу физиологическим раствором [0,9%-ным (массовая доля)] и высушивают стерильными ватными шариками. Используют новый стерильный пульпоэкстрактор или зазубренный зонд для корневого канала для отрезания пульпы (1,0 +/- 0,5) мм от верхушечного отверстия, используют рентгенограммы в качестве руководства при использовании инструментов. Повторно промывают корневой канал раствором гипохлорита натрия [рекомендуемые концентрации колеблются от 1,0% до 5,25% (массовая доля)], затем стерильным 0,9%-ным (массовая доля) физиологическим раствором.
Увеличивают корневой канал, используя все более длинные стерильные пульпоэкстракторы, калиброванные по длине до уровня, на котором была отрезана пульпа, пока его длина не стала приемлемой для пломбирования. Прилагают особые усилия для исключения дентинных осколков из корневого канала, которые могут заблокировать верхушку зуба и препятствовать контакту эндодонтического материала с верхушечной тканью. По завершении применения инструментов промывают корневой канал раствором гипохлорита натрия [рекомендуемые концентрации колеблются от 1,0% до 5,25% (массовая доля)], затем стерильным 0,9%-ным (массовая доля) физиологическим раствором, и высушивают стерильными ватными шариками и большими притупленными стерильными бумажными штифтами, не затрагивая верхушечный пульпарный остаток.
6.6.3.2.2 При приготовлении исследуемых материалов следуют инструкциям изготовителя. Если изготовитель рекомендует процедуры подготовки зубов, отличающиеся от описанных выше, то следуют инструкциям изготовителя.
6.6.3.2.3 Следует использовать случайный отбор для определения, какие полости получат исследуемый наполняющий материал и материалы отрицательного и положительного контроля до подготовки полости. По объективной возможности, сочетайте контрольные и исследуемые зубы анатомически, т.е. правый верхнечелюстной премоляр и левый верхнечелюстной премоляр, правый нижний премоляр и правый верхний премоляр и т.д. Путем случайной выборки один зуб становится исследуемым образцом, а контралатеральные и противоположные зубы становятся контролями.
В зависимости от вида животного и его доступности выбор зубов может быть изменен.
6.6.3.2.4 На каждый период времени заполняют по меньшей мере 10 зубов испытуемым материалом и по меньшей мере пять подходящим эталонным материалом. Смешивают эндодонтические и эталонные материалы на пластине (подкладке), избегая микробной контаминации. Заполняют корневой канал испытуемым или эталонным материалом, используя гуттаперчу у места разрыва пульпы. Заделывают полость доступа усиленным цинк-оксид-эвгеноловым (ZOE) цементом, покрытым либо поликарбоксилатным цементом, либо обычным (самоотверждающимся) стеклоиономерным цементом, либо композиционным материалом с сохраненной протравленностью. Делают рентгенограммы, показывающие прикорневую область всех заполненных зубов.
6.6.3.2.5 При выборе обезьян, собак или миниатюрных свиней необходимо использовать не менее двух животных на каждый период времени. При выборе хорьков необходимо использовать не менее четырех животных на каждый период времени, так как применимы только клыки.
6.6.3.2.6 При использовании композиционного материала необходимо предварительно нанести на ZOE тонкий слой либо обычного (самоотверждающегося) стеклоиономерного цемента, либо поликарбоксилатного цемента. Помещение композиционного материала в прямом контакте с цементом ZOE может привести к подавлению полимеризации композиционного материала.
Примечание - Цемент ZOE, отдельно или с другими добавками, такими как герметик Гроссмана, является подходящим эталонным материалом.
6.6.3.2.7 Наблюдают за животными и обращаются с ними, как описано в 6.4.3.2.6.
6.6.3.3 Приготовление препаратов
6.6.3.3.1 После (28 +/- 3) сут и (90 +/- 5) сут проводят эвтаназию передозировкой анестетика или применением других общепринятых веществ достаточного количества животных для предоставления по меньшей мере 10 зубов, содержащих исследуемый материал. Осматривают восстановленные зубы и их опорные ткани и регистрируют подробности каких-либо аномалий. Удаляют каждый обработанный зуб вместе с окружающими его твердыми и мягкими тканями единым блоком и закрепляют в подходящем фиксирующем агенте.
Примечание - Сосудистая перфузия тканей с фиксирующим агентом во время эвтаназии до их удаления предоставляет лучшую фиксацию.
6.6.3.3.2 После фиксации делают рентгенограмму каждого блока ткани для определения каких-либо рентгенографических изменений. Готовят секции для осмотра, как указано в 6.4.3.5, параллельно длинной оси зуба сквозь корневой канал и его ответвления, показывая поверхность контакта материала/пульпарной ткани и прилегающей прикорневой ткани.
6.6.3.4 Оценка тканей
Осматривают секции слепым методом, не удостоверясь, является ли исследуемый образец опытным или контрольным. Для каждой серии секций регистрируют полное описание всех гистологических признаков в пульпе, прикорневых тканях, дентине и цементе в верхушечной части зуба. Для каждого исследуемого образца оценивают изменения ткани по шкале, приведенной в таблице 9. Примеры гистологических признаков для рассмотрения приведены ниже.
Таблица 9
Шкала | Наблюдение |
0 | Нет воспаления |
1 | Легкое воспаление: в исследуемых образцах обнаруживаются рассеянные воспалительные клетки с преобладанием хронических, а структурные характеристики остаточной пульпы все еще поддаются идентификации |
2 | Умеренное воспаление: исследуемые образцы показывают фокальные скопления воспалительных клеток, но без некроза тканей, и некоторое нарушение структурных характеристик остаточной пульпы и прикорневых тканей |
3 | Значительное воспаление: обширное замещение остаточной пульпы или прикорневых тканей воспалительным клеточным инфильтратом |
4 | Образование абсцесса |
Примеры гистологических признаков для регистрации включают:
a) оценку для определения, является ли наполнение корневого канала коротким, вровень или экструдированным: соотносят это наблюдение с наличием воспаления, резорбцией корня и костной реакцией;
b) экструдирование уплотнителя (цемента) корневого канала: определяют, экструдирован ли уплотнитель сквозь верхушку в окружающее периодонтальное пространство и костные ткани. Хотя наиболее вероятно, что это произойдет через 28 дней, из этой оценки не следует исключать долговременный период;
c) наличие некротической верхушечной ткани;
d) качество адаптации материала, заполняющего корневой канал, оцениваемое как хорошее, среднее или плохое: хорошая адаптация означает, что пломбирующий материал хорошо адаптируется к стенкам корня не только на одной, но и на сериях секций, без видимых пустот. Среднюю оценку ставят, когда некоторые секции обнаруживают пустоты или области, где пломбирующий материал плохо адаптируется к корню. Плохая адаптация отмечается, когда пломбирующий материал не прилегает плотно к стенкам корня или когда наблюдаются многочисленные пустоты;
e) дальнейшее уточнение воспаления, очерченного выше (и оцененного по шкале от 0 до 4) по типу присутствующих воспалительных клеток: регистрируют преобладающий тип клетки и учитывают, что воспалительные клетки (лейкоциты) появляются раньше, в то время как одноядерные клетки (лимфоциты, моноциты, макрофаги и многоядерные гигантские клетки) появляются позже. Классифицируют воспалительную реакцию как острую (О), хроническую (Х) или смешанную (С);
f) резорбцию корня (наличие или отсутствие);
g) реакцию верхушечной кости, оцениваемую как нормальная или воспаленная (оценивают воспаление), и определение, присутствует ли гранулема и показывает ли кость признаки резорбции;
h) оценку воспалительного ответа по шкале от 0 до 3, как описано в таблице 9.
6.6.4 Оценка результатов
Оценивают результаты, как указано в 6.4.4, включая их статистический анализ. Если результаты сообщаются путем оценки (непараметрические данные) категорий, таких как приведенные выше как гистологические свойства, нужно использовать непараметрический статистический тест.
6.6.5 Отчет об испытании
Представляют результаты в отчете об испытании в соответствии с 6.4.5.
(справочное)
ВИДЫ ИСПЫТАНИЙ ДЛЯ ОЦЕНКИ БИОСОВМЕСТИМОСТИ МИ,
ПРИМЕНЯЕМЫХ В СТОМАТОЛОГИИ
Таблица A.1 содержит виды испытаний для оценки биосовместимости МИ, применяемых в стоматологии.
Таблица A.1
применяемых в стоматологии
Характер контакта с организмом | Длительность контакта | Общие положения | Группа I | Группа II | Группа III | ||||||||||
A - кратковременный (<= 24 ч) B - длительный (> 24 ч до 30 сут) C - долговременный (> 30 сут) | Физические и/или химические данные | Испытания на цитотоксичность | Испытания на цитотоксичность | Испытания на цитотоксичность | Гиперчувствительность замедленного типа | Раздражение или внутрикожная реактивность | Острая системная токсичность | Субхроническая (подострая) системная токсичность | Генотоксичность | Имплантация | Испытание пульпарного и дентинного использования | Испытание пульпарной прокладки | Испытание эндодонтического использования | Испытание применения внутрикостного имплантата | |
ИСО 7405, подразделы 6.2 и 6.3 | ИСО 7405, приложение B | ИСО 10993-10 | ИСО 10993-10 | ИСО 10993-11 | ИСО 10993-11 | ИСО 10993-6 | ИСО 7405, подраздел 6.4 | ИСО 7405, подраздел 6.5 | ИСО 7405, подраздел 6.6 | ИСО 7405, приложение C | |||||
Изделия, контактирующие с поверхностью тела человека | A | X | E | E | - | E | E | - | - | - | - | - | - | - | - |
B | X | E | E | - | E | E | E | E | - | E | - | - | - | - | |
C | X | E | E | - | E | E | E | E | E | E | - | - | - | - | |
Изделия, присоединяемые извне | A | X | E | E | E | E | E | E | - | - | - | E | - | - | - |
B | X | E | E | E | E | E | E | E | E | E | E | - | - | - | |
C | X | E | E | E | E | E | E | E | E | E | E | - | - | - | |
Имплантируемые изделия | A | X | E | E | - | E | E | - | - | - | - | - | E | - | - |
B | X | E | E | - | E | E | E | E | E | E | - | E | - | E | |
C | X | E | E | - | E | E | E | E | E | E | - | E | E | E | |
Примечание 1 - X обозначает предварительную информацию, необходимую для оценки риска. Примечание 2 - E обозначает конечные точки для рассмотрения в процессе оценки риска (либо путем использования существующих данных, дополнительного тестирования, конкретного для конечных точек, либо обоснования, почему оценка конечной точки не требует дополнительного набора данных). Если МИ состоит из новых материалов, ранее не применявшихся в качестве МИ, а данные по токсикологии отсутствуют в научной литературе, необходимо рассмотреть дополнительные конечные точки, кроме обозначенных как E в данной таблице. Существует вероятность, что для конкретных МИ необходимо включить большее или меньшее количество конечных точек, чем обозначено. Примечание 3 - См. также ISO 10993-1, таблица A.1. | |||||||||||||||
(справочное)
B.1 Цель
В настоящем приложении приведен метод испытания на цитотоксичность дентинного барьера, который следует использовать отдельно или в сочетании с другими исследованиями цитотоксичности, иммуногенности, мутагенности или генотоксичности.
Эти методы предназначены для демонстрации изменения концентрации либо идентифицированных компонентов стоматологических материалов, либо экстрактов полимеризованных или затвердевших материалов, используемых в их окончательной форме при расположении на одной стороне дентина и возможной диффузии на противоположную сторону. Данный метод является моделью пульповой камеры in vitro для изучения процессов фильтрации и диффузии материалов из подготовленной зубной полости в пульпу.
Для измерения диффузии веществ через дентинный барьер можно использовать полимеризованные или затвердевшие материалы либо их компоненты, применяемые на практике. Для измерения концентраций диффундирующих веществ возможно использовать радиоизотопно-меченые растворы, либо конкретный раствор можно измерить методами колориметрии, спектрофотометрии, хроматографии или другими методами.
B.2 Приборы и материалы
B.2.1 Клетки
Можно использовать известную клеточную линию, которая легко доступна, например из Американской коллекции типовых культур (ATCC). В качестве варианта могут быть использованы клональные клетки, трансфицированные большим T-антигеном SV40, например выведенные из зубного сосочка теленка. Их поддерживают в питательной среде в увлажненной атмосфере при температуре (37 +/- 2) °C и 5% CO2. Также можно применять другие известные клеточные линии со свойствами, подобными одонтобластам, или другими свойствами, имеющими отношение к физиологии тканей пульпы.
B.2.2 Культуральная среда
Среда, указанная для выбранной клеточной линии, как приведено в Американской коллекции типовых культур (ATCC), или эквивалент.
Примечание - Для рекомендаций см. https://www.lgcstandards-atcc.org/?geocountry=ch. Питательная среда для клеток, трансфицированных большим T-антигеном SV40, состоит из  с добавлением 20%-ной телячьей сыворотки (FBS), 150 ME пенициллина, 150 мкг/мл стрептомицина, 0,125 мкг/мл амфотерицина Б и 0,1 мг/мл генетицина.
с добавлением 20%-ной телячьей сыворотки (FBS), 150 ME пенициллина, 150 мкг/мл стрептомицина, 0,125 мкг/мл амфотерицина Б и 0,1 мг/мл генетицина.
 с добавлением 20%-ной телячьей сыворотки (FBS), 150 ME пенициллина, 150 мкг/мл стрептомицина, 0,125 мкг/мл амфотерицина Б и 0,1 мг/мл генетицина.
с добавлением 20%-ной телячьей сыворотки (FBS), 150 ME пенициллина, 150 мкг/мл стрептомицина, 0,125 мкг/мл амфотерицина Б и 0,1 мг/мл генетицина.B.2.3 Реагенты
B.2.3.1 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий бромид (MTT).
B.2.3.2 Антибиотики/фунгициды, пенициллин, стрептомицин, амфотерицин Б и генетицин только для клональных клеток, трансфицированных SV40.
B.2.4 Оборудование
B.2.4.1 Вкладыши для планшета для культуры клеток, например Millicell <1>.
--------------------------------
<1> Millicell является торговым наименованием изделия, поставляемого Millipore, Билрике, США. Эта информация приведена для удобства пользователей настоящего стандарта и не является рекламой указанного изделия со стороны ISO.
B.2.4.2 6-луночные и 24-луночные культуральные планшеты.
B.2.4.3 Полиамидные сетки диаметром 8 мм, например Sefar <2>, ширина ячейки 150 мкм.
--------------------------------
<2> Sefar является торговым наименованием изделия, поставляемого Sefar, Вассербург-на-Инне, Германия. Эта информация приведена для удобства пользователей настоящего стандарта и не является рекламой указанного изделия со стороны ISO.
B.2.4.4 Двухкамерное перфузионное устройство.
Далее приведены описания двух приемлемых перфузионных камер, моделирующих пульповую камеру in vitro.
Первое двухкамерное перфузионное устройство Minucells <3> (см. рисунок B.1) состоит из перфузионной камеры, изготовленной из поликарбоната с основанием 40 x 40 мм и высотой 35 мм. Пульповая часть устройства соединена с одной стороны с емкостью с запасом культуральной среды и с другой стороны с перистальтическим насосом и сосудом для отработанной среды.
--------------------------------
<3> Minucells является торговым наименованием изделия, поставляемого Minucells & Minutissue GmbH, Бад-Аббах, Германия. Эта информация приведена для удобства пользователей настоящего стандарта и не является рекламой указанного изделия со стороны ISO.
1 - подача культуральной среды; 2 - нагреватель;
3 - перфузионная камера; 4 - насос; 5 - сливной сосуд
дентинного барьера на цитотоксичность
Внутри испытательного оборудования две камеры разделены срезом дентина, закрепленным в стальном штативе (см. рисунок B.2).
1 - испытуемый материал; 2 - сетка с клетками;
3 - срез дентина; 4 - стальное кольцо; 5 - стальная вставка
среза дентина и клеточной культуры
в испытательном оборудовании
Второе двухкамерное устройство, перфузионная камера Американской Ассоциации Стоматологов (ADA) <1> (см. рисунок B.3), состоит из полупрозрачных стен, изготовленных либо из Delrin <2>, либо из Lexan <3>, оба нетоксичные. Впускной и выпускной клапаны выполнены из нетоксичной нержавеющей стали с портом для иглы. Маленькие уплотнительные кольца изготовлены из красного силикона (внешний диаметр 15,9 мм, внутренний диаметр 12,42 мм). Внутренний 6-миллиметровый диаметр меньшего уплотнительного кольца создает область поверхностной диффузии в 28 мм2. Объем камеры составляет 0,5 мл жидкости. Этот объем можно уменьшить, заполнив камеру снизу нетоксичным поливинилсилоксановым слепочным материалом (например, Reprosil <1>) таким образом, чтобы объем камеры составлял менее 100 мкл.
--------------------------------
<1> Перфузионная камера ADA является торговым наименованием изделия, поставляемого Biomedical Engineering, Медицинский Колледж Джорджии, Огаста, Джорджия 30912, США, #NT-8214A. Эта информация приведена для удобства пользователей настоящего стандарта и не является рекламой указанного изделия со стороны ISO.
<2> Delrin является торговым наименованием изделия из класса материалов полиацеталь, поставляемого DuPont. Эта информация приведена для удобства пользователей настоящего стандарта и не является рекламой указанного изделия со стороны ISO.
<3> Lexan является торговым наименованием изделия из класса материалов поликарбонат, поставляемого General Electric Plastics. Эта информация приведена для удобства пользователей настоящего стандарта и не является рекламой указанного изделия со стороны ISO.
<1> Reprosil является торговым наименованием изделия из класса материалов гидрофобный нетоксичный поливинилсилоксановый слепочный материал, поставляемого Dentsply International, Йорк, Пенсильвания, США. Эта информация приведена для удобства пользователей настоящего стандарта и не является рекламой указанного изделия со стороны ISO.
1 - верхняя часть; 2 - резиновое уплотнительное кольцо;
3 - средняя часть; 4 - эластомерный лист; 5 - вход-выход;
6 - покровное стекло; 7 - низ; 8 - культуральная среда;
9 - испытуемый материал; 10 - срез дентина, удерживаемый
резиновыми уплотнительными кольцами
B.2.4.5 Планшет-ридер, 96-луночные планшеты, длина волны 540 нм, или любой аналогичный фотометр с требуемыми параметрами.
B.2.4.6 Срезы дентина из дентина человека или рогатого скота.
Примечание - При применении дентина нечеловеческого происхождения определяют проницаемость срезов до использования для подтверждения, что он схож с дентином человека на сопоставимом уровне пульпарно-дентинного соприкосновения. Для этих целей применяют капиллярную систему [например, Flowdec <2>].
--------------------------------
<2> Flowdec является торговым наименованием изделия, поставляемого DeMarco Engineering, Женева, Швейцария. Эта информация приведена для удобства пользователей настоящего стандарта и не является рекламой указанного изделия со стороны ISO.
B.3 Процедура испытания
B.3.1 Приготовление клеточной культуры
B.3.1.1 Трехмерные клеточные культуры
Трехмерные клеточные культуры рекомендуется использовать вместе с перфузионной камерой Minucells. Инкубируют полиамидные сетки в 0,1 моль/л уксусной кислоты в течение 30 мин, промывают три раза деминерализованной водой, высушивают на воздухе, покрывают фибронектином (0,03 мг/мл) и высушивают на воздухе в стерильных условиях. Помещают вкладыш клеточной культуры в каждую лунку 6-луночной планшеты вместе с 1,25 мл культуральной среды. Помещают сетки на вкладыши и засевают 20 мкл клеточной суспензии при 4 x 106 клеток/мл. После 48 ч инкубации при температуре (37 +/- 2) °C и под 5% CO2 при относительной влажности (90 +/- 10)% переносят сетки в 24-луночные планшеты и инкубируют (14 +/- 2) сут. Меняют культуральную среду три раза в неделю и в конце первой недели переносят сетки в новую 24-луночную планшету.
B.3.1.2 Монослойные культуры
Монослойные клеточные культуры рекомендуется использовать вместе с перфузионной камерой ADA. Применяют методы, описанные в ISO 10993-5, используя известную линию клеток, являющуюся общедоступной, например из Американской коллекции типовых культур (ATCC).
B.3.2 Приготовление срезов дентина
B.3.2.1 Дентин человека
Выбирают некариозные свежеизвлеченные молярные зубы, удаляют инородные частицы и присоединенные мягкие ткани ручными инструментами и погружают в 70%-ный этанол по меньшей мере на 15 мин. Готовят срезы дентина путем секционирования зубов под прямым углом к их длинным осям через самую широкую часть их головок, под окклюзионной эмалью и над окклюзионными пределами пульповых камер.
B.3.2.2 Дентин животного происхождения (бычий)
Выбирают целые зубы, без видимых признаков стираемости, из числа четырех средних нижних резцов убойных животных возрастом от 3 до 7 лет. Удаляют зубы, очищают от инородных частиц и присоединенных мягких тканей ручными инструментами и хранят в 0,5%-ном хлорамине или других схожих агентах до использования. Секционируют зубы вдоль их длинных осей как можно ближе к пульповой камере. Для испытания используют срезы околошеечной части зуба.
B.3.2.3 Обработка срезов дентина
Протравливают предполагаемый "пульпарный" фрагмент среза дентина 50%-ной лимонной кислотой в течение 30 с, тщательно промывают и стерилизуют либо автоклавированием (121 °C; 9,6 мПа; 25 мин) в 0,9%-ном растворе натрия хлорида, либо погружением в 70%-ный этанол на 15 мин, затем тщательным промыванием деминерализованной водой. Дентинные срезы могут храниться в 0,9%-ном растворе натрия хлорида при температуре (4 +/- 2) °C до трех недель. Следует убедиться в стерильности дентинных срезов с помощью микробиологического посева исследуемого образца из каждой партии.
Толщина среза дентина может различаться в зависимости от глубины клинической полости, которую испытание должно смоделировать. Срез дентина толщиной (500 +/- 50) мкм представляет количество дентина, остающееся под клинической полостью средней глубины. Могут быть получены более тонкие срезы для детального анализа глубоких клинических полостей.
Срезы дентина могут храниться в 0,9%-ном растворе хлорида натрия до использования.
B.3.2.4 Сборка перфузии (проведение перфузии)
B.3.2.4.1 Устройство Minucells
Помещают сетку с клетками в опытный прибор и вставляют срез дентина, закрепленный в штативе из нержавеющей стали.
Примечание - Подходящий штатив показан на рисунке B.2.
Опрыскивают (заполняют) камеры 0,3 мл среды для количественного определения (питательная среда с 6 г/л буфера HEPES) каждый час в течение 24 ч. Останавливают перфузию и помещают испытуемый материал в верхнее отделение в прямом контакте с "полостной" стороной среза дентина.
После приемлемого периода времени (например, 24 ч или 3 сут) удаляют сетку с клетками из пульповой части камеры и помещают в 48-луночные планшеты, содержащие 0,5 мл предварительно нагретого раствора МТТ (0,5 мл в питательной среде), инкубируют 2 ч при температуре (37 +/- 2) °C с фосфатно-буферным физиологическим раствором. Экстрагируют осадок синего формазана, используя 0,25 мл диметилсульфоксида, встряхивая планшеты при комнатной температуре 30 мин. Переносят 200 мкл этого раствора в 96-луночную планшету и определяют абсорбцию спектрофотометрическим методом на длине волны 540 нм. Выражают результаты как процент контрольных образцов или как фотометрические показания.
Используют от 5 до 10 лунок для каждого материала и контрольного образца в одном испытании и проводят каждое испытание по меньшей мере дважды.
B.3.2.4.2 Сборка перфузионной камеры ADA
Устанавливают срез дентина в устройстве перфузионной камеры. Наполняют нижнее отделение подходящей культуральной средой (или другой экстрагирующей жидкостью) и соединяют его с сосудами подачи и слива, если необходимо. Затем вносят исследуемыми материалами. После определенного времени воздействия удаляют культуральную среду и используют ее для испытания на цитотоксичность на обычных монослойных культурах клеток, например, используя синтез ДНК, митохондральную активность (анализ МТТ) или стимуляцию функций, таких как регуляция генов, в качестве биологических конечных точек.
B.4 Контрольные образцы
Используют положительный и отрицательный контрольные образцы для каждого испытуемого вещества. Положительный контрольный образец должен сократить жизнеспособность клеток примерно на 50% после воздействия в 24 ч; отрицательный контрольный образец не должен иметь никакого воздействия на жизнеспособность клеток. Примеры материалов положительного контроля <1> приведены в таблице B.1.
Примечание - В качестве отрицательного контрольного образца приемлем гидрофобный нетоксичный поливинилсилоксановый слепочный материал. В качестве положительного контрольного образца можно использовать материалы с составами, перечисленными в таблице B.1, или эквивалентные.
--------------------------------
<1> Следующие сырьевые материалы являются примерами пригодных коммерчески доступных продуктов. Эта информация приведена для удобства пользователей настоящего стандарта и не является рекламой указанного изделия со стороны ISO. Стеклянный порошок с размером частицы (30 +/- 10) мкм: Schott, номер для заказа GM35429. Полиакриловая кислота: Sigma-Aldrich, номер для заказа 323667. Хлорид дифенилиодония: Sigma, номер для заказа D209082. Камфорохинон: Sigma, номер для заказа 124893. Этил-4-диметиламинобензоат: Merck, номер для заказа 841086. HEMA (2-гидроксиэтил-метакрилат): Merck, номер для заказа 800588.
Таблица B.1
Материал <a> | Масса образца, мг | Масса образца, % | Конечная масса, % |
Порошок | |||
Стеклянный порошок | 829,000 | 82,90 | 66,30 |
Полиакриловая кислота | 146,000 | 14,60 | 11,70 |
Хлорид дифенилиодония | 25,000 | 2,50 | 2,00 |
Всего | 1 000,00 | 100,00 | 80,00 |
Жидкость | |||
Камфорохинон | 0,625 | 0,25 | 0,05 |
Этил-4-диметиламинобензоат | 0,625 | 0,25 | 0,05 |
HEMA | 187,500 | 75,00 | 15,00 |
Дистиллированная вода | 61,250 | 24,50 | 4,90 |
Всего | 250,000 | 100,00 | 20,00 |
<a> См. ссылку [32]. | |||
Смешивают компоненты порошка и жидкости отдельно и затем немедленно смешивают оба компонента в пропорции 1000 мг порошка и 250 мг жидкости. Отверждают стандартным способом в течение 40 с при 700 - 800 мВт/см2.
B.5 Оценка результатов
Не учитывают опыт, если между отрицательным и положительным контрольными образцами нет статистически значимой разницы.
В дополнение к описанной оценке следует обратиться к ISO 10993-5 для дальнейшей информации. Оценка данных, полученных от устройства Minucells, основана на статистическом сравнении (непараметрические методы) данных испытуемого материала с данными контрольных материалов, предполагая от пяти до 10 независимых культур для каждого материала. Определяют клеточные повреждения согласно таблице B.2 и оценивают результаты согласно таблице B.3. Включают результаты оценки в отчет об испытании.
Таблица B.2
Оценочная шкала | Описание повреждения |
0 | Не отличается статистически от отрицательного контрольного образца, но отличается от положительного контрольного образца или вызывает еще меньшее клеточное повреждение, чем отрицательный контрольный образец |
1 | Отличается статистически как от отрицательного, так и от положительного контрольных образцов |
2 | Не отличается статистически от положительного контрольного образца, но отличается от отрицательного контрольного образца или вызывает еще более значительное клеточное повреждение по сравнению с положительным контрольным образцом |
Таблица B.3
Оценочная шкала | Описание |
0 | Не цитотоксичный |
1 | Умеренно цитотоксичный |
2 | Резко цитотоксичный |
B.6 Отчет об испытании
Отчет об испытании должен включать следующую информацию:
a) использованную линию клеток;
b) использованную культуральную среду;
c) подробности исследуемого материала;
d) подробности подготовки исследуемого материала;
e) подробности положительного и отрицательного контрольных образцов;
f) процент жизнеспособности клеток по сравнению с отрицательным контрольным образцом;
g) результаты оценки.
(справочное)
C.1 Общая часть
В настоящем приложении приведен метод испытания на животных, связанный с функциональной оценкой систем внутрикостного имплантата, с использованием как макроскопических, так и микроскопических параметров. Он предназначен для применения только в случае, когда анализ риска указывает на необходимость дополнительной информации, которая может быть предоставлена только испытанием на животных.
Испытание с использованием животных также может помочь при оценке функционального стресса ответа организма на систему дентальной имплантации.
Настоящее приложение не предназначено для предоставления информации по механической прочности самих имплантируемых материалов, а скорее, для количественной оценки поверхности имплантат - кость.
Примечание - Механические свойства системы дентальной имплантации описаны в ISO 14801.
C.2 Метод испытания
Перед испытанием каждой конкретной системы дентальной имплантации производитель или заказчик отвечают за подготовку протокола детального испытания, который должен включать, по меньшей мере, следующую информацию:
a) цель испытания;
b) причину и обоснование испытания на животных и другая соответствующая информация, которые могут потребоваться для соответствия с ISO 10993-2;
c) исследуемую систему дентальной имплантации, включая ее химический состав и физическую структуру (включая поверхностную модификацию, если присутствует), а также ее рекомендуемый способ установки и использования в клинических условиях, а также используемые средства контроля;
d) выбранный вид животных, условия их содержания, а также обоснование выбора;
e) протокол испытания, включая количество животных и исследуемых образцов, выбранные временные интервалы и обоснование их использования;
f) запланированные методы оценки, как клинические, так и лабораторные, а также обоснование их использования;
g) запланированные методы анализа клинических и лабораторных данных, а также критерий определения результата испытания;
h) информация, которая должна быть включена в протокол испытаний.
Так как существует широкое разнообразие планов и клинических процедур, связанных с применением различных систем дентальной имплантации, невозможно сформулировать единый подробный протокол испытания. Тем не менее данное приложение предоставляет руководство по некоторым фундаментальным характеристикам метода испытания, которое должно быть одним для всех протоколов. Ссылки на протоколы испытаний на животных, отличных от человека, представлены в библиографии.
C.2.2 Животные и обращение с животными
C.2.2.1 Обращение с животными
Обращение с животными обеспечивается в соответствии с 6.4.2.
C.2.2.2 Лабораторные животные
Пока ни одна конкретная животная модель или исследование применения систем дентальной имплантации не были утверждены как подходящие к ситуации с использованием на человеке. Таким образом, рекомендуется выбор вида животных, соответствующего следующим критериям:
a) может осуществляться гигиена полости рта естественным или искусственным путем;
b) челюсти достаточного размера для нормального хирургического доступа и для размещения системы дентальной имплантации в форме, предназначенной для применения на человеке;
c) участок, где будет размещена система дентальной имплантации, должен иметь зубы-оппозиционеры;
d) животные должны достичь скелетной зрелости, если применимо для предназначенного использования;
e) предпочтительны животные со всеядной схемой движения жевательной челюсти.
C.2.2.3 Количество животных
Количество животных должно быть обосновано и являться минимально необходимым для определения заявленных целей исследования.
C.2.3.1 Исследуемые образцы
Используют предоставленные системы дентальной имплантации как предназначенные для клинического применения на человеке. Если дентальные имплантаты, каким-либо образом отличающиеся от предназначенных для клинического применения, включены в исследование, то необходимо обосновать такое решение.
C.2.3.2 Контрольные образцы
Используют подходящие контроли, если отсутствуют данные сопоставимых исследований. Возможно, что данные ранее опубликованного исследования являются приемлемыми, если условия испытания в двух исследованиях строго сопоставимы. Если нужен контроль системы дентальной имплантации, подходящими могут служить либо система дентальной имплантации, для которой имеются проверенные клинические данные, прошедшие экспертную ревизию, либо дентальный имплантат, аналогичный исследуемому имплантату, но без нагрузки.
C.2.3.3 Хирургическая подготовка участков для установки дентального имплантата
При необходимости перед установкой дентального имплантата создают участок челюсти, свободной от зубов.
Когда необходимо, до любых хирургических процедур животные должны быть анестезированы согласно надлежащим условиям лабораторной практики с применением признанной методики анестезии. Все хирургические процедуры должны проводиться в условиях асептики. Удаляют количество зубов, требуемое для предоставления участка или участков, необходимых для размещения зубного имплантата или имплантатов, применяя надлежащие методы. Животным может потребоваться соответствующее лечение для предотвращения инфекций в клинических условиях, максимально имитирующих применение у человека. Далее, в послеоперационный период животные должны быть на соответствующей щадящей диете для сведения к минимуму риска повреждения заживаемых тканей. Если исследуемый имплантат предназначен для отложенной, а не немедленной или немедленно отложенной имплантации, то имплантат должен быть размещен после соответствующего периода восстановления. Имплантат должен быть установлен после соответствующего периода заживления.
C.2.3.4 Размещение систем дентальной имплантации
Проводят хирургические процедуры для размещения дентальных имплантатов и их сопряженных компонентов в асептических условиях и точно следуют протоколу исследования. Процедуры должны проводиться под надлежащей анестезией. Зубное протезирование должно быть выполнено в соответствии с протоколом испытаний. Послеоперационные режимы ухода должны отражать цель исследования и признанные процедуры реабилитации.
C.2.3.5 Периоды испытания
Оценивают систему дентальной имплантации и реакцию организма на нее после интервалов времени, соответствующих целям испытания. Когда целью испытания является применимость клинического использования системы дентальной имплантации, рекомендованы как минимум три периода испытания, включая исходный и определенные периоды дальнейшего наблюдения после имплантации. Начальная точка для таких периодов дальнейшего наблюдения должна отражать любые послеоперационные интервалы, когда животное не находилось на нормальной диете. При отсутствии других требований только последний период будет подчеркивать хирургическое удаление и микроскопический анализ. Если целью является оценка резорбции кости и/или расшатывание имплантата, то необходимо оценить соответствующий долгосрочный long-term период.
Примечание - Для периодов времени имплантатов в ткани также см. ISO 10993-6.
C.2.3.6 Борьба с зубным камнем
По необходимости животные должны получать регулярные процедуры для борьбы с зубным камнем; включите все детали в протокол исследования.
C.2.3.7 Клинический и рентгенографический осмотр
Отражают состояние гингивальных и корневых тканей через определенные интервалы. В дополнение к визуальному осмотру гингивальных тканей рекомендуется по возможности отражать документально статус гигиены ротовой полости, зубного камня и гингивального воспаления, используя признанные клинические индексы. Особенно отмечают стабильность или степень мобильности устройства, наличие воспаления в окружающих тканях и любые признаки местной инфекции.
Делают стандартизованные рентгенограммы места зубного имплантата, прилегающих и окклюдирующих зубов, а также поддерживающей кости в заранее запланированное время, когда животные находятся под анестезией, чтобы серия до- и послеоперационных снимков была получена до времени завершения исследования.
C.2.3.8 Завершение периода испытания
По необходимости проводят эвтаназию животных при завершении периода исследования в соответствии с ISO 10993-2.
C.2.4 Оценка
Оценивают тканевые ответы путем клинического, рентгенологического, гистопатологического, статистического и других методов анализа в зависимости от необходимости для исследования. Если в целях исследования не указано другое, то хирургическое удаление зубного имплантата и гистопатологическая оценка тканевых ответов вокруг него должны ограничиваться только самым длительным или последним периодом наблюдения.
C.2.4.1 Клиническая оценка
Предоставляют соответствующие детали общего состояния животных в течение исследования, включая массу тела. Состояние мягких тканей вокруг исследуемых и контрольных систем дентальной имплантации и вокруг прилегающих и окклюдирующих зубов, а также обеих челюстей целиком и сопряженной мышечной ткани должно оцениваться для определения, изменились ли они в течение исследования. Отражают документально какие-либо изменения в структуре имплантата, включая связанные с ним искусственные зубы.
Примечание - Любые вышедшие из строя имплантаты и способ их установки.
C.2.4.2 Рентгенографическая оценка
Оценивают рентгенологическое изображение исследуемых и контрольных систем дентальной имплантации, включая окружающую кость и прилегающие и окклюдирующие зубы, для определения, изменились ли данные костные структуры в течение исследования.
C.2.4.3 Извлечение образца
При необходимости по окончании исследования извлекают блоки тканей, представляющих целую челюсть и сопряженную мышечную ткань, а также конкретно блоки тканей, содержащих исследуемые и контрольные системы дентальной имплантации, вместе с прилегающими зубами, костными и рото-полостными мягкими тканями in situ, для гистопатологических и/или других анализов. В зависимости от конкретных целей исследования может потребоваться извлечение других фрагментов ткани и/или их исследование другими методами.
C.2.4.4 Подготовка образца для гистопатологического исследования
Если блоки ткани были извлечены, то их готовят для гистопатологического исследования надлежащим образом.
В соответствии с конкретными параметрами гистопатологической оценки могут понадобиться как не очищенные химически, так и очищенные секции. Рекомендуется микроскопическое исследование твердых, запрессованных в пластмассу, не очищенных химически образцов для оценки сопрягающих поверхностей имплантата/ткани и имплантата/ротовой полости.
C.2.4.5 Микроскопическая оценка
Исследуют достаточное количество секций для оценки природы взаимодействия между окружающими твердыми и мягкими тканями и системой дентальной имплантации или системой контроля. Особое внимание должно быть уделено качеству и количеству, по меньшей мере, следующих факторов:
a) зоны прямого контакта имплантата с костью;
b) новая кость и/или фиброзная ткань;
c) резорбция кости;
d) воспаление, инфекция, абсцедирование и некроз;
e) любые изменения в челюстях и сопряженной мышечной ткани;
f) по возможности, любые изменения в зубном имплантате.
Необходимо исследовать достаточное количество срезов с блоков соседних и смыкающихся зубов для определения их состояния и состояния окружающих тканей.
C.2.4.6 Статистический анализ
Существует множество международных стандартов, охватывающих область статистического анализа. Приводят соответствующий международный стандарт, если таковой был использован, если нет - обозначают аналитические методики, которые будут применены.
C.2.5 Отчет об исследовании
Оформляют отчет об исследовании, содержащий по меньшей мере следующую информацию:
a) все подробности протокола испытания, как обозначено в C.2.1, а также любые отклонения от первоначального протокола;
b) все подробности клинических и лабораторных наблюдений и измерений и соответствующие анализы в соответствии с C.2.3;
c) общий анализ данных, полученных в результате исследования, включая сравнение с контролями, с заключениями, в какой степени были достигнуты цели исследования, особенно в отношении биосовместимости исследуемой системы дентальной имплантации.
(справочное)
МЕЖГОСУДАРСТВЕННЫМ СТАНДАРТАМ
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего межгосударственного стандарта |
ISO 1942 | - | |
ISO 6344-1 | - | |
ISO 10993-1 | IDT | ГОСТ ISO 10993-1-2021 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования в процессе менеджмента риска" |
ISO 10993-2 | IDT | ГОСТ ISO 10993-2-2025 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 2. Требования к обращению с животными" |
ISO 10993-3 | IDT | ГОСТ ISO 10993-3-2018 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 3. Исследования генотоксичности, канцерогенности и токсического действия на репродуктивную функцию" |
ISO 10993-5 | IDT | ГОСТ ISO 10993-5-2023 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследования на цитотоксичность методами in vitro" |
ISO 10993-6 | IDT | ГОСТ ISO 10993-6-2021 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 6. Исследования местного действия после имплантации" |
ISO 10993-10 | IDT | ГОСТ ISO 10993-10-2023 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 10. Исследования сенсибилизирующего действия" |
ISO 10993-11 | IDT | ГОСТ ISO 10993-11-2021 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 11. Исследования общетоксического действия" |
ISO 10993-12 | IDT | ГОСТ ISO 10993-12-2023 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 12. Отбор и подготовка образцов для проведения исследований" |
ISO 10993-18 | IDT | ГОСТ ISO 10993-18-2022 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 18. Исследование химических свойств материалов в рамках процесса менеджмента риска" |
ISO/TS 10993-19 | IDT | ГОСТ ISO/TS 10993-19-2024 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 19. Исследования физико-химических, морфологических и топографических свойств материалов" |
ISO 14971 | IDT | ГОСТ ISO 14971-2021 "Изделия медицинские. Применение менеджмента риска к медицинским изделиям" |
ISO 16443 | - | |
<*> Соответствующий межгосударственный стандарт отсутствует. До его принятия рекомендуется использовать перевод на русский язык данного международного стандарта. Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: - IDT - идентичные стандарты. | ||
[1] | ISO 10993-7, Biological evaluation of medical devices - Part 7: Ethylene oxide sterilization residuals (Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание этиленоксида после стерилизации) |
[2] | ISO 10993-9, Biological evaluation of medical devices - Part 9: Framework for identification and quantification of potential degradation products (Оценка биологического действия медицинских изделий. Часть 9. Основные принципы идентификации и количественного определения потенциальных продуктов деградации) |
[3] | ISO 10993-13, Biological evaluation of medical devices - Part 13: Identification and quantification of degradation products from polymeric medical devices (Оценка биологическая медицинских изделий. Часть 13. Идентификация и количественная оценка продуктов разложения в полимерных медицинских устройствах) |
[4] | ISO 10993-14, Biological evaluation of medical devices - Part 14: Identification and quantification of degradation products from ceramics (Оценка биологического действия медицинских изделий. Часть 14. Идентификация и количественная оценка продуктов деградации керамики) |
[5] | ISO 10993-15, Biological evaluation of medical devices - Part 15: Identification and quantification of degradation products from metals and alloys (Оценка биологического действия медицинских изделий. Часть 15. Идентификация и количественное определение продуктов деградации из металлов и сплавов) |
[6] | ISO 10993-16, Biological evaluation of medical devices - Part 16: Toxicokinetic study design for degradation products and leachables (Оценка биологического действия медицинских изделий. Часть 16. Концепция токсикокинетических исследований продуктов разложения и выщелачиваемых веществ) |
[7] | ISO 10993-17, Biological evaluation of medical devices - Part 17: Establishment of allowable limits for leachable substances (Оценка биологического действия медицинских изделий. Часть 17. Оценка токсикологического риска компонентов медицинских изделий) |
[8] | ISO 14801, Dentistry - Implants - Dynamic fatigue test for endosseous dental implants (Стоматология. Имплантаты. Испытание под динамической нагрузкой эндооссальных зубных имплантатов) |
[9] | ISO/IEC 17025, General requirements for the competence of testing and calibration laboratories (Общие требования к компетентности испытательных и калибровочных лабораторий) |
[10] | ANSI/ADA Specification No. 41, Recommended Standard Practices for Biological Evaluation of Dental Materials |
[11] | OECD 420: OECD Guidelines for Testing Chemicals - Acute Oral Toxicity. Fixed Dose Procedure, Organisation for Economic Co-operation and Development, 75775 Paris Cedex 16, France |
[12] | OECD 423: OECD Guidelines for Testing Chemicals - Acute Oral Toxicity. Acute Toxic Class Method, Organisation for Economic Co-operation and Development, 75775 Paris Cedex 16, France |
[13] | OECD 425: OECD Guidelines for Testing Chemicals - Acute Oral Toxicity. Up-and-Down Procedure, Organisation for Economic Co-operation and Development, 75775 Paris Cedex 16, France |
Barka T., & Anderson P.J. Histochemistry. Theory, practice and bibliography, Chapter XIII, Hoeber Medical Division, Harper & Row Publishers, New York, 1963 | |
[15] | Bendall D.S., Ranson S.L., Walker D.A. Effects of carbon dioxide on the oxidation of succinate and reduced diphosphopyridine nucleotide by Ricinus mitochondri, Biochem. J., 1960; 76:221-5 |
[16] | Berbert F.L., Leonardo M.R., Silva L.A., Tanomaru Filho M., Bramante C.M. Influence of root canal dressings and sealers on repair of apical periodontitis after endodontic treatment, Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod., 2002, 93, pp. 184 - 189 |
[17] | Browne R.M. Animal tests for biocompatibility of dental materials: relevance, advantages and limitations, J. Dent. 1994, 22, pp. 21 - 24 |
[18] | Franz A., |
[19] | Hanks C.T., Diehl M.L., Craig R.G., Makinen P.L., Pashley D.A. Characterization of the "in vitro pulp chamber" using the cytotoxicity of phenol, J. Oral Path., 1989, 18, pp. 97 - 107 |
[20] | Magloire H., Joffre A., Bleicher F. An in vitro model of human dental pulp repair. J. Dent. Res., 1996, 75, pp. 1971 - 1978 |
[21] | Meryon S.D. The model cavity method incorporating dentine, Int. Endod. J., B, pp. 79 - 84, 1988 |
[22] | Murray P.E., Hafez A.A., Smith A.J., Windsor L.J., Cox C.F. Histomorphometric analysis of odontoblast-like cell numbers and dentine bridge secretory activity following pulp exposure, Int. Endod. J., 2003, 36, pp. 106 - 116 |
[23] | Murray P.E., Lumley P.J., Ross H.F., Smith A.J. Tooth slice organ culture for cytotoxicity assessment of dental materials, Biomaterials, 2000, 21, pp. 1711 - 1721 |
[24] | Pameijer C.H., & Stanley H.R. Pulp reaction to a dentin bonding agent, Am. J. Dent, 1995, 8, pp. 140 - 114 |
[25] | Pascon E.A., Leonardo M.R., Safavi K., Langeland K. Tissue reaction to endodontic materials: methods, criteria, assessment, and observations, Oral Surg. Oral Med. Oral Pathol., 1991, 72, pp. 222 - 237. Erratum in: Oral Surg. Oral Med., 73, p. 347, 1992 |
[26] | Schmalz G. Agar overlay method, Int. Endod. J., 1988, 21, pp. 59 - 66 |
[27] | Schmalz G., Garhammer P., Schweikl H. A commercially available cell culture device for dentin barrier tests, J. Endod., 1996, 22, pp. 249 - 252 |
[28] | Schmalz G., Hiller K.-A.,  F. New developments in the filter test system for cytotoxicity testing, J. Mat. Sci., Materials in Medicine, 1994, 5, pp. 43 - 51 F. New developments in the filter test system for cytotoxicity testing, J. Mat. Sci., Materials in Medicine, 1994, 5, pp. 43 - 51 |
[29] | Schmalz G., & Schweikl H. Characterization of an in vitro barrier test using a standard toxicant, J. Endod., 1994, 20, pp. 592 - 594 |
[30] | Schuster U., Schmalz G., Thonemann B., Mendel N., Metzl C. Cytotoxicity testing with three-dimensional cultures of transfected pulp-derived cells, J. Endod., 2001, 27, pp. 259 - 265 |
[31] | Wennberg A., Hasselgreen G., Tronstad L. A method for toxicity screening of biomaterials using cells cultured on millipore filters, J. Biomed. Mater. Res., 1979, 13, pp. 109 - 120 |
Schmalz G., Hiller K.-A., Seidenader C., Schweikl H. Interlaboratory testing of a new cytotoxic reference dental restorative material. J. Dent Res., 90, Spec Issue A, 2011 (www.dentalresearch.org), Abstract #273, http://iadr.confex.com/iadr/2011sandiego/webprogramschedule/Paper146565. html | |
[33] | Parr G.R., Gardner L.K., Steflik D.E., Sisk A.L. Comparative implant research in dogs: A prosthodontic model, J. Prosthet. Dent. 1992, 68 (3), pp. 509 - 514 |
[34] | Sisk A.L., Steflik D.E., Parr G.R., Hanes P.J. A light and electron microscopic comparison of osseointegration of six implant types. J. Oral Maxillofac. Surg. 1992, 50 (7), pp. 709 - 716 |
[35] | De Lange G.V., & De Putter C. Structure of the bone interface to dental implants in vivo. J. Oral Implantol. 1993, 19(2), pp. 123 - 135 |
[36] | Sagara M., Akagawa Y., Nikai H., Tsuru H. The effects of early occlusal loading on one-stage titanium alloy implants in beagle dogs: A pilot study. J. Prosthet. Dent. 1993, 69 (3), pp. 281 - 288 |
[37] | Piattelli A., Ruggeri A., Franchi M., Romasco N., Trisi P. A histologic and histomorphometric study of bone reactions to unloaded and loaded non-submerged single implants in monkeys: A pilot study. J. Oral Implantol. 1993, 19 (4), pp. 314 - 320 |
[38] | Steflik D.E., White S.L., Parr G.R., Sisk A.L., Schoen S.P., Lake F.T., Hanes P.J. Clinical evaluation data from a comparative dental implant investigation in dogs. J. Oral Implantol. 1993, 19 (3), pp. 199 - 208 |
[39] | Akagawa Y., Ichikawa Y., Nikai N., Tsuru H. Interface histology of unloaded and early loaded partially stabilized zirconia endosseous implants in initial bone healing. J. Prosthet. Dent. 1993, 69 (6), pp. 599 - 604 |
[40] | Steflik D.E., Sisk A.L., Parr G.R., Gardner L.K., Hanes P.J., Lake F.T., Brewer P. Osteogenesis at the dental implant interface: High-voltage electron microscopic and conventional transmission electron microscopic observations. J. Biomed. Mater. Res. 1993, 27 (6), pp. 791 - 800 |
[41] | Steflik D.E., Parr G.R., Sisk A.L., Hanes P.J., Berkery D.J., Brewer P. Osteoblast activity at the dental implant-bone interface: Transmission electron microscopic and high voltage electron microscopic observations. J. Periodontol. 1994, 65(5), pp. 404 - 413 |
[42] | Steflik D.E., Sisk A.L., Parr G.R., Lake F.T., Hanes P.J., Berkery D.J., Brewer P. Transmission electron and high-voltage electron microscopy of osteocyte cellular processes extending to the dental implant surface. J. Biomed. Mater. Res. 1994, 28 (9), pp. 1095 - 1107 |
[43] | Steflik D.E., Corpe R.S., Lake F.T., Sisk A.L., Parr G.R., Hanes P.J., Buttle K. Composite morphology of the bone and associated support-tissue interfaces to osseo-integrated dental implants: TEM & HVEM analyses. Int. J. Oral Maxillofac. Implants. 1997, 12 (4), pp. 443 - 453 |
[44] | Caulier H., Hayakawa T., Naert I., Van Der Waerden J.P., Wolke J.G., Jansen J.A. An animal study on the bone behaviour of Ca-P-coated implants: influence of implant location. J. Mater. Sci. Mater. Med. 1997, 8 (9), pp. 531 - 536 |
[45] | Overgaard S., Lind M., Glerup H., Grundvig S., Bunger C., |
[46] | Steflik D.E., Corpe R.S., Lake F.T., Young T.R., Sisk A.L., Hanes P., Berkery D.J. Ultrastructural analyses of the attachment (bonding) zone between bone and implanted biomaterials. J. Biomed. Mater. Res. 1998, 39 (4), pp. 611 - 620 |
[47] | Miyata T., Kobayashi Y., Araki H., Ohto T., Shin K. The influence of controlled occlusal overload on peri-implant tissue. Part 3: A histologic study in monkeys. Int. J. Oral Maxillofac. Implants. 2000 May - Jun., 15 (3), pp. 425 - 431 |
[48] | Assenza B., Scarano A., Petrone G., Iezzi G., Thams U., San Roman F., Piattelli A. Osteoclast activity around loaded and unloaded implants: a histological study in the beagle dog. J. Oral Implantol. 2003, 29 (1), pp. 1 - 7 |
[49] | Ko C.C., Douglas W.H., Delong R., Rohrer M.D., Swift J.Q., Hodges J.S., An K.N., RITMAN E.L. Effects of implant healing time on crestal bone loss of a controlled-load dental implant. J. Dent. Res. 2003, 82 (8), pp. 585 - 591 |
[50] | Xiropaidis A.V., Qahash M., Lim W.H., Shanaman R.H., Rohrer M.D.,  U.M., Hanes P., Hall J. Bone-implant contact at calcium phosphate-coated and porous titanium oxide (TiUnite)-modified oral implants. Clin. Oral Implants Res. 2005, 16 (5), pp. 532 - 539 U.M., Hanes P., Hall J. Bone-implant contact at calcium phosphate-coated and porous titanium oxide (TiUnite)-modified oral implants. Clin. Oral Implants Res. 2005, 16 (5), pp. 532 - 539 |
[51] | Bousdras V.A., Walboomers F., Jansen J.A., Cunningham J.L., Blunn G., Petrie A., SINDETPEDERSEN S., GOODSHIP A.E. Immediate functional loading of single-tooth TiO2 grit-blasted implant restoration. A controlled prospective study in a porcine model. Part II: Histology and histomorphometry. Clin. Implant Dent. Relat. Res. 2007, 9 (4), pp. 207 - 216 |
[52] | Cochran D.L., Bosshardt D.D., Grize L., Higginbottom F.L., Jones A.A., Jung R.E., Wieland M., Dard M. Bone response to loaded implants with non-matching implant-abutment diameters in the canine mandible. J. Periodontol. 2009, 80 (4), pp. 609 - 617 |
УДК 615.46:002:006.354 | МКС 11.060.10 | IDT |
Ключевые слова: стоматологический материал, конечный продукт, стандартный материал, пульповая камера in vitro | ||