СПРАВКА
Источник публикации
СПб.: Издательство "Лань", 2015
Примечание к документу
Название документа
"Временные методические указания по диагностике болезни Гамборо"
(утв. Минсельхозпродом РСФСР 19.07.1990 N 044-3)
"Временные методические указания по диагностике болезни Гамборо"
(утв. Минсельхозпродом РСФСР 19.07.1990 N 044-3)
Утверждены
19 июля 1990 г. N 044-3
ВРЕМЕННЫЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ДИАГНОСТИКЕ БОЛЕЗНИ ГАМБОРО
1.1. Лабораторная диагностика болезни включает:
- обнаружение антигена вируса болезни Гамборо в патологическом материале (фабрициевы сумки) в реакции диффузионной преципитации (РДП);
- выявление специфических антител в сыворотке крови переболевшей птицы в РДП;
- постановку биопробы на 30...40-дневных СПФ или чувствительных цыплятах;
- выделение вируса на СПФ-эмбрионах кур (КЭ) или в культуре куриных фибробластов (ФЭК);
- гистологическое исследование фабрициевых сумок больной или переболевшей птицы.
1.2. Диагноз на болезнь Гамборо устанавливают на основании эпизоотологических, клинических, патологоанатомических данных с учетом результатов комплекса лабораторных исследований.
1.3. Для обследования птицехозяйства на болезнь Гамборо проводят серологические исследования, используя реакцию диффузионной преципитации (РДП). С этой целью в лабораторию направляют 20...25 проб сывороток крови (1,0...2,0 см3) от цыплят суточных или старше 60-дневного возраста. Выявление специфических антител указывает на циркуляцию вируса в хозяйстве и дает основания для проведения лабораторных исследований патологического материала.
2.1. Для исследования в лабораторию направляют патологический материал (фабрициевы сумки) - 5...10 проб от больных цыплят 25...50-дневного возраста, который помещают в термос со льдом или консервируют 30%-ным раствором глицерина на фосфатном растворе pH 7,2.
Для гистологического исследования патологический материал фиксируют 10...15%-ным раствором формалина.
2.2. Отобранный патологический материал тщательно растирают в ступке со стерильным битым стеклом и готовят гомогенат на стерильном физиологическом растворе с pH 7,2...7,4 в соотношении 1:1.
После трехкратного замораживания и оттаивания центрифугируют при 5000 об/мин 20...25 мин. Надосадочную жидкость сливают и используют для исследования в РДП.
2.3. Для выделения вируса из фабрициевых сумок готовят 10%-ную суспензию на физиологическом растворе, центрифугируют при 3000 об/мин в течение 15...20 мин. К надосадочной жидкости добавляют 200 ЕД/мл пенициллина и 100 мкг/мл стрептомицина. Исследуемый материал выдерживают 12 ч при 48 °C, затем проверяют на стерильность и при отсутствии роста бактериальной микрофлоры в МПБ и МПА используют для заражения КЭ или культуры ФЭК или биологической пробы на цыплятах.
2.4. Для гистологического исследования из фабрициевых сумок готовят парафиновые срезы и окрашивают их гематоксилин-эозином общепринятым методом.
3.1. При постановке РДП используют набор для диагностики болезни Гамборо.
Лиофилизированные препараты, входящие в набор, растворяют в 0,5 мл дистиллированной воды. Положительную сыворотку используют в рабочем разведении, которое на одно разведение меньше указанного на этикетке коробки титра сыворотки. Не использованные в течение дня растворы антигенов и сывороток можно перелить в стерильные пробирки, закрыть резиновой пробкой и хранить при температуре не выше 2...4 °C не более 14 сут.
3.2. Для приготовления агарового геля в колбе из термостойкого стекла в 100 мл дистиллированной воды растворяют 8,0 г хлорида натрия, затем добавляют 1,0 г агара "Дифко". Колбу выдерживают на кипящей водяной бане до полного расплавления и просветления агара и разливают в стерильные чашки Петри по 15...20 мл агара. После застывания агара вырезают лунки с помощью металлического пробойника (штампа) из семи жестко закрепленных трубочек диаметром 5 мм (одна в центре и шесть по периферии на расстоянии 5 мм). Агаровые пробки удаляют иглой, пинцетом или канюлей, соединенной с вакуумной установкой.
3.3. Для исследования патматериала в центральную лунку вносят положительную сыворотку в рабочем разведении, в две периферические, диаметрально противоположные лунки - положительный и отрицательный контрольные агенты, а в оставшиеся четыре - полученную по п. 2.2 надосадочную жидкость в объеме 0,05 мл.
Для каждой пробы антигена используют отдельную пастеровскую пипетку.
3.3.1. С целью, выявления антител в сыворотке в центральную лунку вносят специфический антиген, а в периферические - контрольные и исследуемые сыворотки в объеме 0,05 мл. Каждую сыворотку берут отдельной пастеровский пипеткой.
3.4. После заполнения лунок чашки Петри помещают во влажную камеру (термостат) при температуре (37,0 +/- 0,5) °C.
3.5. Учет результатов РДП проводят через 24 и 48 ч после постановки реакции. Чашки просматривают на темном фоне в направленном луче света.
Реакцию учитывают только при наличии линии преципитации между сывороткой и антигеном в контроле.
За положительный результат при выявлении антигена принимают образование 1...2 линий преципитаций между лунками с исследуемым материалом и специфической сывороткой, а при выявлении антител - наличие линий преципитаций между лунками с исследуемой сывороткой и положительным антигеном.
4.1. Биопробу проводят на СПФ или 30...40-дневных цыплятах чувствительных к вирусу болезни Гамборо. Показатель чувствительности цыплят к данному возбудителю определяют с помощью индекса сумки (соотношение массы фабрициевой сумки к массе тела цыпленка).
Для определения указанного индекса из общей группы цыплят произвольно отбирают 5...10 голов, определяют вес каждого, затем их убивают, взвешивают от них фабрициевы сумки и вычисляют по формуле индекс сумки (Ис):
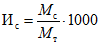 ,
,где Mс - масса фабрициевой сумки (г); Mт - живая масса тела (г).
Цыплят, в группе которых индекс сумки 4 и выше, используют для проведения биопробы.
4.2. Суспензию исследуемого материала, приготовленную, как указано в п. 2.3, вводят по 0,5 мл перорально 5 цыплятам. В контроле одновременно содержат в аналогичных условиях незараженных цыплят (5 гол.) одинакового возраста. За цыплятами устанавливают ежедневное наблюдение в течение 7 дней, отмечая клинические признаки заболевания.
4.3. За положительную биопробу принимают наличие у зараженных цыплят через 72...96 ч характерных клинических признаков заболевания: угнетение, отказ от корма, диарея, и патологоанатомических изменений - увеличение фабрициевой сумки, отечность, кровоизлияния.
5.1. Для заражения используют СПФ-эмбрионы кур 10...11-суточной инкубации.
5.2. Приготовленным и проверенным на стерильность 10%-ным (п. 2.3) гомогенатом заражают СПФ-куриных эмбрионов в объеме по 0,2 мл на хорионаллантоисную оболочку (ХАО). Зараженные эмбрионы помещают в термостат при температуре 37,5 °C и дважды в день овоскопируют. КЭ, погибшие в первые 48 ч после заражения, не учитывают (неспецифическая гибель). Эмбрионы, погибшие через 3 сут и позже и все оставшиеся живыми на 7-е сутки после заражения, охлаждают в холодильнике при 4 °C в течение 4...5 ч, затем их вскрывают и учитывают изменения эмбрионов. Характерными признаками для вируса болезни Гамборо являются наличие кровоизлияний в области головы, шеи, конечностей, отеки брюшной полости, а также отставание эмбрионов в росте, застойные явления в легких и разложение почек, печень увеличена, со множеством некротических очажков. ХАО у зараженных эмбрионов отечна и геморрагически воспалена.
5.3. При отсутствии специфических изменений у зараженных КЭ в первом пассаже проводят на СПФ-эмбрионах кур до 5 пассажей, используя для заражения суспензию из ХАО и эмбрионов предыдущего пассажа.
6.1. Для выделения вируса болезни Гамборо из патологического материала используют 24...48-часовую культуру первично трипсинизированных куриных фибробластов, которую готовят общепринятым методом и выращивают в стеклянных флаконах объемом 100 мл (матрасах). Для приготовления культуры клеток используют куриные эмбрионы из любого птицехозяйства.
В качестве питательной среды для культивирования клеток используют гидролизат лактальбумина, среду Игла или среду N 199. В ростовую среду добавляют 10% сыворотки крупного рогатого скота. Поддерживающая среда состоит из тех же сред, но без сыворотки крупного рогатого скота.
6.2. Из полученной и обработанной 10%-ной суспензии (согласно п. 2.3), свободной от контаминации микрофлорой, дополнительно готовят разведения суспензии на физиологическом растворе 10-2 и 10-3 и затем каждым разведением исследуемого материала в объеме по 3 мл заражают по 3 флакона с монослоем. Предварительно до заражения монослоя из матраса (флакона) удаляют ростовую среду и промывают раствором Хенкса. Зараженную культуру клеток выдерживают при температуре 37 °C в течение 30 мин, трижды промывают раствором Хенкса и затем добавляют поддерживающую среду. Для контроля культуры 2...3 матраса (флакона) оставляют незараженными. Зараженные и контрольные флаконы инкубируют при 37...38 °C.
6.3. Для учета цитопатического действия (ЦПД) флаконы просматривают под малым увеличением микроскопа через каждые 24 ч в течение 7 дней.
Цитопатическое действие (ЦПД) вируса болезни Гамборо наступает через 48...96 ч и характеризуется появлением отдельных округлых и изогнутых клеток, или очагов дегенерации, состоящих из округлых, слегка увеличенных в размере и преломляющих свет клеток на фоне сохранявшего целостность монослоя. Через 48...72 ч 80% клеток монослоя имеют зернистость.
При наличии ЦПД проверяют его специфичность путем нейтрализации действия вируса положительной сывороткой к вирусу болезни Гамборо (по общепринятой методике).
При отсутствии ЦПД вируса в первом пассаже проводят еще четыре последовательных пассажа. Если ЦПД в течение 4 пассажей не проявилось, результат считают отрицательным.
7.1. При микроскопическом исследовании гистосрезов в фабрициевой сумке на ранней стадии заболевания цыплят болезнью Гамборо отмечают отек межфолликулярной соединительной ткани, инфильтрацию ее мононуклеарными клетками и псевдоэозинофилами, очаговые или диффузные кровоизлияния, иногда тотальный или фибринозный бурсит. В фолликулах фабрициевых сумок наблюдают некроз лимфоцитов. Отдельные фолликулы заполняются клеточным детритом или инфильтрированы псевдоэозинофилами.
Реже обнаруживают коагуляционный некроз мозговой и корковой зон фолликулов с макрофагальной реакцией по периферии.
У переболевших цыплят отмечают увеличение количества стромы, атрофию складок и частичное или полное отсутствие фолликулов фабрициевых сумок, вместо которых образуются железистые структуры. Также выявляют "псевдофолликулы", сформированные в основном ретикулярными клетками, реже кистозные полости, равные по размерам фолликулам или превышающие их в 2...3 раза. Встречают регенерирующие фолликулы с пролиферацией лимфоцитов в корковом слое фолликула с последующим восстановлением структуры мозгового слоя. В соединительнотканной строме складок слизистой оболочки отмечают периваскулярные лимфоидноклеточные пролифераты, из которых затем формируются новообразованные фолликулы.
Выделение вируса на КЭ и КК - 10...50 дней.
Постановка РДП - 3 дня.
Биологических - 15 дней.
Гистологических - 7...10 дней.