СПРАВКА
Источник публикации
Документ опубликован не был
Примечание к документу
Данный документ включен в Перечень не действующих на территории Российской Федерации нормативных правовых актов, утвержденный Приказом Минздрава РФ от 23.12.2002 N 398.
Документ утратил силу в связи с изданием Приказа Минздрава СССР от 28.12.1989 N 691.
Название документа
"Инструкция о показаниях к приему и переводу беременных, рожениц и родильниц во второе акушерское (обсервационное) отделение родильного дома"
(вместе с "Инструкцией о показаниях к переводу недоношенных и заболевших новорожденных детей из родильного дома в соответствующие отделения детских больниц", "Инструкцией по организации и проведению комплекса санитарно-гигиенических мероприятий в акушерских стационарах", "Инструкцией по бактериологическому контролю эффективности санитарно-гигиенических мероприятий в акушерских стационарах", "Инструкцией по бактериологическому обследованию на выявление носителей золотистого стафилококка и проведению санации в акушерских стационарах", "Временной Инструкцией по стирке и дезинфекции белья родильных домов и гинекологических больниц")
(утв. Приказом Минздрава СССР от 06.12.1979 N 1230)
"Инструкция о показаниях к приему и переводу беременных, рожениц и родильниц во второе акушерское (обсервационное) отделение родильного дома"
(вместе с "Инструкцией о показаниях к переводу недоношенных и заболевших новорожденных детей из родильного дома в соответствующие отделения детских больниц", "Инструкцией по организации и проведению комплекса санитарно-гигиенических мероприятий в акушерских стационарах", "Инструкцией по бактериологическому контролю эффективности санитарно-гигиенических мероприятий в акушерских стационарах", "Инструкцией по бактериологическому обследованию на выявление носителей золотистого стафилококка и проведению санации в акушерских стационарах", "Временной Инструкцией по стирке и дезинфекции белья родильных домов и гинекологических больниц")
(утв. Приказом Минздрава СССР от 06.12.1979 N 1230)
Утверждена
Приказом Минздрава СССР
от 6 декабря 1979 г. N 1230
О ПОКАЗАНИЯХ К ПРИЕМУ И ПЕРЕВОДУ БЕРЕМЕННЫХ, РОЖЕНИЦ
И РОДИЛЬНИЦ ВО ВТОРОЕ АКУШЕРСКОЕ (ОБСЕРВАЦИОННОЕ)
ОТДЕЛЕНИЕ РОДИЛЬНОГО ДОМА
Приему во второе акушерское (обсервационное) отделение родильного дома подлежат:
I. Беременные и роженицы, имеющие:
1. Острое респираторное заболевание (грипп, ангину и др.); проявления экстрагенитальных воспалительных заболеваний (пневмония, отит и др.).
2. Лихорадочное состояние (температура 37,6° и выше без клинически выраженных других симптомов).
3. Длительный безводный период (излитие околоплодных вод за 12 и более часов до поступления в стационар).
4. Внутриутробную гибель плода (при отсутствии в городе специализированного отделения, учреждения).
5. Грибковые заболевания волос и кожи; кожные заболевания (псориаз, дерматит, экзема и др.).
6. Гнойные поражения кожи и подкожной клетчатки.
7. Острый или подострый тромбофлебит.
8. Пиелонефрит, пиелит, цистит и другие инфекционные заболевания почек.
9. Проявления инфекции родовых путей.
10. Токсоплазмоз, листериоз.
11. Венерические заболевания.
12. Туберкулез (закрытая форма любой локализации при отсутствии специализированного отделения) <*>.
--------------------------------
<*> Беременные и роженицы с открытой формой туберкулеза госпитализируются в специализированные родильные дома (отделения); при отсутствии таковых госпитализируются в боксы или изоляторы обсервационного отделения с последующим переводом после родов в туберкулезный диспансер.
13. Диарею.
14. Родильницы в раннем послеродовом периоде (в течение 24 часов после родов) в случае родов вне лечебного учреждения.
Переводу во второе акушерское (обсервационное) отделение из 1-го (физиологического) подлежат беременные, роженицы и родильницы имеющие:
1. Повышение температуры в родах до 38° и выше (при трехкратном измерении через каждый час).
Примечание: Роженицы с преждевременными родами, с нормальной температурой и целыми водами при поступлении, подлежат приему в 1-е акушерское (физиологическое) отделение родильного дома.
2. Повышение температуры после родов однократное до 37,6° и выше.
3. Субфебрилитет (до Т° - 37,5) продолжающийся более 1 дня.
4. Гнойные выделения, расхождение швов, "налеты" на швах независимо от температуры.
5. Проявления экстрагенитальных воспалительных заболеваний (грипп/ангина, острое респираторное заболевание и др.).
6. Диарею <*>.
--------------------------------
<*> Беременные, роженицы и родильницы, страдающие инфекционными заболеваниями, подлежат госпитализации и переводу в соответствующие инфекционные больницы.
Примечание: 1. В случае перевода новорожденного во второе акушерское (обсервационное) отделение вместе с ним переводят родильницу (бокс, отдельная палата или изоляция по заболеваниям).
2. При застойных явлениях в молочной железе родильницы переводятся во второе акушерское (обсервационное) отделение при наличии субфебрилитета в течение 2 дней, а также при покраснении кожи молочной железы независимо от температуры.
При наличии гнойного мастита, гнойного эндомиометрита, перитонита и проявлении других гнойно-септических заболеваний родильницы и роженицы подлежат немедленному выводу из родильного дома (отделения) и госпитализации в специализированное родильное отделение для септических больных.
Начальник Главного управления
лечпрофпомощи детям и матерям
Е.И.АНДРЕЕВА
Утверждена
Приказом Минздрава СССР
от 6 декабря 1979 г. N 1230
О ПОКАЗАНИЯХ К ПЕРЕВОДУ НЕДОНОШЕННЫХ И ЗАБОЛЕВШИХ
НОВОРОЖДЕННЫХ ДЕТЕЙ ИЗ РОДИЛЬНОГО ДОМА В СООТВЕТСТВУЮЩИЕ
ОТДЕЛЕНИЯ ДЕТСКИХ БОЛЬНИЦ
Переводу из родильного дома в соответствующие
отделения детских больниц подлежат:
I. Новорожденные, имеющие инфекционные заболевания:
1. Воспалительного характера.
2. Острые вирусные инфекции.
3. Гнойно-септические инфекции.
II. Новорожденные, имеющие неинфекционные заболевания:
1. Последствия внутриутробной гипоксии и асфиксии.
2. Гемолитическая болезнь (средней и тяжелой формы).
3. Анемия.
4. Заболевания почек.
5. Сердечно-сосудистая патология.
6. Патология эндокринной системы.
7. Наследственные аномалии обмена веществ.
8. Хирургические заболевания.
9. Неврологическая и церебральная патология.
III. Новорожденные, имеющие состояние "высокого риска".
1. Незрелость.
2. Отечный синдром.
3. Эмфизема легких.
Сроки перевода
- доношенные и недоношенные дети с инфекционной и гнойно-септической патологией, дети с хирургической патологией и сердечно-сосудистой недостаточностью при врожденных пороках подлежат срочному переводу (в день установки диагноза);
- доношенные и недоношенные дети с массой тела выше 2500 г переводятся не ранее 2-х суток после рождения;
- недоношенные дети с массой тела до 1500 г подлежат переводу на 7 - 8 день после рождения;
- недоношенные дети с массой тела выше 1500 г и больные новорожденные <*>, родившиеся с массой тела до 2500 г подлежат переводу на 5 - 6 день после рождения;
--------------------------------
<*> Новорожденные с заболеваниями неинфекционной этиологии.
- недоношенные здоровые дети с массой тела выше 2000 г могут быть выписаны домой после 8 суток жизни (при прибавке веса и активном состоянии), при условии активного их патронажа на дому.
В обсервационном отделении родильного дома находятся:
- дети, родившиеся в этом отделении и поступившие с матерью после родов, происшедшие вне родильного дома;
- дети, переведенные из физиологического отделения родильного дома по поводу заболевания матери, и дети с врожденным везикулезом до уточнения этиологии заболевания (не более суток).
Перевод новорожденных из родовспомогательных учреждений производится после согласования с заведующим специализированным отделением или главным врачом больницы, куда переводится ребенок.
Заместитель начальника
Главного управления лечпрофпомощи
детям и матерям Минздрава СССР
В.В.КОЧЕМАСОВА
Утверждена
Приказом Минздрава СССР
от 6 декабря 1979 г. N 1230
ПО ОРГАНИЗАЦИИ И ПРОВЕДЕНИЮ КОМПЛЕКСА
САНИТАРНО-ГИГИЕНИЧЕСКИХ МЕРОПРИЯТИЙ
В АКУШЕРСКИХ СТАЦИОНАРАХ <*>
--------------------------------
<*> Инструкция разработана Всесоюзным научно-исследовательским институтом дезинфекции и стерилизации Министерства здравоохранения СССР.
1.1. Инструкция предназначена для персонала родильных домов, работников санитарно-эпидемиологических и дезинфекционных станций, организующих и контролирующих проведение мероприятий по неспецифической профилактике внутрибольничных инфекций.
1.2. Основной особенностью родовспомогательных учреждений является постоянное пребывание в них высокочувствительных к инфекциям новорожденных детей и перенесших роды женщин.
1.3. Современные внутрибольничные инфекции в родильных домах вызываются различными микроорганизмами и проявляются синдромом нагноений и септических поражений.
1.4. К важнейшим клиническим формам внутрибольничных инфекций, наблюдаемых в родильных домах, относятся следующие гнойно-септические заболевания матерей и новорожденных: пиодермии, послеродовые маститы, эндометриты, послеоперационные гнойные процессы (после Кесарева сечения, перинеотомии и т.д.), послеродовой сепсис, воспалительные реакции при мелких травмах (потертости, ссадины и т.п.) кожи новорожденных, везикуло-пустулезные поражения кожи тела, век, слизистых оболочек, пемфигус новорожденных, конъюнктивиты, назофарингиты, омфалиты, фурункулы, абсцессы, отиты, пневмонии, пиелиты и пиелонефриты, энтериты и энтероколиты, сепсис, флегмоны, панариций, лимфоаденит, инфильтраты, импетиго и др.
1.5. Доминирующим возбудителем внутрибольничных инфекций в родильных домах является золотистый стафилококк, характеризующийся высокой вирулентностью и множественной устойчивостью к широко применяемым антибиотикам. В последние годы в этиологической структуре гнойно-септической инфекции возрос удельный вес заболеваний, обусловленных грамотрицательными микроорганизмами (протей, кишечная палочка, клебсиеллы, синегнойная палочка, серрации), грибами кандида, а также ассоциациями бактерий.
1.6. Источниками внутрибольничных инфекций в родильных домах являются больные с острыми и хроническими формами гнойно-септических заболеваний, а также носители патогенных микроорганизмов среди персонала, рожениц, родильниц и новорожденных.
1.7. Распространение возбудителей внутрибольничных инфекций в родильных домах происходит двумя путями: воздушно-капельным и контактным. Основные факторы передачи - воздух, руки, многочисленные объекты внешней среды (перевязочный материал, инструменты, белье и т.д.).
1.8. Для профилактики и борьбы с внутрибольничными инфекциями в родильных домах организуют и проводят комплекс санитарно-гигиенических мероприятий. Комплекс включает: своевременное выявление и изоляцию рожениц, родильниц и новорожденных с гнойно-септическими заболеваниями, своевременное выявление носителей золотистого стафилококка и их санацию, применение высокоэффективных методов обеззараживания рук медицинского персонала и кожи операционного поля, пастеризацию грудного молока, организацию централизованной стерилизации белья, перевязочного материала, инструментов, шприцев, использование методов и средств дезинфекции для обработки различных объектов внешней среды (постельные принадлежности, одежда, обувь, посуда и т.д.), имеющих потенциальное эпидемиологическое значение в механизме передачи внутрибольничных инфекций.
2.1. Ответственность за проведение комплекса санитарно-гигиенических мероприятий по борьбе с внутрибольничными инфекциями в родильных домах возлагается на главного врача родильного дома.
2.2. Заведующие отделениями вместе со старшими акушерами (сестрами) отделений организуют и контролируют выполнение настоящей инструкции.
2.3. Старшая акушерка (сестра) отделения проводит инструктаж среднего и младшего медицинского персонала по выполнению комплекса санитарно-гигиенических мероприятий, не реже 1 раза в месяц.
2.4. Лица, поступающие на работу в родильный дом, проходят полный медицинский осмотр в соответствии с постановлением Совнаркома СССР от 1 октября 1936 г. N 1769/ С.З. СССР, 1936, N 50, ст. 410 "Об обязательном медицинском осмотре лиц, занятых в пищевом деле, предприятиях по санитарно-гигиеническому обследованию населения и на сооружениях по водоснабжению", с "Инструкцией по проведению обязательных профилактических медицинских обследований лиц, поступающих на работу и работающих в пищевых предприятиях, на сооружениях по водоснабжению, в детских учреждениях и др.", утвержденной Главной санитарной инспекцией СССР 6 февраля 1961 г. N 352-61 и согласованной с ВЦСПС с изменениями и дополнениями (N 10-88/14-104 от 26 августа 1965 г.) к указанной инструкции.
- инструктаж по проведению санитарно-противоэпидемических мероприятий на порученном данному сотруднику участке работы.
2.5. Весь работающий персонал должен быть взят под диспансерное наблюдение для своевременного выявления и излечения хронических воспалительных заболеваний носоглотки, кожи, излечения кариозных зубов.
2.6. Заведующий отделением один раз в квартал организует медицинский осмотр и обследование медицинского персонала на носительство золотистого стафилококка и в случае выявления носителей организует проведение санации.
2.7. При возникновении внутрибольничных инфекций среди родильниц и новорожденных проводят внеочередное бактериологическое обследование обслуживающего персонала на носительство.
2.8. Персонал ежедневно перед выходом на смену принимает гигиенический душ и проходит врачебный осмотр (термометрия, осмотр зева и кожи). Лиц с воспалительными или гнойными процессами, недомоганием или лихорадкой к работе не допускают.
2.9. Персонал обеспечивают: индивидуальными шкафчиками для хранения собственного платья, платья для работы, сменной обуви, санодеждой (халат, шапочка или косынка, маска и т.д.), индивидуальными полотенцами.
2.10. Санодежду меняют ежедневно. 4-х слойные маркированные маски меняют каждые 4 часа при возникновении внутрибольничных инфекций и в обсервационном отделении.
2.11. Акушерские стационары закрывают для полной дезинфекции не реже 1 раза в год.
2.12. При возникновении в родильном доме внутрибольничных инфекций эпидемиолог санитарно-эпидемиологической станции проводит детальное эпидемиологическое обследование, в ходе которого выявляет возможные источники инфекции, пути и факторы передачи и намечает мероприятия по предупреждению дальнейшего распространения заболевания. Эпидемиологическое обследование проводят при возникновении 2-х и более случаев заболеваний в течение 1 - 10 дней после выписки из родильного дома, а также при возникновении каждого случая сепсиса у детей в возрасте до одного месяца. Прием рожениц в родильный дом прекращают. Для дезинфекции освобождают от родильниц и новорожденных все палаты сначала на одном этаже, а затем, по мере выписки оставшихся в родильном доме родильниц и новорожденных, подвергают тщательному обеззараживанию последовательно помещения всех этажей с последующим проведением бактериологического контроля.
2.13. Санитарно-эпидемиологические станции: организуют и обеспечивают систематические проверки персонала родильных домов на носительство золотистого стафилококка (не реже 1 раза в квартал), проводят фаготипирование выделенных культур, контролируют эффективность санации; организуют и обеспечивают регулярный бактериологический контроль.
ПОМЕЩЕНИЙ И ПОРЯДОК ПРИЕМА РОЖЕНИЦ
3.1. Приемно-смотровые отделения имеют один фильтр и две смотровые для приема рожениц в первое физиологическое акушерское отделение и во второе (обсервационное) акушерское отделение.
3.2. Смотровые должны иметь свои комнаты для санитарной обработки поступающих женщин с душевой кабиной, санитарным узлом и установкой для мытья суден, раздельное оборудование и инвентарь, легко доступные для мытья и обеззараживания. Стены, пол душевой кабины должны быть облицованы легко моющимися материалами. Душевую оснащают шлангом с подводкой горячей воды. Каждая душевая кабина должна иметь коврик из рифленой резины, приспособления для мыла, мочалки и др. Для каждого отделения выделяют свой маркированный уборочный инвентарь, отдельный инвентарь для туалета и комнат санитарной обработки.
3.3. Приемно-смотровые помещения оснащают настенными или потолочными облучателями - БОН-150 из расчета один облучатель на 30 м3 помещения, ОБП-300 - на 60 м3. Необходимо осуществлять раздельное включение ламп прямого и отраженного действия, входящих в состав облучателя. Включение ламп отраженного действия осуществляется непосредственно из помещения, где установлены облучатели, ламп прямого действия - вне этого помещения, но в непосредственной близости от него.
3.4. В комнате-фильтре поступающая на роды женщина снимает верхнюю одежду (пальто, обувь, платье) и получает обеззараженные тапочки (пункт 10).
3.5. У поступающих женщин в комнате-фильтре осматривают кожные покровы с использованием лампы-рефлектора, зев с помощью шпателя и измеряют температуру. Деревянные шпатели после использования уничтожают, а металлические - обеззараживают. Термометры целиком помещают в сосуд с дезинфицирующим раствором (приложение 2).
3.6. При подозрении на педикулез женщину направляют во второе обсервационное отделение, где она проходит соответствующую обработку.
3.7. Осмотр женщин проводят на специальной кушетке, покрытой клеенкой и стерильной простыней. После приема каждой женщины клеенку протирают ветошью, смоченной раствором дезинфектанта (приложение 2), а простыню меняют.
3.8. Перед купанием роженице ставят клизму, после чего она стрижет ногти на пальцах рук и ног. Ножницы погружают в 10% раствор формалина на 15 минут, а затем хранят в чистой сухой емкости.
3.9. Область лобка роженицы намыливают жидким мылом или мыльным спиртом при помощи стерильного ватного тампона на корнцанге или пинцете и сбривают волосы. Для каждой роженицы используют отдельное лезвие для одноразового пользования, которое после применения выбрасывают. Бритье в подмышечных впадинах производят отдельной бритвой. Металлические станочки для безопасных бритв после каждого использования кипятят 15 минут, хранят в сухом виде.
3.10. Перед приемом душа роженице дают комплект стерильного белья, включающий рубашку, полотенце, пеленку, халат и обеззараженную мочалку. Роженица принимает душ, используя твердое мыло в одноразовой расфасовке.
3.11. После осмотра женщины персонал моет руки теплой проточной водой с мылом в течение 2 минут. Для мытья рук используют брусковое хозяйственное мыло или туалетное мыло в мелкой расфасовке (на одну обработку).
3.12. После осмотра рожениц с воспалительными процессами персонал обеззараживает руки растворами бактерицидных препаратов.
3.13. В качестве средств для дезинфекции рук применяют 80% этиловый спирт, 0,5% раствор хлоргексидина биглюконата (гибитан) в 70% этиловом спирте, 1% раствор иодопирона, 0,5% раствор хлорамина. Рабочие растворы указанных препаратов готовит аптека родильного дома. Емкости с растворами устанавливают в смотровых.
3.14. При обеззараживании рук этиловым спиртом, иодопироном или спиртовым раствором хлоргексидина препарат наносят на ладонные поверхности кистей в количестве 5 - 8 мл и втирают его в кожу рук в течение 2 минут.
3.15. Обработку рук раствором хлорамина производят в эмалированном тазу. В таз наливают 3 литра раствора. Руки погружают в препарат и моют в течение 2 минут. Указанный раствор пригоден для 10-ти обработок рук.
3.16. Щетки для обработки рук моют и кипятят в воде или 2% содовом растворе в течение 15 минут. Чистые щетки хранят в стерильных биксах, вынимают по мере надобности стерильным корнцангом.
3.17. Собственные вещи роженицы: пальто, платье, обувь отдают родственникам, в исключительных случаях складывают в два хлопчатобумажных мешка (второй мешок для обуви) и передают в камеру хранения до выписки женщины.
Стул, на котором сидела роженица, кушетку, подушку в клеенчатом или полиэтиленовом чехле протирают раствором дезинфектанта (приложение 2). Растворы для протирания содержат в выделенной емкости.
3.18. Весь медицинский инструментарий после использования обрабатывают чистой ветошью, обильно смоченной одним из рекомендуемых дезинфицирующих растворов (приложение 2).
3.19. Все оборудование и жесткий инвентарь в фильтре и приемных отделениях протирают раствором дезинфектанта (приложение 2). Растворы для протирания содержат в выделенных и маркированных емкостях.
3.20. После мытья роженицы внутреннюю поверхность кабины, приспособления для мыла, мочалки, резиновый коврик тщательно промывают горячей водой из шланга.
3.21. Унитаз перед пользованием покрывают кольцеобразной прокладкой из бумаги или клеенки. Бумажные прокладки после однократного использования уничтожают, клеенчатые промывают, обеззараживают в паровом стерилизаторе в течение 20 минут при давлении 0,5 кгс/см2, а затем используют повторно. Наконечники для клизм обеззараживают (приложение 2).
3.22. Пол протирают 0,5% осветленным раствором хлорной извести. В отсутствие приема помещение облучают бактерицидными лампами в течение 1 - 2 часов с 30 - 40 минутными интервалами и проветривают в течение 30 минут.
3.23. По окончании смены все помещения душевой промывают обильным количеством горячей воды, начиная со стен сверху вниз, затем кабины внутри и снаружи, в последнюю очередь моют пол, смывая воду по направлению к трапам. Резиновые коврики ставят на ребро для подсушивания.
3.24. Уборку помещений приемного отделения производят не реже 2 раз в день влажным способом с применением дезинфицирующих средств (приложение 2).
3.25. Уборочный материал (ведра, тазы и т.д.) маркируют и используют строго по назначению. После использования уборочный материал обеззараживают (приложение 2).
4.1. Родовое отделение должно иметь предродовые палаты, родильные залы, комнаты обработки новорожденных, смотровую санитарную комнату, подсобные помещения для обработки, сушки клеенок, суден и временного хранения грязного белья, уборочного маркированного инвентаря.
4.2. Предродовые палаты оборудуют стационарными или передвижными бактерицидными лампами (БОН-150, ОБП-300).
4.3. Строго соблюдают цикличность заполнения палат.
4.4. Каждой роженице выделяют индивидуальное пронумерованное судно, которое хранят на подставке, вмонтированной в кровать, или на окрашенной масляной краской скамейке.
4.5. После перевода роженицы в родильный зал ее постельное белье (наволочки, простыни) собирают в специально выделенную емкость с крышкой с вложенным в нее клеенчатым или хлопчатобумажным мешком и производят обработку кровати.
4.6. Металлические части кроватей, клеенчатые чехлы на матрацах, подушках обрабатывают растворами дезинфектантов (приложение 2).
4.7. Не менее 3-х раз в сутки осуществляют проветривание палат.
4.8. Судна после использования промывают проточной водой, а после перевода роженицы в родильный зал обеззараживают (приложение 2).
4.9. Подкладные клеенки моют водой и подвергают обеззараживанию (приложение 2).
4.10. Стетоскоп, тазомер, термометры обеззараживают 0,5% раствором хлорамина или 3% раствором перекиси водорода с 0,5% моющего средства.
4.11. Ежедневную уборку палат производят не менее 3 раз в сутки с применением одного из дезинфектантов, указанных в приложении 2.
4.12. Родовые палаты оборудуют стационарными или передвижными бактерицидными облучателями и в период, когда нет приема родов, облучают помещение в течение 1 - 2 часов с 30 - 40 минутными интервалами. Для снижения микробной обсемененности воздуха родильных залов рекомендуется установка воздухоочистителей передвижных рециркуляционных ВОПР-09 и ВОПР-1,5 (приложение 4). Дверь в родовую палату держат постоянно закрытой. Вход в родовую палату персоналу, не участвующему непосредственно в приеме родов, запрещают. Кроме того, родовые залы оборудуют приточно-вытяжной вентиляцией с преобладанием притока воздуха над вытяжкой.
4.13. При наличии двух родильных залов прием родов осуществляют в них поочередно. Каждый родильный зал работает в течение 1 - 2 суток, а затем в нем проводят генеральную уборку.
4.14. При наличии одного родильного зала прием родов проводят поочередно на различных рахмановских кроватях.
2 раза в неделю проводят генеральную уборку родильного зала.
4.15. При переводе в родильный зал роженице одевают стерильную рубашку, косынку, бахилы.
4.16. Акушерка перед приемом родов моет руки, как для хирургической операции, по одному из способов, указанных в настоящей инструкции, п. 11.
4.17. В процессе приема родов используют только стерильный медицинский инструментарий и перевязочный материал.
4.18. Новорожденного принимают в лоток, покрытый стерильной пеленкой.
4.19. Для обработки новорожденного используют только стерильные индивидуальные комплекты.
4.20. Первичную обработку кожи новорожденного проводят стерильным вазелиновым или растительным маслом. Масло готовят во флаконах емкостью не более 30,0 мл (для однократного применения на одного ребенка).
4.21. Пеленальный столик в родовой палате после каждого пеленания новорожденного, а также весы после взвешивания протирают стерильной ветошью, смоченной 1% раствором перекиси водорода. Перед первичным туалетом новорожденного пеленальный столик покрывают стерильной пеленкой.
4.22. Наркозные маски, баллоны для отсоса слизи у новорожденного моют, высушивают, а затем обрабатывают в паровом стерилизаторе при 0,5 кгс/см2 в течение 20 минут. Рожки для кислородных подушек моют мылом и кипятят в течение 15 минут.
4.23. После приема родов лотки для приема новорожденных и последов промывают горячей водой с мылом стерильной ветошью, а затем протирают ветошью, смоченной раствором дезинфектанта, выдерживают 30 минут, моют и складывают, обращая внутренними сторонами друг к другу.
4.24. Последы, плацентарную кровь хранят в специальном холодильнике.
4.25. Резиновые пузыри для льда и грелки после использования промывают горячей водой с мылом, затем протирают раствором одного из препаратов, указанным в приложении 2. Резиновые пузыри со льдом и грелки хранят в специально отведенном месте в эмалированной посуде с плотно закрытой крышкой. Недопустимо хранение льда в туалетной комнате или холодильнике для последов.
4.26. Все белье, использованное в процессе приема родов, собирают в бак с вложенным в него клеенчатым или хлопчатобумажным мешком. Перевязочный материал сбрасывают в таз, завернутый в стерильную пеленку. Таз меняют после каждых родов.
4.27. После приема родов подушки и матрацы, обшитые клеенкой, металлические части рахмановских кроватей протирают стерильной ветошью, обильно смоченной одним из дезинфицирующих растворов. Затем матрацы закатывают, подушки складывают одна на другую, выдерживают экспозицию 30 минут. Через 30 минут матрацы и подушки, обшитые клеенкой, промывают водой.
4.28. Ежедневно помещения родовых палат убирают не менее трех раз с использованием одного из дезинфицирующих средств (приложение 2).
4.29. Каталку для перевозки родильниц после использования протирают ветошью, обильно смоченной раствором (приложение 2).
4.30. При цикличном использовании родовых палат одновременно на цикличную обработку закрывают предродовые палаты.
ФИЗИОЛОГИЧЕСКОГО ОТДЕЛЕНИЯ
5.1. Палаты послеродового отделения заполняют строго циклично в соответствии с палатами детского отделения.
5.2. Каждую родильницу обеспечивают индивидуальным маркированным судном, хранящимся на подставке, вмонтированной в кровать, или специальной скамеечке, окрашенной масляной краской.
5.3. Постельное белье родильниц меняют каждые 3 дня. Подкладные пеленки в первые 3 дня меняют 4 раза в день, в последующие дни - 2 раза в день. Рубашку, полотенце, бюстгальтер родильнице меняют ежедневно. Клеенку перед сменой подкладных пеленок протирают раствором дезинфектанта (приложение 2).
5.4. Грудные железы родильницы обрабатывают до и после каждого кормления ребенка над раковиной в палате. Родильница моет руки мылом, затем моет грудь мылом и насухо вытирает стерильной салфеткой (раздаваемой перед каждым кормлением).
5.5. Родильнице перед кормлением выдают косынку, пеленку для подкладывания под новорожденного во время кормления. В период подъема острых респираторных инфекций родильнице выдают также маску, которую меняют после каждого кормления.
5.6. Для сцеживания молока каждой родильнице выдают стерильную банку (емкость 200 мл), накрытую стерильной салфеткой. Молоко после каждого сцеживания собирает медицинская сестра.
5.7. Туалет родильнице в первые дни проводят в палате, а последующие - в специально выделенной комнате.
5.8. Персонал, обслуживающий родильниц, систематически обеззараживает руки, как указано в п. п. 3.11 - 3.15.
5.9. Очередную смену постельного и нательного белья родильниц производят перед влажной уборкой помещения и не менее чем за час перед кормлением новорожденных.
5.10. Грязное белье собирают в специальный бак с плотно закрывающейся крышкой с вложенным в него хлопчатобумажным или клеенчатым мешком, который подвозят непосредственно к месту сбора грязного белья (кровать родильницы). Чистое белье в отделении хранят в специальном шкафу для чистого белья.
5.11. Ежедневно, не менее трех раз в день, производят влажную уборку послеродовых палат, коридоров и всех подсобных помещений. Один раз в конце смены уборку производят с использованием дезинфицирующих растворов. После уборки палаты проветривают не менее 30 минут и проводят ультрафиолетовое облучение. Ветошь для уборки после использования кипятят или обеззараживают (приложение 2).
5.12. Постельные принадлежности после выписки родильницы сдают в камерную обработку (матрацы, подушки, одеяла).
5.13. При появлении у родильниц или новорожденных первых признаков заболеваний их переводят во второе акушерское (обсервационное) отделение или в специализированное учреждение в соответствии с инструкциями Министерства здравоохранения СССР, утвержденными настоящим приказом. Постельное и нательное белье закладывают в хлопчатобумажный мешок или клеенчатый мешок, сдают в стирку.
5.14. Производят обеззараживание всех предметов, с которыми соприкасался заболевший, а также влажную уборку с применением одного из дезинфицирующих растворов (приложение 2).
5.15. В случае появления в родильном доме гнойно-септических заболеваний среди родильниц или новорожденных прием рожениц в родильный дом прекращается.
Родильный дом закрывают на генеральную уборку.
5.16. Порядок обработки освободившихся от родильниц палат указан в приложении 1.
6.1. Палаты для новорожденных заполняют строго циклически.
6.2. Палаты оснащают настенными и потолочными бактерицидными облучателями, размещая их над входом в палаты.
6.3. Пеленальные столы должны иметь легко обрабатываемую поверхность, которую по окончании пеленания каждого ребенка протирают стерильной ветошью, смоченной 1% раствором перекиси водорода.
6.4. Перед пеленанием детей сестра моет руки мылом, надевает специальный халат, клеенчатый фартук, стерильную маску, обеззараживает руки перед обслуживанием каждого новорожденного (п. 3.11 - 3.15).
6.5. Пеленание и подмывание детей медицинский персонал производит в клеенчатом фартуке, который после пеленания каждого ребенка протирают ветошью, смоченной в растворе одного из дезинфектантов (приложение 2). После туалета всех детей фартук моют и замачивают в 3% растворе перекиси водорода с 0,5% моющего средства или в 1% растворе хлорамина на 30 минут.
6.6. Новорожденных детей подмывают над раковиной проточной водой так, чтобы ножки ребенка (или другие части тела) не соприкасались с поверхностью раковины. В случае отсутствия горячей централизованной воды новорожденных подмывают над тазом, поливая воду из кружки или используя бачок, устанавливая его на высокой тумбочке над раковиной или тазом.
6.7. Перед взвешиванием ребенка на весы подстилают стерильную пеленку. Для пеленания ребенка эту пеленку не используют.
После взвешивания всех детей весы протирают раствором одного из дезинфектантов (приложение 2).
6.8. Грязные пеленки сбрасывают в бак с педальным устройством. Внутрь бака вкладывают клеенчатый или хлопчатобумажный мешок, который вместе с пеленками направляют в стирку.
6.9. В течение всего периода пребывания детей в родильном доме при уходе за новорожденными используют только стерильное белье (пеленки, распашонки, кофточки). Белье хранят в специальном шкафу, перед пеленанием сестра снимает первую упаковку и переносит мешок со стерильным бельем в детскую. Оставшееся в мешке неиспользованное во время пеленания белье передают в стерилизацию.
6.10. Чайные ложки, соски, бутылочки, пипетки, баллончики для клизм моют проточной водой и кипятят 15 минут, после чего сливают воду, не открывая крышки. Хранят до использования в этой же емкости.
Клеенку на каталке для перевозки детей протирают раствором одного из дезинфектантов (приложение 2).
6.11. Ежедневную влажную уборку палат производят не реже 3 - 5 раз с использованием дезинфицирующих растворов. После влажной уборки палаты проветривают и облучают бактерицидными лампами. Уборку и проветривание палат производят во время кормления новорожденных, т.е. в их отсутствие. Генеральную уборку детских палат после выписки новорожденных проводят в соответствии с приложением 1 настоящей инструкции.
6.12. После выписки детей постельные принадлежности подвергают камерной обработке с фиксацией результатов в журнале.
И ХРАНЕНИЯ ГРУДНОГО МОЛОКА
7.1. Каждое послеродовое отделение (физиологическое или обсервационное) должно иметь отдельную комнату для сбора, пастеризации и хранения грудного молока.
7.2. Комната должна быть оборудована:
а) электрической или газовой плитой,
б) двумя столами для чистой и использованной посуды,
в) холодильником,
г) медицинским шкафом,
д) баками или ведрами для сбора и кипячения посуды, молочных бутылочек, молокоотсосов, стеклянных воронок.
7.3. Молочные бутылочки, в которых проводят пастеризацию молока, стеклянные банки для сцеживания моют проточной водой с ершом и кипятят в течение 15 мннут. Прокипяченную и подсушенную посуду хранят в шкафу. Ерши для обработки посуды промывают теплой водой с мылом, кипятят 15 минут, хранят в сухом виде.
7.4. При необходимости использования молокоотсосов их кипятят перед употреблением в течение 15 минут.
7.5. Посуду для сбора грудного молока прикрывают марлевыми салфетками и выдают родильницам перед каждым кормлением и собирают со сцеженным молоком после кормления.
7.6. Собранное грудное молоко разливают через воронку в молочные бутылочки емкостью не более 200,0 мл, закрывают стерильными ватными тампонами и подвергают пастеризации.
Пастеризацию производят следующим образом: бутылочки с молоком кипятят в водяной бане не более 5 - 7 минут. Экспозиция отсчитывается от момента закипания воды.
7.7. Бутылочки с молоком после пастеризации остужают при комнатной температуре и хранят в холодильнике при +4 °C, установленном в комнате для сбора грудного молока.
7.8. Выдачу молока новорожденным производят по требованию детских отделений в индивидуальных разливах. Перед кормлением молоко подогревают на водяной бане.
7.9. Молоко от родильниц с трещинами сосков, маститом, а также больных другими заболеваниями (туберкулез, острые кишечные инфекции и т.д.) сбору на подлежит (уничтожают).
7.10. Персонал комнат для сбора, пастеризации и хранения грудного молока, систематически обеззараживают руки, как указано в п. п. 3.11 - 3.15.
7.11. Влажную уборку помещения комнаты для сбора грудного молока производят 3 раза в смену раздельной ветошью для предметов обстановки и пола, 1 раз в неделю уборку производят с использованием дезинфицирующих средств. Ветошь кипятят в маркированной посуде.
8.1. Обсервационное отделение (приемно-смотровое помещение, родовое отделение, послеродовые палаты, палаты для новорожденных, санитарные узлы и пр.) обеспечивают и оснащают необходимым оборудованием, медицинским инструментарием, бактерицидными лампами, бельем и др., как и физиологическое отделение.
8.2. При переходе из физиологического отделения в обсервационное врач меняет полностью санодежду, обувь. При выходе из обсервационного отделения санодежду, обувь снимают, хранят ее до окончания смены в специально выделенном месте. Санодежду по окончании смены сдают в стирку, обувь протирают 1% раствором хлорамина. Маску меняют после каждого использования.
8.3. Родильница во время пребывания в обсервационном отделении кормит ребенка в стерильной маске. Маску меняют перед каждым кормлением.
8.4. Санитарно-гигиенический режим аналогичен режиму физиологического отделения.
ГРЯЗНОГО БЕЛЬЯ И ОБРАБОТКИ ТРАНСПОРТА
9.1. Чистое белье родильного дома хранят на полках или стеллажах завернутым в простыни небольшими комплектами (по 50 штук).
9.2. Перед разбором, пересчетом и выдачей чистого белья сестра-хозяйка тщательно моет руки и одевает стерильную маску.
9.3. При приеме стиранного белья один из мешков (наружный) снимают, а второй (внутренний) вместе с бельем поступает в помещение для хранения чистого белья. Снятые наружные мешки хранят в помещении для разборки грязного белья в специальном ларе.
9.4. Грязное белье собирают и сортируют в выделенной комнате, стены которой выложены кафелем на высоту 1,5 м; в комнате предусматривают вытяжную вентиляцию.
9.5. Разборку грязного белья производит санитарка в специальной одежде (темный халат, клеенчатый фартук, резиновые перчатки, резиновая обувь). Разобранное белье складывают в два хлопчатобумажных мешка с завязками, вложенными один в другой, и в таком виде перевозят в прачечную. После сдачи и отправки белья в прачечную, комнату моют дезинфицирующим раствором. После чего санитарка принимает гигиенический душ.
9.6. В случае, если нет возможности иметь отдельную прачечную для родильного дома, белье стирают в больничной прачечной, но отдельно от белья других отделений.
9.7. При стирке в коммунальной прачечной белье родильного дома стирают в специально выделенный день. Следят за тем, чтобы технологические процессы обработки чистого и грязного белья не перекрещивались.
9.8. Транспортировку грязного и чистого белья производят на разных специально выделенных для этой цели машинах. В случае отсутствия такой возможности автотранспорт, на котором перевозили грязное белье из родильных домов и отделений, подвергают мойке и обеззараживанию.
9.9. Категорически запрещают перевозить грязное белье и чистое белье на одной машине без ее предварительного обеззараживания.
9.10. Для обработки транспорта должна быть соответствующая тара, щетка, ветошь и дезинфицирующее средство.
9.11. После сдачи белья в прачечную машину обрабатывают раствором хлорной извести (на 1 ведро объемом 10 литров добавляют 50 г сухой хлорной извести). Обработку проводит персонал родильного дома.
9.12. Порядок транспортировки белья и обработки транспорта устанавливается распоряжением местных органов здравоохранения.
Тапочки обрабатывают в дезинфекционной камере по пароформалиновому способу. При невозможности камерной обработки тапочки обрабатывают следующим образом: в носок закладывают бумагу, вату, ветошь, смоченные 10% раствором формалина; обувь помещают в завязывающийся клеенчатый или брезентовый мешок, выдерживают экспозицию 2 часа. Через 2 часа вынимают смоченные формалином вату или ветошь, мягкой щеткой или тампоном, смоченными в 10% растворе аммиака (нашатырного спирта), пропитывают внутреннюю поверхность обуви, накрыв ее на 30 минут тканью. Через 30 минут раскладывают тапочки на воздухе для проветривания (до исчезновения запаха формалина). Хранят обувь в закрытом шкафу.
РУК ВРАЧЕЙ-АКУШЕРОВ, АКУШЕРОК, РЕЗИНОВЫХ ПЕРЧАТОК
В ХОДЕ ОПЕРАЦИИ ИЛИ РОДОВ
11.1. Обязательной является обработка рук всех лиц (акушерок, врачей, операционных сестер и т.д.), участвующих в приеме родов, а также при различных оперативных вмешательствах.
11.2. Для обработки рук используют различные препараты, разрешенные фармакологическим комитетом Министерства здравоохранения СССР: рецептура С-4, хлоргексидин биглюконат (гибитан), церигель, дегмин, дегмицид, диоцид.
11.3. Перед обработкой рук рекомендуемыми кожными антисептиками, руки моют проточной водой щеткой с мылом в течение 1 минуты. После этого руки насухо вытирают стерильной салфеткой.
11.4. Рецептуру С-4 (первомур) готовят из перекиси водорода и муравьиной кислоты, которые смешивают в стеклянной посуде, последнюю помещают в холодную воду на 1 - 1,5 часа и периодически встряхивают. Полученный раствор хранят не более суток в стеклянном сосуде с герметичной пробкой в прохладном месте. Раствор готовят и используют только в день операции.
Для обработки рук используют 2,4% раствор рецептуры С-4 (первомур). Обработку проводят в течение 1 минуты, полностью погружая руки в эмалированный таз с раствором рецептуры С-4. После чего руки вытирают стерильной салфеткой и надевают стерильные перчатки.
КОЛИЧЕСТВО ИНГРЕДИЕНТОВ ДЛЯ ПРИГОТОВЛЕНИЯ
РЕЦЕПТУРЫ С-4 (ПЕРВОМУР)
К-во рабочего раствора (л) | Количество ингредиентов | |||
30 - 33% перекись водорода (мл) | Муравьиная кислота | Вода (л) | ||
100% (мл) | 85% (мл) | |||
1 | 17,1 | 6,9 | 8,1 | до 1 |
2 | 34,2 | 13,8 | 16,2 | до 2 |
5 | 85,6 | 34,5 | 40,5 | до 5 |
10 | 171,0 | 69,0 | 81,0 | до 10 |
11.5. Хлоргексидин биглюконат (гибитан) выпускается в виде 20% водного раствора в стеклянных бутылях емкостью по 500 мл. Для получения раствора препарат разводят в 70% спирте в соотношении 1:40. Для обработки рук используют 0,5% водно-спиртовой раствор препарата. Обработку рук производят ватным тампоном, смоченным 0,5%, спиртовым раствором хлоргексидина в течение 5 минут.
11.6. Церигель - прозрачная, бесцветная несколько вязкая жидкость. В состав препарата введен пленкообразователь, за счет которого при обработке рук образуется тонкая пленка церигеля. Обработку рук проводят путем тщательного растирания 3 - 4 г препарата в течение 8 - 10 секунд. При этом следят за тем, чтобы препарат покрыл ладонные и тыльные поверхности, межпальцевые промежутки и нижнюю треть предплечий. После окончания работы пленку церигеля снимают спиртом.
11.7. Дегмин - твердое воскоподобное вещество, хорошо растворимое в воде. Растворы дегмина слегка опалесцируют и устойчивы при хранении.
Дегмицид - жидкость, содержит 30% дегмина.
Дегмин и дегмицид рекомендованы в 1%, концентрации для обработки рук. Обработку рук проводят путем последовательного протирания двумя тампонами, обильно смоченными раствором препарата, по 3 минуты. При повторной обработке руки протирают одним тампоном 2 - 3 минуты.
11.8. Диоцид - для обработки рук используют в концентрации 1:5000. Обработку рук диоцидом проводят в растворе диоцида в эмалированном тазу с помощью стерильной марлевой салфетки в течение 3 - 5 минут. После такой обработки руки высушивают стерильной салфеткой и затем обрабатывают 96° спиртом в течение 1 - 2 минут.
11.9. После окончания работы руки смазывают обычным смягчающим средством.
11.10. При наличии в родовых залах аппаратов "Ультра-Эйс", предназначенных для обработки рук, рекомендуется мытье согласно приложенной инструкции.
11.11. Для обработки кожи операционного поля и родовых путей рожениц применяют йодонат, хлоргексидин биглюконат (гибитан) или спиртовую настойку йода.
11.12. Рабочие растворы иодоната готовят путем разбавления исходного раствора в 5 раз кипяченой или стерильной водой. Кожу операционного поля и родовые пути (имеются в виду наружные половые органы и внутренняя поверхность бедер) обрабатывают двухкратным смазыванием стерильными тампонами, смоченными 5 - 7 мл раствора иодоната 1% концентрации по свободному йоду.
11.13. Хлоргексидин биглюконат (гибитан) применяют в виде спиртового раствора в 0,5% концентрации. Обработку проводят двухкратным смазыванием стерильными тампонами, смоченными в растворе препарата.
11.14. Спиртовую настойку йода применяют 5 - 7% концентрации. Методика обработки аналогична указанной в предыдущем пункте.
12.1. Предстерилизационную обработку осуществляют ручным или механизированным способом.
12.2. Предстерилизационную обработку ручным способом проводят в следующей последовательности:
а) предварительное ополаскивание под проточной водой, в течение 0,5 минут;
б) замачивание в моющем растворе при полном погружении изделия на 15 минут при температуре 50 °C;
в) мойка в моющем растворе при помощи ерша или ватно-марлевого тампона - 0,5 минуты;
г) ополаскивание проточной, а затем дистиллированной водой - 0,5 минуты; в случае использования моющих средств "Лотос" или "Астра" время ополаскивания равно одной минуте;
д) сушка в суховоздушных стерилизаторах горячим воздухом при температуре 80 - 85 °C до полного исчезновения влаги.
12.3. В качестве моющего средства используют:
а) комплекс перекиси водорода с моющими средствами "Прогресс", "Триас-А", "Лотос" или "Астра";
б) препарат "Биолот".
12.4. Механизированная мойка.
Механизированную обработку инструментов проводят в моечных машинах специального назначения: для игл, шприцев, инструментов по инструкции, приложенной к аппарату.
ОБРАБОТКИ ИНСТРУМЕНТАРИЯ
13.1. Качество мойки хирургических инструментов, шприцев, игл определяют путем постановки бензидиновой, ортотолидиновой или амидопириновой проб.
13.2. Бензидиновая проба.
Существуют две модификации пробы: 1 проба с солянокислым бензидином. Смешивают 0,5 - 1% раствор солянокислого бензидина, приготовленного на дистиллированной воде, с равным количеством 3% раствора перекиси водорода, II проба с сернокислым бензидином. В раствор, состоящий из 5 мл 50% уксусной кислоты и растворенного в ней 0,025 г сернокислого бензидина, добавляют 5 мл 3% переписи водорода.
13.3. Орто-толидиновая проба. Существуют три модификации пробы.
I. Готовят 4% раствор орто-толидина в 96% этиловом спирте. Раствор хранят в холодильнике. Для повседневного употребления из основного спиртового раствора берут небольшое количество (5 - 10 мл) и добавляют к нему равное количество 50% уксусной кислоты и столько же дистиллированной воды. На контролируемый предмет наносят 2 - 3 капли раствора и 1 - 2 капли 20% перекиси водорода.
II. К реактиву, состоящему из 5 мл 50% уксусной кислоты и растворенного в нем 0,25 г орто-толидина, добавляют 5 мл 3% раствора перекиси водорода.
III. Смешивают равные количества 1% водного раствора орто-толидина, приготовленного на дистиллированной воде, и 3% раствора перекиси водорода.
13.4. Амидопириновая проба.
Смешивают равные количества 5% спиртового раствора амидопирина, 30% уксусной кислоты и 3% раствора перекиси водорода (по 2 - 3 мл).
13.5. Методика постановки проб: на контролируемое изделие наносят 2 - 3 капли реактива. При наличии кровяных загрязнений появляется сине-зеленое окрашивание.
13.6. Фенол-фталеиновая проба.
Готовят 1% спиртовой раствор фенол-фталеина. Наносят на вымытое изделие 1 - 2 капли раствора. При наличии остаточных количеств моющего средства появляется розовое окрашивание.
13.7. Изделия, дающие положительную пробу на кровь или на моющее средство, обрабатывают повторно до получения отрицательного результата.
ПЕРЕВЯЗОЧНОГО МАТЕРИАЛА, БЕЛЬЯ
14.1. Стерилизация обеспечивает гибель в стерилизуемом материале вегетативных и споровых форм патогенных и непатогенных микроорганизмов.
14.2. Стерилизацию проводят различными методами: паром, сухим горячим воздухом, растворами химических веществ и газами. Выбор того или иного способа стерилизации зависит от особенностей стерилизуемого объекта.
14.3. В паровых стерилизаторах стерилизуют белье, перевязочный материал, хирургические инструменты, детали приборов и аппаратов, изготовленных из коррозионностойких металлов и сплавов, шприцы с надписью 200 °C, стеклянную посуду, изделия из резины (перчатки, трубки, катетеры, зонды и т.д.).
14.4. Резиновые перчатки перед стерилизацией внутри и снаружи пересыпают тальком для предохранения их от склеивания. Между перчатками прокладывают марлю, каждую пару перчаток завертывают отдельно в марлю и в таком виде помещают в биксы. Хирургическое белье, перевязочный материал, резиновые перчатки, хирургические инструменты стерилизуют в стандартных биксах, рыхло закладывая их для свободного поступления пара.
14.5. В качестве упаковочных материалов используют двойной слой бязевой ткани или однослойные конверты из растительного пергамента ГОСТ 134-160.
14.6. Хирургические и гинекологические инструменты, детали и узлы приборов и аппаратов, в том числе изготовленные из коррозионнонестойких материалов и сплавов, шприцы с надписью 200 °C, режущие инструменты стерилизуют в воздушных стерилизаторах.
В качестве упаковочного материала используют металлические пеналы, упаковку из крафтбумаги, швы конверта заклеивают 10% клеем из поливинилового спирта или 5% крахмальным клеем.
14.7. Хирургические инструменты из коррозионностойких металлов и сплавов, изделия из резины, пластических масс, в том числе с металлическими частями, стерилизуют растворами препаратов.
14.8. Для стерилизации растворами используют эмалированные, стеклянные или пластмассовые емкости с плотно закрывающейся крышкой. Изделия, подлежащие стерилизации, свободно раскладывают в емкости с раствором и расправляют их. При большой длине изделия его укладывают по спирали. При стерилизации изделия полностью погружают в раствор. После окончания стерилизационной выдержки изделия дважды погружают на 5 минут в стерильную воду, каждый раз меняя ее, затем изделия стерильным корнцангом переносят в стерильный бикс, выложенный стерильной простыней.
14.9. Смотровые инструменты обеззараживают кипячением или погружением в растворы. После погружения изделия прополаскивают в проточной воде.
15.1. Используемые для обеззараживания, предстерилизационной обработки и стерилизации химические препараты обладают в различной степени местным и общим токсическим действием. Безопасность их применения для больных и медицинского персонала гарантируется соблюдением следующих мер предосторожности.
15.2. К работе допускаются лица не моложе 18 лет, прошедшие соответствующий инструктаж по обязанностям, технике безопасности, мерам предосторожности и профилактике случайных отравлений, изложенных в данной инструкции. Ответственный за инструктаж главный врач учреждения или специально назначенное административное лицо.
15.3. Медицинский персонал проходит предварительный и периодические (раз в год) медицинские осмотры. Лица с повышенной чувствительностью к применяемым химическим средствам от работы с ними отстраняются.
15.4. Замачивание белья, посуды и других предметов в растворах дезинфицирующих средств, предстерилизационную мойку и стерилизацию изделий медицинского назначения химическими средствами проводят в специальных помещениях, оборудованных приточно-вытяжной вентиляцией.
15.5. Расфасовку, приготовление рабочих растворов формальдегида, перекиси водорода, дезоксона-1, хлорамина и др. проводят в вытяжном шкафу или в крайнем случае в отдельном проветриваемом помещении. Хранить растворы и выдерживать обрабатываемые объекты необходимо в плотно закрывающихся емкостях.
15.6. Необходимо строго соблюдать последовательность и точно выполнять все этапы мойки и обеззараживания, обеспечивающие максимальное удаление с обрабатываемых объектов остатков моющих и дезинфицирующих средств.
15.7. Всю работу с моющими, дезинфицирующими и стерилизующими химическими средствами проводят в резиновых перчатках, герметичных очках (ПО-2, ПО-3) и 4-слойной марлевой маске или в противопылевых или универсальных респираторах.
По окончании работы руки моют и смазывают смягчающим кремом.
16.1. При нарушении режима работы, при несоблюдении мер предосторожности и в аварийных ситуациях у персонала могут возникнуть явления общего и местного отравления.
16.2. Характерным для всех применяемых химических средств дезинфекции и стерилизации является раздражающее действие в отношении кожных покровов, слизистых оболочек глаз и дыхательных путей.
16.3. Первая помощь при попадании на незащищенную кожу состоит в немедленном, обильном обмывании пораженного места чистой водой. При поражении формальдегидом лучше обмывать кожу 5% раствором нашатырного спирта.
16.4. Первая помощь при отравлении через дыхательные пути состоит в немедленном удалении пострадавшего из помещения на свежий воздух или в хорошо проветриваемое помещение. Необходимо прополаскать рот и носоглотку водой.
16.4.1. В случае отравления формальдегидом рекомендуется вдыхание водяных паров с добавлением нескольких капель нашатырного спирта.
16.4.2. Во всех случаях показан прием теплого молока с питьевой содой или боржомом. По показаниям - сердечные, успокаивающие, противокашлевые средства, вдыхание кислорода. В тяжелых случаях - госпитализация.
16.5. При попадании любого препарата в глаза немедленно промыть их струей воды или 2% раствором гидрокарбоната натрия в течение нескольких минут. При поражении глаз закапать раствор альбуцида, при болях 1 - 2% раствор новокаина.
16.6. При попадании в желудок хлорактивных препаратов промыть желудок 2% раствором тиосульфата натрия и дать внутрь 5 - 15 капель нашатырного спирта с водой, молоко, питьевую соду, магнезиальную взвесь (1 - 2 столовые ложки на стакан воды).
При отравлении формальдегидом проводят обычно промывание желудка с добавлением в воду нашатырного спирта или 3% раствором карбоната или ацетата натрия (аммония).
После промывания дают сырые яйца, белковую воду, молоко.
Заместитель Начальника
Главного санитарно-эпидемиологического
управления Минздрава СССР
О.Г.ИМАМАЛИЕВ
Заместитель начальника
Главного управления лечпрофпомощи
детям и матерям Минздрава СССР
В.В.КОЧЕМАСОВА
ОБРАБОТКИ РОДИЛЬНЫХ ЗАЛОВ, ПРЕДРОДОВЫХ, ПОСЛЕРОДОВЫХ
И ДЕТСКИХ ПАЛАТ ПОСЛЕ ВЫПИСКИ РОДИЛЬНИЦ И НОВОРОЖДЕННЫХ
Генеральную уборку родильных залов проводят в соответствии с прилагаемым графиком предродовых палат и детских комнат после выписки родильниц и детей. При уборке используют 6% раствор перекиси водорода с 0,5% моющего средства или 5% раствор хлорамина. Помещение и все оборудование (кровати, прикроватные тумбочки, раковины и т.д.) протирают стерильной ветошью, обильно смоченной дезинфицирующим раствором. Затем помещение закрывают на 1 час, после чего моют водой с помощью стерильной ветоши.
Персонал при этом одевает чистые халаты, обувь, маски.
После окончания уборки включают бактерицидные лампы на 1,5 - 2 часа. Уборочную ветошь стирают, кипятят или автоклавируют (121° - 45 минут). После уборки палат, перед включением бактерицидных ламп вносят прошедшие камерную обработку постельные принадлежности (матрацы, одеяла, подушки). Перед поступлением родильниц в палаты кровати заправляют постельным бельем.
(образец заполнения)
График проведения генеральной уборки родильных залов
Месяцы | род. залы | Числа месяца | ||||||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | ||
январь | N 1 | Р | Р | + | III | III | Р | Р | Р | + | III | Р |
N 2 | III | III | Р | Р | Р | + | III | III | Р | Р | Р | |
февраль | N 1 | |||||||||||
N 2 | ||||||||||||
март | N 1 | |||||||||||
N 2 | ||||||||||||
Обозначения: Р - родильный зал работает,
+ - генеральная уборка,
III - род. зал отдыхает.
N п/п | Наименование объектов | Дезинфицирующий агент | Режимы дезинфекции | Способ обработки | |
концентрация раствора, % | Время дезинфек. выдержки, мин. | ||||
1 | 2 | 3 | 4 | 5 | 6 |
1. | Гинекологические инструменты, применяемые для осмотра | Температура кипения | 30 | В воде | |
2. | Инструменты из металла, изделия из стекла | Температура кипения | 30 | В воде | |
Сухой горячий воздух 120° +/- 4 °C | 45 | Выдерживание в воздушном стерилизаторе | |||
"Тройной раствор" | формалин - 2% фенол - 0,3% двууглекислая сода - 1,5% | 45 | Погружение в раствор | ||
3. | Инструменты и другие изделия из коррозионностойких металлов, полимерных материалов и резин | Хлорамин Б | 0,5 | 30 | Погружение в раствор с последующим промыванием в воде |
Хлорамин Б с 0,5% моющего средства | 0,5 | 15 | |||
Перекись водорода | 3 | 80 | |||
Перекись водорода с 0,5% моющего средства | 3 | 30 | |||
Дезоксон-1 | 0,1 (по надуксусной кислоте) | 15 | |||
Дезоксон-1 с 0,5% моющего средства | 0,05 (по надуксусной кислоте) | 15 | |||
Дихлор-1 | 1 | 30 | |||
Сульфохлорантин | 0,1 | 30 | |||
4. | Шпатели металлические | Температура кипения | 0,2 | 15 | В воде |
5. | Термометры медицинские | Хлорамин Б | 0,5 | 30 | Полное погружение в раствор с последующим промыванием в воде |
Перекись водорода | 3 | 80 | |||
Дезоксон-1 | 0,1 (по надуксусной кислоте) | 15 | |||
"Тройной раствор" | 45 | ||||
6. | Стетоскопы, тазомеры, сантиметровые ленты | Хлорамин Б | 1 | Двукратное протирание | |
Перекись водорода | 3 | ||||
Дезоксон-1 | 0,1 | ||||
7. | Манжетка аппарата для измерения артериального давления | Перекись водорода | 3 | Двукратное протирание | |
8. | Ножницы для стрижки ногтей, бритвенный прибор | Температура кипения | 15 | В воде | |
"Тройной раствор" | 45 | Погружение в раствор с последующим промыванием в воде | |||
9. | Щетки для мытья рук, мочалки, губки из резины, поролона | Температура кипения | 15 | В воде | |
10. | Наконечники для клизм (стеклянные, пластмассовые) | Температура кипения | 15 | В воде | |
Медицинские приборы, аппараты, оборудование с лакокрасочным, гальваническим или полимерным покрытием (в том числе рахмановские кровати, каталки, баллоны с O2 и CO2 весы, пеленальные столы, лотки для приема новорожденных, лотки для последов) | Хлорамин Б | 1 | Двукратное протирание | ||
Хлорамин Б с 0,5% моющего средства | 0,75 | ||||
Перекись водорода с 0,5% моющего средства | 3 | ||||
Дезоксон-1 | 0,1 (по надуксусной кислоте) | ||||
Дезоксон-1 с 0,5% моющего средства | 0,05 (по надуксусной кислоте) | ||||
Сульфохлорантин | 0,2 | ||||
Дихлор-1 | 2 | ||||
Хлордезин | 0,5 | ||||
Подкладные клеенки, фартуки из клеенки и полимерной пленки, пленочные покрытия мебели, чехлы для матрацев и подушек | Хлорамин Б | 1 | Двукратное протирание | ||
Хлорамин Б с 0,5% моющего средства | 0,75 | ||||
Перекись водорода с 0,5% моющего средства | 3 | ||||
Дезоксон-1 | 0,1 (по надуксусной кислоте) | ||||
Сульфохлорантин | 0,2 | ||||
Дихлор-1 | 2 | ||||
Хлордезин | 0,5 | ||||
13. | Кислородные маски, рожки от кислородных подушек | Перекись водорода | 3 | Двукратное протирание | |
Этиловый спирт | 70 | ||||
14. | Баллоны для отсасывания слизи | Водяной насыщенный пар под давлением 110 °C +/- 2° | 20 | Автоклавирование | |
15. | Резиновые грелки, пузыри для льда | Моют и двукратно протирают одним из растворов, указанных в п. 12 | |||
16. | Посуда | Температура кипения | 15 | В воде | |
Хлорамин Б | 0,5 | 30 | Погружение в раствор с последующим промыванием в воде | ||
Хлорамин Б с 0,5% моющего средства | 0,5 | 15 | |||
Перекись водорода с 0,5% моющего средства | 3 | 30 | |||
Дезоксон-1 | 0,05 (по надуксусной кислоте) | 30 | |||
Дезоксон-1 | 0,1 (по надуксусной кислоте) | 15 | |||
Сульфохлорантин | 0,1 | 30 | |||
Дихлор-1 | 1 <...> | 30 | |||
Хлордезин | 0,25 | 30 | |||
17. | Молочные бутылочки, соски, пипетки, мензурки | Температура кипения | 15 | В воде | |
18. | Постельные принадлежности (матрацы, подушка, одеяло) | Обеззараживание в пароформалиновых камерах по паровоздушному и пароформалиновому методам | см. приложение п. 26 | ||
19. | Нательное и постельное белье | Стирка в прачечной с кипячением | |||
20. | Подкладные судна | Хлорамин Б | 1 | 120 | Погружение в раствор после освобождения от содержимого |
Сульфохлорантин | 0,2 | 120 | |||
Дихлор-1 | 2 | 120 | |||
Хлордезин | 1 | 120 | |||
21. | Тазы для использованного перевязочного материала | Хлорамин Б | 1 | Промывают | |
Перекись водорода с 0,5% моющего средства | 3 | ||||
Хлордезин | 1 | ||||
Дихлор-1 | 2 | ||||
Сульфохлорантин | 0,2 | ||||
22. | Помещения, предметы, обстановки | Двукратно протирают одним из растворов, перечисленных в п. 11 | |||
23. | Резиновые коврики | Хлорамин | 5 | Двукратное протирание или орошение | |
Перекись водорода с 0,5% моющего средства | 6 | ||||
24. | Санитарно-техническое оборудование (раковины, ванны и т.д.) | Дихлор-1 "Белка", | 0,5 г на 100 см2 поверхности | 5 | Протирают увлажненной ветошью |
"Санита", "Дезус", | |||||
"Блеск-2", "ПЧД" | |||||
Хлорамин Б | 1 | Двукратное протирание | |||
Перекись водорода с 0,5% моющего средства | 3 | ||||
Сульфохлорантин | 0,2 | ||||
Дихлор-1 | 2,0 | ||||
Хлордезин | 0,5 | ||||
25. | Уборочный материал | Хлорамин | 1 | 60 | Погружают в раствор, затем моют и сушат |
Сульфохлорантин | 0,2 | 60 | |||
Дихлор-1 | 2 | 60 | |||
Хлордезин | 1 | 60 | |||
Примечание: В качестве моющих средств к растворам хлорамина и перекиси водорода добавляют "Астру", "Лотос", "Новость", к растворам дезоксона-1 - "Лотос".
Методы и варианты дезинфекции | Норма загрузки на 1 кв. м полезной площади камеры в кг | Температура по наружному термометру | Расход формалина на 1 кв. м камеры в мл | Экспозиция в мин. | Сроки обработки в мин., не считая загрузки и выгрузки вещей |
Обычный метод | 30 | 47 - 59 | 75 | 45 | 90 |
Щадящий | 24 | 49 - 51 | 150 | 90 | 135 |
Более щадящий | 15 | 40 - 42 | 200 | 180 | 225 |
27. Режим паровоздушной дезинфекции: температура 80 - 90°, норма загрузки 50 кг/на м3 полезной площади камеры, экспозиция 20 минут.
РЕЖИМЫ СТЕРИЛИЗАЦИИ ОТДЕЛЬНЫХ ОБЪЕКТОВ В РОДИЛЬНЫХ ДОМАХ
N п/п | Наименование объектов | Стерилизующий агент | Режим стерилизации | Примечания | ||
температура | экспозиция | |||||
1. | Перевязочные материалы, инструменты, детали приборов и аппаратов (соприкасающихся с раневой поверхностью), изготовленные из коррозионностойких материалов и сплавов, шприцы с надписью 200 °C, стеклянная посуда | Водяной пар под давлением | а) | 132 °C +/- 2 °C р = 2 ати | 20 минут | Стерилизация в стандартных биксах, мягкой упаковке или пергаментной бумаге |
б) | 120 °C + 2 °C р = 1,1 ати | 45 минут | Рекомендован для стерилизации перчаток и изделий из резины | |||
2. | Инструменты, детали и узлы приборов и аппаратов (соприкасающихся с раневой поверхностью), в том числе изготовленные из коррозионнонестойких металлов и сплавов. Шприцы с надписью 200 °C, стеклянная посуда | Горячий воздух | 180 °C | 60 минут | Стерилизация в крафтбумаге, или без упаковки (в открытых емкостях) | |
3. | Инструменты из коррозионностойких металлов и сплавов. Изделия из резины, пластических масс, в том числе с металлическими частями из коррозионностойких металлов и сплавов | 6% раствор перекиси водорода | а) | 18 °C | 6 минут | Погружение с последующим промыванием стерильной водой |
б) | 50 °C | 3 часа | ||||
4. | Изделия из резины и пластических масс, в том числе однократного пользования | Смесь "ОБ" или "ОБЭБМ" (окись этилена с бромистым метилом в соотношении 1:1,5, 1:2,5 по весу соответственно) | а) | 18 °C при расходе 3,0 г/л | 16 часов | Упаковка в полиэтиленовую пленку, пергамент |
б) | 50 °C при расходе 2,0 г/л | 6 часов | Срок сохранения стерильности - 3 года, пергамент - 1 год | |||
ВОЗДУХА В ПОМЕЩЕНИЯХ МАЛОГО ОБЪЕМА
Воздухоочистители передвижные рециркуляционные (ВОПР-0,9 и ВОПР-1,5) предназначены для очистки воздуха от пыли и снижения микробной обсемененности в операционных, перевязочных, палатах и т.д.
Воздухоочистители обеспечивают быструю и высокоэффективную очистку воздуха. Запыленность и бактериальная обсемененность в течение первых 15 минут непрерывной работы снижается в 7 - 10 раз.
Работа воздухоочистителей основана на непрерывной циркуляции воздуха через фильтр из ультратонких волокон. Работают в режиме как полной рециркуляции, так и с забором воздуха из смежных помещений или улицы.
Воздухоочистители используют для очистки воздуха, во время работы они не вызывают неприятных ощущений и не оказывают вредного влияния на окружающих. Надежны и просты в эксплуатации и не требуют квалифицированного обслуживания.
ТЕХНИЧЕСКИЕ ДАННЫЕ
ВОПР-0,9 | ВОПР-1,5 | |
Производительность М з/ч | 900 | 1500 |
Электропитание от сети 220 в, 50 мг | ||
Потребление мощности, вт | не более 300 | |
Габаритные размеры, мм | 1150 x 450 x 1470 | |
Выпуск производится Борисоглебским приборостроительным заводом (Воронежская область).
Утверждена
Приказом Минздрава СССР
от 6 декабря 1979 г. N 1230
ПО БАКТЕРИОЛОГИЧЕСКОМУ КОНТРОЛЮ ЭФФЕКТИВНОСТИ
САНИТАРНО-ГИГИЕНИЧЕСКИХ МЕРОПРИЯТИЙ В АКУШЕРСКИХ СТАЦИОНАРАХ
1.1. Инструкция по бактериологическому контролю эффективности санитарно-гигиенических мероприятий предназначена для санитарно-эпидемиологических, дезинфекционных станций и лечебно-профилактических учреждений.
1.2. Бактериологический контроль проводят в комплексе с проверкой противоэпидемического режима в акушерском стационаре.
1.3. Бактериологический контроль в акушерских стационарах осуществляют санитарно-эпидемиологические и дезинфекционные станции при плановых обследованиях в порядке текущего надзора. Кратность бактериологического контроля не реже 4 раз в год (1 раз в квартал). Бактериологические лаборатории лечебного учреждения контролируют соблюдение противоэпидемического режима не реже 1 раза в месяц.
По эпидемическим показаниям при возникновении заболеваний среди новорожденных и родильниц контроль проводят внепланово.
1.4. Объектами исследования при плановых обследованиях являются:
- воздушная среда;
- различные предметы в акушерском стационаре;
- медицинский инструментарий, перевязочный и шовный материал;
- грудное молоко, жидкости, используемые для питья новорожденных, масла, применяемые для ежедневного туалета новорожденных;
- кожа рук обслуживающего персонала.
--------------------------------
Инструкция разработана Всесоюзным научно-исследовательским институтом дезинфекции и стерилизации Минздрава СССР, институтом хирургии им. А.В. Вишневского АМН СССР и Московским научно-исследовательским институтом эпидемиологии и микробиологии Минздрава РСФСР.
2.1. Исследование микробной обсемененности воздуха.
2.1.1. Бактериологическое исследование воздуха предусматривает:
- определение общего содержания микроорганизмов в 1 м3 воздуха;
- определение содержания вида золотистого стафилококка в 1 м3 воздуха.
2.1.2. Отбор проб воздуха для бактериологического контроля проводят в следующих помещениях:
- родильный зал первого (физиологического) и второго (обсервационного) отделения;
- палаты для новорожденных первого и второго отделений;
- палаты для недоношенных и травмированных детей;
- послеродовые палаты первого и второго отделений;
- операционные, манипуляционные, перевязочные;
- комнаты сбора и стерилизации грудного молока.
2.1.3. Пробы воздуха отбирают аспирационным методом с помощью прибора для бактериологического анализа воздуха, модель 818 (Аппарат Кротова). Скорость протягивания воздуха - 25 л в минуту. Количество пропущенного воздуха - 100 литров для определения общего содержания микроорганизмов (4 минуты) и 250 литров для определения наличия золотистого стафилококка (10 минут). Пересчет выросших колоний производят по формуле:
Кол-во выросших колоний на чашке · 1000
---------------------------------------
Кол-во пропущенного воздуха
Например: на чашке выросло 150 колоний, следовательно, 1 м3 воздуха содержит  колоний.
колоний.
 колоний.
колоний.2.1.4. Для определения общего содержания микроорганизмов в 1 м3 воздуха забор проб проводят на 2% питательный агар. Посевы инкубируют при температуре 37 °C в течение 24 часов, затем посевы оставляют на 24 часа при комнатной температуре, после чего подсчитывают количество выросших колоний и производят пересчет на 1 м3 воздуха. Если на питательном агаре в чашках выросли колонии спорообразующих бактерий или плесневых грибов, их учитывают отдельно с пересчетом на 1 м3 воздуха.
2.1.5. Для определения количества вида золотистого стафилококка забор проб проводят на желточно-солевой агар. Чашки с посевами инкубируют при 37 °C в течение 24 часов и 24 часа при комнатной температуре. Колонии, подозрительные на стафилококк, подлежат дальнейшей идентификации.
2.2. Исследование микробной обсемененности предметов окружающей среды.
2.2.1. Бактериологическое исследование микробной обсемененности предметов окружающей среды предусматривает выявление золотистого стафилококка, кишечной палочки, синегнойной палочки и протея. Забор проб с поверхностей объектов осуществляют методом смыва.
2.2.2. Взятие смывов производят стерильным ватным тампоном на палочках, вставленных в пробирки, или марлевыми салфетками размером 5 x 5 см, простерилизованными в бумажных пакетах или в чашках Петри. Для увлажнения в пробирки с тампонами наливают по 2,0 мл стерильного 0,9% раствора натрия хлорида (СФХ-427), (физиологический раствор), или стерильной водопроводной воды. При использовании марлевых салфеток стерильный раствор натрия хлорида (водопроводную воду) разливают в стерильные пробирки по 2 мл. Салфетку захватывают стерильным пинцетом, увлажняют раствором натрия хлорида из пробирки, после взятия смыва салфетку помещают в ту же пробирку.
2.2.3. При контроле мелких предметов смывы салфеткой забирают с поверхности всего предмета. При контроле предметов с большой поверхностью смывы производят в нескольких местах исследуемого объекта площадью примерно в 100 см2.
2.2.4. Для выделения золотистого стафилококка посев делают непосредственно на чашку Петри с желточно-солевым агаром (схема исследования на стафилококк). Кроме того, в качестве среды накопления используют бульон с 6,5% натрия хлорида, разлитый в пробирки по 5,0 мл, в которые засевают по 0,2 - 0,3 мл смывной жидкости. Засеянные пробирки инкубируют при 37 °C в течение 20 - 24 часов, после чего производят посев на желточно-солевой агар. Дальнейшее изучение их проводят по схеме.
Схема бактериологического исследования на стафилококк.
1. Первый день.
Посев на селективные среды (желточно-солевой, молочно-солевой или молочно-желточно-солевой агар). Засеянные среды выдерживают в термостате при 37 °C в течение 2 суток либо одни сутки в термостате и дополнительно 24 часа на свету при комнатной температуре.
2 - 3. Второй - третий день.
Просмотр чашек, фиксация в журнале характера и массивности роста колоний. На вышеуказанных средах стафидококк растет в виде круглых, блестящих, маслянистых, выпуклых часто пигментированных колоний. На средах, содержащих желток, золотистый стафилококк, выделенный от человека, в 60 - 70% случаев образует радужный венчик вокруг колонии (положительная лецитовителлазная реакция).
Стафилококки животного происхождения дают положительную лецитовителлазную реакцию в 5 - 10% случаев.
С желточно-солевого агара на скошенный агар снимают в первую очередь колонии стафилококков, образующие радужный венчик (положительная лецитовителлазная реакция), изучению подлежат также пигментированные колонии и с отрицательной лецитовителлазной реакцией. При отсутствии на чашках пигментированных колоний и колоний с положительной лецитовителлазной реакцией для исследования снимают беспигментные колонии, похожие по морфологии на стафилококк. При одновременном наличии на чашках колоний стафилококка, отличающихся по пигменту, следует отвивать не менее двух колоний различного вида.
Пробирки с посевами помещают в термостат при 37 °C на 18 - 20 часов.
4. Четвертый день.
После суточной инкубации у выделенных штаммов проверяют морфологию, тинкториальные свойства (окраска по Граму) и наличие плазмокоагулирующей активности. Характер роста культуры на скошенном агаре в ряде случаев дает возможность "предвидеть" принадлежность ее к виду золотистого стафилококка или эпидермального стафилококка. Первые, как правило, дают обильный, равномерный рост по ходу посева.
Окраску по Граму проводят общепринятым методом. Под микроскопом, окрашенные по Граму стафилококки, имеют вид фиолетово-синих кокков, располагающихся гроздьями или небольшими кучками ("кружево").
Плазмокоагулирующую активность проверяют в реакции коагуляции плазмы (РКП).
С учетом положительных результатов РКП и лецитовителлазной активности в 70 - 75% случаев на четвертый день исследования может быть подтверждена принадлежность выделенного штамма к виду золотистого стафилококка и выдан соответствующий ответ.
Если культура обладает только лецитовителлазной активностью, то для окончательного ответа требуется определение 1 - 2 дополнительных признаков, характерных для вида золотистого стафилококка (ДНКазная активность, анаэробная ферментация маннита, фибринолитическая активность, хлопьеобразующий фактор и т.д.).
В этих случаях ответ выдают в зависимости от результатов, полученных при определении названных признаков.
Если культура обладает только плазмокоагулирующей активностью, но является типичной по морфологии и образует пигмент, то может быть выдан ответ о ее принадлежности к виду золотистого стафилококка.
Если культура стафилококка типичная по морфологии, не обладает ни плазмокоагулирующей, ни лецитовителлазной активностью, то для ее идентификации следует использовать тесты, указанные в таблице N 1.
Выделенные культуры золотистого стафилококка подлежат обязательному фаготипированию.
5. Пятый день.
Учет результатов фаготипирования, дополнительных признаков патогенности (ДНКазной активности, фибринолитической и т.д.).
Выдача окончательного ответа.
2.2.5. Для выявления бактерий группы кишечных палочек посев производят на среду обогащения, для чего тампон (марлевую салфетку) погружают в 20% желчный бульон. Через сутки инкубирования при 37 °C делают пересев на среду Эндо. Подозрительные колонии на среде Эндо микроскопируют и пересевают на 2-ю бродильную пробу - среду Гисса с глюкозой. Среду выдерживают 24 часа при 43 °C.
Таблица 1
тесты | Плазмокоагулаза | Фосфотаза | Аэробная ферментация маннита | Отношение к новобиоцину | |
Вид стафилококка | |||||
Золотистый стафилококк | + | + | + | чувствителен | |
Эпидермальный стафилококк | - | + | - | чувствителен | |
Сапрофитный стафилококк | - | - | + | устойчив <*> | |
--------------------------------
Примечание: При использовании свиной желчи для приготовления желчного бульона концентрация желчи должна быть в 20 раз меньше.
2.2.6. Для выделения синегнойной палочки можно использовать среду Эндо, кровяной агар, агар с бриллиантовым зеленым. На поверхности питательного агара синегнойная палочка образует крупные, круглые колонии, диаметром 1 - 3 мм, с ровным или слегка волнистым краем, гладкой, блестящей поверхностью, часто с сине-зеленым пигментом и характерным запахом.
Наличие пигмента (пиоцианина) и запаха являются характерными, но не обязательными признаками для синегнойной палочки. На кровяном агаре колонии синегнойной палочки могут давать зону гемолиза.
Колонии подозрительные на синегнойную палочку пересевают на скошенный агар с глицерином (не менее 2-х колоний). При наличии на глицериновом агаре роста пигментообразующих колоний (среда окрашивается в сине-зеленый цвет с характерным запахом), может быть выдан ответ о выделении синегнойной палочки.
Синегнойная палочка грамотрицательна, при микроскопии располагается короткими цепочками или параллельно, или в виде отдельных клеток. На средах Гисса ферментирует только глюкозу с образованием кислоты без газа, не разлагает лактозу, разлагает мочевину, разжижает желатину, дает положительную пробу с хлороформом, выявляющую наличие пигмента.
Методика реакции заключается в следующем: в питательный бульон засевают суточную культуру синегнойной палочки и инкубируют при 37 °C в течение 18 - 20 часов, а затем оставляют на сутки при комнатной температуре. Бульонную культуру подщелачивают содой (5 - 6 капель 20% раствора) и добавляют 2,0 - 3,0 мл химически чистого хлороформа. Пробирку тщательно встряхивают в течение 1 - 2 минут. При наличии пиоционина хлороформ окрашивается в синий цвет.
2.2.7. Для выделения протея используют обычные питательные среды, на поверхности которых протей образует серые, неправильной формы расплывающиеся колонии, способные к быстрому распространению. При микроскопировании грамотрицательные палочки расположены поодиночке, парами, часто длинными цепочками, резко подвижны. Основными признаками протея являются: быстрое разжижение желатины, расщепление мочевины и быстрый ползущий рост на косом агаре. Для обнаружения последнего свойства в пробирку со свежескошенным агаром вносят петлю культуры и растирают ее на дне в конденсате, не касаясь агара. Протей ползет по поверхности среды и очень быстро покрывает всю ее поверхность даже при комнатной температуре.
2.3. Ориентировочный перечень объектов, подлежащих бактериологическому контролю:
2.3.1. Приемное отделение.
1. Клеенка на кушетке.
2. Руки акушерки.
3. Мочалки чистые.
4. Бритвы.
2.3.2. Родильный зал.
1. Польстер.
2. Рахмановская кровать.
3. Лоток, подготовленный к приему новорожденного.
4. Баллончик для отсоса слизи у новорожденных.
5. Шланг вакуумэкстрактора.
6. Руки акушерки.
7. Таз для мытья рук.
8. Щетки для мытья рук.
9. Фартук акушерки.
10. Глазные капли (на стерильность).
11. Набор первичной и вторичной обработки новорожденного (на стерильность).
2.3.3. Комната для вторичной обработки новорожденных.
1. Весы.
2. Клеенка детского пеленального столика.
3. Детская кровать.
4. Аппарат искусственной вентиляции легких.
5. Насадка и шланг кислородной подводки.
2.3.4. Палаты новорожденных.
1. Пеленальный стол.
2. Весы.
3. Детская кровать.
4. Медицинский стол.
5. Глазные пипетки (на стерильность).
6. Кран раковины для подмывания детей.
7. Соски (чистые) (на стерильность).
8. Кювез (внутренняя поверхность).
9. Градусники.
10. Руки детской сестры.
11. Фартук детской сестры.
12. Зонды и баллоны для отсоса слизи.
13. Раствор глюкозы для питания детей.
14. Масла для туалета новорожденных.
15. Детское белье (на стерильность).
2.3.5. Послеродовая палата.
1. Клеенка или пеленка, используемая родильницей при кормлении новорожденного.
2. Комплект чистого постельного и нательного белья.
3. Емкость, подготовленная для сцеживания грудного молока.
4. Грудные железы и руки родильницы перед кормлением новорожденного.
2.3.6. Комната для сбора, пастеризации и хранения грудного молока.
1. Грудное пастеризованное молоко.
2. Рабочий стол.
3. Руки медицинской сестры.
4. Емкости для сцеживания грудного молока.
5. Молокоотсосы.
6. Внутренняя поверхность холодильника для хранения грудного молока.
7. Ватные тампоны, марлевые салфетки, приготовленные для укупорки бутылочек для грудного молока.
2.3.7. Аптека.
1. Различные лекарственные формы.
Кроме вышеперечисленного ориентировочного перечня предметов, подлежащих бактериологическому контролю, целесообразно проводить исследование (выборочно) посуды пищеблока и буфетов-раздаточных отделений.
2.4. Исследование грудного молока, раствора глюкозы для питания новорожденных.
2.4.1. Исследование грудного молока, подвергнутого пастеризации, и раствора глюкозы для питания новорожденных проводят с целью установления общей бактериальной обсемененности, титра кишечной палочки и определения золотистого стафилококка.
2.4.2. Для исследования берут пробы грудного молока и растворов для питания новорожденных как из комнаты для сбора, пастеризации и хранения грудного молока, так и непосредственно из детских палат.
2.4.3. Для определения титра бактерий группы кишечных палочек в грудном молоке и растворе глюкозы последние засевают на среду Кесслера в следующих объемах: 0,1 мл, 1,0 мл и 10,0 мл из разведений 1:10 и 1:100.
Дальнейшее исследование проводят в соответствии с действующим ГОСТом 9225-68 "Молоко и молочные продукты. Методы микробиологического исследования".
2.4.4. Для определения общего количества бактерий в растворе глюкозы засевают параллельно две чашки Петри по 1,0 мл, при исследовании грудного молока засевают по 1,0 мл из разведений 1:10 также на две чашки. Посев производят глубинным методом по Коху. После инкубации посевов при 37 °C в течение 24 часов производят подсчет выросших колоний.
2.4.5. Исследование масла проводят на наличие золотистого стафилококка и кишечной палочки, для этого производят посевы по 0,3 - 0,5 мл в пробирки с питательным бульоном и средой Кесслера по схеме исследования на стафилококк.
3.1. При обследовании родильных домов по эпидемическим показаниям проводят отбор проб для бактериологического исследования совместно с эпидемиологом.
3.2. При обследовании по эпидемическим показаниям смывы с объектов и предметов проводят как с чистых, так и с объектов и предметов, бывших в употреблении.
3.3. Учитывая, что внутрибольничные инфекции в акушерских стационарах могут быть вызваны различными микроорганизмами, при обследовании по эпидемическим показаниям круг микробиологических анализов расширяют и в зависимости от конкретного случая исследования проводят не только на вышеприведенные микроорганизмы, но и на стрептококк, пневмококк, серрации, палочку инфлюэнце, провиденции, цереус и др.
3.4. Бактериологические лаборатории санитарно-эпидемиологических или дезинфекционных станций исследуют: воздух, предметы внешней среды, руки обслуживающего персонала, грудное молоко, жидкости для питания новорожденных, лекарственные формы и слизь из верхних дыхательных путей.
3.5. Для выделения стрептококков используют среду Гарро или кровяной агар, при росте стрептококки образуют мелкие (1 - 2 мм в диаметре) полупрозрачные колонии. По характеру гемолиза стрептококки делят на 4 типа:
- гемолитический стрептококк типа 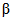 имеет вид мелких колоний (до 1 мм) с большой плотной зоной гемолиза. Зона гемолиза может быть в 3 - 4 раза больше самой колонии; при окраске по Граму - длинные цепи;
имеет вид мелких колоний (до 1 мм) с большой плотной зоной гемолиза. Зона гемолиза может быть в 3 - 4 раза больше самой колонии; при окраске по Граму - длинные цепи;
- гемолитический стрептококк типа  растет в виде таких же мелких колоний, но вокруг них имеется зона позеленения среды, обычно раза в два превышающая величину колонии; при окраске по Граму - короткие цепи;
растет в виде таких же мелких колоний, но вокруг них имеется зона позеленения среды, обычно раза в два превышающая величину колонии; при окраске по Граму - короткие цепи;
- гемолитический стрептококк типа  образует менее выраженную и мутноватую зону гемолиза по сравнению с колониями стрептококка типа
образует менее выраженную и мутноватую зону гемолиза по сравнению с колониями стрептококка типа  при окраске по Граму могут быть короткие по 6 - 8 кокков и длинные цепи;
при окраске по Граму могут быть короткие по 6 - 8 кокков и длинные цепи;
- негемолитический стрептококк типа  растет такими же мелкими колониями, однако без следов гемолиза, при окраске по Граму могут быть иногда очень длинные цепи.
растет такими же мелкими колониями, однако без следов гемолиза, при окраске по Граму могут быть иногда очень длинные цепи.
Колонии, подозрительные на стрептококк, высевают в 1% сахарный бульон. В жидких питательных средах стрептококки дают придонный рост, часто поднимающийся по стенке, при прозрачном бульоне. Принадлежность штамма к стрептококку основывают на характере колоний, гемолиза, характере роста в бульоне, окраске по Граму и морфологии.
Для заключения о выделении стрептококков наибольшее значение имеет его дифференциация от энтерококков и пневмококков.
Стрептококки в отличие от энтерококков не растут на бульоне с 40% желчью, не редуцируют 0,1% метиленовую синь в молоке. Для энтерококков характерен мутящий рост в бульоне, при окраске положительные по Граму полиморфные кокки, располагающиеся кучками, короткими цепочками или попарно.
3.6. Идентификацию пневмококков проводят по следующим показателям: на кровяном агаре пневмококки образуют мелкие колонии буроватого цвета с зоной позеленения вокруг, с ровным краем и гладкой поверхностью. При окраске по Граму имеют вид парных кокков несколько удлиненной формы с заостренными наружными концами. Иногда встречаются диплококки, состоящие из двух правильно овальных или даже округлых кокков. Пневмококки легко лизируются желчью в отличие от стрептококков. Постановка реакции: 2,0 - 3,0 мл 18 - 20 часовой культуры засевают в 10% желчный бульон. При этом бульон сразу мутнеет. Инкубируют при 37 °C в течение 24 часов. Если через сутки бульон просветляется, то, следовательно, наступил лизис и культуру относят к пневмококкам.
3.7. Идентификация палочки Фридлендера (Клебсиелла).
Клебсиеллы - короткие палочки, иногда толстые, с закругленными концами, преимущественно располагаются поодиночке. Неподвижны, имеют капсулу, грамотрицательны. Ферментируют 1 ряд углеводов с образованием кислоты и газа (глюкоза, лактоза, сахароза), разлагают мочевину, хорошо растут на обычных питательных средах. На поверхности питательного агара образуют белые, блестящие, гладкие колонии правильной формы; дают помутнение бульона, образуя толстые нити или кольцо. Встречаются преимущественно в дыхательном тракте человека.
3.8. Провиденция относится к семейству кишечных бактерий; грамотрицательная, подвижная палочка, растет на обычных питательных средах, быстро ферментирует глюкозу с образованием кислоты и газа, однако 15% культур газ не образуют. Желатину не разжижает, редуцирует нитраты. Встречаются культуры, медленно ферментирующие маннит (обычно через несколько дней).
Встречаются в испражнениях и при заболеваниях мочевых путей и часто ошибочно принимаются за шигеллы. Схема исследования на грамотрицательную группу бактерий приведена в приложении 2.
3.9. Serratia marcescens мелкие грамотрицательные палочковидные бактерии, расположены поодиночке, иногда цепочками. Подвижны, перитрихи с 4 жгутиками. При посеве на поверхность агара образуют круглые, мелкие, зернистые, серые, затем красные колонии, при росте на косом агаре дают белый, гладкий, влажный налет, приобретающий через 3 - 4 дня оранжево-красный оттенок или цвет фуксина с металлическим блеском, рост в бульоне мутный по периферии, может быть красное кольцо или тонкая пленка и серый осадок. В глубине посева колонии бесцветны. Хорошо растет на всех обычных средах и на органических субстратах. Энергично разжижает желатину, молоко свертывает, не цептонизирует его.
3.10. Бактерия инфлюэнцы - мелкие неподвижные грамотрицательные палочки, на концах содержат хорошо окрашивающиеся зерна; иногда клетки сильно удлиненные, слегка искривленные, в некоторых случаях покрыты небольшой слизистой капсулой. Растет только на кровяных или других средах из животных тканей (плацентарные среды, асцитическая жидкость). При посеве на кровяную среду образуют бесцветные, прозрачные, тонкие, плоские, гладкие колонии. Факультативный аэроб, оптимум температуры 37 °C. Выделяется при инфекциях дыхательных путей.
3.11. При исследовании на B. cereus (строго по эпидемическим показаниям) исследуемый материал перед посевом прогревают в течение 20 минут при 65 °C, затем по 0,1 и 1,0 мл засевают на обычные питательные среды. Инкубация посевов при температуре 30 °C - 48 часов. Растет культура в виде беловатых круглых или шероховатых плоских колоний неправильной формы с отростками. При микроскопировании - палочки с обрубленными и закругленными концами, соединенные в цепочки. Споры элипсовидной формы, на скошенном агаре обильный рост, в бульоне сильная равномерная муть с мягкой легко опадающей пленкой. B. cereus на кровяном агаре образует отчетливую зону гемолиза, обладает резко выраженной лецитиназной активностью, пептонизирует молоко, редуцирует крахмал, разжижает желатину, нитраты редуцирует в нитриты.
в лечебно-профилактических учреждениях
4.1. Забор проб на стерильность проводит операционная сестра под руководством сотрудника бектериологической лаборатории в стерильные емкости с соблюдением строжайших правил асептики непосредственно перед проведением операции.
4.2. Для контроля стерильности используют следующие питательные среды:
- сахарный бульон Хоттингера (0,5 и 1% глюкозы);
- тиогликолевую среду;
- бульон Сабуро.
Одновременный посев изделий на 3 вышеуказанные среды обязателен. При посеве изделия или его части непосредственно в питательную среду количество среды в пробирке (колбе, флаконе и т.д.) должно быть достаточным для полного погружения изделия или его части.
4.3. Посевы в бульон Хоттингера и тиогликолевую среду выдерживают в термостате при температуре 32 °C, среду Сабуро - при температуре 20 - 22 °C. Посевы инкубируют в термостате в течение 8 суток.
4.4. Описание состава, способа приготовления и правила контроля стерильности питательных сред изложены в приложении 3.
условия при посевах
5.1. Требования к помещению для посева на стерильность.
5.1.1. Посев исследуемого материала желательно проводить в настольных боксах с ламинарным потоком воздуха. Эти боксы размещают в отдельных помещениях бактериологической лаборатории.
При отсутствии боксов с ламинарным потоком воздуха контроль стерильности проводят в боксированных помещениях (бокс с предбоксником). Общая площадь бокса должна быть не менее 3 м2.
5.1.2. В боксированном помещении стены должны быть окрашены масляной краской или выложены кафельной плиткой, не должны иметь выступов, карнизов, трещин; пол в боксе и рабочий стол должны быть покрыты линолеумом, стенки и ножки стола покрашены масляной краской.
5.1.3. Боксы оборудуют приточно-вытяжной вентиляцией (с преобладанием притока над вытяжкой); в них подается стерильный воздух, проходящий через бактериальные фильтры с материалом Петрянова.
5.1.4. В боксе и предбокснике устанавливают настольные (БОН) и потолочные (ОБП) ультрафиолетовые облучатели из расчета 2 вт удельной мощности ламп, создающих прямое излучение на 1 м2 помещения. Облучатели размещают на высоте 2 - 2,5 м от пола.
5.1.5. Для тушения пожара в боксированном помещении должны быть в наличии противопожарные средства, углекислотные огнетушители типа ОУ-2 из расчета один огнетушитель на предбоксник и бокс.
5.2. Подготовка бокса, инструментов и персонала к работе.
5.2.1. Ежедневно до проведения работы помещения бокса и предбоксника подвергают тщательной обработке. Стены, пол, поверхности инвентаря протирают раствором, содержащим 3% перекиси водорода и 0,5% моющего средства (Триас-А, Прогресс, Астра, Лотос). В случае обнаружения в воздухе грибов или споровых форм микроорганизмов влажную уборку проводят 6% раствором перекиси водорода с 0,5% вышеперечисленных моющих средств.
Внутреннюю поверхность настольного бокса обрабатывают так же, как и помещение бокса. Через 45 - 60 минут после обработки в бокс вносят все необходимое для работы: материалы и инструменты, кроме образцов продукции.
5.2.2. Перед внесением материалов в настольном боксе включают вентиляцию на время, достаточное для обеспечения полного обмена воздуха в нем.
5.2.3. За 1,5 - 2 часа до начала работы в боксе и предбокснике на 1,5 - 1 час включают бактерицидные лампы.
5.2.4. Инструменты, посуду, спецодежду, используемые в работе, предварительно стерилизуют, а тканевые изделия обрабатывают при следующем режиме: температура 132 °C +/- 2 °C, время стерилизационной выдержки 20 минут; изделия из резины (перчатки и т.д.) - при температуре 120 °C + 2 °C в течение 45 минут.
В процессе работы вспомогательный инструмент 2 - 3 раза заменяют новым стерильным комплектом.
5.2.5. Перед входом в бокс работники лаборатории тщательно моют руки теплой водой с мылом и щеткой, вытирают стерильным полотенцем, одевают в предбокснике на ноги бахилы, стерильные халаты, 4-слойные маски, шапочки, стерильные перчатки.
В процессе посева в боксе регулярно проверяют обсемененность воздуха. Для этого на рабочий стол ставят 2 чашки с мясо-пептонным агаром (МПА), открывая их на 15 минут, затем чашки помещают в термостат при температуре 37 °C на 48 часов. Допускается рост не более трех колоний неспорообразующих сапрофитов.
В случае роста на чашках более 3 колоний проведение дальнейших работ в данном боксе запрещается. В боксе дополнительно проводят тщательную уборку и обработку 6% раствором перекиси водорода с 0,5% моющего средства.
ИС МЕГАНОРМ: примечание. Нумерация пунктов дана в соответствии с официальным текстом документа. |
5.2.7. Контроль стерильности изделий путем погружения в питательные среды. В исключительных случаях, когда необходимо проверить стерильность инструмента больших размеров, пробы забирают методом смыва стерильной марлевой салфеткой размером 5 x 5 см2, предварительно увлажненной стерильным физиологическим раствором или стерильной водопроводной водой.
5.2.8. Перед посевом исследуемый материал вносят в предбоксник, предварительно снимая наружную мягкую упаковку. В предбокснике пакеты, биксы протирают снаружи с помощью стерильного пинцета (корнцанга) стерильной салфеткой (ватным тампоном), обильно смоченной 6% раствором перекиси водорода, перекладывают на стерильный лоток и оставляют на 30 минут. При поступлении изделий в мягкой упаковке первый слой снимают в предбокснике, и изделия во внутренней упаковке сразу переносят в бокс.
5.2.9. Посевы на стерильность проводит бактериолог с помощью лаборанта.
6.1. Хирургический инструментарий с помощью стерильного пинцета извлекают из биксы или мягкой упаковки и целиком погружают в пробирки с питательными средами. Как исключение, в отдельных случаях, если все простерилизованные инструменты в одной упаковке крупных размеров (иглодержатели, ранорасширители и т.д.), производят смыв с поверхности инструмента стерильной салфеткой, смоченной в стерильном физиологическом растворе или стерильной водопроводной воде, и погружают салфетку в пробирку с тиогликолевой средой. Аналогичные смывы с других инструментов засевают в пробирки со средой Хоттингера и Сабуро.
6.2. Методика посева на стерильность игл и шприцев.
Для контроля на стерильность отбирают шприцы малой емкости (1,0 мл или 2,0 мл) в условиях бактериологического бокса, с соблюдением правил асептики погружают в пробирки с питательными средами отдельно цилиндр, поршень, иглы.
При необходимости контроля шприцев большой емкости (10, 20 мл и более) исследование стерильности производят методом смыва, при этом стерильной салфеткой, смоченной в стерильном физиологическом растворе или водопроводной воде, протирают с помощью пинцета внутренние части шприца и погружают салфетку в питательную среду.
6.3. Исследование на стерильность систем переливания крови многоразового использования.
От резинового шланга, ближе к игле, отрезают ножницами с помощью пинцета небольшие кусочки (1 - 2 см) и погружают в пробирки с питательными средами, иглу отдельно погружают в питательные среды.
6.4. Посев на стерильность катетеров, резиновых перчаток и других изделий из резины и пластикатов.
Контроль стерильности зондов, катетеров, резиновых перчаток и других изделий из резины производят путем полного погружения мелких изделий в питательные среды, от более крупных с помощью стерильного пинцета стерильными ножницами отрезают небольшие кусочки (1 - 2 см) и погружают в питательные среды.
6.5. Посев на стерильность хирургического шовного материала.
Перед посевом емкость с отобранными образцами шовного материала в предбокснике протирают стерильной марлевой салфеткой, обильно смоченной 6% раствором перекиси водорода, и оставляют на 30 минут. Затем вносят в бокс.
6.5.1. Кетгут. Подготовленный к работе кетгут в операционном блоке хранят в спиртовом растворе йода. Кетгут перед посевом подвергают специальной обработке для нейтрализации и отмывания нейтрализующего раствора. Моток кетгута, приготовленный для исследования, перекладывают стерильным корнцангом или пинцетом в стерильный 10% раствор гипосульфита натрия. Раствор гипосульфита натрия готовят на дистиллированной воде, разливают в пробирки (колбы) по 20 - 30 мл, стерилизуют текучим паром по 30 минут в продолжении 3 дней. Кетгут выдерживают в растворе гипосульфита в течение 24 часов при комнатной температуре (возможно помутнение раствора за счет выпадения серы), затем перекладывают в пробирки с 20 - 30 мл стерильной дистиллированной воды, где также выдерживают в течение 24 часов при комнатной температуре. Непосредственно перед посевом моток кетгута извлекают стерильным пинцетом и перекладывают в стерильную чашку Петри, с помощью пинцета и ножниц его разрезают на мелкие кусочки длиной 1 - 2 см и раздергивают для прорастания микроорганизмов кетгута.
Посев производят в 2 пробирки с тиогликолевой средой, 2 пробирки со средой Сабуро и 2 пробирки со средой Хоттингера, помещая в каждую пробирку по 4 - 5 кусочков исследуемого материала.
6.5.2. Шелк. Подготовленный к работе шелк в операционных хранят в спиртовом растворе, поэтому перед посевом шелк (лавсан) помещают на 24 часа - в стерильную дистиллированную воду при комнатной температуре. Перед посевом моток шелка (лавсана) перекладывают в стерильные чашки Петри, разрезают на мелкие кусочки длиной 1 - 2 см. Посев шелка производят так же, как и кетгута.
6.6. Исследование на стерильность аппаратов экстракорпорального кровообращения.
Исследование на стерильность аппарата искусственного кровообращения проводит бактериолог и лаборант лечебно-профилактического учреждения в операционной после асептической сборки аппарата.
Контролю подлежат:
- смыв из аппарата;
- перфузат до перфузии;
- кровь после перфузии.
Стерильный физиологический раствор в количестве не менее 250 мл прогоняют через аппарат, подготовленный к операции, отбирают 100 мл раствора и засевают на питательные среды. Аналогично производят посев перфузата до перфузии и крови после перфузии.
6.7. Посев на стерильность перевязочного материала.
Бинты, ватные шарики, марлевые салфетки, турунды и т.п. отбирают из разных мест биксы стерильным пинцетом. Мелкие изделия целиком погружают в пробирки с питательными средами. От бинтов (внутренних частей) и крупных марлевых салфеток с помощью стерильных ножниц отрезают кусочки и погружают в пробирки с питательными средами. На каждый вид перевязочного материала используют по 2 пробирки каждой среды.
6.8. Посев на стерильность хирургического белья.
Простерилизованными и фламбированными ножницами (смоченными в спирте и проведенными через пламя горелки) с помощью пинцета от хирургического белья отрезают небольшие кусочки ткани (завязка, внутренние швы, и т.п.) и погружают в пробирки (колбы) с питательными средами, по возможности, не касаясь стенок пробирки (колбы).
Материал стерилен при отсутствии роста во всех посевах.
Материал не стерилен при росте микрофлоры.
кожи операционного поля и рук хирургов
Смывы с кожи операционного поля и рук хирургов производят стерильными марлевыми салфетками размером 5 x 5 см2, смоченными в растворе нейтрализатора, если таковой имеется, или в физиологическом растворе. Марлевой салфеткой тщательно протирают ладони, околоногтевые и межпальцевые пространства обеих рук. После забора проб марлевую салфетку помещают в широкогорлые пробирки или колбы с раствором нейтрализатора (воды или физиологического раствора) и стеклянными бусами, встряхивают в течение 10 минут, производят отмыв марлевой салфетки. Отмывную жидкость засевают глубинным способом по 0,5 мл на 2 чашки Петри с мясо-пептонным агаром, а марлевую салфетку - в 0,5% сахарный бульон. Посевы инкубируют при температуре 37 °C в течение 48 часов.
Кожа и руки стерильны при отсутствии роста микроорганизмов как на твердой, так и на жидкой питательных средах.
КРИТЕРИИ ОЦЕНКИ МИКРОБНОЙ ОБСЕМЕНЕННОСТИ
ВОЗДУХА В РОДИЛЬНЫХ ДОМАХ
Место забора проб | Условия работы | Общее количество колоний в 1 м3 воздуха | Количество золотистого стафилококка в 1 м3 воздуха |
Операционные, родильные залы первого и второго отделений | до начала работы | не выше 500 | не должно быть |
во время работы | не выше 1000 | не более 10 | |
Палаты для недоношенных и травмированных детей | в подготовленных к приему детей | не выше 750 | не должно быть |
ИССЛЕДОВАНИЯ НА ГРАМОТРИЦАТЕЛЬНЫЕ БАКТЕРИИ
Первый день. Посев на элективные среды - среду Эндо и ацетамидный агар. Посевы выдерживают в термостате при 37 °C в течение суток; чашку с ацетамидным агаром при отсутствии роста или слабом росте выдерживают в термостате в течение 2 - 3 суток.
Второй - третий день. Просмотр чашек, фиксация в журнале характера и интенсивности роста.
На среде Эндо грамотрицательные энтеробактерии растут в виде гладких колоний, окрашенных или неокрашенных в красный цвет (в зависимости от их способности ферментировать лактозу). Синегнойная палочка на среде Эндо и на агаре с бриллиантовым зеленым растет в виде колоний в S-форме, обладающих типичным запахом триметиламида и образующих сине-зеленый пигмент.
Необходимо отметить, что и запах, и пигментообразование могут сильно варьировать, а в ряде случаев вообще отсутствовать. На ацетамидном агаре, который является элективной средой для синегнойной палочки, последние растут в виде мелких слегка зеленоватых колоний в S-форме, обладающих запахом аммиака.
Изучение морфологии и тинкториальных свойств бактерий при исследовании мазков, окрашенных по Граму.
При наличии на чашках роста смешанной микрофлоры отсевают на скошенный агар для дальнейшего исследования не менее двух колоний различных видов грамотрицательных бактерий с последующей инкубацией посевов в термостате при 37 °C в течение 18 - 20 часов.
При наличии на чашках роста однородной микрофлоры непосредственно с чашек с элективными средами проводят идентификацию выделенных бактерий.
Четвертый - пятый день. Отобранные для идентификации штаммы бактерий засевают на ряд дифференциально-диагностических сред, позволяющих изучить основные биохимические свойства (семейство, триба, род, вид) бактерий, относящихся к семейству Энтеробактерий (кишечная палочка, Клебсиелла, Провиденциа и др.) и роду Псевдомонас (синегнойная палочка) (таблица 1). Выдача ответа.
ИС МЕГАНОРМ: примечание. Нумерация пунктов дана в соответствии с официальным текстом документа. |
2.2.6. Идентификация грамотрицательных бактерий семейства Энтеробактерий и рода Псевдомонас.
Одним из существенных свойств кишечной палочки является способность ферментировать лактозу с образованием кислоты и газа, хотя это их свойство может быть выражено в различной степени. Кишечная палочка не обладает протеолитическими свойствами, не выделяет сероводород, не утилизирует в качестве источников питания цитрат и малонат натрия и не обладает ферментом фенилаланиндезаминазой. Очень близкие по свойствам к кишечной палочке Citrobacter. Эти бактерии также активно ферментируют лактозу, но в отличие от кишечной палочки обладают способностью использовать в качестве источников углеводов цитрат натрия. Способность к росту на среде Симонса является отличительной особенностью Citrobacter. Эти бактерии не разжижают желатину и не обладают фенилаланиндезаминазой, остальные биохимические тесты могут быть выражены и не выражены. Клебсиелла - это грамотрицательные капсульные неподвижные бактерии. Эти микробы обладают определенной биохимической активностью, но они не разжижают желатину, не выделяют сероводород и фенилаланиндезаминазу. При идентификации клебсиелл обычно в дополнение к изучению биохимических свойств изучают наличие у этих бактерий капсул, для чего применяют окраску по Гинс-Бурри. Протей - подвижные грамотрицательные бактерии, не ферментирующие лактозу и не утилизирующие малонат натрия, но постоянно гидролизирующие мочевину и утилизирующие в подавляющем большинстве случаев цитрат натрия.
Определенные виды протеев разжижают желатину и образуют сероводород. Очень ценным является тест на наличие фермента фенилаланиндезаминазы - лишь бактерии из рода Протея и близкие к ним Провиденциа выделяют фенилаланиндезаминазу. Тест на наличие фенилаланиндезаминазы является весьма ценным критерием дифференциации бактерий из рода Протея и Провиденции от других грамотрицательных бактерий. Бактерии из группы Провиденции очень близки по свойствам к Протею. Так же как Протей Провиденциа обладают фенилаланиндезаминазой, но в отличие от Протеев Провиденции не гидролизируют мочевину. Синегнойная палочка принадлежит к числу цитохромположительных подвижных микробов, кроме того она является облигатным аэробом. Поэтому на полужидком агаре при посеве уколом синегнойная палочка растет преимущественно на поверхности среды в виде поверхностно расположенного кольца. В том случае, если штаммы синегнойной палочки образуют пигмент, это кольцо приобретает сине-зеленый оттенок. Поскольку 0,3% агар совершенно прозрачен, то удается обнаружить пигментообразование у штаммов синегнойной палочки, у которых это свойство выражено слабо и ка обычных питательных средах не улавливается. Синегнойная палочка обладает выраженной протеолитической активностью (разжижает желатину, гидролизует мочевину), утилизирует цитрат и малопат натрия, но не ферментирует лактозу, не выделяет сероводород и не обладает ферментом фенилаланиндезаминазой. Весьма ценным свойством является способность утилизировать в качестве единственного источника углеводов ацетамид. Рост синегнойной палочки на ацетамидном агаре довольно типичен. Эти бактерии растут на ацетамидном агаре в виде мелких в большинстве случаев зеленоватых колоний в S-форме, обладающих запахом аммиака, поскольку рост синегнойной палочки на ацетамидном агаре сопровождается дезаминированием ацетамида. Бактерии семейства Энтеробактерии в подавляющем большинстве случаев на ацетамидном агаре не растут, что позволяет использовать агаровую среду с ацетамидом в качестве селективной среды для выделения синегнойной палочки, в частности, для выделения атипичных беспигментных вариантов.
В случае необходимости производят идентификацию отдельных представителей Энтеробактерий до видовой принадлежности, для чего применяют ряд дополнительных биохимических тестов. Данные по видовой идентификации бактерий Клебсиелла и Протей представлены в таблице 2. Для Клебсиеллы характерно наличие отрицательной реакции на метиловый красный и положительного теста Фогес-Проскауера. Тесты на декарбоксилирование аминокислот (лизина, аргинина, орнитина) дают возможность дифференцировать отдельные виды трибы Клебсиеллы. Для трибы Протея характерно наличие положительной реакции на метиловый красный и отрицательного теста Фогес-Проскауера; декарбоксилазы в отношении орнитина выражены лишь у двух видов протеев - Proteus mirabilis и Proteus morganii.
Таблица 1
Дифференциально-диагностические тесты и среды | Цитохромоксидаза | Полужидкий агар (подвижность) | Лактоза | Желатина | Мочевина | Трехсахарный агар (H2) | Цитрат натрия | Малонат натрия | Фенилаланин | Ацетамидный агар | ||
Семейства, триды, роды бактерий | ||||||||||||
Enterobacterinceae | Escherichia (Ecoli) | - | + | + | - | - | - | - | - | - | - | |
Citrobacter | - | + | + | - | +/- | + | + | +/- | - | +/- | ||
Klebsiella | - | - | + | - | + | + | + | + | - | - | ||
Proteus | - | + | - | +/- | + | +/- | +/- | - | + | +/- | ||
Providencia | - | + | - | - | - | + | + | - | + | - | ||
Pseudomonas (Ps aeroginosa) | + | + | - | + | + | + | + | + | - | + | ||
Таблица 2
ВСТРЕЧАЮЩИХСЯ БАКТЕРИЙ СЕМЕЙСТВА ENTEROBACTERIACEAE
KLEBASIELLEAE - PROTEAE
Трибы, роды бактерий | Тесты | Полужидкий агар (подвижность) | Лактоза | Желатина | Мочевина | Трехсахарный агар (H2) | Цитрат натрия | Малонат натрия | Фенилаланин | Индол | Метил-рот | Фогес-Проскауер | Декарбоксилаза | |||||
Лизин | Аргинин | Орнитин | ||||||||||||||||
Klebsiellae | Klebsiella | - | + | - | + | - | + | + | - | +/- | - | + | + | - | - | |||
Entero bacter | Cloaca | + | + | + | + | - | + | + | - | - | + | + | - | + | + | |||
Aerogenes | + | + | +/- | - | - | + | +/- | - | - | - | + | + | - | + | ||||
Serratia | + | - | + | +/- | - | + | - | - | - | +/- | +/- | + | - | + | ||||
Proteae | Proteus | Vulgaris | + | - | + | + | + | +/- | - | + | + | + | - | - | - | - | ||
Mirabilis | + | - | + | + | + | + | - | + | + | + | +/- | - | - | + | ||||
Morganii | + | - | - | + | - | - | - | + | + | + | - | - | - | + | ||||
Rettgeri | + | - | - | + | - | + | - | + | + | + | - | - | - | - | ||||
Proridencia | Alcalifaciens | +/- | - | - | - | - | + | - | + | + | + | - | - | - | - | |||
Stuarti | +/- | - | - | - | - | + | - | + | + | + | - | - | - | - | ||||
1.1. Состав:
гидролизат казеина (в пересчете на сухой остаток) | - 15 г |
дрожжевой экстракт (10% в пересчете на сухой остаток) | - 5 г |
натрия хлорид | - 2,5 г |
глюкоза | - 5 г |
цистин | - 0,75 г |
тиогликолевая кислота | - 0,3 мл |
раствор резазурина 1:1000 (свежеприготовленный) | - 1 мл |
агар-агар дальневосточный | - 0,75 г |
вода дистиллированная до | - 1000 мл |
pH среды после стерилизации 7,0 - 7,2. | |
1.2. Приготовление.
Смешивают все компоненты среды, кроме глюкозы и тиогликолевой кислоты.
Цистин предварительно растворяют в небольшом количестве дистиллированной воды при постепенном добавлении 10 - 20% раствора едкого натра до pH 8,0 - 8,2, кипятят в котле с паровой рубашкой или на открытом огне при постоянном перемешивании до расплавления агар-агара 5 - 10 минут. Можно автоклавировать 20 минут при 100°; затем прибавляют горячую воду до первоначального объема, прибавляют глюкозу и тиогликолевую кислоту, фильтруют через полотно, устанавливают pH 7,2 - 7,3. Добавляют раствор резазурина, смешивают и разливают в стерильные пробирки по 20 мл. Стерилизуют 20 минут при 120°.
Тиогликолевую среду можно хранить до посева, предохраняя ее от света, при комнатной температуре в течение не более 7 суток со дня приготовления.
Примечание: 1. Допускается приготовление среды без раствора резазурина натрия.
2. Допускается применение других сортов агара, но с заранее вытитрованным количеством.
(селективная среда для синегнойной палочки)
2.1. | Хлористый натрий | - 5,0 г |
2.2. | Сернокислый магний | - 0,2 г |
2.3. | Фосфорнокислый аммоний однозамещенный | - 1,0 г |
2.4. | Двузамещенный фосфорнокислый калий | - 1,0 г |
2.5. | Ацетамид | - 20,0 г |
2.6. | Агар-агар | - 20,0 г |
2.7. | Дистиллированная вода | до 1000,0 мл |
pH среды = 6,7. |
3.1. | Сернокислый магний | - 0,2 г |
3.2. | Фосфат натрия-аммония | - 1,5 г |
3.3. | Двузамещенный фосфорнокислый калий | - 1,0 г |
3.4. | Цитрат натрия кристаллический | - 3,0 г |
3.5. | Дистиллированная вола | до 1000,0 мл |
После стерилизации в автоклаве добавляют 20 г агар-агара, нагревают до расплавления, устанавливают pH = 7,2 и затем прибавляют 1 мл 1,5% спиртового раствора бромтимолового синего.
Заместитель начальника Главного
санитарно-эпидемиологического
управления
О.Г.ИМАМАЛИЕВ
Утверждена
Приказом Минздрава СССР
от 6 декабря 1979 г. N 1230
ПО БАКТЕРИОЛОГИЧЕСКОМУ ОБСЛЕДОВАНИЮ НА ВЫЯВЛЕНИЕ НОСИТЕЛЕЙ
ЗОЛОТИСТОГО СТАФИЛОКОККА И ПРОВЕДЕНИЮ САНАЦИИ
В АКУШЕРСКИХ СТАЦИОНАРАХ
Инструкция разработана Всесоюзным научно-исследовательским институтом дезинфекции и стерилизации Минздрава СССР.
1.1. Инструкция предназначена для:
- руководителей акушерских стационаров;
- работников санитарно-эпидемиологических станций;
- работников бактериологических лабораторий.
1.2. В последние два десятилетия наблюдается рост внутрибольничных инфекций, одним из возбудителей которых является золотистый стафилококк.
1.3. По принятой классификации семейство Микрококков включает 3 рода: Микрококки, Стафилококки, Планококки.
1.4. Для медицинской практики наиболее важно дифференцировать стафилококки от микрококков, которые имеют сходную со стафилококком морфологию клеток и нередко выделяются из одних и тех же объектов.
1.5. Род стафилококков состоит из трех видов: золотистый стафилококк, эпидермальный стафилококк, сапрофитный стафилококк.
1.6. В настоящее время четко показано этиологическое значение при гнойно-септических заболеваниях вида золотистого стафилококка. Роль вида эпидермального стафилококка значительно меньше и возможна у ослабленных больных, лиц, страдающих диабетом, получающих большие дозы рентгено- и радиотерапии, а также при заболеваниях мочевыводящих путей.
1.7. Распространение стафилококковой инфекции происходит воздушно-капельным и контактными путями.
1.8. Основным источником стафилококковой инфекции в акушерских стационарах является человек (больной или здоровый бактерионоситель) из числа:
- рожениц и родильниц с гнойно-септическими острыми и хроническими процессами;
- медицинского и обслуживающего персонала (с локализацией возбудителей слизистых оболочках носа, зева, на коже и раневой поверхности).
1.9. Одной из мер профилактики внутрибольничных осложнений является своевременная изоляция больных и выявление носителей золотистого стафилококка с последующей санацией.
по выявлению бактерионосителей
2.1. Каждый сотрудник, поступающий на работу в акушерский стационар проходит полный медицинский осмотр, включающий обследование отолярингологом и стоматологом.
2.2. Работающий персонал должен быть взят под диспансерное наблюдение для своевременного выявления и излечения кариозных зубов, хронических воспалительных очагов в верхних дыхательных путях и ротовой полости, субатрофических состояний слизистых носа и зева, а также своевременного выявления носительства персоналом золотистого стафилококка (3-х кратно в квартал - плановое обследование).
2.3. Если при каждом обследовании данное лицо выделяет один и тот же фаготип золотистого стафилококка в массивном количестве (103 и более микробных клеток на тампоне), то данное лицо считают "злостным" носителем.
2.4. При проведении плановых бактериологических обследований обязательным является исследование слизи из передних отделов носа. Исследование слизи зева проводят выборочно. Забор материала осуществляет старшая акушерка стационара. Результаты плановых бактериологических исследований и обследований ЛОР-специалистом и стоматологом фиксируют в индивидуальной карте сотрудника.
2.5. Приготовление санирующих средств осуществляют аптеки акушерских стационаров.
2.6. Перед проведением санации носители проходят обязательную консультацию у специалистов отолярингологов, т.к. в определенном проценте они страдают аллергическими или хроническими заболеваниями верхних дыхательных путей, тонзиллитами и т.д., требующими обязательного специального лечения.
3.1. Обязательному бактериологическому исследованию подвергают слизь из передних отделов носа; исследование слизи из зева проводят по показаниям, прежде всего при наличии воспалительных процессов в зеве.
3.2. Забор материала из передних отделов носа осуществляют одним стерильным ватным тампоном из обеих половин носа. Сбор материала из зева проводят с поверхности миндалин стерильным ватным тампоном, либо путем смыва. В последнем случае обследуемый полощет горло 5,0 мл стерильного физиологического раствора. Смыв собирают в стерильную колбу (желательно с бусами), закрывают пробкой и встряхивают в течение 10 - 15 минут до получения однородной суспензии. При этом обязательным условием является взятие материала натощак (не ранее, чем через 2 - 3 часа после приема пищи).
3.3. Посев исследуемого материала на питательные среды должен проводиться не позже, чем через 2 часа после его забора.
3.4. Для первичного посева предпочтение должно быть отдано желточно-солевому агару (ЖСА) или желточно-молочно-солевой среде. Одновременно параллельный посев на молочно-солевой агар проводить не целесообразно. При целенаправленных исследованиях на стафилококк применение кровяных сред не обязательно.
3.5. Посев проводят тампоном, которым забирали материал. Тампон следует многократно поворачивать, чтобы перенести на питательную среду максимальное количество взятого материала. При посеве смыва из зева на питательную среду наносят 0,1 мл жидкости и растирают по поверхности среды шпателем.
3.6. При исследовании слизи из верхних дыхательных путей предварительное подращивание смывов в солевом или сахарном бульоне проводить не следует. Такое подращивание не позволит иметь истинного представления о массивности обсеменения верхних дыхательных путей, что имеет значение при характеристике источников стафилококковой инфекции.
верхних дыхательных путей
4.1. Взятый тампоном материал помещают в пробирку с 5,0 мл стерильного физиологического раствора. Тампон ополаскивают в жидкости встряхиванием пробирки в течение 10 минут, затем отжимают о внутренние стенки пробирки и удаляют. Жидкость многократно перемешивают пипеткой. Отдельной пипеткой на чашку с ЖСА наносят 0,1 мл исследуемого смыва и тщательно растирают шпателем. Чашки оставляют в термостате на 2 суток, после чего подсчитывают общее число выросших колоний и отдельно колоний различной морфологии. Особое внимание обращают на колонии, обладающие лецитовителлазной активностью.
4.2. Определение числа снятых на тампон колоний проводится следующим образом: если на чашке с ЖСА после посева 0,1 мл смывной жидкости выросло 15 однородных колоний, а идентификация двух колоний позволила отнести их к золотистому стафилококку одного и того же фаготипа, то это дает основание считать все выросшие на чашке колонии, идентичные по морфологии и пигменту, принадлежащими к золотистому стафилококку одного фаготипа.
Пример расчета: в 0,1 мл содержалось 15 колоний, следовательно, во всем объеме смыва будет 15 x 10 x 5 = 750 колоний или 7,5 x 102.
4.3. Массивность обсеменения, выражающаяся показателем 102 микробных клеток, снимаемых на тампон, является показателем умеренной обсемененности верхних дыхательных путей. При таком обсеменении выделение возбудителя во внешнюю среду, как правило, не имеет места.
4.4. Обсемененность, выражающаяся показателем 103 и более микробных клеток, снимаемых на тампон, является показателем высокой обсемененности, при которой происходит выделение возбудителя во внешнюю среду как при различных экспираторных актах, так и при спокойном дыхании.
4.5. В качестве ориентировочного определения массивности обсеменения верхних дыхательных путей можно пользоваться оценкой роста колоний на чашках при прямом посеве, обозначая в крестах.
+ + + + | сливной рост <*> |
+ + + | сплошной рост изолированных колоний <*> |
+ + | значительный рост (до 100 колоний) |
+ | единичные колонии (10 - 25). |
--------------------------------
Примечание <*>: Сливной и сплошной рост соответствует, как правило, массивности обсеменения 103 и выше микробных клеток, снимаемых на тампон.
5.1. Первый день. Посев на элективные среды (желточно-солевой, молочно-солевой или молочно-желточно-солевой агар). Засеянные среды выдерживают в термостате при 37 °C в течение 2 суток, либо одни сутки в термостате и дополнительно 24 часа на свету при комнатной температуре.
5.2. Второй - третий день. Просмотр чашек, фиксация в журнале характера и массивности роста колоний. На вышеуказанных средах стафилококк растет в виде круглых, блестящих, маслянистых, выпуклых, часто пигментированных колоний. На средах, содержащих желток, золотистый стафилококк, выделенный от человека, в 60 - 70% случаев образует радужный венчик вокруг колонии (положительная лециговителлазная реакция). Стафилококки животного происхождения дают положительную лецитовителлазную реакцию в 5 - 10% случаев.
5.3. С желточно-солевого агара на скошенный агар снимают в первую очередь колонии стафилококков, образующие радужный венчик (положительная лецитовителлазная реакция), изучению подлежат также пигментированные колонии и с отрицательной лецитовителлазной реакцией. При отсутствии на чашках пигментированных колоний и колоний с положительной лецитовителлазной реакцией для исследования снимают беспигментные колонии, похожие по морфологии на стафилококк. При одновременном наличии на чашках колоний стафилококка, отличающихся по пигменту, следует отвивать не менее двух колоний различного вида.
Пробирки с посевами помещают в термостат при 37 °C на 18 - 20 часов.
5.4. Четвертый день. После суточной инкубации у выделенных штаммов проверяют морфологию, тинкториальные свойства (окраска по Граму) и наличие плазмокоагулирующей активности. Характер роста культуры на скошенном агаре в ряде случаев дает возможность "предвидеть" принадлежность ее к виду золотистого стафилококка или эпидермального стафилококка. Первые, как правило, дают обильный равномерный, сочный рост, вторые - очень скудный и неравномерный рост по ходу посева. Окраску по Граму проводят общепринятым методом. Под микроскопом, окрашенные по Граму стафилококки, имеют вид фиолетово-синих кокков, располагающихся гроздьями или небольшими кучками ("кружево"), Плазмокоагулирующую активность проверяют в реакции коагуляции плазмы (РКП).
5.5. С учетом положительных результатов РКП и лецитовителлазной активности в 70 - 75% случаев на четвертый день исследования может быть подтверждена принадлежность выделенного штамма в виду золотистого стафилококка и выдан соответствующий ответ. Возможные варианты сочетаний результатов определения плазмокоагулирующей и лецитовителлазной активности представлены в таблице 1.
5.6. Если культура обладает только лецитовителлазной активностью, то для окончательного ответа требуется определение 1 - 2 дополнительных признаков, характерных для вида золотистого стафилококка (ДНКазная активность, хлопьеобразующий фактор и т.д.).
В этих случаях ответ выдают в зависимости от результатов, получаемых при определении названных признаков.
Если культура обладает только плазмокоагулирующей активностью, но является типичной по морфологии и образует пигмент, то может быть выдан ответ о ее принадлежности к виду золотистого стафилококка.
Если культура стафилококка типична по морфологии, не обладает ни плазмокоагулирующей, ни лецитовителлазной активностью, то для ее идентификации следует использовать тесты, указанные в таблице 1.
Таблица 1
Тесты | Плазмокоагулаза | Фосфатаза | Аэробная ферментация маннита | Отношение к новобиоцину | |
Вид стафилококка | |||||
Золотистый стафилококк | + | + | + | чувствителен | |
Эпидермальный стафилококк | - | + | - | чувствителен | |
Сапрофитный стафилококк | - | - | + | устойчив <*> | |
--------------------------------
5.7. Определение антибиограммы проводят только после выделения чистой культуры по показаниям (установление идентичности выделенных штаммов и др.).
Выделенные культуры золотистого стафилококка подлежат обязательному фаготипированию.
5.8. Пятый день. Учет результатов фаготипирования, определения чувствительности к антибиотикам, дополнительных признаков патогенности (ДНКазной активности, фибринолитической и т.д.). Выдача окончательного ответа.
6.1. Для ежедневной санации персонала, приступающего к работе, используют следующие санирующие средства: фурациллин 1:5000, риванол 1:5000; 1% раствор борной кислоты, марганцевокислый калий (розово-красный раствор), раствор Люголя (водный или на глицерине), настой листьев эвкалипта (Приложение 1).
N п/п | Препарат | Способ приготовления | Метод санации |
1 | 2 | 3 | 4 |
1 | Очищенный гексахлорофен, 2,21-диокси-3,5,6,31,51,61-гексахлордифенил метанбифельное соединение. Гексахлорофен - белый, мелкокристаллический порошок с температурой плавления 163 - 174°, молекулярный вес - 406,9. Препарат хорошо растворим в органических растворителях, 70° спирте, в воде не растворим, нейтрализуется растворами, имеющими щелочное значение pH выше 8.0. Гексахлорофен (гх) обладает высоким бактерицидным действием в отношении вегетативных форм микроорганизмов и грибов. Гексахлорофен стойкий при хранении препарат. Его хранят в сухом и прохладном месте. Гх относится к высокотоксичным веществам, при введении в желудок 50% животных погибает от дозы 150 мг/кг веса. Он хорошо всасывается через неповрежденную и поврежденную кожу. Раздражающие свойства чистого гх выражены умеренно и в рекомендуемых концентрациях практически не проявляются. Гх является слабым аллергеном, при длительном постоянном применении без соответствующих мер предосторожности он может накапливаться в организме, поэтому его используют строго по назначению врача. Для санации слизистой носа применяют 1% мазь гх на вазелиновой основе | Для приготовления 100 г 1%-ной мази требуется вазелина медицинского 99 г; очищенного гексахлорофена 1 г. Отвешенное количество гх небольшими порциями добавляют в вазелин при постоянном помешивании (20 - 30 минут) до получения однородной массы. Готовую мазь фасуют в соответствующую тару. Хранят мазь в банках из темного стекла или в защищенном от света месте | При локализации носительства в носу 1% гексахлорофеновой мазью с помощью ватного тампона смазывают передние отделы носовой полости, в течение 1 минуты производят мягкий массаж крыльев носа для равномерного распределения мази (количество мази на одну обработку около 1 г). Такую обработку проводят 1 раз в сутки в течение 5 - 6 дней (при ежедневной работе персонала). У дежурящих в течение суток - 3 раза в сутки в течение - 3-х очередных дежурств с перерывом между ними не более 3-х дней (всего проводят 9 обработок). Персонал, работающий 12 часов в смену, санируют 2-кратно: в начале и в конце работы смены. Обработку проводят в течение 4-х дежурств с промежутками не более 2 дней (всего проводят 8 обработок) |
2. | Хлорофиллипт (ХФ). Представляет собой сложное органическое соединение, в состав которого входит хлорофилл "а" и хлорофилл "в". Это порошок ярко-зеленого цвета, горьковатого вкуса, не растворим в воде, растворим в органических растворителях. В медицинской практике препарат используется в виде спиртового и масляного растворов. Спиртовой раствор представляет собой прозрачную жидкость ярко-зеленого цвета, образующую с водой флуоресцирующий масляный раствор - густую жидкость ярко-зеленого цвета. ХФ обладает антибактериальной (бактериостатической и бактерицидной) активностью в отношении антибиотикоустойчивых стафилококков. ХФ применяют при лечении заболеваний, вызванных антибиотико-устойчивыми стафилококками и при санации стафилококковых носителей. При применении препарата возможно появление аллергических реакций. Препарат выпускается в виде 1% и 0,25% спиртового раствора и 2% масляного раствора. Препарат хранится в стеклянной герметически закрытой посуде, в сухом, прохладном и защищенном от света месте | Готовят 2% масляный раствор | При локализации носительства в носу, закапывают 2% масляный раствор хлорофиллипта трижды в день в течение 6 - 7 дней. Для санации зева используют 1% спиртовой раствор хлорофиллипта (20 - 30 мл препарата на 10 мл воды). Полоскание зева проводят 3 раза в день в течение 6 - 7 дней |
3. | Лизоцим. Антибиотическое вещество ферментного характера находится в слезах, мокроте, слюне, сыворотке, лейкоцитах, костном мозгу, хрящах, сердце, печени, легких, почках и т.д. Лизоцим обладает бактериостатическим действием не только в отношении сапрофитов, но и ряда патогенных микробов (стафилококки, стрептококк, гонококк, менингококк, палочки сибирской язвы, холерный вибрион, брюшно-тифозная палочка и т.д.). | Готовят следующим образом: предварительно целые яйца протирают спиртом (скорлупа). Затем яичные белки отделяют от желтков и помещают в мерный стакан. Белки разводят 0,5%-ным стерильным физиологическим раствором в 2 раза, взбалтывают, а затем разводят в 15 раз. Полученную смесь подкисляют 1% (или 5%) лимонной кислотой до PH 4,4 - 4,6, доводят до кипячения и кипятят 5 минут (обязательно беспрерывно помешивая). Горячей смеси дают остыть. Охлажденную смесь нейтрализуют CaCO3 (мелом) до pH 7,0 - 7,2. Дают мелу осесть. Лизоцим содержится в надосадочной жидкости. Надосадочную жидкость отфильтровывают дважды до получения прозрачной жидкости, разливают в стерильные флаконы и закрывают. Лизоцим хранится при Т° +4 °C не более 5 дней | При локализации носительства в носу проводят обработку передних отделов носа 1% лизоцимной мазью или закапывают 0,1% лизоцима по 2 - 4 капли в каждую ноздрю. Санацию проводят ежедневно в течение 6 суток по 3 раза в день. Полоскание зева 0,1% р-ром кристаллического или жидкого лизоцима |
4. | Стафилококковый бактериофаг (выпускается Горьковским НИИ эпидемиологии) | Для санации носа 2 раза в день на 15 - 20 минут закладывают ватные тампоны, обильно смоченные стафилококковым батериофагом. Для санации зева проводят полоскание 3 раза в день в течение 6 - 7 дней | |
5. | Фурацилин. Желтый или зеленовато-желтый мелкокристаллический порошок, без запаха, горького вкуса, очень мало растворим в воде (1:4200), мало - в спирте, растворим в щелочах. Представляет антибактериальное средство, действующее на ряд грамположительных и грамотрицательных микробов: стафилококки, стрептококки, дизентерийную и кишечную палочку, возбудителя газовой гангрены и др. В концентрации 1:9000 - 15:4200 оказывает бактерицидное действие. Резистентность микроорганизмов к препарату развивается медленно. Не раздражает тканей | Для приготовления водного р-ра 1 часть фурацилина растворяют в 5000 частей изотонического р-ра хлорида натрия или дистиллированной воды. Для ускорения рекомендуют применение кипящей воды или горячей. При хранении р-ры фурацилина могут приобретать бурую окраску. Изменение цвета препарата и р-ров не изменяет их активности | Ежедневно 1 раз в сутки полоскание зева и протирание тампоном слизистой переднего отдела носа в течение 6 - 7 дней |
6. | Риванол. Желтый кристаллический порошок горького вкуса без запаха. Малорастворим в холодной воде (1:50), легче в горячей, мало растворим и спирте (1:110). Водные р-ры нестойки, особенно на свету становятся бурыми. Пользоваться следует свежеприготовленными растворами. Оказывает противомикробное действие, главным образом при инфекциях; вызванных кокками, особенно стрептококками. Препарат мало токсичен, не вызывает раздражения тканей. Применяют как наружное профилактическое и лечебное антисептическое средство в отолярингологии. При воспалении слизистой оболочки рта, зева, носа назначают полоскание 0,1% раствором | Готовят 1:5000 растворы | Ежедневно 1 раз в сутки полоскание зева и протирание тампоном слизистых передних отделов носа в течение 6 - 7 дней |
7. | Борная кислота. Бесцветные блестящие слегка жирные на ощупь чешуйки или белый мелкокристаллический порошок без запаха. Растворим в холодной воде (1:25) и легко (1:4) в кипящей воде, растворим в спирте (1:25). Водные растворы имеют слабокислую реакцию. Применяют наружно как антисептическое средство в виде водных растворов (2 - 4%) для полоскания полости рта, зева и для промывания глаз | Готовят 1% водные растворы | Ежедневно 1 раз в сутки полоскание зева и протирание тампоном передних отделов носа в течение 6 - 7 дней |
8. | Раствор Люголя. Раствор йода в водном растворе йодида калия. Состав: йода 1 часть, калия йодида 2 части, воды 17 частей | Готовят из расчета: 1 чайная ложка на 200 мл воды | Ежедневно 1 раз в сутки полоскание |
9. | Люголь в глицерине. Применяют раствор Люголя наружно, главным образом, для смазывания слизистой оболочки глотки, гортани | Готовят из расчета: йода 1 часть калия йодида 2 части, глицерина, 94 части, воды 3 части | Смазывать зев 1 раз в сутки в течение 6 - 7 дней |
10. | Калий марганцевокислый. Темно- или красно-фиолетовые кристаллы или мелкий порошок с металлическим блеском. Растворим в воде (1:18 в холодной и 1:3,5 в кипящей). Образует раствор темно-пурпурного цвета. При взаимодействии с органическими (уголь, сахар, ткани) и легко окисляющимися веществами может произойти взрыв. Является сильным окислителем. Применяют как антисептическое средство наружно в водных растворах для промывания ран (0,1 - 0,5%), для полоскания рта и гортани (0,01 - 0,1%) | Готовят 0,01% растворы на воде, (раствор розово-красного цвета) | Ежедневно 1 раз в сутки полоскание в течение 6 - 7 дней |
11 | Настой листьев эвкалипта. Высушенные листья культивируемых деревьев эвкалипта содержат эфирное масло (не менее 2,5% в цельных листьях и 1,5% в резаных листьях), сложные эфиры, органические кислоты, дубильные и др. вещества. Отвар и настой эвкалипта применяют в качестве асептических средств для полоскания верхних дыхательных путей. Является слабым аллергеном | Отвар готовят следующим образом: 10 г листьев заливают стаканом холодной воды и кипятят на слабом огне в течение 15 мин., остужают и процеживают. Для полоскания и ингаляций берут 1 столовую ложку на стакан воды | Ежедневно 1 раз в сутки полоскание |
6.2. Для получения наиболее эффективных результатов санации бактерионосителей следует проводить смену санирующих средств через каждые 7 дней.
6.3. Для санации "злостных" носителей используют 1% мазь гексахлорофена или хлорофиллипта, лизоцим и стафилококковый бактериофаг.
6.4. В период эпидемического неблагополучия (вспышка ОРЗ, подъем заболеваемости внутрибольничными инфекциями, значительная обсемененность стафилококками предметов окружающей среды и т.п.) в акушерских стационарах следует санировать весь персонал одномоментно средствами, указанными в пункте 6.3.
6.5. Санацию "злостных" носителей стафилококка проводят один раз в квартал до следующего планового бактериологического обследования.
6.6. В тех случаях, когда невозможно добиться санацией снижения или полного избавления от носительства стафилококка, строго следят за правильным ношением маски, закрывающей рот, нос и волосы. При этом необходимо иметь график ношения масок и проводить смену масок каждые три часа.
Заместитель начальника
Главного управления карантинных
инфекций Минздрава СССР
О.Г.ИМАМАЛИЕВ
Заместитель начальника
Главного управления лечпрофпомощи
детям и матерям Минздрава СССР
В.В.КОЧЕМАСОВА
Утверждена
Приказом Минздрава СССР
от 6 декабря 1979 г. N 1230
ПО СТИРКЕ И ДЕЗИНФЕКЦИИ БЕЛЬЯ РОДИЛЬНЫХ ДОМОВ
И ГИНЕКОЛОГИЧЕСКИХ БОЛЬНИЦ
Инструкция разработана Академией Коммунального хозяйства и Всесоюзным научно-исследовательским институтом дезинфекции и стерилизации Министерства здравоохранения СССР.
Постельное и нательное белье больных может служить одним из факторов передачи инфекционных заболеваний. Самым распространенным и массовым методом обеззараживания белья является механизированная стирка. В целях обеспечения санитарно-гигиенического режима и пресечения возможного распространения патогенных возбудителей через белье родильных домов и гинекологических отделений стирку белья из этих учреждений целесообразно проводить в специально выделенных для этой цели прачечных, отдельно от белья других больниц и отделений.
При обработке белья должна соблюдаться поточность в соответствии с требованиями технологической последовательности.
Белье родильных домов и гинекологических больниц принимают в стирку отдельно в подготовленном виде, то есть освобожденном от посторонних предметов и механических загрязнений, сложенным по ассортименту не более:
простыни - 25 шт.
пододеяльники - 20 шт.
одеяла и халаты - 10 шт.
наволочки, полотенца, сорочки, куртки, фартуки, распашонки - 20 шт.
пеленки, подкладные, простынки, косынки, лифчики - 50 шт.
Рваное белье в прачечную не должно приниматься. Все белье должно иметь четкий штамп лечебного учреждения с указанием года и месяца начала его эксплуатации.
Мелкое белье (пеленки, салфетки и т.п.) должно быть обезличенным и приниматься по весу и поштучно.
Белье сортируется при его приеме по ассортименту, степени загрязненности и цвету.
По ассортименту:
1. Простыни, пододеяльники, одеяла тканевые, наволочки, полотенца, сорочки.
2. Халаты (бязевые), лифчики.
3. Детское белье - распашонки, пеленки (летние, байковые), косынки.
4. Подкладные.
5. Куртки, фартуки, колпаки поварские.
6. Халаты байковые (по цвету).
7. Одеяла байковые (по цвету).
По степени загрязненности:
1. Белье со специфическими (белковыми) загрязнениями - подкладные, пеленки и др.
ИС МЕГАНОРМ: примечание. Нумерация пунктов дана в соответствии с официальным текстом документа. |
3. Обычно загрязненное белье - простыни, наволочки, пододеяльники, сорочки и т.п. (белое и цветное).
- Микропартии подбираются в соответствии с загрузочной массой стиральных машин на прачечной с учетом цвета белья.
Стирка белья должна производиться умягченной водой. Для замочки (за исключением подкладных и пеленок), стирок и двух первых полосканий необходима горячая умягченная вода с температурой не выше 40 °C. Для последних двух полосканий используется жесткая вода. При стирке подкладных и пеленок производится несколько предварительных полосканий. Во избежание заваривания белковых загрязнений на подкладных и пеленках первое предварительное полоскание производится холодной жесткой водой, два последних - смешанной (холодной и горячей) водой с постепенным повышением температуры от 25 до 40 °C.
Коэффициент, учитывающий степень загрязненности белья, принимается равным 1 для обычных стиральных машин; для комбинированных - типа "Текстима" - 0,8 (в машину загружается 150 кг белья).
Перегрузка машин бельем сверх установленных норм запрещается, т.к. ведет к резкому ухудшению качества отстирывания и дезинфекции белья.
Стирка белья родильных домов, гинекологических больниц в зависимости от ассортимента, вида загрязнений и типа машин производится по режимам, приведенным в таблицах N 1, 2, 3, 4.
Таблица 1
РЕЖИМ СТИРКИ БЕЛОГО БЕЛЬЯ С ОБЫЧНЫМИ ЗАГРЯЗНЕНИЯМИ
N п/п | Наименование операций | Температура ванны °C | Жидкостный модуль | Продолжительность, мин. | Примечание |
1. | Первая стирка | 40 - 60 | 4 | 10 | Отбелка кислородсодержащими препаратами |
2. | Вторая стирка | 60 - 95 | 4 | 10 | |
3. | Третья стирка | 95 - 100 | 4 | 14 | |
4. | Первое полоскание | 80 - 70 | 6 | 5 | |
5. | Второе полоскание | 70 - 60 | 6 | 5 | Отбелка хлорсодержащими препаратами |
6. | Третье полоскание | 50 - 40 | 8 | 3 | |
7. | Четвертое полоскание | 30 - 20 | 8 | 3 | |
8. | Пятое полоскание | 20 | 8 | 3 | |
Итого: | 53 | ||||
Примечание: При использовании хлорсодержащих отбеливателей второе и третье полоскание объединяются.
Таблица 2
N п/п | Наименование операций | Температура ванны °C | Жидкостный модуль | Продолжительность, мин. | Примечание |
1. | Первая стирка | 30 - 40 | 6 | 10 | |
2. | Вторая стирка | 40 - 60 | 6 | 15 | Дезинфекция кислородсодержащими препаратами |
3. | Первое полосканне | 60 - 40 | 8 | 4 | |
4. | Второе полоскание | 40 - 30 | 8 | 4 | |
5. | Третье полоскание | 30 - 20 | 8 | 3 | |
6. | Четвертое полоскание | 20 | 8 | 3 | |
7. | Пятое полоскание | 20 | 8 | 3 | |
Итого: | 42 | ||||
Таблица 3
(БЕЛКОВЫМИ) ЗАГРЯЗНЕНИЯМИ
N п/п | Наименование операций | Температура ванны °C | Жидкостный модуль | Продолжительность, мин. | Примечание |
1. | Замочка | Температура холодной воды | 8 | 5 | |
2. | Предварительное полоскание | 25 - 30 | 8 | 5 | |
3. | Предварительное полоскание | 30 - 40 | 8 | 5 | Добавление соды |
4. | Первая стирка | 40 - 60 | 4 | 10 | |
5. | Промежуточное полоскание | 60 - 70 | 8 | 3 | |
6. | Вторая стирка | 70 - 100 | 4 | 20 | Отбелка кислородосодержащими препаратами |
7. | Первое полоскание | 80 - 70 | 6 | 5 | |
8. | Второе полоскание | 70 - 60 | 6 | 5 | Отбелка хлорсодержащими препаратами |
9. | Третье полоскание | 50 - 40 | 8 | 3 | |
10. | Четвертое полоскание | 30 - 20 | 8 | 3 | |
11. | Пятое полоскание | 20 | 8 | 3 | |
Итого: | 67 | ||||
Примечание: 1. При использовании хлорсодержащих отбеливателей второе и третье полоскания объединяются.
2. Температуры указаны на начало и конец операции.
В комбинированных стирально-отжимных машинах два предварительных полоскания заменяются промежуточным отжимом. Для постельного и нательного белья разработан трехванный способ стирки, для подкладных, пеленок и цветного нательного белья - двухванный. На комбинированных машинах за счет промежуточного отжима для постельного и нательного белья достаточно двух моющих ванн.
В качестве моющего средства рекомендуется синтетический порошок по МРТУ 18/273-69 и кальцинированная сода. Нормы расхода указаны в таблице 5.
Мешки, в которые упаковывается белье, должны каждый раз стираться с применением дезпрепаратов.
Таблица 4
N п/п | Наименование операций | Температура ванны °C | Жидкостный модуль | Продолжительность, мин. | Примечание |
1. | Замочка | 30 - 40 | 7 | 5 | Добавление соды |
2. | Промежуточный отжим | - | - | 1 - 3 | |
3. | Первая стирка | 40 - 60 | 4 | 10 | |
4. | Промежуточный отжим | - | - | 1 - 3 | |
5. | Вторая стирка | 70 - 100 | 4 | 20 | Отбелка кислородсодержащими препаратами |
6. | Промежуточный отжим | - | - | 1 - 3 | |
7. | Первое полоскание | 80 - 70 | 6 - 7 | 5 | |
8. | Промежуточный отжим | - | - | 1 - 3 | |
9. | Второе полоскание | 70 - 60 | 6 - 7 | 5 | Отбелка хлорсодержащими препаратами |
10. Третье полоскание | 50 - 40 | 6 - 7 | 5 | ||
11. | Промежуточный отжим | - | - | 1 - 3 | |
12. | Четвертое полоскание | 30 - 20 | 6 - 7 | 5 | |
13. | Окончательный отжим | - | - | 15 | |
14. | Растряска | - | - | 4 | |
Итого: | 78 - 89 | ||||
Примечание: Температуры указаны на начало и конец операции.
Моющий порошок и сода могут подаваться в стиральные машины централизованно в виде раствора или в сухом виде.
Сода подается в последнее предварительное полоскание, моющее средство в зависимости от режима подается следующим образом:
при двухванном способе стирки 2/3 от общего количества в первую и по 1/3 - во вторую моющие ванны; при трехванном - 1/2 в первую и по 1/4 во вторую и третью ванны.
Белье должно быть полностью отполоскано, при необходимости следует провести дополнительное полоскание.
По желанию больниц медицинские халаты и постельное белье может быть накрахмалено в соответствии с Правилами технологического процесса обработки белья в прачечных.
Таблица 5
Вид белья | Нормы расхода, кг/т белья | |
порошок по МРТУ 18/273-69 | сода кальцинированная | |
При стирке в умягченной воде | ||
Белое постельное и нательное | 30 | - |
Цветное нательное | 25 | - |
Подкладные и пеленки | 24 | 15 |
При стирке в жесткой воде | ||
Белое постельное и нательное | 36 | - |
Цветное нательное | 30 | - |
Подкладные и пеленки | 29 | 15 |
Все белье родильных домов и гинекологических больниц должно подвергаться дезинфекции. В качестве дезпрепаратов могут быть использованы:
хлорсодержащие препараты - Дихлор 1, Белка, гипохлорит натрия; кислородсодержащие препараты - пергидроль, Аленушка (ОДР), перпирофосфат натрия и пергидрат сульфата натрия.
Все использованные препараты являются одновременно и отбеливающими средствами, способствующими удалению неотстиранных пятен крови и лекарств.
Все препараты являются взаимозаменяемыми. Отбеливающе-дезинфицирующим компонентом в Дихлор 1 является калиевая соль дихлоризоциануровой кислоты; в Белке - двутреть основная соль гипохлорита натрия, пергидрат сульфата натрия - перекись водорода.
Кислородсодержащие отбеливающе-дезинфицирующие препараты подаются в последнюю моющую ванну; хлорсодержащие подаются во второе полоскание, последнее совмещается с третьим полосканием. В этом случае вода после второго полоскания не сливается. Длительность отбелки и дезинфекции в первом случае 14 - 20 минут также способствует полному обеззараживанию белья.
Отбеливающе-дезинфицирующие препараты разбавляются в эмалированной или полиэтиленовой посуде в небольшом количестве воды и подаются непосредственно в машину в начале операции. В момент подачи внутренний барабан стиральной машины должен вращаться.
Концентрация в ванне - активного хлора - 0,02 - 0,027%, перекиси водорода - 0,01 - 0,14%.
При приготовлении рабочих растворов дезпрепаратов должны соблюдаться меры предосторожности; использование резиновых перчаток, халата, респиратора типа Ф-46-КС с патроном "А" или РУ-60, или четырехслойной марлевой маски.
При попадании концентрированных растворов на кожу или в глаза, их надо смыть водой, кожу затем смазать мазью от ожогов. Дезпрепараты, как и моющие средства, должны храниться в сухом темном помещении, специально выделенном для этой цели, с непременным наличием на них этикеток.
Таблица 6
НОРМЫ РАСХОДА ДЕЗИНФИЦИРУЮЩИХ И ОТБЕЛИВАЮЩИХ СРЕДСТВ
Наименование препаратов | Нормы расхода на 1 тн белья | |
кг | л | |
Дихлор 1 (7% активного хлора) | 16 | - |
Белка (10% активного хлора) | 16 | - |
Гипохлорит натрия (185 г/л активного хлора) | - | 4 |
Пергидроль (30% H2O2) | - | 4 |
Аленушка (ОДР) 10% H2O2 | - | 16 |
Перпирофосфат натрия (18% H2O2) | 2 | - |
Пергидрат сульфата натрия (14% H2O2) | 4 | - |
Операции отжима, сушки, глажения и складирования производятся в соответствии с Правилами технологического процесса обработки белья в прачечных. Остаточная влажность белья после отжима не должна превышать 45 - 50%. Температура при глажении должна быть не ниже 160 - 180 °C.
При перевозке чистого белья должна использоваться упаковочная тара. Совместная перевозка чистого и грязного белья категорически запрещается.
Дезинфекционные мероприятия в помещениях прачечной.
В цехах, где происходит прием, сортировка и стирка белья, необходимо проводить ежедневно влажную уборку с применением дезинфицирующих средств (1%-ным раствором хлорамина или 0,5%-ным осветленным раствором хлорной извести), с 0,5%-ным раствором, применяемого на прачечной моющего средства по МРТУ 18/273-69 - на основе сульфанола.
Кроме того, необходима ежедневная смена спецодежды обслуживающего персонала вышеуказанных цехов.
Согласовано
Директор Академии
коммунального хозяйства
Ф.ШЕВЕЛЕВ
Директор Всесоюзного НИИ
дезинфекции и стерилизации
П.ЛЯРСКИЙ
Утверждена
Приказом Минздрава СССР
от 6 декабря 1979 г. N 1230
(МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ)
Внедрение в клиническую практику новых антибиотиков (полусинтетических пенициллинов, цефалоспоринов, тетрациклинов, аминогликозидов и др.) расширило возможности терапии заболеваний, вызванных пенициллиназопродуцирующими стафилококками, протеем, кишечной и синегнойной палочками и их ассоциациями.
Общие принципы антибиотикотерапии определяются, в первую очередь, правильными показаниями к их назначению. Выбор антибиотика производится на основании микробиологического подтверждения диагноза с учетом антимикробного спектра действия препарата. Терапевтическая эффективность антибиотиков во многом зависит от их фармакокинетических особенностей: скорость всасывания, распределение в органах и тканях, достаточное проникновение через физиологические и патологические барьеры, элиминация из организма, степень связывания белками сыворотки крови, которая снижает диффузионную способность и антибактериальное действие препарата. Исходя из фармакокинетических данных, устанавливается разовая доза и "режим введения" препарата. В процессе лечения следует контролировать чувствительность возбудителя заболевания, так как появление вторичной лекарственной устойчивости снижает клиническую эффективность антибиотикотерапии.
Наиболее широкое применение в акушерской практике находит группа пенициллина.
Бензилпенициллин (пенициллин д) обладает высокой антимикробной активностью преимущественно в отношении грамположительных микроорганизмов (пенициллиназонегативные стафилококки, пневмококки, стрептококки) грамотрицательные кокки (менингококки, гонококки и др.).
При послеродовых и послеабортных инфекционных осложнениях чаще используется натриевая и калиевая соли бензилпенициллина. В связи с распространением устойчивых микробов к антибиотику изменилась тактика его применения - назначение в "Мега" дозах (10 - 20 млн ЕД и более в сутки). Введение больших доз создает высокие концентрации антибиотика в крови и очаге инфекции. В этих дозах пенициллин становится активен в отношении некоторых грамотрицательных микроорганизмов (протея и др.). Необходимым условием для назначения бензилпенициллина является выделение возбудителя, чувствительного к препарату. Антибиотик связывается белками крови на 48 - 68%, обладает низкой токсичностью, что позволяет применять его в различных дозах в зависимости от степени тяжести заболевания (в сутки 2000000 ЕД и более). При назначении больших доз возможно развитие гиперкалиемии (при применении калиевой соли бензилпенициллина) и появление нейротоксического действия, особенно при почечной недостаточности. Основным механизмом выделения антибиотика из организма является экскреция почками (40 - 70%) препарата выводится с мочой в биологически активной форме).
Из полусинтетических производных пенициллина для акушерской практики представляют интерес три группы препаратов:
1. Пенициллиназоустойчивые - метициллин и оксациллин.
2. Антибиотики с широким спектром антимикробного действия - ампициллин, карбеонициллин.
3. Комбинированные препараты - ампиокс.
По механизму действия полусинтетические пенициллины так же, как и бензилпенициллин, относятся к ингибиторам биосинтеза клеточной стенки (С.М. Навашин, И.П. Фомина, 1974), оказывая бактерицидный эффект, обладают перекрестными аллергическими реакциями.
Метициллин активен в отношении пенициллиназопродуцирующих стафилококков, пневмококков, стрептококков, гонококков и др. грамположительных микроорганизмов, но не действует на грамотрицательные бактерии и энтерококки. Антибиотик быстро всасывается при внутримышечном и внутривенном введении, терапевтическая концентрация в крови после внутримышечного введения 1,0 г препарата сохраняется в течение 2 - 3 часов.
Метициллин хорошо проникает в ткани и жидкости организма (матка, молоко, плевральный и перитонеальный экссудаты), проходит через плацентарный барьер. Связывается с белками крови на 28 - 49%. Из организма выводится путем клубочковой фильтрации и канальцевой секреции, причем до 60 - 75% препарата экскретируется в первые 4 часа с момента введения, 2 - 3% от введенной дозы выводится желчью. При лечении больных с нарушением выделительной функции почек или сердечной недостаточностью следует помнить о возможности гипернатриемии. Метициллин назначается суточными дозами 4 - 6 г, в зависимости от степени тяжести заболевания, суточную дозу можно увеличить до 12 г.
Оксациллин - антимикробный спектр его близок к бензилпенициллину, но препарат устойчив к стафилококковой пенициллиназе, наиболее активен в отношении стрептококков и пневмококков, но не действует на грамотрицательные микроорганизмы. Преимущество оксациллина - кислотоустойчивость, что позволяет применять его энтерально. Препарат связывается белками сыворотки крови на 86 - 93%, быстро всасывается при энтеральном введении и держится на терапевтическом уровне в крови в течение 2 - 3 часов. Антибиотик в ограниченном количестве проходит в молоко родильницы и через плацентарный барьер.
Выведение оксациллина происходит путем экскреции с мочой (23 - 75%), а также с желчью. Действие внепочечных факторов очищения позволяет применять оксациллин при почечной недостаточности по обычным схемам. Антибиотик вводится энтерально, внутримышечно или внутривенно в суточной дозе 3 - 6 г, при тяжелых септических процессах возможно увеличение суточной дозы до 10 - 12 г.
Ампициллин - кислотоустойчив, инактивируется пенициллиназой, обладает широким спектром антимикробного действия, активен в отношении тех же микробов, что и бензилпенициллин, но действует на энтерококки и большинство грамотрицательных микроорганизмов, за исключением группы клебсиелла, энтеробактер, псерогеноза. Они не активны в отношении пенициллиназообразующих стафилококков.
Антибиотик связывается белками сыворотки крови лишь на 10 - 12%. Отличительной способностью его является быстрое и полное всасывание при различных путях введения. Терапевтический уровень препарата в крови сохраняется до 8 часов при энтеральном введении, до 4 - 6 часов при внутримышечном. Ампициллин хорошо диффундирует в ткани и проникает через гематоэнцефалический барьер. Антибиотик в основном выводится почками (около 60% в течение 24 часов). В связи с широкими колебаниями чувствительности микробов к препарату, схема его введения разрабатывается индивидуально. Средняя суточная доза составляет 2 - 3 г, но может быть увеличена до 6 г и более.
Карбенициллин (пиопен) - активен в отношении грамположительных и грамотрицательных микроорганизмов. Активность его ниже, чем бензилпенициллина в отношении патогенных стафилококков, а также энтерококков. Разрушается пенициллиназой, вырабатываемой стафилококками. Преимущество препарата по сравнению с другими пенициллинами - высокая эффективность в отношении протея и синегнойной палочки. Антибиотик связывается белками сыворотки крови на 26 - 55%. Максимальная концентрация в крови при парентеральном введении определяется через 1 - 2 часа. Препарат хорошо проникает в жидкости и ткани организма, проходит через плацентарный барьер. Выводится с мочой в неизмененном виде до 84% препарата, а также экскретируется желчью. Путь введения возможен энтеральный и парентеральный при суточной дозе препарата от 4 до 12 г в зависимости от тяжести процесса.
Ампиокс - комбинированный препарат ампициллина с оксациллином. Антимикробный спектр соответствует спектру входящих в его состав антибиотиков. Его преимущества определяются возможностью использования в больших дозах без опасности развития токсических реакций, медленным развитием у возбудителей устойчивости в процессе лечения (или отсутствием ее). Препарат умеренно связывается белками сыворотки крови, создавая высокие концентрации в крови и тканях, моче, мокроте и желчи. Ампиокс применяют парентерально (внутривенно и внутримышечно) в суточной дозе от 1,5 до 4,0 г с интервалами в 6 - 8 часов. В основном используется при тяжелом течении инфекций и невыделенном возбудителе, смешанных инфекциях, для профилактики осложнений при инфекционном анамнезе и в микропедиатрической практике.
Цефалоспорины - группа антибиотиков обладает широким антибактериальным спектром, бактерицидным типом действия на микробную клетку, почти полным отсутствием перекрестных аллергических реакций с пенициллинами (1 - 5%). При назначении препаратов этой группы врач должен знать, что закупка их по импорту непостоянна.
В настоящее время из группы цефалоспоринов в клиническую практику внедрены цефалоридин (цепорин) и цефазолин (кефзол).
Цефалоридин - обладает наибольшей активностью в отношении пиогенных и зеленящих стрептококков и пенициллиназопродуцирующих стафилококков, а также грамотрицательных микроорганизмов, за исключением синегнойной палочки и индолпозитивных штаммов протея. Антибиотик не связывается белками сыворотки крови, при парентеральном введении хорошо всасывается и диффундирует в органы и ткани, проходит через плацентарный барьер. Терапевтические концентрации в крови после парентерального введения поддерживаются от 6 до 8 часов. Препарат элиминируется с мочой (70 - 80% за сутки). Суточная доза цефалоридина составляет 2 - 4 г, в зависимости от тяжести заболевания может быть увеличена до 12 г в сутки при постоянном контроле за функцией почек.
Кефзол - обладает активностью в отношении стафилококков, стрептококков, пневмококков и большинства грамотрицательных бактерий (кроме псевдомонас, протей, энтеробактер).
Препарат связывается с белками сыворотки крови, но эти связи легко обратимы. Он активно диффундирует в органы и ткани, проходит через плацентарный барьер. Терапевтическая концентрация в крови после парентерального введения сохраняется в течение 8 часов. Препарат в основном выделяется с мочой (86% введенного препарата в течение суток). Суточная доза кефзола составляет от 750 мг до 8 г. При почечной недостаточности дозировка зависит от степени нарушения функции почек (при анурии 250 - 500 мг в сутки). Препарат вводится внутримышечно и внутривенно (растворяется дистиллированной водой).
Макролиды. К этой группе препаратов относятся антибиотики, в молекулах которых имеется макроциклическое лактамное кольцо, связанное с одним или несколькими углеводными остатками. Макролиды обладают активностью в отношении грамположительных микроорганизмов, а также гонококков, менингококков, бруцелл, риккетсий, крупных вирусов и простейших, проявляя перекрестную устойчивость внутри группы.
Наибольшее практическое применение имеет эритромицин и олеандомицин, которые используются при инфекциях, вызванных устойчивыми и полирезистентными микроорганизмами. Эти препараты в терапевтических дозах бактериостатически действуют на микробную клетку.
Эритромицин хорошо всасывается при энтеральном введении и находится на терапевтическом уровне в течение 6 - 7 часов, проникает в ткани и жидкости организма. Концентрация препарата в крови плода составляет 10%, в молоке родильниц до 50% уровня в сыворотке крови. Антибиотик связывается сывороткой крови на 40 - 60%. Препарат выделяется желчью на 20 - 30% от введенной дозы, с мочой на 8 - 15%. Суточная доза препарата для приема внутрь составляет 0,8 - 2,0 г. Эритромицина фосфат вводится внутривенно в суточной дозе 0,6 - 1,0 г.
Олеандомицина фосфат - аналогичен по антимикробному спектру эритромицину, но менее активен в отношении бруцелл, гонококков и менингококков. Препарат концентрируется в печени, селезенке, поджелудочной железе, молочных железах, связывается белками крови на 30 - 60%. Препарат экскретируется мочой и желчью. В клинике применяется олеандомицина фосфат в суточной дозе 1 - 2 г. Наибольшее применение в клинической практике находят комбинированные препараты - олеандомицина с тетрациклинами - олеотетрин и олеоморфоциклин.
Олеотетрин - комбинация олеандомицина фосфата с тетрациклином в соотношении 1:2 - обладает широким спектром антимикробного действия, бактериостатическим типом действия на микробную клетку. Препарат хорошо всасывается, быстро создавая терапевтические концентрации в жидкостях и тканях организма, не обладая кумулятивным действием. Суточная доза составляет от 1,0 до 2,0 г энтерально или внутривенно.
Олеоморфоциклин - (комбинация олеандомицина с морфоциклином в соотношении 1:1,5) - активен в отношении грамположительных и грамотрицательных микроорганизмов, используется при тяжелом течении инфекций, вызванных чувствительными к олеандомицину и тетрациклинам; возбудителями. Применяется внутривенно в разовой дозе 0,25 г с интервалом в 8 - 12 часов.
Сходны с макролидами по спектру антимикробной активности и механизму действия на микробную клетку линкомицин и фузидин.
Линкомицин гидрохлорид отличается от макролидов отсутствием активности в отношении энтерококков, гонококков, менингококков, связывается белками сыворотки крови до 25%, хорошо всасывается при энтеральном и внутримышечном введении. Максимальная концентрация в крови определяется через 2 - 4 часа. Препарат проникает в ткани и органы, до 65% уровня в сыворотке матери, определяется в крови плода и проникает в больших количествах в материнское молоко (50 - 70%). Выделяется с мочой до 30% после приема внутрь в течение 24 часов. Антибиотик применяют внутрь и парентерально в суточной дозе 1,5 г.
Фузидин обладает преимущественной активностью в отношении грамположительных и грамотрицательных кокков, в основном, действуя на полирезистентные штаммы стафилококка, гонококка и менингококка. Препарат хорошо всасывается при применении внутрь и сохраняется на терапевтическом уровне до 24 часов, проникая в органы и ткани. Наибольшая концентрация препарата обнаруживается в печени. Препарат связывается белками крови до 90%. Фузидин в основном экскретируется из организма желчью, с мочой выводится 0,1% препарата. Суточная доза составляет 1,5 г внутрь. Препарат не обладает аллергизирующим действием.
Антибиотиками выбора при стафилококковой инфекции могут быть ристомицин и рифампицин.
Ристомицина сульфат активен в отношении грамположительных кокков, мало связывается белками сыворотки крови и обладает бактерицидным типом действия. Недостатком препарата является внутривенный путь введения, при котором возможно развитие флебитов и тромбофлебитов. Препарат хорошо проникает в почки, селезенку, легкие, где создаются концентрации, превышающие количество антибиотика в крови. Выведение препарата из организма осуществляется почками (до 80% за 36 - 60 часов). Суточная доза ристомицина сульфата составляет от 1000000 до 1500000 ЕД. Препарат чаще назначается при тяжелых септических стафилококковых процессах после отсутствия эффекта от лечения другими антибиотиками.
Рифампицин - полусинтетическое производное рифампицина, активен в отношении грамположительных и грамотрицательных микроорганизмов и микобактерий.
При приеме внутрь в дозе 150 мг препарат всасывается быстро и сохраняется на терапевтическом уровне в течение 8 - 12 часов, хорошо проникает в жидкости и ткани организма (ткань печени, желчь и т.д.), на 75 - 80% связывается белками сыворотки крови. Выводится из организма с желчью и мочой. Суточная доза составляет 600 мг при тяжелом течении болезни она может быть увеличена до 900 - 1200 мг.
В связи с быстрым развитием резистентности к препарату рекомендуется применить антибиотик в комбинациях с другими препаратами (бета-лактаминами, налидиксовой кислотой).
Тетрациклины - эта группа антибиотиков обладает широким антимикробным спектром, активна в отношении грамположительных и грамотрицательных микробов, спирохет, лептоспар, крупных вирусов; проявляет бактериостатический тип действия на микробную клетку.
Тетрациклиновые препараты (тетрациклина гидрохлорид, окситетрациклина гидрохлорид) при приеме внутрь всасывается неполностью, часть их выделяется в неизмененном виде с калом. При энтеральном введении терапевтические концентрации сохраняются в крови в течение 6 - 8 часов. При повторном введении возможна кумуляция антибиотиков, они хорошо проникают в плевральную жидкость, в молоко родильниц, в печень, почки, селезенку, легкие, проходят через плацентарный барьер.
Тетрациклины выводятся из организма почками путем клубочковой фильтрации. В клинической практике используется тетрациклина гидрохлорид для внутримышечного введения в суточной дозе 150 - 300 мг и окситетрациклина гидрохлорид для парентерального введения, максимальная суточная доза которого не должна превышать 300 мг.
Из новых производных тетрациклинов нашли широкое применение в акушерской практике морфоциклин, вибрамицин (доксициклин), метациклин (рондомицин).
Морфоциклин сходен по антимикробной активности с тетрациклином. При внутривенном введении создает высокие концентрации в крови, хорошо проникает в органы и ткани, проходит через плацентарный барьер. До 90% препарата выводится с мочой. Суточная доза антибиотика составляет 150 - 300 мг. Путь введения только внутривенный.
Вибрамицин (доксициклин) отличается пролонгированным действием, антимикробная активность в отношении стафилококков и энтерококков выше других тетрациклинов. Антибиотик на 93% связывается белками крови. Препарат хорошо всасывается в кишечнике. Терапевтические концентрации сохраняются в крови в течение 24 часов и более, при повторном введении наблюдается кумуляция в крови. За сутки выводится с мочой до 42% препарата. Суточная доза антибиотика 200 мг в первый день и 100 мг в последующие дни. Применяется энтерально и внутривенно.
Метациклина гидрохлорид (рондомицин) активен в отношении тех же микроогранизмов, что и другие тетрациклины. Отличие заключается в быстром всасывании после энтерального введения и длительном сохранении терапевтической концентрации в крови. Суточная доза антибиотика составляет 600 мг.
Отдельную группу составляет левомицетин (хлорамфеникол), который обладает широким антимикробным спектром (грамположительные и грамотрицательные микроорганизмы, риккетсии, спирохеты, некоторые крупные вирусы), бактериостатическим действием на микробную клетку.
Антибиотик при энтеральном и парентеральном введении быстро и полно всасывается, терапевтические концентрации поддерживаются в крови в течение 6 - 8 часов. Препарат хорошо проникает в жидкости и ткани организма, проходит через гемато-энцефалический барьер и плаценту. Левомицетин выводится из организма с мочой, причем около 10% - в не измененном виде и 80% в виде лишенных антибиотической активности метаболитов, с желчью (3%) и калом (1 - 3%) - Максимальная суточная доза препарата составляет 3,0 - 4,0 г при приеме внутрь и 1,5 - 4,0 при парентеральном введении. Для парентерального введения применяется левомицетин сукцинат натрия (хлороцид C).
Аминогликозиды в последние годы находят все большее практическое применение в связи с появлением новых препаратов этой группы (канамицин, гентамицин).
Неомицин - антибиотик антимикробного спектра действия, но мало активен в отношении стрептококков и не действует на большинство штаммов синегнойной палочки, механизм действия на микробную клетку бактерицидный. В настоящее время используется в основном местно, в виде аэрозоля - неотизоль. Неомицина сульфат применяется внутрь в дозе 2,0 - 4,0 г в сутки.
Канамицин - высоко активен в отношении грамотрицательных и грамположительных микроорганизмов, но мало или совсем не активен против энтерококка, стрептококка, синегнойной палочки, анаэробов. Препарат относится к бактерицидным антибиотикам. При приеме внутрь плохо всасывается в кровь, поэтому, в основном, применяется внутримышечно. Антибиотик не связывается с белками крови. Терапевтические концентрации в крови поддерживаются в течение 8 часов. Препарат проходит через плаценту, проникает в материнское молоко, желчь. Канамицин выводится из организма путем клубочковой фильтрации 50 - 80% препарата и лишь 0,15 - 0,5% с желчью. В клинике применяют канамицин сульфат в суточной дозе 1 - 2 г.
Гентамицин - отличается по спектру антимикробного действия от канамицина тем, что высоко активен в отношении синегнойной палочки, стафилококка, кишечной палочки.
Препарат действует бактерицидно и на 25 - 30% связывается белками крови. При внутримышечном введении терапевтические концентрации сохраняются в крови в течение 6 - 8 часов. При повторных введениях наблюдается кумуляция препарата в крови. Особенностью антибиотика является его способность проникать через гематоэнцефалический барьер. Препарат проходит через плацентарный барьер и в молоко матери. В желчи антибиотик не обнаруживается, выделяется почками. Гентамицина сульфат применяется внутривенно или внутримышечно в суточной дозе 0,8 - 1,8 мг/кг веса.
Противогрибковые антибиотики в клинической практике весьма часто применяются при антибактериальной терапии для предупреждения или лечения кандидозов.
Нистатин представляет практический интерес в связи с активностью против грибков рода кандида, однако, при энтеральном введении фунгистические концентрации в сыворотке крови определяются лишь при дозе 6000000 ЕД и более.
Антибиотик мало токсичен, при приеме внутрь больших доз возможно появление тошноты, рвоты, расстройство стула.
Леворин - активен в отношении дрожжеподобных грибков и некоторых простейших (трихомонад). Препарат применяется внутрь в суточной дозе 1500000 ЕД и местно в виде 5% мази или водных суспензий. Его применение противопоказано при заболеваниях печени, острых желудочно-кишечных заболеваниях и язвенной болезни желудка и 12-перстной кишки.
антибактериальных препаратов
Основные требования к рациональному выбору антибактериального препарата сводятся к определению лабораторных показателей (вид возбудителя и его антибиограмма), фармакологической характеристики препарата (полнота всасывания и характер распределения связывания белками сыворотки, концентрации в органах и выведение из организма), особенностей клинического течения заболевания (характер и степень тяжести, локализация процесса, состояние иммунологических сил организма и т.д.).
При равной чувствительности возбудителя заболевания к различным антибиотикам выбор препарата для лечения основан на сравнении свойств - характера действия на микробную клетку, степени токсичности, особенностей и частоты побочных реакций, а также клинических показаний с учетом имеющихся лекарственных форм препаратов.
В настоящее время лечение в большинстве случаев целесообразнее начинать с назначения одного антибиотика. В тех случаях, когда требуется немедленное применение антибиотиков для ориентации врача в отношении микроорганизмов, вызвавших инфекционное осложнение, возможно использовать бактериоскопию патологического материала с окраской по Граму с одновременным посевом для выделения возбудителя. При инфекциях с тяжелым течением следует начинать с применения бактерицидно действующих антибиотиков, а затем при необходимости продолжения антибиотикотерапии переходить на бактериостатически действующие препараты.
Комбинации антибиотиков применяются в следующих случаях:
1. При тяжелом течении инфекции, когда не уточнен диагноз и не известен возбудитель заболевания.
2. При смешанных инфекциях.
3. При необходимости использования антибиотиков, обладающих токсическим эффектом с целью предупреждения токсического действия (применение препаратов в меньших дозах).
4. С целью предупреждения формирования резистентности бактерий.
В результате комбинации антибиотиков возможно получение синергического, аддитивного, индифферентного и антагонистического эффекта.
При сочетании бактериостатических антибиотиков достигается аддитивный эффект, бактерицидных с бактериостатическими - антагонистический эффект, бактерицидных препаратов - синергический. На основе этих положений при сочетанной антибактериальной терапии следует максимально придерживаться принципа Джаветса, т.е. комбинировать препараты с одинаковым типом действия на микробную клетку. В настоящее время выпускаются готовые формы некоторых комбинаций, которые основаны на указанном принципе: ампиокс (ампициллин + оксациллин), олететрин (олеандомицин + тетрациклин), олеморфоциклин (олеандомицин + морфоциклин).
действия антибиотиков
Антибиотик | Энтерально | Путь введения и дозы | |
внутримышечно | внутривенно | ||
1 | 2 | 3 | 4 |
Бактерицидные | |||
Пенициллин | 500 тыс. - 1 млн. ед. | 500 тыс. - 1 млн. ед. | |
Метициллин | 0,5 - 1,0 г | 0.5 - 1,0 г | |
Оксациллин | 0,5 - 1,0 г | 0,5 - 1,0 г | 0,5 - 1,0 г |
Ампициллин | 0,5 - 1,0 г | 0,25 - 1,0 г | 0,25 - 1,0 г |
Карбенициллин | 1,0 г | 1,0 г | |
Цепорин | 0,5 - 1,0 г | 1,0 г | |
Кефзол | 0,5 - 1,0 г | 1,0 г | |
Неомицин | 0,2 - 0,5 г | ||
Канамицин | 0,5 - 1,0 г | ||
Гентамицин | 40 - 80 мг | ||
Ристомицин | 250 - 500 тыс. | ||
Бактериостатические | |||
Эритромицин | 0,1 - 0,5 г | 200 мг | |
Олеандомицин | 250 мг | 250 - 500 мг | 500 мг |
Линкомицин | 500 мг | 500 мг | |
Фузидин | 500 мг | ||
Рифампицин | 300 мг | ||
Тетрациклина гидрохлорид | 500 мг | 50 - 100 мг | |
Окситетрациклина гидрохлорид | 250 мг | 100 мг | |
Морфоциклин | 150 мг | ||
Метациклин (рондомицин) | 150 - 300 мг | ||
Вибрамицин (доксициклин) | 100 - 200 мг | 100 мг | |
Левомицетин (хлорамфеникол) | 0,5 г | 0,5 - 1,0 г | |
Примечание: совместное применение мономицина, канамицина и гентамицина противопоказано.
во время беременности
Инфекционные заболевания во время беременности представляют серьезную опасность как для матери, так и для плода.
В связи с этим возникает необходимость назначения антибиотиков для лечения инфекционных заболеваний во время беременности. Известно, что плацентарный барьер является препятствием для перехода некоторых лекарственных препаратов от матери к плоду. Однако, проницаемость плаценты меняется в зависимости от срока беременности. Выбор антибиотика для лечения зависит от срока беременности, данных их трансплацентарного перехода с учетом возможного эмбриотоксического и тератогенного действия. Установлено, что пенициллин и его полусинтетические производные проникают через плацентарный барьер. Пенициллин легко проникает во все ткани и органы плода, причем переход антибиотика к плоду увеличивается в поздние сроки беременности.
Полусинтетические пенициллины (метициллин, оксациллин, ампициллин), проникает через плаценту в ткани и органы плода, околоплодные воды, определяются на более низком уровне, чем в крови матери. С увеличением срока беременности проницаемость плацентарного барьера снижается для оксациллина, а для ампициллина, который кумулируется в околоплодных водах в конце беременности и в родах, увеличивается; карбенициллин проникает через хорион на ранних сроках, а при больших дозировках проникает в околоплодные воды.
Имеются сообщения о способности цефалоспоринов проникать через плацентарный барьер и накапливаться в крови в околоплодных водах.
Антибиотики - макролиды и близкие к ним ристомицин и линкомицин обладают способностью трансплацентарного перехода. Количество линкомицина в крови плода составляет 65% от уровня его в крови матери. По мере прогрессирования беременности повышается проницаемость плаценты для эритромицина фосфата и ристомицина сульфата. Аналогичные результаты получены для фузидина, который проникает через плаценту в различные сроки беременности, особенно в поздние сроки, причем при многократном введении препаратов способен кумулироваться в организме матери и плода.
Антибиотики тетрациклиного ряда проникают через плацентарный барьер и в период органогенеза, замедляют развитие плода и плаценты, вызывая внутриутробную его гибель.
Антибиотики - аминогликозиды проходят через плацентарный барьер. Стрептомицин легко проходит через плаценту, а переход канамицина ограничен, но усиливается в конце беременности. Концентрация гентамицина в крови плода составляет 70% от его уровня в крови матери в конце беременности, причем количество препарата в крови плода достаточно для получения бактерицидного действия.
Пенициллин и его полусинтетические производные в терапевтических дозах не оказывают тератогенного или эмбриотоксического действия, лишь при назначении массивных доз оксациллина может наблюдаться эмбриотоксический эффект.
Аналогичное влияние наблюдается при прямом воздействии фузидина (высокие концентрации) на эмбрионы. Использование тетрациклинов в I триместре беременности может отразиться на развитии костного скелета плода и его зубов, в последнем триместре происходит замедление роста плода, вследствие отложения препаратов в костях, а у детей отмечается увеличение частоты кариеса.
Применение левомицетина во время беременности противопоказано ввиду его способности к кумуляции, гепатотоксичности, угнетения эритропоэза. Опасен "серый синдром у новорожденных" при лечении левомицетином беременных. Аминогликозиды в терапевтических дозах не оказывают влияния на плод, однако, описаны случаи внутриутробной интоксикации плода и рождения глухих детей.
При лечении инфекционных заболеваний во время беременности можно применять следующие группы антибиотиков: пенициллин и его полусинтетические производные, цефалоспорины, из которых цефалоридины с осторожностью, макролиды с учетом анамнеза беременных в плане заболеваний печени и кроветворных органов, нарушение функций которых является противопоказанным для применения макролидов, фузидина, линкомицина.
Выбор антибиотиков должен производиться с учетом срока беременности, основываясь на данных о возбудителе инфекционного процесса и его антибиограммы.
Не следует применять во время беременности тетрациклины, рифампицин, левомицетин и аминогликозиды из-за их эмбриотоксического, тератогенного и других побочных эффектов.
Нецелесообразно назначение максимальных доз и длительных курсов лечения для препаратов, обладающих способностью кумулироваться в организме плода, вследствие возникновения эмбриотоксического действия.
гнойно-септических заболеваний
Антибиотикотерапия послеродовых инфекционных заболеваний является ведущей в комплексном лечении.
В зависимости от степени тяжести заболевания, помимо антибактериальных средств, необходимо вводить препараты, повышающие специфический и неспецифический иммунитет организма, проводить дезинтоксикационную, десенсибилизирующую и витаминотерапию, коррегировать нарушения обменных процессов, производить хирургические операции (по показаниям), назначать противогрибковые препараты.
послеродовых инфекционных заболеваний
Послеродовая язва. Возбудителем инфекционного процесса могут быть различные грамположительные и грамотрицательные микробы. Исходя из чувствительности возбудителя заболевания, может быть применена местно аэрозоль с антибиотиками-неотизоль, которая наносится на инфицированную поверхность ежедневно или 2 - 3 раза в сутки, до появления грануляции.
Послеродовой эндомиометрит в большинстве случаев вызывается патогенным стафилококком, кишечной палочкой, стрептококком или их ассоциациями. С целью предупреждения распространения инфекции за пределы матки назначают антибиотики в зависимости от данных антибиограммы в больших дозах и парентерально. Возможно назначение полусинтетических пенициллинов или цефалоспоринов в суточных дозах 4 - 6 г с интервалами введений через 4 - 6 часов, макролиды в суточных дозах до 1,0 г через 4 - 6 часов и сходных с ними по антимикробному спектру антибиотиками (линкомицин по 500 мг 2 - 3 раза в день), аминогликозидов (канамицин по 0,5 - 1,0 г 2 раза в сутки, гентамицин по 40 - 80 мг 2 - 3 раза в сутки).
Перитонит после кесарева сечения чаще вызывается грамотрицательными микроорганизмами или микробными ассоциациями. В большинстве случаев после оперативного вмешательства рекомендуется проведение перитонеального диализа с аминогликозидами (канамицина сульфат 1,0 г или гентамицина сульфат 10 мг на 1 литр диализирующего раствора) с одновременным и последующим введением выбранных для диализа препаратов в суточной дозе - канамицин 2,0 г или гентамицин 160 мг или цефалоспоринов от 4 до 6 г в сутки. При получении результатов антибиограммы в случае необходимости следует внести изменения в назначении антибиотиков. Продолжительность курса лечения аминогликозидами рекомендуется не более 10 - 14 дней при постоянном контроле за состоянием органа слуха и функции почек. После этого производят смену антибиотиков согласно данным о чувствительности возбудителя заболевания.
Послеродовой сепсис чаще вызывается патогенным стафилококком, кишечной палочкой, стрептококком или анаэробными микроорганизмами. Лечение начинается с парентерального введения массивных доз бактерицидных антибиотиков, причем каждые 2 - 3 недели необходимо проводить смену препаратов с последовательным назначением бактерицидных и бактериостатических антибиотиков. Следует помнить, что при анаэробном сепсисе антибиотиком выбора является бензилпенициллин, назначаемый в "Мега" дозах (30 - 40 млн. ЕД внутривенно капельно), в сочетании со специфической терапией. При необходимости смены препарата можно применять полусинтетические пенициллины (метициллин, карбенициллин) или макролиды в максимальных суточных дозах: (12,0 г или 2,0 - 1,6 г соответственно), а также цефадоспорины или тетрациклины.
При эндотоксическом шоке назначаются пенициллин или полусинтетические пенициллины широкого спектра действия (ампициллин, карбенициллин), левомицетин, тетрациклин. Препараты аминогликозидной группы применяются под контролем концентрации антибиотиков в крови, доза и интервалы введения изменяются в зависимости от состояния функции почек (уменьшают дозы и увеличивают интервалы введения).
Послеродовой мастит чаще вызывается стафилококком или ассоциациями его с грамотрицательными микроорганизмами. Антибактериальное лечение при стафилококковой инфекции следует проводить путем парентерального введения полусинтетических пенициллинов (метициллин, оксациллин в разовых дозах 1,0 г с интервалами введения 4 - 6 часов), макролидов (эритромицин, олеандомицин в дозе до 2,0 г в сутки), линкомицин в дозе 0,5 г 3 раза в день, фузидин 1,5 г в день, при смешанной инфекции применяется ампиокс или цефалоридин, или цефазолин в дозах 2 - 4 г в сутки в зависимости от тяжести заболевания, левомицетин по 1,0 г 3 раза в день под контролем анализов крови, гентамицин в суточной дозе 160 - 320 мг, канамицин - 1,0 - 2,0 или тетрациклины.
Родильницам с отягощенным инфекционным анамнезом (сепсис в анамнезе, хронические гнойные процессы, длительный безводный период в родах и т.д.) рекомендуется применение антибиотиков, исходя из предполагаемого возбудителя заболевания. Сразу после оперативных родов, с целью предупреждения развития инфекционных осложнений, препараты назначаются в средних терапевтических дозах.
В процессе терапии может проявляться побочное действие антибиотиков.
Побочные реакции делятся на 3 группы: аллергические, токсические и биологические.
Аллергические реакции возникают независимо от дозы препарата и по скорости их развития и течения делятся на три группы: острые, которые развиваются мгновенно после введения антибиотиков; подострые, возникающие в течение 1-х суток, и затяжные, проявляющиеся в течение нескольких суток и недель после лечения.
Токсические реакции могут возникать при применении различных антибиотиков и выраженность их находится в зависимости от дозы, метода введения, длительности курса и состояния организма больного.
К биологическим побочным явлениям, связанным с химиотерапевтическим действием антибиотиков, относится развитие суперинфекции, дисбактериоза, авитаминоза, реакций бактериолизиса - реакция Яриша Герксгеймера ("терапевтический шок"), возникновение рецидивов или повторных заболеваний.
С целью профилактики аллергических реакций при применении антибиотиков необходимо выполнять следующие требования:
1. Тщательно собирать анамнез с учетом реакций на применение антибиотиков, в прошлом, аллергических заболеваний, дерматозов.
2. Использовать тесты определения повышенной чувствительности к данному препарату у больных с отягощенным аллергическим и фармакотерапевтическим анамнезом.
3. Избегать профилактического назначения антибиотиков, необоснованных комбинаций препаратов, особенно у лиц, страдающих аллергическими реакциями.
4. Избегать местного применения антибиотиков без четких показаний.
5. Следить за состоянием больного в течение 30 минут после первого введения антибиотиков.
6. Иметь в каждом отделении набор лекарственных средств для оказания экстренной помощи при возникновении анафилактического шока или других аллергических реакций (димедрол, эфедрина гидрохлорид, кальция хлорида, адреналин, кофеин-бензоат натрия, кордиамин, мезатон, кортикостероиды и стерильный шприц с иглой).
В случае появления аллергических реакций в зависимости от тяжести их течения, необходимо немедленно назначать антигистаминрые препараты (димедрол, супрастин, пипольфен, тавегил, витамин B5 (кальция пантотенат), кортикостероиды (гидрокортизон, преднизолон), сосудистые средства (эфедрина гидрохлорид, адреналин, мезатон, кофеин-бензоат натрия, кордиамин).
Путь введения препаратов также зависит от степени тяжести аллергических реакций (при анафилактическом шоке препараты в основном вводятся внутривенно).
Для антибиотиков группы пенициллина характерны аллергические явления. Общее токсическое действие проявляется редко при введении очень больших доз пенициллина и выражается в нейротоксическом действии на центральную нервную систему и нефротоксическом влиянии на функцию почек. Назначение метициллина в больших дозах может сопровождаться угнетением функций костного мозга (нейтрофилопения, агранулоцитоз), развитием нефропатии с явлениями интерстициального нефрита. Опасность токсического действия препарата повышается при почечной недостаточности.
При приеме оксациллина внутрь могут возникнуть диспептические расстройства, в отдельных случаях проявляется гепатотоксическое действие (повышение уровня трансаминаз - глютаминовой и щавелевоуксусной кислот).
Ампициллин обладает низкой токсичностью, редко возникают экзантемы, при приеме внутрь развивается дисбактериоз.
Карбенициллин мало токсичен, иногда отмечается болезненность в месте инъекций, диспептические расстройства и нейротоксические явления.
Антибиотики группы цефалоспоринов редко вызывают побочные реакции, которые проявляются в нефротоксичности при нарушении функции почек при назначении больших доз препарата.
Для антибиотиков группы макролидов не характерно общетоксическое действие и аллергизация. При длительном применении возможны реакции типа холестатической желтухи.
При назначении линкомицина может появляться биологическое побочное действие, выражающееся в диарее и язвенном псевдомембранозном колите.
При лечении ристомицином сульфатом возможно развитие аллергических реакций, местная болезненность, нейтропения, анемия, токсическая тромбопения, эозинофилия, а также встречаются ото- и нефротоксические реакции.
Рифампицин редко вызывает побочные реакции, которые заключаются в диспептических расстройствах и нарушении функции печени (лекарственная желтуха).
Антибиотики группы тетрациклинов часто вызывают аллергические реакции (разнообразные экзантемы и др.); осложнения токсического генеза встречаются реже (токсическое поражение кожи слизистой, медикаментозные гастриты, нарушения функции печени, токсическая гранулопения и повышение внутричерепного давления ликвора); также наблюдается эмбриотоксическое и тератогенное действие тетрациклинов. При лечении тетрациклинами возможно тяжелое проявление дисбактериоза (стоматиты, энтероколиты, колиты).
Левомицетин может оказывать токсическое действие на костный мозг. При назначении больших доз антибиотика возможно возникновение агранулоцитоза и нейтропении, апластической или гипопластической анемии, тромбопенической пурпуры, а также нарушение функции центральной нервной системы (психомоторные расстройства, спутанность сознания, зрительные и слуховые галлюцинации) и функции кровообращения (цианоз, экстрасистолия, снижение артериального давления).
При назначении антибиотиков группы аминогликозидов встречаются редко аллергические реакции. Побочные действия аминогликозидов проявляются в ото- и нефротоксичности. В процессе лечения этими препаратами необходимо проводить функциональное исследование слуховых нервов; острота слуха, камертональные пробы Ринне и Вебера, а при возможности аудиологическое исследование (порог звукового восприятия), костная и воздушная проводимость и систематический контроль функции почек.
Согласно рекомендаций Всесоюзного центра по изучению побочного действия лекарственных средств Минздрава СССР определение сенсибилизации организма к выбранному для лечения антибиотику проводится поэтапно у больных группы риска на возникновение аллергического шока.
Последовательное проведение контактных проб следующее:
1) капельные или аппликационные пробы;
2) скарификационные или сублингвальные пробы;
3) внутрикожная проба.
При отрицательных результатах всех проб возможно введение терапевтических доз препарата.
У больных с наиболее высокой степенью риска контактные пробы на первом этапе противопоказаны. Выявление гиперчувствительности к антибиотику необходимо начинать с проведения иммунологических лабораторных исследований (лейколизиса, реакции аггломерации лейкоцитов и др.). При получении отрицательных результатов лабораторных исследований проводятся контактные пробы в указанной выше последовательности.
С целью профилактики токсических реакций при назначении антибиотиков следует обращать серьезное внимание на функции печени, почек, кровообращения, состояние обменных процессов, не допускать превышения суточных доз препаратов, не применять комбинации антибиотиков и их последовательное назначение при наличии у них ото- и нефротоксического действия.
В случае появления токсического действия препарата его необходимо немедленно отменить. Если дальнейшее применение антибиотиков необходимо, следует подобрать препараты, обладающие минимальной токсичностью. В большинстве случаев токсическое действие препаратов ликвидируется в ближайшие дни после прекращения лечения.
Профилактика биологических осложнений антибиотикотерапии сводится к рациональному применению антибиотиков, сочетанному применению антибактериальных препаратов с антигистаминными и противогрибковыми средствами.
Методические рекомендации подготовлены Московским областным научно-исследовательским институтом акушерства и гинекологии (проф. И.Р. Зак, к.м.н. Г.С. Минасова) и Главным управлением лечебно-профилактической помощи детям и матерям Министерства здравоохранения СССР.
Заместитель начальника
Главного управления
лечебно-профилактической помощи
детям и матерям Министерства
здравоохранения СССР
В.В.КОЧЕМАСОВА
Утверждены
Приказом Минздрава СССР
от 6 декабря 1979 г. N 1230
В РОДОВСПОМОГАТЕЛЬНЫХ УЧРЕЖДЕНИЯХ
Источником сальмонеллезной инфекции в родильных домах и отделениях чаще всего являются больные роженицы (родильницы), реже - персонал, а также заболевшие дети и здоровые бактерионосители. Описаны случаи внутриутробного заражения плода.
Передача возбудителя в очагах внутрибольничного распространения заболеваний происходит нередко "бытовым" путем (через руки персонала и матерей, предметы ухода за детьми, в первую очередь соски, постельное белье, краны умывальников), но чаще инфекция распространяется пищевым путем через инфицированное молоко или растворы для питья (растворы глюкозы, Рингера и пр.). Пищевые вспышки легко распознаются, т.к. носят "взрывной" характер.
Распространение инфекции в родовспомогательных учреждениях возникает, как правило, при недостаточно четком соблюдении правил санитарно-гигиенического и противоэпидемического режима (перегрузка отделений сверх установленных норм, перемещение обслуживающего персонала из одного отделения в другое, несоблюдение персоналом правил личной гигиены, неправильное хранение и стерилизация посуды, в первую очередь бутылочек для молока и сосок, участие в раздаче пищи технического персонала и т.д.).
Способствует распространению инфекции длительное пребывание возбудителя во внешней среде (на предметах ухода, белье, мягком инвентаре, в пыли). Как правило, групповые заболевания, возникающие в родильных домах, обусловлены одним серологическим типом сальмонелл "Тифи-муриум", точнее, его особой разновидностью, отличающейся рядом биологических свойств. Однако известны случаи заболеваний, вызванных и другими серологическими типами.
У новорожденных детей тяжесть и степень выраженности отдельных проявлений сальмонеллеза определяются общим состоянием детей до инфицирования, массивностью инфектдозы, а также сочетанием с условнопатогенными микробами.
При внутриутробном инфицировании признаки заболевания проявляются с первых дней жизни - цианоз, вялость, плохое сосание или отказ от еды - носят генерализованный характер с развитием септических очагов (менингит, остеомиелит, деструктивные поражения легких и др.). Температурная реакция чаще отсутствует, иногда температура достигает 37,5 - 38°. Дисфункция кишечника в начальный период болезни может отсутствовать. Патологический стул (учащенный с примесью бурозеленой слизи, а затем и крови) появляется к концу первой недели или на второй неделе болезни.
При заражении новорожденных во время рождения или после него, инкубационный период колеблется от нескольких часов (при массивном инфицировании) до 2 - 6 дней. Первичными симптомами болезни являются умеренное учащение стула, его бурозеленое окрашивание, с появлением через 2 - 4 дня примеси слизи и, нередко крови. Рвота наблюдается редко, срыгивание и снижение аппетита выявляются у многих детей с 1 - 4 дня болезни.
У доношенных детей с неотягощенным анамнезом явления интоксикации могут быть мало выраженными, дети хорошо сосут, весовая кривая не дает снижения. При несвоевременном начале лечения симптомы болезни могут нарастать - усиливается понос, интоксикация, физиологическое желтушное окрашивание кожных покровов не уменьшается, увеличивается печень и селезенка. Легкие и среднетяжелые формы сальмонеллеза наблюдаются у 60 - 70% новорожденных.
У детей, родившихся недоношенными, с родовой травмой, при одновременном инфицировании их патогенными стафилококками, заболевание с первых дней может принять тяжелое течение. Бурно нарастают явления интоксикации, развиваются циркуляторные расстройства. Кожа приобретает землистый или сероцианотичный оттенок. Стул 3 - 7 раз, в ряде случаев учащен до 10 - 17 раз, жидкий, вначале обильный, а затем скудный с зеленой окраской, с примесью мутной слизи и иногда крови. Температурная реакция (до 37 - 38,5°) выявляется лишь у 40 - 60% заболевших. При тяжелой форме болезни рано развиваются нарушения водно-электролитного и белкового обмена, нарастает интоксикация и метаболический ацидоз, на первой неделе болезни нередко возникают перитонит, менингит, воспаление легких, гнойное поражение кожи, костей.
Диагноз сальмонеллеза подтверждается бактериологическим исследованием испражнений, крови, мочи. У отдельных новорожденных сальмонеллы удается выделить в смывах из зева. У погибших детей на секции сальмонеллы с наибольшим постоянством высеваются из содержимого толстой и тонкой кишки, из желчного пузыря, мезентериальных желез и гнойных очагов.
сальмонеллеза в родовспомогательных учреждениях
С целью предупреждения заноса и распространения сальмонеллеза в родовспомогательных учреждениях должен быть рационально организован и неукоснительно соблюдаться надлежащий санитарно-гигиенический режим.
У беременных женщин, рожениц, поступающих в родовспомогательные учреждения, необходимо собрать анамнез о наличии кишечных заболеваний. Все поступающие с дисфункцией кишечника или предъявляющие жалобы о болезни в последние 2 недели, подвергаются бактериологическому обследованию и обязательно изолируются (в мельцеровском боксе).
В случае поступления роженицы с дисфункцией кишечника, подозрительной на кишечное инфекционное заболевание, в помещении приемного покоя проводится заключительная дезинфекция влажным способом с использованием дезинфицирующих средств (1% раствор хлорамина или 0,5% осветленный раствор хлорной извести) и обработка рук персонала (мытье с мылом и обработка 0,2% раствором хлорамина). Такая же дезинфекция проводится в предродовой и родовой палатах.
В случае появления симптомов энтерита или энтероколита у ребенка или матери, заболевшие немедленно переводятся в отделения соответствующего профиля. За контактными ведется тщательное клиническое наблюдение.
При установлении диагноза "сальмонеллез" все контактировавшие с заболевшими подвергаются бактериологическому обследованию, а сведения о контакте с сальмонеллезным больным передаются участковому врачу педиатру и терапевту, осуществляющему диспансерное наблюдение.
После выписки матерей с детьми постельные принадлежности (подушки, матрацы, одеяла) подлежат обязательной камерной дезинфекции, проводится бак. контроль помещения, отделение подвергается заключительной дезинфекции и генеральной уборке, в соответствии с приказом Минздрава СССР N 288 от 23.03.76 и N 720 от 31.07.78.
Начальник
Главного управления
лечпрофпомощи детям и матерям
Е.И.АНДРЕЕВА