СПРАВКА
Источник публикации
СПб.: Издательство "Лань", 2015
Примечание к документу
Название документа
"Временное наставление по лабораторной диагностике гриппа лошадей"
(рекомендовано Минсельхозом СССР 15.01.1973)
"Временное наставление по лабораторной диагностике гриппа лошадей"
(рекомендовано Минсельхозом СССР 15.01.1973)
Рекомендовано
15 января 1973 года
ВРЕМЕННОЕ НАСТАВЛЕНИЕ
ПО ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ ГРИППА ЛОШАДЕЙ
Грипп лошадей - высококонтагиозное инфекционное вирусное заболевание, характеризующееся коротким инкубационным периодом, кратковременной сильной лихорадкой, общим угнетением, сильным сухим кашлем и конъюнктивитом.
Клинически грипп лошадей трудно диагностировать, поскольку он имеет сходство с другими респираторными заболеваниями лошадей как вирусной, так и невирусной этиологии.
Лабораторная диагностика гриппа лошадей основана на:
1) выделении вируса на развивающихся куриных эмбрионах;
2) идентификации вновь выделенного вируса в реакции торможения гемагглютинации с типоспецифическими гриппозными сыворотками;
3) установлении специфических антител в парных сыворотках животных.
Для лабораторной диагностики используют специальный диагностический набор, который состоит из антигенов и позитивных сывороток.
Антигены представляют собой инактивированную лиофилизированную вируссодержащую аллантоисную жидкость. Антигены готовят из штаммов A Equi-2/Miami/63 и A Equi-1/Cambridge/63, соответствующих двум антигенным разновидностям.
Антигемагглютинирующие - лиофилизированные гипериммунные сыворотки кроликов, полученные на два указанных штамма: A Equi-2/Miami/63 и A Equi-1/Cambridge/63.
А. Взятие, пересылка и подготовка материала
1. С целью выделения вируса используют носовые смывы от больных лошадей в первые 2...3 дня от начала заболевания. Материал из носовых полостей берут стерильными тампонами, смоченными физиологическим раствором поваренной соли. Такими тампонами тщательно протирают носовые ходы, после чего опускают тампоны в пробирки.
2. Если транспортировка материала занимает более 4 ч, тампоны следует поместить в термос со льдом и в таком виде доставить в лабораторию для исследования.
3. В лаборатории тампоны тщательно отжимают. Полученную жидкость, содержащую слизь, обрывки ткани и другие аморфные частицы, центрифугируют при 4 тыс. об/мин в течение 15 мин. Надосадочную жидкость отсасывают в стерильные пробирки, добавляют антибиотики (пенициллин и стрептомицин) по 500 ЕД/мл и выдерживают при 4 °C в течение одного часа, после чего используют для заражения куриных эмбрионов.
Б. Заражение куриных эмбрионов
4. Для заражения используют эмбрионы 9...10-дневного срока инкубации. Для исследования одной пробы материала заражают не менее 6 эмбрионов.
5. Перед заражением эмбрионы предварительно овоскопируют, карандашом на скорлупе отмечают границу воздушного пространства (пуги). Сбоку яйца между кровеносными сосудами отмечают участок для прокола скорлупы и инокуляции испытуемого материала. Отобранные для заражения эмбрионы переносят в бокс. Скорлупу со стороны пуги и участок, где намечено производить прокол и введение материала, тщательно протирают спиртом и обжигают. В центре воздушного пространства и в месте введения материала сбоку пробойником делают отверстия, затем через боковое отверстие на глубину 2...3 мм вводят испытуемый материал в объеме 0,2 мл.
6. После заражения эмбрионов отверстия в скорлупе заливают парафином и переносят их в термостат, где инкубируют в течение 72 ч при температуре 37,5 °C. В процессе инкубации их овоскопируют один раз в сутки, погибшие эмбрионы до вскрытия сохраняют в холодильнике при 4 °C. На третий день инкубации все погибшие и выжившие эмбрионы вскрывают после предварительного их охлаждения при 4 °C в течение 8 ч.
7. Перед вскрытием скорлупу над воздушным пространством дезинфицируют. Затем на границе с пугой стерильными ножницами срезают скорлупу, осторожно пинцетом снимают подскорлупную оболочку, разрывают хорионаллантоис, отгибая в стороны на края скорлупы разорванные участки мембраны. Из одного куриного эмбриона можно собрать 6...9 мл эмбриональной жидкости.
8. Контроль на стерильность взятых образцов эмбриональной жидкости производят путем посева 0,2 мл ее на МПА и МПБ. Посевы выдерживают в термостате в течение 5 сут. Помимо того, взятые из каждого эмбриона образцы эмбриональной жидкости проверяют на гемагглютинирующую активность. При наличии гемагглютинации и отсутствии бактериального загрязнения образец взятой жидкости титруют в реакции гемагглютинации. Если титры ГА выделяемого вируса низки, проводят еще 2...3 дополнительно слепых пассажа его на куриных эмбрионах. При отсутствии ГА активности выделяемого вируса после 2...3 пассажей дальнейшее выделение вируса из данного образца исследуемого материала прекращают.
Идентификацию выделенного вируса проводят в реакции торможения гемагглютинации с заведомо известными типоспецифическими сыворотками вируса гриппа лошадей.
ТОРМОЖЕНИЯ ГЕМАГГЛЮТИНАЦИИ (РТГА)
9. Реакция торможения гемагглютинации применяется для идентификации вновь выделенного вируса, обладающего гемагглютинирующей активностью с заведомо известными специфическими гриппозными сыворотками и для определения специфических антител в сыворотках реконвалесцентов.
10. Для постановки реакции торможения гемагглютинации необходимо иметь типоспецифические сыворотки к вирусу гриппа лошадей; исследуемый гемагглютинирующий вирус; физиологический раствор поваренной соли pH 7,2...7,4; 1%-ную суспензию эритроцитов петуха; доски из плексигласа или бактериологические пробирки; пипетки на 2,0 и 10,0 мл; 30%-ную соляную кислоту; мел; аппарат Киппа.
Типоспецифические сыворотки имеются в диагностическом наборе.
11. В ампулу, содержащую сухую диагностическую сыворотку, добавляют дистиллированной воды в количестве 9 мл, т.е. делают разведение ее 1:10 и пипетируют до полного растворения содержимого.
12. Наличие в иммунных сыворотках ингибиторов к различным серотипам вируса гриппа затрудняет идентификацию вновь выделенных штаммов в реакции торможения гемагглютинации.
13. Для удаления термолабильных ингибиторов разведенную сыворотку прогревают на водяной бане при 60 °C в течение 30 мин.
14. Для осаждения термостабильных ингибиторов через разведенную и прогретую сыворотку пропускают углекислый газ (CO2) из аппарата Киппа (схема 4) в течение 2...3 мин или опускают в нее кусочки твердой углекислоты. После обработки углекислотой сыворотку центрифугируют в течение 5 мин при 2 тыс. об/мин. После чего сыворотку используют в реакции торможения гемагглютинации для идентификации вируса.
15. Для получения 1%-ной суспензии эритроцитов используют петухов старше 6 мес.
16. Взятие крови у петухов производят из подкрыльцовой вены, набирают пипеткой необходимое количество крови в стеклянную баночку с физиологическим раствором и 2,5%-ным раствором лимоннокислого натрия.
17. Полученную кровь трижды отмывают физиологическим раствором, осаждая на центрифуге в течение 10 мин при 1500 об/мин.
18. Из осадка отмытых эритроцитов готовят 1%-ную суспензию, которую хранят при 4 °C не более 4 сут.
19. Реакция гемагглютинации является подготовительным этапом в постановке реакции торможения гемагглютинации.
20. Вначале готовят двукратные разведения вируссодержащего материала от 1:2 до 1:1024. Для этого в ряд лунок или пробирок (рис. 9) наливают физиологический раствор в объеме 0,2 мл. Затем в первую лунку вносят по 0,2 мл вируса, трехкратно пипетируют и переносят 0,2 смеси во вторую и так далее до требуемого разведения. Из последней лунки 0,2 мл смеси удаляют в дезинфицирующий раствор.
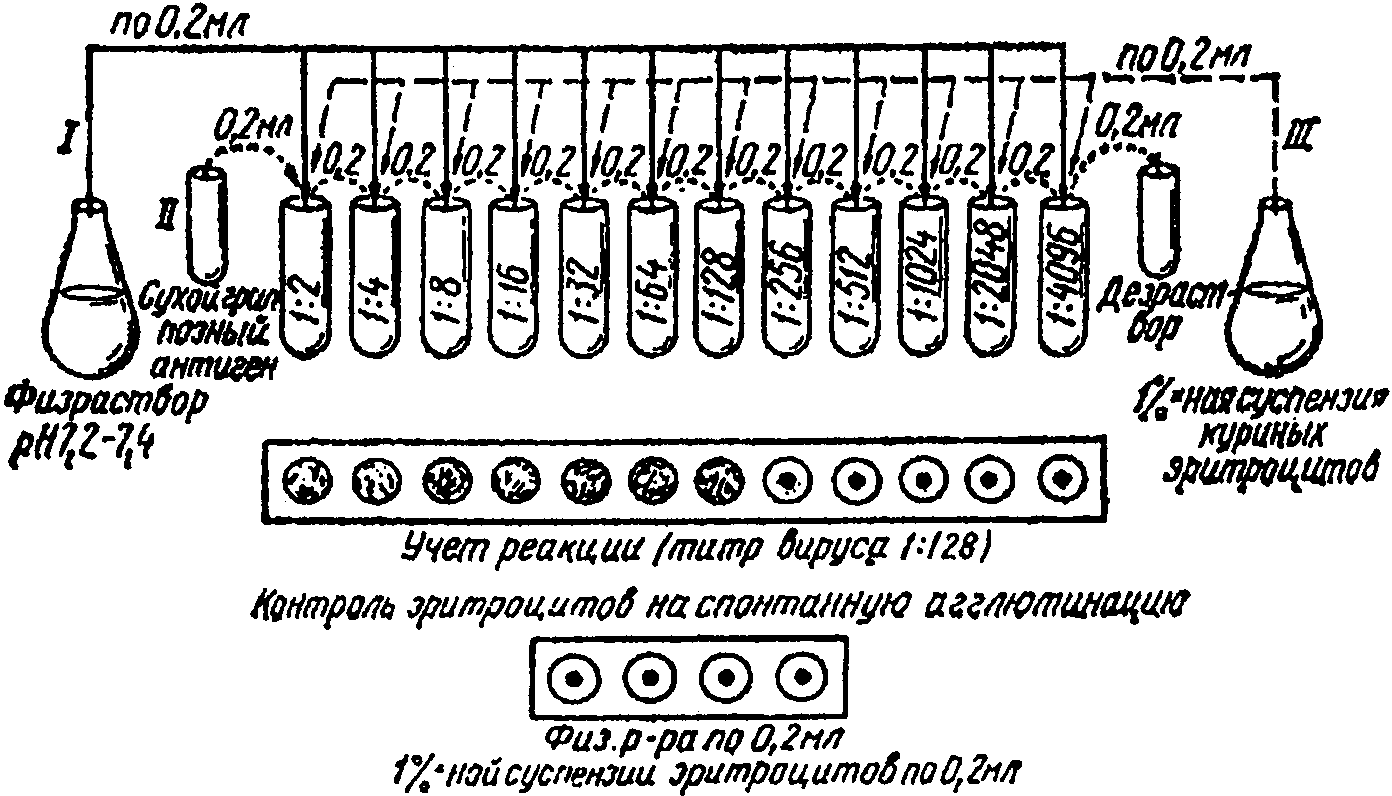
Схема постановки реакции гемагглютинации
21. В каждую лунку добавляют по 0,2 мл 1%-ной суспензии эритроцитов. Необходимо ставить контроль на спонтанную агглютинацию эритроцитов (к 0,2 мл физиологического раствора добавляют 0,2 мл 1%-ной суспензии эритроцитов).
22. Доски с лунками встряхивают и оставляют при комнатной температуре, учет реакции проводят через 30 мин.
23. Положительная реакция гемагглютинации оценивается по форме осадка эритроцитов, которые осаждаются не только на дне, но и на стенках, образуя "зонтик". В случае отрицательной реакции так же, как и в контроле, эритроциты оседают под действием тяжести, образуя на дне лунки диск с ровными краями.
24. Титром вируса считается его наибольшее разведение, при котором наблюдается еще и агглютинация эритроцитов, что и соответствует 1 АЕ.
25. После того как определен титр гемагглютинации вновь выделенного вируса, переходят к постановке реакции торможения гемагглютинации. Последняя основана на способности специфических антител нейтрализовать гемагглютинирующую активность вируса.
26. Для постановки реакции торможения гемагглютинации готовят рабочую дозу вновь выделенного вируса, в 0,2 мл которого содержится 4 АЕ вируса. С этой целью исходный вирус разводят физиологическим раствором во столько раз, сколько получают от деления на 4 цифры, указывающей гемагглютинирующий титр. Например, если титр гемагглютинации 1:128, рабочее разведение будет 128 : 4 = 32, т.е. в 0,2 мл разведенного 1:32 вируса будет содержаться 4 АЕ. Для его приготовления необходимо взять 31 мл физиологического раствора и добавить 1 мл исходного вируса. Перед постановкой основного опыта проверяют правильность выбора 4 АЕ. Для этого (рис. 10) берут 5 лунок, в первую и вторую наливают 4 АЕ по 0,2 мл, т.е. выбранное разведение вируса, после чего во вторую, третью, четвертую, пятую лунки наливают по 0,2 мл физиологического раствора. После пипетирования из второй лунки переносят 0,2 мл в третью, из третьей после смешивания 0,2 мл переносят в четвертую, а затем в пятую, из пятой лунки удаляют 0,2 мл смеси в дезинфицирующий раствор. Таким образом, во 2-й лунке остается 2 АЕ вируса, в 3-й - 1 АЕ, в 4-й - 0,5 АЕ, в 5-й - 0,25 АЕ. После этого в каждую лунку добавляют по 0,2 мл 1%-ной суспензии эритроцитов, доски легко встряхивают и оставляют на 30 мин при комнатной температуре. При правильном выборе рабочей дозы (4 АЕ) в 1-й, 2-й, 3-й лунках должна быть полная агглютинация эритроцитов (зонтик); в 4-й лунке агглютинация может быть частичной или отсутствовать, а в 5-й лунке агглютинация не должна быть. Если в 4-й лунке оказывается полная агглютинация, а в 5-й частичная или отсутствует - это означает, что выбранная доза вируса содержит не 4 АЕ, а больше (8 АЕ). В этом случае и доза должна быть соответственно уменьшена вдвое, т.е. следует взять 0,2 мл следующего разведения и повторно проверить рабочую дозу. Особенно важно, чтобы в 3-й лунке, где должна быть 1 АЕ вируса, была бы полная агглютинация. Если в ней агглютинация не полная, то выбранная рабочая доза вируса содержит меньше 4 АЕ в 0,2 мл и должна быть увеличена и повторно проверена.
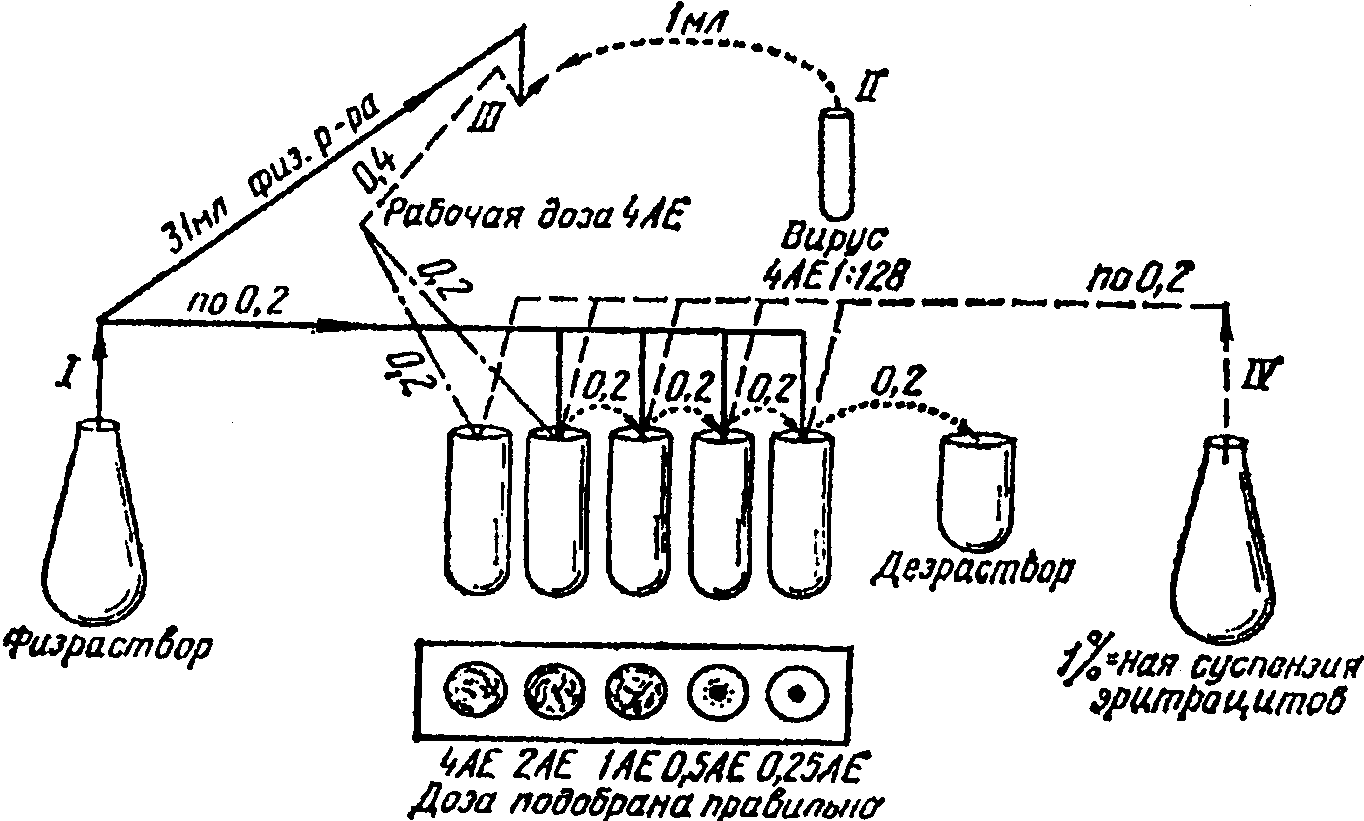
Приготовление рабочей дозы вируса
27. Схема постановки РТГА сводится к следующему (рис. 11): в ряд лунок, начиная со второй, наливают по 0,2 мл физиологического раствора; затем в первую и вторую лунки добавляют по 0,2 мл заведомо известной приготовленной сыворотки в разведении 1:10; во второй лунке пипетируют и переносят 0,2 мл смеси в третью и так далее до разведения 1:2560; из последней лунки удаляют 0,2 мл в дезинфицирующий раствор. После этого во все лунки вносят по 0,2 мл рабочего разведения (4 АЕ) испытуемого вируса. Доски с лунками встряхивают и оставляют при комнатной температуре на 30 мин. После тридцатиминутного контакта сыворотки с вирусом в каждую лунку добавляют по 0,4 мл 1%-ной суспензии эритроцитов.
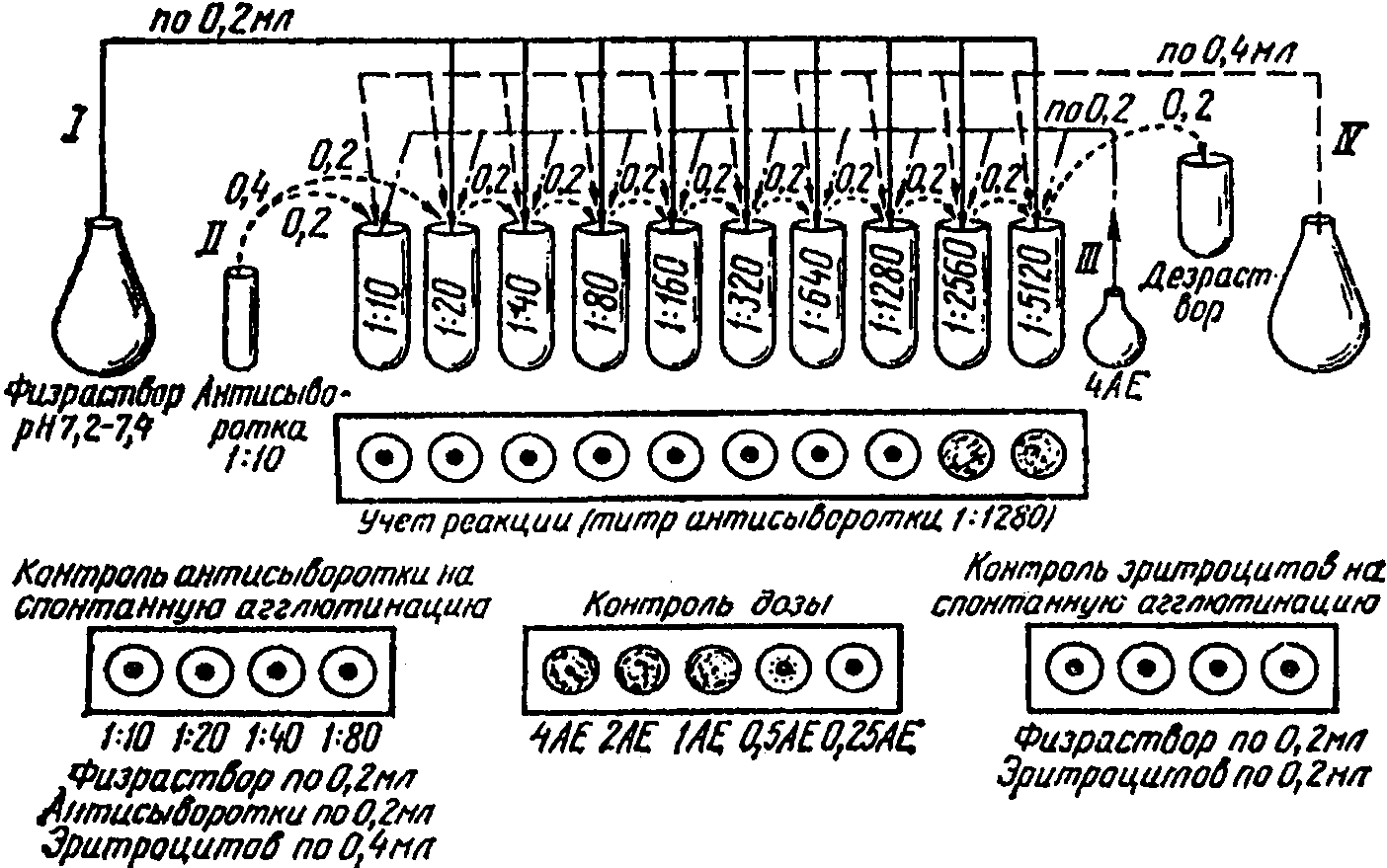
Схема постановки реакции торможения гемагглютинации
28. Для точности учета РТГА ставят контроль:
1) контроль сыворотки для исключения присутствия гемагглютининов к куриным эритроцитам (0,2 мл сыворотки в разведении 1:10, 0,2 мл физиологического раствора и 0,4 мл 1%-ной суспензии эритроцитов);
2) контроль избранной дозы вируса (0,2 мл рабочей дозы вируса (4 АЕ), 0,2 мл физиологического раствора и 0,2 мл 1%-ной суспензии куриных эритроцитов);
3) контроль стандартных диагностикумов (антигена 0,2 мл + 0,2 мл гомологичной сыворотки + 0,4 мл 1%-ной суспензии эритроцитов);
4) контроль эритроцитов на спонтанную агглютинацию (0,2 мл физиологического раствора и 0,2 мл 1%-ной суспензии эритроцитов).
29. Титром сыворотки считается последнее разведение ее, давшее полную задержку гемагглютинации. Идентификацию возбудителя считают завершенной, если заведомо активная диагностическая сыворотка набора тормозит гемагглютинирующую активность испытуемого полевого штамма вируса в пределах целого или 1/2...1/8 титра.
30. На выделение и идентификацию вируса необходимо 3...10 сут.
(АНТИГЕМАГГЛЮТИНИНОВ) В СЫВОРОТКЕ
ПЕРЕБОЛЕВШИХ ЖИВОТНЫХ К ВИРУСУ ГРИППА ЛОШАДЕЙ
31. Изучение парных сывороток в реакции торможения гемагглютинации является ценным и чувствительным методом диагностики, дающим возможность ретроспективно установить этиологию перенесенного заболевания.
32. Парные сыворотки исследуют на 10...14-й день после проявления первых клинических признаков заболевания и на 21-й день после первого взятия сыворотки.
33. Для исследования парных сывороток в реакции торможения гемагглютинации необходимо иметь типоспецифические антигены гриппа лошадей; исследуемые парные сыворотки; физиологический раствор поваренной соли pH 7,2...7,4; 1%-ную суспензию эритроцитов петуха; доски из плексигласа или бактериологические пробирки; пипетки 2,0 и 10,0 мл; 30%-ную соляную кислоту; мел; аппарат Киппа (см. рис. 12).
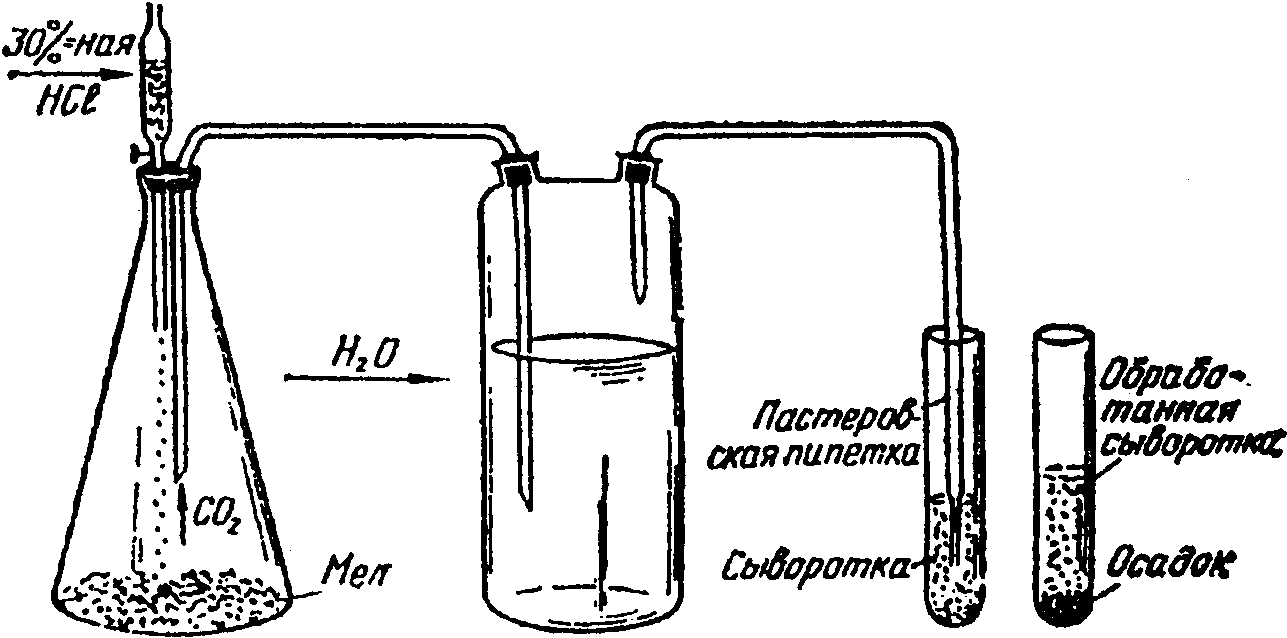
Типы капельных воронок, заменяющих
аппарат Киппа для получения CO2
Типоспецифические сухие гриппозные антигены имеются в диагностическом наборе.
А. Получение и приготовление сывороток
34. Кровь от лошадей берут стерильно в области верхней трети шеи (яремной вены) в пробирки, увлажненные физиологическим раствором. Полученную кровь выдерживают 2...3 ч при комнатной температуре, осторожно по стенке пробирки обводят иглой и ставят в прохладное помещение с температурой не выше 10 °C. Через 12...24 ч сыворотку отсасывают в стерильную пробирку, добавляют мертиолят в количестве 1:20 000.
35. Перед использованием сыворотки в РТГА ее разводят дистиллированной водой 1:10 (т.е. 0,5 мл сыворотки + 4,5 мл дистиллированной воды). Разведенную сыворотку прогревают при температуре 56 °C в течение 30 мин, обрабатывают углекислым газом, как описано в разделе II, А.
36. Приготовление 1%-ной суспензии эритроцитов кур аналогично описанному в разделе II, Б.
37. Постановка реакции гемагглютинации (описана в разделе II, В) с антигеном из ампул, разведенным 1,0 мл физиологического раствора.
Б. Установление специфических антител в сыворотках
животных-реконвалесцентов в реакции торможения
гемагглютинации с помощью типоспецифических
гриппозных антигенов
38. Схема постановки реакции торможения гемагглютинации описана в разделе II, Г.
39. Титром сыворотки считается ее последнее разведение, давшее полную задержку гемагглютинации с одним из заведомо известных антигенов.
40. Штаммовая принадлежность определена, если испытуемая сыворотка тормозит гемагглютинирующую активность диагностического антигена в пределах целого или 1/2...1/8 его титра с гомологичной диагностической сывороткой, при отсутствии реакции с другим антигеном или же в реакции не выше 1:20. Ретроспективно диагноз на грипп может быть поставлен, если частное от деления гемагглютинирующего титра испытуемой сыворотки, взятой на 30-й день после заболевания, на титр сыворотки, взятой в начале заболевания, будет соответствовать четырехкратному увеличению титра сыворотки (1).