СПРАВКА
Источник публикации
"Ветеринарный консультант", 2004, N 5
Примечание к документу
Взамен "Наставления по диагностике паратуберкулезного энтерита (паратуберкулеза) крупного рогатого скота" (приложение N 1 к Инструкции о мероприятиях по профилактике и ликвидации паратуберкулезного энтерита (паратуберкулеза), утв. ГУВ Минсельхоза СССР 18.08.1975, "Наставления по аллергической диагностике паратуберкулеза у овец", утв. ГУВ Минсельхоза СССР 11.08.1981, "Временного наставления по постановке реакции связывания комплемента для диагностики паратуберкулеза крупного рогатого скота и овец с антигеном Сибирского научно-исследовательского ветеринарного института", утв. ГУВ Минсельхоза СССР 31.05.1968.
Название документа
"Наставление по диагностике паратуберкулеза (паратуберкулезного энтерита) животных"
(утв. Минсельхозом России 05.04.2001 N 13-5-02/0050)
"Наставление по диагностике паратуберкулеза (паратуберкулезного энтерита) животных"
(утв. Минсельхозом России 05.04.2001 N 13-5-02/0050)
Утверждаю
Заместитель руководителя
Департамента Ветеринарии
Е.А.НЕПОКЛОНОВ
5 апреля 2001 г. N 13-5-02/0050
НАСТАВЛЕНИЕ ПО ДИАГНОСТИКЕ ПАРАТУБЕРКУЛЕЗА
(ПАРАТУБЕРКУЛЕЗНОГО ЭНТЕРИТА) ЖИВОТНЫХ
1.1. Паратуберкулез (паратуберкулезный энтерит, болезнь Johne) - инфекционная, хронически протекающая болезнь жвачных, преимущественно, крупного и мелкого рогатого скота, верблюдов, северных оленей, вызываемая Mycobacterium paratuberculosis и характеризующаяся поражением кишечника и мезентериальных лимфатических узлов.
Болезнь протекает, в основном, в латентной форме, при переходе в клиническую стадию сопровождается диареей, анемией, истощением и заканчивается, как правило, гибелью животных.
1.2. У зараженных животных развивается состояние повышенной чувствительности (сенсибилизация) к туберкулину для птиц и в крови появляются специфические антитела.
1.3. Исследование на паратуберкулез в благополучных хозяйствах проводят при обнаружении у животных признаков, вызывающих подозрение на заболевание, в неблагополучных хозяйствах - для выявления больных животных.
Диагноз на паратуберкулез устанавливают на основании результатов клинического осмотра животных, аллергического, серологического, бактериоскопического, патологоанатомического и гистологического методов исследования с учетом эпизоотологических данных.
1.4. Диагноз на паратуберкулез считается установленным:
- при наличии у животных характерных клинических признаков болезни и получении одновременно положительных результатов бактериоскопического или гистологического исследования биоматериала от этих животных;
- при обнаружении характерных патологоанатомических изменений в кишечнике и мезентериальных лимфатических узлах животных с гистологическим или бактериоскопическим подтверждением болезни, независимо от наличия или отсутствия клинических признаков заболевания.
1.5. В неблагополучных по паратуберкулезу хозяйствах (стадах, фермах, дворах) больными считают животных:
Крупный рогатый скот:
- с выраженными клиническими признаками болезни независимо от результатов аллергического и серологического исследований;
- при слабо выраженных клинических признаках болезни и одновременно положительном результате серологического или бактериоскопического исследования;
- при отсутствии клинических признаков, но совпадающих положительных результатах аллергического и серологического исследований.
Овцы и козы:
- при наличии клинических признаков болезни, или при положительных результатах аллергического и серологического, или бактериоскопического исследования.
Верблюды:
- при наличии клинических признаков болезни и при положительном результате аллергического или бактериоскопического исследования.
Северные олени:
- при наличии клинических признаков болезни и положительном результате, бактериоскопического исследования.
2.1. У крупного рогатого скота клинические признаки болезни проявляются в возрасте не ранее 3 лет в виде диареи и истощения, у дойных коров наблюдается снижение молочной продуктивности.
По мере развития болезни резко снижается упитанность при сохранении аппетита, глаза западают в глазных впадинах, возникает диарея, в начале перемежающаяся, а затем все более стойкая и изнуряющая. Вследствие постоянных сильных потуг позвоночник изгибается, мышцы таза атрофируются ("шилозадость"). Фекалии жидкие, зеленовато-желтые или коричневые, с пузырьками газа и слизью, иногда с кровью, зловонного запаха. При параличе сфинктера прямой кишки дефекация происходит самопроизвольно, загрязняются хвост, вымя, тазовые конечности. Часто наблюдаются отеки в подчелюстном пространстве и в области подгрудка, взъерошенность волосяного покрова.
2.2. У овец и коз клинические признаки болезни развиваются медленно, основными из них являются сильное истощение при нормальном аппетите с возможным развитием перемежающейся диареи. При отсутствии диареи фекалии менее плотные и не формируются в шарики. Отмечаются подтянутость живота, бледность слизистых оболочек, отеки подчелюстного пространства, подгрудка и живота.
При выраженных клинических признаках животное погибает.
2.3. У верблюдов клинические признаки болезни проявляются, в основном, в возрасте 1 - 3 лет и характеризуются диареей, сильным истощением, синюшностью слизистых оболочек, тусклостью волосяного покрова, вздутием живота, увеличением печени. Кал зловонного запаха, темно-коричневого или землистого цвета, с пузырьками газа. Тазовые конечности и хвост испачканы жидкими каловыми массами, анус вывернут.
Повышения температуры тела не наблюдается. Больные животные стонут, часто ложатся.
2.4. У северных оленей клиническое проявление болезни начинается в возрасте 1,5 - 2,5 лет с постепенного исхудания. Больные животные подбирают задние ноги под живот, позднее появляется постоянная или перемежающаяся диарея.
3.1. Аллергическое исследование животных на паратуберкулез проводят сухим очищенным (ППД) туберкулином для птиц.
Аллергическому исследованию подвергают крупный рогатый скот с 6 мес., овец и коз - с 3 мес., верблюдов - с годовалого возраста.
Не разрешается исследовать туберкулиновой пробой животных в течение трех недель после вакцинации.
3.2. Крупному рогатому скоту ППД-туберкулин применяют в дозе 2500 МЕ в 0,2 мл раствора. Для этого содержимое флакона с туберкулином (500 000 МЕ) растворяют в двух флаконах растворителя микобактериальных аллергенов.
В месте инъекции волос выстригают, кожу дезинфицируют 70% этиловым спиртом. Раствор туберкулина вводят животным (кроме быков) внутрикожно в середине шеи, быкам - в подхвостовую складку.
Для внутрикожного введения туберкулина используют безыгольные инъекторы или шприцы с бегунком вместимостью 1 - 2 мг и иглы для внутрикожных инъекций.
Учет и оценку реакции проводят через 72 часа, при этом у каждого животного прощупывают место введения туберкулина. При обнаружении припухлости измеряют кутиметром толщину кожной складки в месте инъекции и определяют величину ее утолщения в миллиметрах сравнением с толщиной складки неизмененной кожи вблизи от места введения туберкулина.
Реагирующими на туберкулин считают животных при образовании отечной болезненной припухлости и при утолщении кожной складки на 6 мм и более.
3.3. Овцам и козам ППД-туберкулин применяют в дозе 5 000 МЕ в 0,2 мл раствора. Для этого содержимое флакона с туберкулином (500 000 МЕ) растворяют в одном флаконе растворителя микобактериальных аллергенов.
Раствор туберкулина вводят только шприцем с бегунком вместимостью 1 - 2 мл и иглами для внутрикожных инъекций в толщу нижнего века, отступя от его края на 1,5 - 2 см. Место инъекции предварительно дезинфицируют 70% этиловым спиртом.
Учет и оценку реакции проводят через 48 часов, при этом у каждого животного прощупывают место введения туберкулина и сравнивают веки левого и правого глаза.
Реагирующими на туберкулин считают животных при образовании ощутимой припухлости в месте введения препарата.
3.4. Верблюдам ППД-туберкулин вводят, как овцам и козам, в дозе 5 000 МЕ в 0,2 мл раствора. Туберкулин вводят безыгольным инъектором или шприцем с бегунком вместимостью 1 - 2 мл и иглами для внутрикожных инъекций в кожу бесшерстного участка брюшной стенки в области паха на уровне горизонтальной линии седалищного бугра. Место инъекции предварительно дезинфицируют 70% этиловым спиртом.
Учет и оценку реакции проводят через 72 часа, при этом у каждого животного прощупывают место введения туберкулина. При обнаружении припухлости измеряют кутиметром толщину кожной складки и определяют величину ее утолщения в миллиметрах сравнением с толщиной складки неизмененной кожи вблизи от места инъекции препарата.
Реагирующими считают животных при образовании отечной болезненной припухлости и утолщении кожной складки на 7 мм и более.
Серологическую диагностику паратуберкулеза осуществляют у крупного и мелкого рогатого скота с помощью реакции связывания комплемента (РСК).
4.1. Компоненты реакции:
- сыворотка крови обследуемых животных свежая или консервированная;
- антиген паратуберкулезный для РСК;
- сыворотка паратуберкулезная для РСК (позитивная);
- сыворотка крови здорового крупного или мелкого рогатого скота (негативная);
- комплемент сухой для РСК;
- сыворотка гемолитическая для РСК (гемолизин);
- эритроциты барана, 2,5% взвесь;
- раствор физиологический, pH 6,8 - 7,2 (физраствор).
4.1.1. Неконсервированная сыворотка крови пригодна для исследования в течение 5 суток со дня взятия крови с сохранением ее при температуре от 4 °C до 8 °C.
Сыворотка, консервированная кристаллами борной кислоты до насыщения, пригодна для исследования в течение 10 суток.
Мутные, проросшие, гемолизированные пробы сыворотки крови исследованию не подлежат.
Испытуемые пробы сыворотки крови, а также позитивную и негативную сыворотки, разводят физраствором 1:10 и инактивируют в течение 30 мин., крупного рогатого скота - при температуре 59 - 60 °C, овец и коз - при температуре 63 - 64 °C.
4.1.2. Антиген паратуберкулезный для РСК приготавливают к реакции в соответствии с наставлением по его применению и используют в рабочем разведении 1:100. Для получения рабочего разведения один объем антигена из ампулы переносят сухой мерной пипеткой на дно сухой колбы и добавляют по каплям 90 объемов физраствора при постоянном покачивании колбы. Растворенный антиген оставляют для созревания на 20 - 30 мин. при комнатной температуре. Затем по стенке колбы при постоянном перемешивании вносят 90 объемов физраствора.
4.1.3. Для получения взвеси эритроцитов дефибринированную или консервированную кровь барана центрифугируют в течение 10 мин при 2500 - 3000 об/мин и отмывают эритроциты физраствором с помощью двух-четырехкратного центрифугирования при таком же режиме до полного обесцвечивания надосадочной жидкости. Надосадочную жидкость сливают, из осадка эритроцитов готовят 2,5% взвесь на физиологическом растворе.
4.1.4. Сыворотку гемолитическую для РСК используют в реакции в удвоенном титре (при титре гемолизина 1:1500 готовят разведение 1:750, при титре 1:1750 - разведение 1:875 и т.д.).
4.1.5. Из полученной 2,5% взвеси эритроцитов и раствора гемолизина в удвоенном титре готовят гемолитическую систему путем смешивания этих компонентов в равных объемах. Для этого в колбу со взвесью эритроцитов медленно вливают раствор гемолизина при постоянном перемешивании содержимого, затем гемосистему выдерживают в водяной бане при 37 - 38 °C в течение 20 мин.
4.1.6. Приготовление рабочего раствора комплемента.
Титрование комплемента проводят в гемолитической системе перед каждой постановкой реакции. Отбирают необходимое для данного объема количество ампул (флаконов) с комплементом (из примерного расчета одна ампула или флакон комплемента на 250 пробирок реакции объемом 1,0 мл), растворяют препарат в физрастворе, количество которого указано на ампуле (флаконе), сливают в одну емкость и осторожно перемешивают. Таким образом получают основной раствор комплемента, который хранят при температуре от 4 °C до 8 °C до постановки реакции.
Для титрования из основного раствора комплемента готовят разведение 1:20, для чего берут 0,1 мл раствора и разводят его 1,9 мл физраствора.
Комплемент в разведении 1:20 разливают в ряд пробирок дозами от 0,02 до 0,20 мл, увеличивая дозу в каждой следующей пробирке на 0,02 мл в соответствии с таблицей.
Таблица
N п/п | Компоненты реакции | Номера пробирок, дозы компонентов, мл | |||||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||
1. | Комплемент в разведении 1:20 | 0,02 | 0,04 | 0,06 | 0,08 | 0,10 | 0,12 | 0,14 | 0,16 | 0,18 | 0,20 |
2. | Физраствор | 0,58 | 0,56 | 0,54 | 0,52 | 0,50 | 0,48 | 0,46 | 0,44 | 0,42 | 0,40 |
3. | Гемолитическая система | 0,40 | 0,40 | 0,40 | 0,40 | 0,40 | 0,40 | 0,40 | 0,40 | 0,40 | 0,40 |
Водяная баня 37 - 38 °C на 10 мин. | |||||||||||
Примерный результат | ЧГ | ЧГ | ЧГ | ЧГ | ПГ | ПГ | ПГ | ПГ | ПГ | ПГ | |
Обозначения: ЧГ - частичный гемолиз, ПГ - полный гемолиз.
Затем в пробирки добавляют физраствор до 0,60 мл общего объема жидкости, после чего в каждую пробирку вносят по 0,40 мл гемолитической системы.
Штатив с пробирками встряхивают и помещают в водяную баню при температуре 37 - 38 °C на 10 мин.
Штатив с пробирками извлекают из бани и немедленно проводят учет результатов реакции в проходящем свете.
Примечание. Для удобства в работе и получения более точной дозировки вначале можно приготовить необходимые разведения комплемента в десятикратных объемах. Для этого в дополнительный ряд пробирок вносят комплемент, разведенный 1:20, в дозах 0,2; 0,4; 0,6 и т.д. до 2,0 мл и добавляют в каждую пробирку недостающее до 2,0 мл количество физраствора, то есть соответственно 1,8; 1,6; 1,4 мл и т.д. Из каждой пробирки дополнительного ряда переносят по 0,2 мл жидкости в соответствующую пробирку ряда для титрования (из первой пробирки - в первую, из второй - во вторую и т.д.). Данный перенос жидкости можно выполнять аппаратом Флоринского.
Затем в пробирки добавляют физраствор по 0,4 мл и далее продолжают работу как описано выше.
Титром комплемента считают наименьшее его количество (наибольшее разведение), при котором в течение 10 мин. при температуре 37 - 38 °C наступает полный гемолиз 0,2 мл 23% взвеси эритроцитов барана в присутствии 0,2 мг гемолитической сыворотки в общем объеме жидкости 1,0 мл. В примере, представленном в таблице, титр комплемента равен 0,10.
В реакцию берут комплемент в дозе, большей его титра на один интервал (например, при титре 0,10 берут 0,12).
Количество комплемента для постановки реакции определяют по формуле:
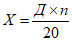 , где
, гдеX - количество основного раствора комплемента, необходимое для постановки реакции, мл;
Д - доза комплемента, большая его титра на один интервал, мл;
П - количество пробирок в реакции;
20 - кратность разведения комплемента при титрации.
Например: в реакции должно быть 200 пробирок, титр комплемента (по табл.) равен 0,10. Следовательно, количество основного раствора комплемента для постановки реакции равно:
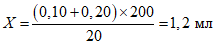
Необходимое количество рабочего раствора комплемента для постановки реакции равно 40 мл (по 0,2 мл рабочего раствора в каждую из 200 пробирок), отсюда - к 1,2 мл основного раствора комплемента следует добавить 38,8 мл физраствора.
4.2. Постановка реакции
Каждую пробу инактивированной сыворотки крови в разведении 1:10 исследуют в двух рядах пробирок с антигеном и без антигена. Для этого в первый и второй ряд пробирок штатива вносят по 0,02 мл испытуемой сыворотки и добавляют по 0,18 мл физраствора, затем в пробирки первого ряда вносят по 0,2 мл рабочего раствора антигена, в пробирки второго ряда - по 0,2 мл физраствора.
Одновременно ставят следующие контроли: позитивная и негативная сыворотки в разведении 1:10 с антигеном и без антигена, антиген без сыворотки, антиген без сыворотки и комплемента, гемсистема с физраствором. Штатив с пробирками встряхивают, и во все пробирки, за исключением пробирки контроля без комплемента, вносят по 0,2 мл рабочего раствора комплемента. Штатив встряхивают и помещают в водяную баню при температуре 37 - 38 °C на 20 мин.
Затем во все пробирки вносят по 0,4 мл гемсистемы, встряхивают и вновь помещают в водяную баню при той же температуре на 20 мин.
Штатив с пробирками извлекают из бани и оставляют при температуре 4 - 8 °C на 14 - 16 час.
4.3. Учет и оценка результатов реакции
Реакцию учитывают по степени гемолиза эритроцитов в крестах, определяемых по шкале гемолиза эритроцитов:
"++++" - полная задержка гемолиза эритроцитов (0% гемолиза);
"+++" - гемолиз 25% эритроцитов;
"++" - гемолиз 50% эритроцитов;
"+" - гемолиз 75% эритроцитов;
"-" - полный гемолиз эритроцитов (100%).
Учитывают результаты РСК проб сыворотки крови в пробирках без антигена. При любой степени задержки гемолиза в пробирке без антигена проба сыворотки крови не учитывается и подлежит повторному исследованию.
Реакцию считают положительной при задержке гемолиза в "+++" или "++++", и сомнительной при реакции в "++". Реакция считается отрицательной при задержке гемолиза в "+" или полном гемолизе эритроцитов. Кровь от животных с сомнительной реакцией исследуют повторно через 2 - 3 недели. При этом животных неблагополучных по паратуберкулезу хозяйств, с сывороткой крови которых получен дважды сомнительный результат РСК, считают положительно реагирующими, а благополучных - отрицательно.
Результаты РСК отмечают в ведомости проб сыворотки крови словами: положительная, отрицательная или сомнительная. В случае получения положительного результата РСК дальнейшие мероприятия проводятся в соответствии с п. 3.3, 5.1.1 и 5.2.1 Правил по профилактике и ликвидации паратуберкулеза животных.
Патологоанатомические изменения при паратуберкулезе обнаруживаются преимущественно в заднем участке тонкого отдела кишечника, реже в толстых кишках, а также в мезентериальных лимфатических узлах.
Степень патологических изменений не всегда соответствует тяжести клинического проявления болезни, а при наличии изменений возбудитель не всегда обнаруживается при бактериоскопическом исследовании материала. Возможны резко выраженные патологические изменения у животных, не имеющих клинических признаков болезни.
5.1. У крупного рогатого скота патологические изменения находят, главным образом, в заднем отрезке тощей и подвздошной кишках. Стенки кишок плотные, утолщены, просвет сужен, на разрезе выступает выраженная продольная и поперечная складчатость слизистой оболочки, отдельные складки гиперемированы, на других поверхность может быть бугристая, покрыта вязкой слизью. В кишках содержится небольшое количество желтоватой жидкости, пищевых масс почти нет. Илеоцекальная заслонка набухшая, темно-вишневого или багрово-красного цвета. В слепой кишке изменения выражены слабее, ободочная кишка поражается редко, в прямой кишке изменений нет. Мезентериальные лимфатические узлы и лимфатические узлы области илеоцекального соединения увеличены, набухшие, на разрезе влажные. Поверхность разреза бело-желтая. Иногда наблюдаются отеки серозной оболочки кишечника и брыжейки. Лимфатические сосуды утолщены.
5.2. У овец и коз в тощей и подвздошной кишках утолщение стенки и складчатость слизистой оболочки отмечается непостоянно, изменения могут быть выражены очень слабо. Серозные оболочки кишечника и брыжейки могут быть отечны, а лимфатические сосуды плотные, в виде тяжей. Мезентериальные лимфатические узлы увеличены, на разрезе сочные, белого или желтовато-белого цвета. В лимфатических узлах могут быть инкапсулированные очаги, иногда обызвествленные.
5.3. У верблюдов изменения сходны с таковыми у крупного рогатого скота, но могут быть более распространенными и тяжелыми. Наблюдается атрофия тонкого отдела кишечника, особенно двенадцатиперстной кишки, стенка которой сильно истончена. Вместе с тем, отмечаются очаговые утолщения стенки тонких кишок и диффузное утолщение стенки всего толстого отдела кишечника. В патологический процесс вовлекаются сычуг и сетка.
Мезентериальные лимфатические узлы сильно увеличены (до размера кулака взрослого человека). У отдельных животных обнаруживают изменения на слизистой оболочке глоточного кольца и гортани, на слизистой сетки в виде плотных узелков. Подчелюстные, заглоточные и паховые лимфатические узлы могут быть также сильно увеличены. В селезенке под капсулой и в толще паренхимы обнаруживают большое количество плотных узелков серо-белого цвета. Печень несколько увеличена, глинистого цвета. Селезенка и печень могут быть пронизаны тяжами.
6.1. Для прижизненного бактериоскопического исследования готовят по 4 - 6 мазков из комочков слизи и обрывков слизистой оболочки кишечника, обнаруживаемых в фекалиях животных, подозреваемых в заболевании.
От убитых или павших животных готовят по 4 - 6 мазков из участков кишечника или мезентериальных лимфоузлов, имеющих изменения, сходные с паратуберкулезными.
6.2. Мазки подсушивают на воздухе, фиксируют над пламенем горелки и окрашивают по методу Циля-Нильсена. Микобактерии паратуберкулеза в мазках представляют собой мелкие тонкие палочки красного цвета, располагающиеся кучками, частоколами по три и более.
6.3. При обнаружении хотя бы в одном из мазков красных палочек характерного строения и расположения, результаты бактериоскопии считают положительными.
В случае отсутствия в мазках красных палочек, или при обнаружении единичных, отдельно лежащих палочек, результаты бактериоскопии считают отрицательными.
Лабораторный диагноз на паратуберкулез ставят на основании положительных результатов бактериоскопического и гистологического исследования. При необходимости проводят бактериологическое исследование.
7.1. Кусочки лимфатических узлов и отдельно соскобы (ткань) слизистой оболочки и подслизистого слоя кишечника в количестве 4 - 5 г измельчают ножницами на кусочки по 2 - 3 мм, помещают в разные стерильные ступки, покрытые стерильной, пергаментной бумагой. Лимфатические узлы заливают 3% раствором серной кислоты в соотношении 1:10, а слизистую оболочку кишечника 6% раствором этой же кислоты и выдерживают 10 - 15 минут. Затем раствор кислоты сливают, а материал заливают в зависимости от концентрации серной кислоты на 5 или 10 минут соответственно стерильным физиологическим раствором в таком же объеме. Физиологический раствор сливают, кусочки материала растирают и суспендируют в небольшом количестве стерильного физиологического раствора.
Материал высевают на одну из следующих питательных сред с добавлением 2% фактора роста (экстракта из M. phlei): модифицированную казеиновую среду Дюбо-Смита, яичные среды Петраньяни, Левенштейна-Йенсена и ФАСТ-ЗЛ. Посевы выдерживают в термостате при 38 +/- 0,5 °C в течение 3 мес.
При сильном обсеменении тканей M. paratuberculosis рост возбудителя появляется через 18 - 20 суток, при слабом - через 45 - 90. Культуры вырастают в виде мельчайших плоских колоний светло-кремового или светло-желтого цвета с неровными краями. В дальнейшем они увеличиваются и принимают бугристый вид.
Для идентификации выделенную культуру высевают на вышеуказанные среды с фактором роста и без него. Возбудитель паратуберкулеза в первых генерациях размножается на питательных средах только в присутствии фактора роста.
Микобактерии паратуберкулеза не патогенны для лабораторных животных.
7.2. Питательные среды для бактериологического исследования.
Приготовление спиртового экстракта M. phlei по методу Смита (модификация ВГНКИ)
M. phlei выращивают на синтетической питательной среде Сотона или 2А в течение 10 - 14 суток до получения пышного роста на поверхности среды. Затем культуру отделяют от жидкой части среды путем пропускания через двойной бумажный фильтр, промывают 2 - 3 раза стерильной дистиллированной водой, отжимают фильтровальной бумагой, обрабатывают в аппарате Коха 30 мин. при 80 °C и подсушивают в термостате и течение 10 - 12 часов.
Высушенную культуру микобактерий в количестве 20 г помещают в стерильную ступку и тщательно растирают, затем приливают 150 мл этилового спирта. Полученную смесь переливают в круглодонную колбу и проводят спиртовую экстракцию фактора роста (микобактина) кипячением на водяной бане с обратным холодильником. Полученный экстракт (примерно 100 - 130 мл) ярко-желтого цвета сливают в сборную колбу, а к биомассе дважды приливают по 150 мл спирта и отгонку повторяют. Полученный экстракт (300 - 350 мл) оставляют на ночь для осаждения, на следующий день надосадочную жидкость пропускают через бумажный фильтр и сливают в колбу. Затем проводят отгонку спирта из экстракта путем кипячения в водяной бане с прямым холодильником. Полученную вязкую красновато-оранжевую жидкость (объемом примерно 3 - 6 мл) смешивают с 50% раствором глицерина из расчета: к 2 мл "концентрата" приливают 40 мл глицерина. Устанавливают pH - 7,6, жидкость прогревают в кипящей водяной бане 10 мин., затем горячий раствор переливают в делительную воронку и оставляют на ночь.
На следующий день из делительной воронки сливают нижнюю светлую часть жидкости (pH - 7,0), разливают в ампулы и стерилизуют при 120 °C в течение 20 мин. Экстракт (микобактин) хранится длительное время.
Синтетическая среда Сотона (ингредиенты и приготовление)
Аспарагин - 5 г
Аммоний лимоннокислый двузамещенный - 2 г
Калий фосфорнокислый двузамещенный - 5 г
Магний сернокислый - 0,5 г
Железо сернокислое закисное - 0,05 г
Глицерин - 50 мл
Лимонная кислота - 4 г
Цинк сернокислый - 0,1 г
Дистиллированная вода - до 1 л
В дистиллированной воде, подогретой до 70 - 80 °C, последовательно растворяют аспарагин, аммоний лимоннокислый двузамещенный, калий фосфорнокислый двузамещенный, сернокислый магний, железо сернокислое закисное, глицерин. Затем добавляют водный 25% раствор аммиака до pH - 7,0 и кипятят 1 час, после чего добавляют лимонную кислоту и сернокислый цинк, аммиаком устанавливают pH 7,2 - 7,3. Питательную среду охлаждают до 50 °C, пропускают через бумажный фильтр, разливают в 0,5 литровые флаконы и стерилизуют при 120 °C в течение 30 мин.
Среда 2А (ингредиенты и приготовление)
Аспарагин - 5 г
Сернокислая магнезия - 0,5 г
Калия фосфат двузамещенный - 1,5 г
Цитрат железа - 0,05 г
Цитрат натрия - 1,5 г
Глюкоза - 5 г
Глицерин - 50 г
Крахмал - 0,1 г
Нитрат аммония - 1,5 г
Дистиллированная вода - до 1000 мл
Вещества растворяют в дистиллированной воде, подогретой до температуры 60 - 70 °C, в произвольном порядке, устанавливают pH - 5,6 - 5,8, среду стерилизуют при 120 °C в течение 30 мин.
Модифицированная казеиновая питательная среда Дюбо-Смита
а) Состав среды:
Однозамещенный фосфорнокислый калий - 1 г
Двузамещенный фосфорнокислый натрий - 6,25 г
Сернокислый магний - 0,01 г
Хлористый калий - 0,0005 г
Сернокислый цинк - 0,0001 г
Сернокислая медь - 0,0001 г
Лимоннокислое аммонийное железо - 0,05 г
Аспарагин - 1 г
Гидролизат казеина - 80 мл
Спиртовый экстракт микобактерий тимофеевой травы - 20 мл
Дистиллированная вода - до 1000 мл
Агар Дифко - 1,5%
Стерильная инактивированная сыворотка крупного рогатого скота - 20%
Пенициллин - 50 ЕД/мл
б) Приготовление гидролизата казеина.
Нагревают до 28 °C 1 л водопроводной воды и добавляют 84 г казеина. Едким калием устанавливают pH раствора равный 8,0. Раствор подогревают на водяной бане при температуре 28 °C в течение 3 часов, снова доводят pH до 8,0, затем добавляют 2 г панкреатина и 2 мл хлороформа. Полученную смесь переливают в бутыль, закрывают резиновой пробкой и оставляют при комнатной температуре. Спустя 10 дней содержимое бутыли фильтруют через полотно, устанавливают pH 7,4, разливают по флаконам и стерилизуют при 120 °C в течение 30 мин. Гидролизат может храниться при комнатной температуре длительное время.
в) Приготовление солевых компонентов.
Взвешивают однозамещенный фосфорно-кислый калий, двузамещенный фосфорно-кислый натрий, сернокислый магний и растворяют в 100 - 250 мл дистиллированной воды в литровой колбе. В другой колбе, в таком же объеме воды при подогревании поочередно растворяют аспарагин и лимоннокислое аммиачное железо, этот раствор смешивают с раствором указанных выше солей, а затем прибавляют хлористый кальций, сернокислый цинк и сернокислую медь.
г) Порядок составления среды.
В колбу с растворами солей и аспарагина добавляют 80 мл гидролизата казеина, 20 мл микобактина, дистиллированной воды до 1 литра и полученный раствор пропускают через бумажный фильтр.
Устанавливают соляной кислотой pH - 6,5, разливают равномерно по флаконам, добавляют 1,5% агара и стерилизуют при 120 °C в течение 20 мин. Такой полуфабрикат длительно хранится при комнатной температуре.
Перед употреблением к расплавленному в водяной бане полуфабрикату добавляют 20% стерильной, инактивированной при 50 °C в течение часа сыворотки крови крупного рогатого скота и пенициллин.
Готовую среду разливают по пробиркам, скашивают и выдерживают при комнатной температуре в течение суток.
Яичные среды готовят только в стерильной посуде: добавление яичной массы, фильтрацию и разлив производят в боксе. Для приготовления яичных питательных сред используют только свежие куриные яйца со сроком хранения не более 5 суток. Яйца предварительно тщательно моют щеткой в теплой воде с мылом, смачивают спиртом и обжигают, затем разбивают стерильным пинцетом, выливают содержимое и стерильную банку (большую колбу) с бусами или битым стеклом и энергично встряхивают после внесения каждого яйца.
Среда Петраньяни (ингредиенты и приготовление)
Молоко цельное - 300 мл
Крахмал картофельный - 12 г
Пептон - 2 г
Картофель очищенный, мелко нарезанный - 2 клубня размером с яйцо.
Ингредиенты тщательно смешивают в колбе и варят на слабом огне до образования клейстера. К охлажденной до 50 °C смеси добавляют 8 цельных яиц и 2 желтка, 24 мл глицерина и 20 мл 2% стерильного водного раствора малахитовой зелени. Хорошо смешивают, фильтруют через воронку с двойным слоем марли, разливают по пробиркам (4 - 5 мл в каждую) и стерилизуют при 120 °C в течение 20 мин.
Среда Левенштейна-Йенсена (ингредиенты и приготовление)
а) Солевой раствор
Однозамещенный фосфорнокислый калий - 2,4 г
Сернокислый магний - 0,34 г
Лимоннокислый магний - 0,6 г
Аспарагин - 3,6 г
Глицерин х.ч. - 12 мл
Вида дистиллированная - до 600 мл
Соли растворяют в указанной последовательности, раствор стерилизуют 2 ч текучим паром или в автоклаве в течение 15 мин при температуре 120 °C.
б) Яичная масса.
Приготавливают 1000 мл однородной суспензии из свежих яиц. Для этого яйца, вымытые в проточной воде с мылом, в количестве 20 - 25 штук кладут в 70% спирт на срок не менее 1 часа, затем разбивают в стерильную круглодонную колбу с бусами (из каждого десятка яиц отбрасывают два белка), хорошо размешивают и фильтруют через стерильную марлю.
в) Водный 2% раствор малахитовой зелени.
2 г малахитового зеленого растворяют в 100 мл дистиллированной воды. Стерилизуют в автоклаве в течение 30 мин. при 120 °C.
г) Приготовление среды.
В колбу, содержащую 30 г картофельного крахмала, добавляют 600 мл солевого раствора, смесь нагревают, постоянно взбалтывая, на кипящей бане до вязкой консистенции. К охлажденной до температуры 45 - 60 °C смеси добавляют 1 л яичной массы и 20 мл 2% водного раствора малахитовой зелени, тщательно перемешивают, избегая появления пузырьков воздуха, фильтруют через ватно-марлевый фильтр, разливают в пробирки по 4 - 5 мл, скашивают и сворачивают дважды при 85 °C в течение 20 мин.
Среда ФАСТ-ЗЛ лиофилизированная (способ приготовления)
Во флакон с лиофилизированной средой ФАСТ-ЗЛ вливают 57 мл стерильной дистиллированной воды с pH 6,0 и 1,3 мл микобактина: энергично встряхивают и помещают в термостат с температурой нагрева 37 - 38 °C на 30 мин. с периодическим встряхиванием. Лиофилизированная среда должна полностью раствориться и представлять собой однородную жидкость светло-зеленого цвета консистенции молока.
После растворения сухой среды (30 - 40 мин) ее разливают при периодическом встряхивании флакона в стерильные бактериологические пробирки по 5 мл и укупоривают стерильными ватно-марлевыми пробками.
Пробирки в наклонном положении помещают в аппарат Коха с температурой нагрева 85 °C на 30 мин. для свертывания среды. Затем пробирки в том же положении выдерживают в термостате при температуре 37 - 38 °C в течение 18 - 20 часов и повторно прогревают при температуре 85 °C в течение 20 мин.
8.1. Для гистологического исследования отбирают пораженные участки кишечника и лимфатические узлы, которые фиксируют в 10% растворе формалина.
8.2. Гистологические изменения при паратуберкулезе характеризуются наличием пролифератов из эпителиоидных клеток, располагающихся диффузно и в виде гранулем в слизистой оболочке кишечника, а иногда и в подслизистом слое. Среди них иногда встречаются и гигантские клетки типа Лангганса.
Ворсинки слизистой оболочки увеличены, часто сливаются и имеют вид колбообразных вздутий. Некоторые ворсинки сдавлены и атрофированы. Либеркюновые железы также подвергаются атрофии.
В брыжеечных лимфатических узлах эпителиоидные клетки располагаются преимущественно в краевых и центральных синусах, а в лимфатических сосудах - в их стенках (продуктивный эндолимфангит).
У верблюдов аналогичные эпителиоидные пролифераты выявляют также в печени и селезенке.
В срезах, окрашенных по методу Циля-Нильсена, микобактерии паратуберкулеза обнаруживают в эпителиоидных и гигантских клетках и реже вне их. В отдельных случаях микобактерии обнаружить не удается.
8.3. Изменения при паратуберкулезе следует дифференцировать от туберкулеза, неспецифического катара, паразитарных очагов.
Туберкулез кишечника характеризуется обычно язвенными поражениями кишечной стенки и образованием в брыжеечных лимфатических узлах очагов с творожистым или обызвествленным содержимым, окруженных грануляционной тканью из эпителиоидных, лимфоидных и гигантских клеток. При окраске по методу Циля-Нильсена в содержимом очага могут быть обнаружены единичные красные палочки.
Паразитарные узелки определяют по нахождению паразита и эозинофильноклеточной пролиферации. При неспецифическом катаре кишечника отсутствуют пролифераты из эпителиоидных клеток в стенке кишки и лимфоузлах.
***
С утверждением данного Наставления утрачивают силу "Наставление по диагностике паратуберкулезного энтерита (паратуберкулеза) крупного рогатого скота" (приложение N 1 к Инструкции о мероприятиях по профилактике и ликвидации паратуберкулезного энтерита (паратуберкулеза), утвержденное ГУВ МСХ СССР 18 августа 1975 г., "Наставление по аллергической диагностике паратуберкулеза у овец", утвержденное ГУВ МСХ СССР 11 августа 1981 г., "Временное наставление по постановке реакции связывания комплемента для диагностики паратуберкулеза крупного рогатого скота и овец с антигеном Сибирского научно-исследовательского ветеринарного института", утвержденное ГУВ МСХ СССР 31 мая 1968 г.
***
Разработчики:
Всероссийский научно-исследовательский институт экспериментальной ветеринарии (ВИЭВ),
Всероссийский государственный научно-исследовательский институт контроля, стандартизации и сертификации ветеринарных препаратов (ВГНКИ),
Департамент ветеринарии Минсельхоза РФ,
Центральная научно-методическая ветеринарная лаборатория.
Начальник отдела ветсанэкспертизы
и лабораторной диагностики
В.И.БЕЛОУСОВ