СПРАВКА
Источник публикации
СПб.: Издательство "Лань", 2015
Примечание к документу
Название документа
"Методические указания по определению биологической активности вирусвакцин против ньюкаслской болезни птиц"
(утв. Минсельхозом СССР 12.07.1980 N 115-6)
"Методические указания по определению биологической активности вирусвакцин против ньюкаслской болезни птиц"
(утв. Минсельхозом СССР 12.07.1980 N 115-6)
Утверждены
12 июля 1980 г. N 115-6
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ОПРЕДЕЛЕНИЮ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ ВИРУСВАКЦИН
ПРОТИВ НЬЮКАСЛСКОЙ БОЛЕЗНИ ПТИЦ
1.1. Определение биологической активности вируса против ньюкаслской болезни проводят в республиканских, краевых, областных, зональных и специализированных ветеринарных лабораториях специалисты, владеющие методами вирусологических исследований.
1.2. Биологическую активность вирусвакцин определяют методом титрования на развивающихся эмбрионах кур с последующей статистической обработкой полученных данных.
Вакцину исследуют на биологическую активность перед ее применением для аэрозольной вакцинации птиц против ньюкаслской болезни, также в случаях выявления нарушений режимов хранения или транспортировки биопрепарата.
2.1. Для проведения титрования необходимо иметь:
- оборудованный бокс с предбоксником для вирусологической работы, темную комнату, овоскоп, термостат, центрифугу и бытовой холодильник;
- стерильные плоскодонные колбы (50...250 мл), пастеровские пипетки, градуированные пипетки (1 и 10 мл), пипетки Мора (25...100 мл), шприц для инъекции (1 мл) с иглами (лучше туберкулиновые), пробойник;
- стерилизатор, штативы, глазные пинцеты, глазные изогнутые остроконечные ножницы, лотки с ячейками для эмбрионов, эмалированные кюветы, фарфоровая (стеклянная) кружка;
- антибиотики (пенициллин и стрептомицин), спиртовой раствор йода (0,1%-ный), раствор лимоннокислого натрия (4...5%-ный), взвесь эритроцитов кур (5%-ная), стерильный физиологический раствор (pH 7,1...7,3), стерильные ватные тампоны, парафин, дезраствор (2%-ный раствор едкого натра или хлорамина);
- 9...11-дневные развивающиеся эмбрионы кур (РЭК) с белой скорлупой и петухи-доноры.
2.2. Для исследования берут 3 ампулы или 3 флакона каждой исследуемой серии вакцины из разных коробок.
2.3. Для определения биологической активности вируса лентагенных штаммов ("В1", "Н", "Ла-Сота" и "Бор-74 ВГНКИ" и др.) используют РЭК 9...10-дневного возраста, а из мезогенных штаммов ("Н" и др.) - 10...11-дневного возраста, полученные из благополучного хозяйства.
Для титрования вируса можно использовать РЭК, полученные и от кур, привитых инактивированной или живой вакциной из группы лентагенных штаммов.
2.4. Перед заражением РЭК просматривают на овоскопе, все погибшие, слабые и с неправильным расположением пуги выбраковывают. У остальных простым карандашом отмечают пугу и очерчивают в бессосудистой зоне место для введения вируса.
2.5. На каждое испытуемое 10-кратное разведение вируса используют по 4 эмбриона. При этом на скорлупе каждого эмбриона делают соответствующую маркировку (наименование штамма, номер серии, разведение и дату заражения). Четыре эмбриона оставляют в качестве контроля.
2.6. Маркированные по разведениям (от 10-5 до 10-10) и контрольные РЭК размещают на чистом профламбированном металлическом (деревянном) лотке и до заражения помещают в термостат. При этом в термостате должны быть емкости с водой и открытые вентиляционные каналы.
3.1. Перед тем как приступить к титрованию, обращают особое внимание на расфасовку вакцины в ампулах (флаконах), подвергнутых лиофильному высушиванию. Количество доз и объемное содержание вируса в ампуле (флаконе) указано в Наставлении по применению сухой вирусвакцины против ньюкаслской болезни.
3.2. Исходное разведение лиофилизированного вируса готовят в колбе, начиная с разведения 10-1 (без учета наполнителя), при этом на каждый миллилитр вируса в ампуле (флаконе) берут по 10 мл физиологического раствора (при работе с нативным вирусом берут его 1,0 мл и добавляют 9,0 мл физиологического раствора), содержащего по 200 ЕД/мл пенициллина и стрептомицина.
Пример: 3 ампулы сухой вирусвакцины из штамма "Н" с содержанием в каждой по 0,5 мл вируса разводят в 15 мл, а 3 ампулы вакцины из штамма "Ла-Сота" с содержанием в каждой по 2 мл вируса, разводят в 60 мл физиологического раствора и т.п. Полученную взвесь тщательно взбалтывают и оставляют на 10...15 мин до полного растворения.
3.3. Десятикратное растворение вируса готовят следующим образом. В 9 стерильных пробирок наливают по 9 мл стерильного физиологического раствора. Затем из исходного разведения вируса (10-1), предварительно взболтанного до однородной взвеси, берут 1 мл и переносят в пробирку N 2, не касаясь ее содержимого, получают разведение 10-2. Пипетку, которой внесли исходную взвесь, помещают в кружку с дезинфицирующим раствором. Новой пипеткой путем трехкратного пипетирования перемешивают взвесь в пробирке N 2, отбирают 1 мл содержимого и переносят в пробирку N 3, не касаясь ее содержимого, получают разведение 10-3. Так готовят и последующие разведения вируса до 10-10 включительно, используя при этом на каждое разведение отдельную градуированную пипетку.
3.4. Приготовленными 10-кратными разведениями вируса заражают эмбрионы в аллантоисную полость одним стерильным шприцем, начиная от разведения 10-10 и до 10-5 включительно. Перед заражением ранее отмеченную пугу и бессосудистую зону РЭК обрабатывают спиртом с 0,1%-ным содержанием настойки йода и фламбируют. Затем стерильным пробойником в скорлупе пробивают два отверстия, сначала в центре пуги, а затем в бессосудистой зоне. Каждым разведением вируса заражают по 4 эмбриона в объеме 0,1 мл. После заражения РЭК отверстия заливают расплавленным парафином сначала в месте введения, а затем в области пуги. Зараженные РЭК помещают в термостат и овоскопируют 2 раза в день (утром и вечером). Гибель отдельных РЭК в течение первых 24 ч считается неспецифической.
3.5. Зараженные и контрольные РЭК инкубируют: в течение 72 ч - инфицированные штаммом "Бор-74 ВГНКИ", 96 ч - штаммами "В1" и "Ла-Сота" и 120 - штаммом "Н".
По истечении срока инкубации проводят учет результатов титрования: для штаммов "В1", "Ла-Сота" и "Бор-74 ВГНКИ" по наличию гемагглютинации в исследуемых разведениях, используя при этом феномен "спонтанной" реакции гемагглютинации (кровь живого эмбриона + экстраэмбриональная жидкость этого же эмбриона) и капельной реакции гемагглютинации (экстраэмбриональная жидкость павших РЭК после 24 ч + 5%-ная взвесь эритроцитов кур); для штамма "Н" по наличию гемагглютинации в исследуемых разведениях и капельной реакций гемагглютинации (экстраэмбриональная жидкость только павших РЭК после 24 ч + 5%-ная взвесь эритроцитов кур).
3.6. "Спонтанную" и капельную реакцию гемагглютинации ставят на чистых обезжиренных предметных стеклах или профламбированных кюветах. Вскрытие начинают с контрольных РЭК, а затем от разведения 10-10 и до 10-5, при этом на каждый вскрытый эмбрион используют отдельную пастеровскую пипетку.
3.7. При постановке "спонтанной" капельной реакции гемагглютинации живые РЭК вскрывают со стороны пуги, отделяют ее, надрывают подскорлупную и хорионаллантоисную оболочки. Кровь, полученную при травмировании сосудов РЭК, смешивают (пипетированием) с экстраэмбриональной жидкостью и 2...3 капли смеси переносят на предметные стекла. Затем через 5...8 мин, осторожно наклоняя и покачивая, наблюдают за проявлением хлопьев агглютинирующих эритроцитов. Положительная реакция гемагглютинации служит показателем наличия вируса. В контрольных (незараженных) РЭК реакция должна быть отрицательной.
3.8. Капельную реакцию гемагглютинации от павших РЭК ставят так же, как и от живых, но здесь, к полученной экстраэмбриональной жидкости от каждого эмбриона добавляют по 1 капле 5%-ной взвеси эритроцитов кур, тщательно перемешивают и ведут учет реакции через 5...8 мин.
3.9. Полученные результаты записывают в следующем виде, изложенном в таблице 33.
Таблица 33
Разведение вируса | Объем вводимого инокулята, мл | Количество РЭК, в котором установлен вирус (+), не установлен (-) | Отношение количества РЭК с вирусом/к числу зараженных |
10-5 | 0,1 | ++++ | 4/4 |
10-6 | 0,1 | ++++ | 4/4 |
10-7 | 0,1 | +++- | 3/4 |
10-8 | 0,1 | ++-- | 2/4 |
10-9 | 0,1 | +--- | 1/4 |
10-10 | 0,1 | ---- | 0/4 |
Контроль | - | ---- | 0/4 |
3.10. Титр вируса определяют по методу Кербера, видоизмененному П.П. Ашмариным, по формуле
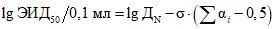 ,
,где ЭИД50/0,1 мл - титр вируса в объеме 0,1 мл, способный вызвать инфицирование 50% зараженных РЭК; ДN - максимальная испытуемая доза вируса (10-5); 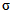 - логарифм кратности разведения (в нашем примере 10-кратные разведение,
- логарифм кратности разведения (в нашем примере 10-кратные разведение, 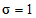 );
); 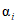 - отношение числа РЭК в испытуемых разведениях, давших положительную реакцию гемагглютинации, к общему числу зараженных;
- отношение числа РЭК в испытуемых разведениях, давших положительную реакцию гемагглютинации, к общему числу зараженных; 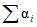 - сумма значений
- сумма значений 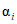 , найденных во всех испытуемых разведениях (в нашем примере
, найденных во всех испытуемых разведениях (в нашем примере 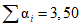 ).
).
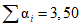 ).
).3.11. Для получения необходимых данных производят следующие расчеты (табл. 34).
Разведения вируса | Результаты заражения | |
10-5 | 4/4 | 1,00 |
10-6 | 4/4 | 1,00 |
10-7 | 3/4 | 0,75 |
10-8 | 2/4 | 0,50 |
10-9 | 1/4 | 0,25 |
10-10 | 0/4 | 0,00 |
Сумма значений:
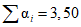 .
.Пользуясь этими данными, находим по формуле титр вируса:
lg ЭИД50/0,1 = lg 10-5 - lg 101·(3,50 - 0,5) =
= -5 - 1·3,00 = -5 - 3,00 = -8,00.
Отсюда lg ЭИД50/0,1 = -8,00;
lg ЭИД50/мл = -9,00 (или 10-9,00 ЭИД50/мл).
Антилогарифм полученного значения: 10-9,00 ЭИД50/мл, он равен разведению 1:1 000 000 000, т.е. 1 мл вируса содержит 1 000 000 000 ЭИД50 (или 10-9,00 ЭИД50/мл).
3.12. Биологическую активность вирусвакцин из штаммов "В1", "Ла-Сота" и "Бор-74 ВГНКИ" выражают в ЭИД50/мл, а из штамма "Н" - в ЭЛД50/мл.
3.13. Для практического использования биологическая активность сухой вирусвакцины из штамма "В1" должна быть не ниже 107,0 ЭИД50/мл, из штаммов "Ла-Сота" и "Бор-74 ВГНКИ" - 107,5 ЭИД50/мл, а из штамма "Н" - не ниже 107,0 ЭЛД50/мл.
3.14. Цифровые значения антилогарифмов биологической активности вирусвакцин определяют при помощи таблицы В.М. Брадиса по цифровым показателям мантиссы и характеристики (табл. 35).
Таблица 35
 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
0 | 1000 | 1259 | 1585 | 1995 | 2512 | 3162 | 3981 | 5012 | 6310 | 7843 |
1 | 1023 | 1288 | 1622 | 2042 | 2570 | 3236 | 4074 | 5129 | 6457 | 8128 |
2 | 1047 | 1318 | 1660 | 2089 | 2630 | 3311 | 4169 | 5248 | 6607 | 8318 |
3 | 1072 | 1349 | 1698 | 2138 | 2692 | 3388 | 4266 | 5370 | 6761 | 8511 |
4 | 1096 | 1380 | 1738 | 2188 | 2754 | 3467 | 4365 | 5495 | 6918 | 8710 |
5 | 1122 | 1413 | 1778 | 2239 | 2818 | 3548 | 4467 | 5623 | 7079 | 8913 |
6 | 1148 | 1446 | 1820 | 2291 | 2884 | 3631 | 4571 | 5754 | 7244 | 9120 |
7 | 1176 | 1479 | 1862 | 2344 | 2951 | 3715 | 4677 | 5888 | 7413 | 9338 |
8 | 1202 | 1514 | 1905 | 2399 | 3020 | 3802 | 4786 | 6036 | 7586 | 9550 |
9 | 1230 | 1549 | 1950 | 2455 | 3090 | 3890 | 4898 | 6166 | 7762 | 9772 |
Пример. Биологическая активность вакцин 108,00 и 108,25 ЭИД50/мл имеет активность в цифровом выражении 1:100 000 000 и 1:177 800 000 ЭИД50 соответственно, т.е. искомое число антилогарифма 8,25 (8 - характеристика, 25 - мантисса) определяется показателем мантиссы на месте пересечения десятых и сотых цифровых значений (табл. 35), а характеристика указывает на количество знаков в цифровом выражении.
3.15. Результаты титрования записывают в соответствующей книге (журнале) учета по произвольной форме.
В книге указывают наименование биопрепарата и учреждения, его изготовившего, номер серии и дату ее изготовления, дату поступления на исследование и наименование хозяйства, откуда препарат поступил.