СПРАВКА
Источник публикации
СПб.: Издательство "Лань", 2015
Примечание к документу
Название документа
"Методические указания по лабораторной диагностике вирусного (трансмиссивного) гастроэнтерита свиней"
(рекомендованы Минсельхозом СССР 30.05.1978 N 116-6а)
"Методические указания по лабораторной диагностике вирусного (трансмиссивного) гастроэнтерита свиней"
(рекомендованы Минсельхозом СССР 30.05.1978 N 116-6а)
Рекомендованы
Министерством сельского
хозяйства СССР
30 мая 1978 г. N 116-6а
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ
ВИРУСНОГО (ТРАНСМИССИВНОГО) ГАСТРОЭНТЕРИТА СВИНЕЙ
- выявлении вирусного антигена в патологическом материале методом иммунофлуоресценции (ИФ);
- выделении вируса в культуре клеток и его идентификации методом ИФ и реакции нейтрализации (РН);
- выявлении специфических антител в сыворотке крови больных и переболевших животных в реакции непрямой гемагглютинации (РНГА).
При необходимости проводят гистологическое исследование, электронную микроскопию и биологическую пробу.
1.2. Лабораторный диагноз на вирусный гастроэнтерит свиней ставят на основании получения положительных результатов по одному из методов, указанных в п. 1.1.
Окончательный диагноз устанавливается на основании эпизоотологических, клинических и патологоанатомических данных с учетом результатов лабораторного исследования.
1.3. Срок исследования по выделению и идентификации вируса - 15 ... 30 дней.
2.1. Для лабораторной диагностики в лабораторию направляют в термосе со льдом патологический материал (кусочки легкого, печени, селезенки, почки, головного мозга и пораженные участки тонкого отдела кишечника) от вынужденно убитых в агональном состоянии или павших животных. Патологический материал от трупов, пролежавших более двух часов после гибели, к исследованию не пригоден.
2.2. Методом ИФ исследуют с применением флуоресцирующей сыворотки мазки-отпечатки или гистологические срезы из органов и тканей или культуру клеток, зараженную патологическим материалом.
Препараты подсушивают на воздухе, фиксируют смесью этилового спирта и уксусной кислоты (9:1) в течение 15 ... 20 мин или охлажденным при 4 °C ацетоном в течение 5 ... 7 мин, прополаскивают в 0,15 М растворе фосфатного буфера и дистиллированной воде и подсушивают на воздухе.
2.3. Перед использованием каждой серии флуоресцирующей сыворотки рекомендуют проверять ее титр. Для этого сыворотку разводят на 1 ... 2 разведения выше и ниже указанного титра и каждым разведением окрашивают препараты, приготовленные из органов больных вирусным гастроэнтеритом и здоровых свиней.
Минимальное разведение сыворотки, обеспечивающее яркое (на +++ и ++++) специфическое свечение клеток в препаратах из тканей свиней, зараженных возбудителем вирусного гастроэнтерита свиней, называют титром.
2.4. Метод иммунофлуоресценции применяют в прямом и непрямом вариантах.
2.5. Прямой вариант метода ИФ. На фиксированные препараты наносят флуоресцирующую сыворотку и выдерживают в течение 30 мин при температуре 37 °C во влажной камере (чашка Петри с увлажненным дном). Затем препараты промывают забуференным раствором и дистиллированной водой, подсушивают на воздухе и просматривают под люминесцентным микроскопом (светофильтры ФС-1, СЭС-7, ВС-8 и окуляры ЖЗВ-19 или Т-2Н).
Для контроля специфичности свечения препараты обрабатывают нормальной меченой сывороткой.
2.6. Непрямой вариант метода ИФ. На препараты наносят специфическую к возбудителю вирусного гастроэнтерита немеченую сыворотку и выдерживают 20 мин при температуре 37 °C во влажной камере. Затем препараты промывают забуференным раствором, подсушивают на воздухе и наносят флуоресцирующую антивидовую сыворотку на 15 мин при температуре 37 °C, после чего их промывают, подсушивают и просматривают под люминесцентным микроскопом.
Для контроля специфичности свечения на препараты наносят немеченую нормальную сыворотку крови свиней, затем - флуоресцирующую антивидовую сыворотку.
2.7. Оценка результатов. Иммунофлуоресценция считается положительной при наличии в препаратах ярко-зеленого свечения клеток или цитоплазмы с наличием ярко светящихся гранул разного размера при отсутствии флуоресценции в контрольных препаратах. Свечение лейкоцитов и дегенеративно измененных клеток не учитывают.
3.1. Выделение вируса проводят на первичных и перевиваемых линиях клеток почек поросят.
Для заражения культуры готовят 10%-ную суспензию из органов поросят (отдельно паренхиматозные органы и кишечник) на растворе Хенкса, центрифугируют при 3000 об/мин в течение 30 мин. К надосадочной жидкости добавляют антибиотики, выдерживают в течение часа при комнатной температуре или 6 ч при температуре 3 ... 4 °C, еще раз центрифугируют при 5000 об/мин в течение 30 мин, проверяют на стерильность и используют для заражения культуры клеток.
3.2. Материал каждой пробы вносят по 0,2 мл в 4 пробирки с культурой клеток, из которых предварительно удаляют питательную среду, а монослой промывают раствором Хенкса.
Зараженную культуру клеток выдерживают при температуре 37 °C в течение 30 мин, затем в каждую пробирку вносят по 0,8 мл поддерживающей среды (среда 199 или 0,5%-ный гидролизат лактальбумина). Для контроля монослоя оставляют четыре пробирки незараженными. Зараженные и контрольные пробирки инкубируют при 37 °C.
Для исследования методом ИФ заражают культуру клеток, выращенную на стеклышках.
3.3. Результаты заражения учитывают через каждые 24 ч в течение 5 ... 7 сут до появления цитопатических изменений (ЦПД). При отсутствии ЦПД в первом пассаже проводят 5 ... 7 последовательных пассажей.
ЦПД вируса вирусного гастроэнтерита свиней наступает через 2 ... 7 пассажей после заражения и характеризуется набуханием, утолщением с последующим укорочением и округлением клеток до полного разрушения монослоя.
4.1. Метод иммунофлуоресценции. Зараженную культуру клеток со стеклышками через 24 и 48 ч инкубации в термостате фиксируют и исследуют методом ИФ (см. пп. 2.5, 2.6 и 2.7).
4.2. Реакция нейтрализации (РН). РН проводят в культуре клеток с использованием 1000 ЦПД50 вируса и 20 нейтрализующих доз сыворотки, которые определяют титрованием вируса и антител.
4.3. Титрование вируса. Для титрования вируса вируссодержащую культуральную жидкость предварительно центрифугируют при 3000 об/мин в течение 30 мин. Из надосадочной жидкости готовят десятикратные разведения на растворе Хенкса (10-1 ... 10-7). Затем по 0,1 мл каждого разведения вируса, начиная с конечного, вносят в пробирки с культурой клеток, в которых предварительно ростовую среду заменяют на 0,9 мл поддерживающей. Для контроля культуры клеток четыре пробирки оставляют незараженными. Опытные и контрольные пробирки инкубируют при 37 °C.
4.4. Учет результатов проводят на 3-и, 5-е, 7-е сутки. Титр вируса определяют по методу Рида и Менча. Дозу вируса определяют, исходя из его титра, с помощью таблицы антилогарифмов. Например, при титре вируса 10-7 1000 ЦПД его будет 10-4.
4.5. Специфическую к возбудителю вирусного гастроэнтерита свиней сыворотку разводят 1:2 питательной средой и инактивируют при 56 °C в течение 30 мин. В РН используют 20 нейтрализующих доз сыворотки. Например: если титр сыворотки 1:1000, то 20 доз ее составит разведение 1:50. Каждую новую серию сыворотки титруют.
4.6. Постановка РН. К каждому из исследуемых вирусов в объеме 0,5 мл с содержанием в 0,1 мл 1000 ЦПД50 добавляют по 0,5 мл иммунной сыворотки, содержащей в 0,1 мл 20 нейтрализующих доз. Смесь выдерживают один час при 37 °C, затем по 0,2 мл вносят в 4 пробирки с культурой клеток, в которых предварительно ростовая среда заменена поддерживающей.
Контроли: четыре пробирки с незараженной культурой клеток; по 2 ... 4 пробирки заражают 1000, 100, 10, 1 дозами вируса; четыре пробирки инокулируют разведением сыворотки, взятым в опыт. Опытные и контрольные пробирки с культурой клеток инкубируют при 37 °C.
4.7. Учет реакции проводят на 4-е и 7-е сутки. Реакция считается положительной, если специфическая сыворотка нейтрализовала ЦПД вируса в 50% пробирок, инокулированных вирус-сывороточной смесью.
5.1. Определение специфических антител в парных сыворотках крови больных и переболевших животных проводят с помощью реакции непрямой гемагглютинации (РНГА).
5.2. Компоненты:
- эритроцитарный диагностикум (эритроциты, сенсибилизированные вирусом вирусного гастроэнтерита свиней);
- испытуемые сыворотки больных и переболевших животных;
- контрольные (положительная и отрицательная) сыворотки к вирусу вирусного гастроэнтерита свиней;
- забуференный физиологический раствор с pH 7,2.
5.3. Реакцию ставят на плексиглазовых пластинах в объеме 0,4 мл. Испытуемые сыворотки инактивируют при температуре 56 ... 58 °C в течение 40 мин, затем готовят двукратные разведения их (от 1:4 до 1:16) в 0,2 мл забуференного физиологического раствора. Добавляют по 0,2 мл эритроцитарного диагностикума. Реакцию ставят при комнатной температуре или при 37 °C в течение 2 ч.
Контроли: эритроцитарный диагностикум + контрольная положительная сыворотка; эритроцитарный диагностикум + контрольная отрицательная сыворотка; эритроцитарный диагностикум + забуференный физиологический раствор.
5.4. Учет результатов РНГА проводят при полном оседании эритроцитов в контроле с отрицательной сывороткой.
Давшими положительный результат считают те пробы сывороток, которые в разведении 1:16 и выше вызывают агглютинацию эритроцитарного диагностикума при положительном результате в контроле с положительной сывороткой и отрицательном результате реакции в других контролях.
5.5. РНГА можно ставить методом микроагглютинации с помощью аппарата Такачи.
6.1. Биопробу ставят на супоросных свиноматках за 3 ... 5 дней до опороса или на поросятах-сосунах 1 ... 2-дневного возраста, взятых из благополучного по инфекционным болезням хозяйства.
Свиноматку или поросят заражают 10%-ной суспензией, приготовленной из пораженных стенок тонкого отдела кишечника вынужденно убитых в агональном состоянии животных или вируссодержащей культуральной жидкостью. Суспензию центрифугируют при 3000 об/мин в течение 30 мин, в надосадочную жидкость добавляют пенициллин из расчета 1000 ЕД и стрептомицина 500 мкг на 1 мл, выдерживают при комнатной температуре в течение 2 ч и проверяют на стерильность (методом посева на МПБ, МПА, среду Китта-Тароцци).
10 мл указанной надосадочной жидкости вводят через рот одной свиноматке или поросятам от одной свиноматки (первая группа).
Контролем служит вторая супоросная свиноматка или незараженные поросята второй свиноматки (вторая группа).
6.2. Биопробу считают положительной, если через 24 ч (реже через 48 ч) после заражения поросята, родившиеся от зараженной свиноматки, или поросята первой группы заболевают с клиникой вирусного гастроэнтерита свиней.
В сомнительных случаях проводят исследование органов от вынужденно убитых в агональном состоянии поросят подопытной группы на наличие вируса этой болезни методом ИФ и РН.
7.1. Электронную микроскопию проводят в научно-исследовательских учреждениях.
7.2. Материалом для исследования служат пораженные участки тонкого отдела кишечника от вынужденно убитых больных поросят.
7.3. Из пораженных участков кишечника готовят препараты-отпечатки. Участки кишечника длиной 4 ... 5 см разрезают вдоль и разворачивают слизистой вверх на предметном стекле. К поверхности слизистой прикладывают коллоидной стороной сеточки, используя для каждой сеточки новые участки. Сеточки промывают 2 ... 3 каплями дистиллированной воды и подвергают негативному контрастированию.
На коллоидную пленку сеточек наносят пипеткой 2%-ный раствор фосфорно-вольфрамата натрия, который снимают фильтровальной бумагой. Затем препараты просматривают в электронном микроскопе.
7.4. Для приготовления раздавленных препаратов на поверхность слизистой пораженного кишечника помещают 3 капли дистиллированной воды, тупым концом глазного скальпеля через воду много раз ударяют по слизистой для получения вируссодержащей суспензии. На полученную суспензию накладывают сеточки коллоидной стороной на 1 ... 2 мин. Затем сеточки промывают 2 ... 3 каплями дистиллированной воды и подвергают негативному контрастированию.
7.5. Обработка препаратов иммунной сывороткой. До негативного контрастирования приготовленные сеточки обрабатывают гипериммунной сывороткой к эталонному штамму вируса вирусного гастроэнтерита свиней с титром не менее 1:160. Для этого на предметное стекло с луночкой помещают несколько капель сыворотки, в которую помещают коллоидные сеточки и выдерживают в течение одного часа при комнатной температуре во влажной камере. Затем сеточки отмывают дистиллированной водой, подвергают негативному контрастированию и просматривают в электронном микроскопе. Для контроля просматривают такие же сеточки, обработанные гетерологичной иммунной сывороткой.
7.6. Учет результатов проводят на приборе с разрешающей способностью 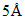 .
.
Диагноз на вирусный гастроэнтерит свиней считается положительным при наличии в препаратах вирионов размером 70 ... 120 нм, на оболочке которых размещены частоколом булавовидные шипы, характерные для коронавирусов; в препаратах, обработанных иммунной сывороткой к вирусу этой болезни, обнаруживают на оболочке вирионов скопления белковых молекул.
В контрольных препаратах, обработанных гетерологичной иммунной сывороткой, таких скоплений на вирионах не наблюдается. Диагноз подтверждают электронными фотографиями (1).