СПРАВКА
Источник публикации
"Лабораторные исследования в ветеринарии", М.: Издательство "Колос", 1974
Примечание к документу
Название документа
"Методические указания по диагностике отравлений рыб и токсичности водной среды"
(одобрены Главным управлением ветеринарии МСХ СССР 14.09.1972)
"Методические указания по диагностике отравлений рыб и токсичности водной среды"
(одобрены Главным управлением ветеринарии МСХ СССР 14.09.1972)
Содержание
Главным управлением
ветеринарии МСХ СССР
14 сентября 1972 года
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ДИАГНОСТИКЕ ОТРАВЛЕНИЙ РЫБ И ТОКСИЧНОСТИ ВОДНОЙ СРЕДЫ
Подготовлены Центральной лабораторией по изучению болезней рыб Всесоюзного ордена Ленина института экспериментальной ветеринарии и отделом по болезням рыб Главного управления ветеринарии МСХ СССР. Одобрены Главным управлением ветеринарии МСХ СССР 14 сентября 1972 г.
Разработаны кандидатами биологических наук А.И. Канаевым, В.В. Метелевым и Л.И. Грищенко.
Современная промышленность, сельское хозяйство и их отрасли используют огромное количество веществ различного химического состава, которые в конечном итоге попадают в водоемы. Все возрастающее применение химических средств в народном хозяйстве (инсектицидов, гербицидов, ихтиоцидов и других ядохимикатов), сброс неочищенных промышленных и коммунально-бытовых сточных вод в водоемы изменяют биоценозы, губительно действуют на молодь и икру рыб, уничтожают нерестилища и нагульные угодья, ограничивают миграции, снижают резистентность организма, ухудшают товарные качества рыбной продукции. Опасно также длительное действие малых доз ядохимикатов, обладающих кумуляцией и способных передаваться по трофическим цепям. Все это создает потенциальную опасность и для человека при употреблении в пищу таких рыб.
Загрязнение водоемов промышленными сточными водами и пестицидами обязывает специалистов, обслуживающих рыбохозяйственные водоемы, осуществлять контроль за чистотой водоемов и вести борьбу с загрязнениями.
При обнаружении гибели рыб проводят комплексные исследования по выяснению причин их гибели согласно нижеприведенным методическим указаниям.
Диагностику отравлений рыб проводят комплексными методами, включающими сбор и анализ анамнестических сведений, а также различные исследования (гидрохимические, гидробиологические и химико-аналитические, в том числе спектральный анализ и хроматографию в тонком слое, радиобиологические, физиологические, клинические, патоморфологические и др.).
В случае гибели рыбы ветврач-ихтиопатолог совместно со специалистами органов рыбоохраны, водного хозяйства и санитарно-эпидемиологической станции должен провести обследование водоема по следующей схеме:
общее обследование водоема и выявление источника его загрязнения;
клиническое и патологоанатомическое исследование рыб;
взятие, консервирование, упаковка и пересылка материала на исследование;
гидрохимическое и химико-аналитическое исследование;
биологическое исследование ("рыбная проба");
органолептическое исследование;
гематологическое, биохимическое и другие исследования. На основании полученных данных обследования делают заключение.
И ВЫЯВЛЕНИЕ ИСТОЧНИКА ЕГО ЗАГРЯЗНЕНИЯ
При подозрении на сброс промышленным предприятием в водоем неочищенных или недостаточно очищенных сточных вод, вызвавших гибель рыб, проводят комиссионное с участием представителя государственной ветеринарной службы, санитарно-эпидемиологической службы, органов рыбоохраны и водного хозяйства обследование этого предприятия и участков водоема, где обнаружены больные и погибшие рыбы. При этом собирают анамнестические сведения об отравлении и гибели рыб, устанавливают место отравления и время появления болезни или гибели рыб, учитывают особенности течения болезни, выявляют видовой состав живых и погибших рыб и других гидробионтов.
Пробу воды, рыбы и грунта для лабораторного исследования берут непосредственно на месте гибели рыб. На месте же определяют температуру, pH, запах, окраску воды, наличие летучих ингредиентов и количество растворенного в воде кислорода, а также проводят клиническое наблюдение и патологоанатомическое вскрытие больных и погибших рыб.
От технологов промышленных предприятий получают сведения о количестве и составе сбрасываемых сточных вод и производят забор проб.
Для сбора данных об условиях образования сточных вод на предприятии изучают технологическую схему производства, надежность работы очистительных сооружений. По каждому узлу предприятия выявляют количество образующихся сточных вод, их состав по данным технологической схемы (по регламенту) заводской лаборатории.
Особое внимание уделяют вопросу о соответствии состава и количества сточных вод, поступающих на очистительные сооружения, запроектированной производительности сооружений. Наиболее трудоемкую часть работы составляет сбор лабораторно-аналитических данных по характеристике сточных вод на разных этапах очистки.
В случае, если на участке водоема ниже выпуска сточных вод одного предприятия расположены и другие промышленные предприятия, сбрасывающие сточные воды, следует отдифференцировать стоки.
Если эти предприятия разного профиля, то ориентируются на ведущие ингредиенты, характерные для каждого предприятия. В случае невозможности отдифференцировать один сток от другого из-за отсутствия условий для аналитических методов количественного определения отдельных ведущих ингредиентов используют расчетные способы разбавления.
При отсутствии промышленных предприятий в районе гибели рыб выявляют возможность поступления токсических веществ в водоем из других очагов загрязнения. В районе гибели рыб и вверх по течению рек необходимо получить сведения о наличии или отсутствии радиоактивного загрязнения водоема, о масштабах и сроках применения пестицидов.
БОЛЬНЫХ И ПАВШИХ РЫБ
ИС МЕГАНОРМ: примечание. В официальном тексте документа, видимо, допущена опечатка: приложение 1а отсутствует. |
На основании клинической картины отравления можно иногда определить группу или природу яда, что, в свою очередь, позволяет определить причину гибели рыб в естественных водоемах (см. приложения 1, 1а).
Внешнему осмотру подвергают 50 - 100 экземпляров больных и погибших рыб.
Клиническое исследование проводят по общей схеме, принятой в ихтиопатологии. В первую очередь изучают поведение рыб. Для этого отловленных рыб (5 - 10 экземпляров каждого вида) помещают в аквариум и после некоторого периода адаптации их в новых условиях изучают поведение.
При этом обращают внимание:
а) на поведение рыбы (спокойна, возбуждена, угнетена);
б) на дыхание (частота, глубина, ритм дыхания);
в) на подвижность (дрожание, стремительное плавание, вялые, затрудненные движения или у нее наступает паралич);
г) на возникновение судорог от внешнего раздражения, а также судорог челюстей, хвоста, плавников; усиливаются они или ослабевают;
д) "чувствует" ли рыба свое положение (движение глаз, компенсаторное положение плавников);
е) испытывает ли она асфиксию (захватывание пузырьков воздуха на поверхности воды).
Далее проводят внешний осмотр и патологоанатомическое вскрытие рыб. Вскрытию подвергают 15 - 20 рыб каждого вида.
При внешнем осмотре устанавливают возраст и вид рыбы, ее упитанность. О времени гибели рыб судят по наличию или отсутствию трупного окоченения, изогнутости тела, положению жаберных крышек и жабр (открыты или прижаты к туловищу).
Обследуют внешние покровы, отмечают их вид (блестящие или тусклые), состояние пигментных клеток-хроматофоров, отсутствие или наличие слизи, ее количество, качество, цвет. На плавниках отмечают целостность лучей, состояние чешуйных покровов, наличие участков гиперемии, гидремии тела, состояние брюшка, жаберных крышек, ротовой полости, анального отверстия.
Отмечают цвет жабр, наличие в них слизи, ее количество, состояние жаберных лепестков, их срастание или слипание, расширение или истончение, наличие между лепестками налета, осадка или инородных предметов, кровоизлияний и т.д. Особенно внимательно просматривают кончики жаберных лепестков, хрящевые лучи которых часто оголяются вследствие разрушения мягких тканей. Это можно установить только под микроскопом.
Для осмотра глаза его извлекают из орбиты, обращают внимание на размер, наличие слизи или гноя, покраснений, кровоизлияний, помутнение хрусталика, определяют состояние роговицы.
Рыбу вскрывают путем разреза брюшной стенки по общепринятому методу и исследуют состояние скелетной мускулатуры (цвет, консистенцию, наличие кровоизлияний, гидремии, степень прикрепления к костям). Затем осматривают брюшную полость, отмечают наличие в ней выпота (количество, цвет, запах, консистенцию), обращают внимание на расположение органов, состояние внутреннего жира (количество, цвет), на изменение брюшины и серозных покровов, состояние крови (свернувшаяся, жидкая). Органы извлекают из брюшной полости и отделяют друг от друга. Определяют их состояние по следующим признакам: размер, характер краев, цвет, консистенция, наличие кровоизлияний или очагов некроза; на разрезе определяют степень кровенаполнения, рисунок.
Желудок и кишечник после наружного осмотра вскрывают и учитывают степень наполнения кормовыми массами, наличие студенистых масс: обращают внимание на цвет, консистенцию, толщину слизистой оболочки, отмечают наличие гиперемии и кровоизлияний.
Для извлечения головного мозга делают три разреза крышки черепной коробки: один из них поперечный - по заднему краю затылочной кости и два продольных - в направлении к носовым отверстиям.
Основное внимание при обследовании головного мозга обращают на состояние жира, кровенаполнение сосудов, цвет, консистенцию вещества мозга, наличие застоя крови.
Клиническое и патологоанатомическое обследование дополняют бактериологическим и паразитологическим исследованием по принятым в ихтиопатологии методикам.
МАТЕРИАЛА ДЛЯ ИССЛЕДОВАНИЯ ПРИ ПОДОЗРЕНИИ НА ОТРАВЛЕНИЕ РЫБ
Отбор проб. На предприятии отбирают среднесменные, при возможности среднесуточные пробы воды общего выпуска, каждую объемом 2 - 3 л. Записывают время и место отбора проб, характер пробы (разовая, среднесуточная) и количество сточной воды.
Кроме взятых с промышленного предприятия проб сточных вод, берут пробы из водоема (2 - 3 л). Пробы воды надо брать так, чтобы образец соответствовал составу всей массы исследуемой воды: на быстринах, перепадах, водосбросах и водоспусках. При отборе необходимо исключить элементы случайности (временная взмученность, случайное загрязнение). Пробы следует брать из поверхностных (30 - 50 см от зеркала) и глубинных слоев. Для взятия глубинных проб воды применяют батометры различных конструкций. Наиболее распространенным является батометр Рутнера. Каждую пробу воды берут в количестве 1 - 3 л.
Важное условие при взятии проб воды - чистота тары и пробки. Воду для химического анализа отбирают в склянки, чисто вымытые (без мыла). Перед наполнением склянку промывают 2 - 3 раза исследуемой водой. Кроме пробы воды, следует брать пробу грунта из водоема. Пробу грунта берут с поверхности дна дночерпателем Экмана или Кирпичникова в количестве 2 кг. Затем грунт сушат на воздухе, протирают через мягкое сито и упаковывают в широкогорлые банки или полиэтиленовые мешочки по 500 г воздушной сухости. Планктон, так же как и грунт, способен кумулировать ядохимикаты. Для получения пробы планктона на 50 - 100 л воды из водоема фильтруют через планктонную сетку. В зимнее время при транспортировке проб нельзя допускать их замораживания.
Рыбу для лабораторного исследования доставляют в свежем виде, не менее пяти экземпляров. Только что уснувших рыб доставляют немедленно. Одновременно направляют рыб того же вида из благополучного водоема. Пробы снабжают этикеткой с подробными сведениями о месте и времени вылова и гибели рыб.
Консервирование проб. Для получения достоверных данных гидрохимического анализа исследование отобранных проб воды должно быть проведено в течение суток с момента взятия. Если определение растворенного кислорода на месте сделать нельзя, его фиксируют: на 50 мл исследуемой воды добавляют 3 мл MnCl2 (40%-ного) и 3 мл смеси раствора NaOH (32%-ного) с KJ (10%-ного). Если при пересылке воды в лабораторию в теплое время потребуется свыше суток, пробы рекомендуется консервировать. Для этого на каждый литр воды добавляют 2 мл хлороформа и хорошо взбалтывают. Эта проба предназначается для определения взвешенных веществ, нитратов и нитритов. Во вторую порцию, предназначенную для определения аммиака, окисляемости и хлоридов, на 1 л добавляют 2 мл 25%-ной серной кислоты. Третью пробу, предназначенную для химического анализа, (нахождение токсических компонентов сточных вод), не консервируют (см. приложение 2).
Если нельзя быстро доставить пробы рыб, их консервируют спиртом-ректификатом. Консервировать формалином, глицерином, карболовой кислотой, сулемой, денатурированным спиртом и другими веществами нельзя. Одновременно высылают 50 - 100 г спирта, которым консервировали материал.
Пробы воды, грунта, планктона и рыб упаковывают в стеклянную посуду или целлофановые пакеты, опечатывают и вместе с актом обследования, данными клинических и патологоанатомических исследований направляют с нарочным в ветлабораторию (гидрохимические исследования по договоренности можно проводить в лабораториях санитарно-эпидемиологических станций). В сопроводительном письме для химико-аналитического исследования указывают предполагаемое токсическое вещество, которое следует установить в воде или рыбе.
Поступивший в лабораторию материал делят на две части: одну часть исследуют, а другую хранят в холодильнике для контроля и на случай возникновения спорных вопросов. Материал подвергают органолептическому, гидрохимическому, химико-аналитическому, гематологическому, биохимическому и другим исследованиям, в зависимости от показаний.
Большое значение в диагностике отравлений рыб имеют органолептические исследования свойств воды, наличие взвешенных частиц, pH, содержание кислорода, окисляемость, биохимическое потребление кислорода (БПК), содержание азота, аммиака, нитритов, нитратов, сульфидов, сульфатов, железа, углекислоты.
На основании гидрохимических исследований исключают роль температурных и заморных явлений в гибели рыб (см. приложение 3).
При получении результатов гидрохимического анализа проб, взятых из водоема, их сопоставляют с данными исследования сточных вод промышленного предприятия и дают объективную характеристику санитарных условий и последствий сброса.
Примечание. Из более чем 150 вредных веществ, спуск которых регламентируется санитарным законодательством, около половины диагностируется по органолептическим признакам. Около 25% вредных сточных вод влияет на гидрохимические свойства воды. Поэтому изменения гидрохимических свойств могут явиться косвенным показателем в установлении последствий сброса сточных вод в водоем.
При проведении химико-аналитических исследований необходимо учитывать, что яды промышленных сточных вод и пестициды в организме рыб имеют определенные места локализации, отличающиеся от мест локализации у теплокровных животных.
Следует также помнить, что обнаружение яда в трупах отравленных рыб может быть осуществлено не во всех случаях и лишь тогда, когда для исследования взята недавно погибшая рыба.
Примечание. Токсическими дозами или концентрациями называются такие, которые вызывают нарушение физиологических функций организма, заканчивающееся выздоровлением или гибелью рыб.
При этом учитывают:
1) максимально токсическую дозу или концентрацию, вызывающую начальные, клинически достоверные признаки отравления;
2) максимально переносимую дозу или концентрацию, вызывающую характерные, резко выраженные признаки отравлений;
3) смертельную дозу. Дозы, вызывающие гибель 100% рыб в остром (за 24, 48 или 96 часов) или хроническом опыте, называются абсолютно смертельными (CL100 - акуста, CL100 - хроника), а 50% гибели (CL50) - медианными летальными;
4) пороговую концентрацию (наименьшую концентрацию химического вещества), вызывающую определенные изменения физиологических функций организма, регистрируемую наиболее чувствительными методами исследования;
5) предельно допустимую концентрацию (ПДК) токсического вещества в водоеме, не оказывающую влияния на плодовитость организма и качество потомства, то есть обеспечивающую сохранность вида.
В слизи, снятой с кожи рыбы и разведенной уксусной кислотой, аналитическим методом определяют соли тяжелых металлов: ртуть, кадмий, никель, кобальт, марганец (см. приложение 4).
Никель, кобальт и ртуть могут быть обнаружены в жабрах; магний и кадмий - в кишечнике, печени, почках; мышьяк и свинец - в мышцах. Фтор при остром отравлении локализуется в лепестках жабр и мышцах, при хроническом отравлении - в костных образованиях.
Спектроскопический метод исследования при отравлении указанными элементами дает отрицательные результаты.
Детергенты локализуются в жабрах, желудочно-кишечном канале (выше желчного протока) и в небольшом количестве в гонадах рыб.
Цианиды у отравленных рыб не обнаруживаются, так как быстро распадаются до конечных продуктов (муравьиная кислота).
Хлорорганические соединения довольно стойкие, концентрируются в висцеральном жире, половых продуктах, пилорических придатках и в небольшом количестве в мышцах и жабрах.
Фосфорорганические соединения локализуются в большом проценте в паренхиматозных органах, в жире, севин - в почках и печени.
При отрицательных результатах исследования воды и рыб необходимо исследовать грунт, ил, бентос. Многие токсические вещества сточных вод кумулируются в донных отложениях, водорослях, водных растениях. Иногда в грунте их накапливается в десятки и даже сотни раз больше, чем в воде. Исследованием водных растений можно установить загрязнение водоема цинком и медью.
Примечания. 1. Гидрохимические исследования проводятся согласно Методическим указаниям по санитарно-гигиеническим исследованиям воды.
2. Химико-аналитические исследования следует проводить по унифицированным методам исследования качества вод (СЭВ, 1971).
3. Исследование рыб на обнаружение токсических веществ следует проводить методами, изложенными в книге "Теория и практика химико-токсикологического анализа в ветеринарии" (А.В. Николаев, 1968).
Биологические исследования. Для доказательства токсичности водной среды проводят биологические исследования методом "рыбной пробы" и одновременно постановкой аквариумных опытов с наиболее чувствительными гидробионтами. Сущность биологического исследования основана на воздействии токсического вещества на организм гидробионта или другого животного с учетом физиологических показателей (клинические признаки, гибель).
Для постановки "рыбной пробы" в делевой садок помещают наиболее чувствительных к токсическим веществам рыб (ерш, окунь, форель, верховка, налим, судак, щука) и ведут за ними наблюдение. Одновременно в аквариумах ставят опыты на исследуемой воде (взятой из водоема) с чувствительными тест-объектами (дафниями, хирономидами, циклопами, аквариумными рыбками) и чувствительными речными рыбами.
В силу простоты и наглядности постановка "рыбной пробы" позволяет быстро определить токсичность водной среды.
В лабораторных условиях при необходимости проводят биологические исследования по определению токсичности водной среды, особенно при подозрении на пестицидное загрязнение водоема.
По чувствительности биологические методы могут соперничать с химическими. При правильном подборе условий (навеска объектов, метод изоляции яда, вид животного) удается обнаружить минимальные количества пестицидов - 0,1 мг на 1 кг веса животного.
В качестве биологических тест-объектов следует использовать кормовых водных беспозвоночных, личинок водных насекомых, моллюсков, нитчатые водоросли, водные растения, комнатных мух, дрозофил и малоценных теплокровных животных.
Метод сухой пленки. Пестициды извлекают из исследуемого объекта ацетоном. Экстракт фильтруют в чашку Петри и испаряют. Затем в чашку помещают 20 - 30 мух и ведут за ними наблюдение. Появление у всех подопытных мух нервно-паралитических явлений и отсутствие их у контрольных указывают на наличие ядохимикатов.
Метод кормления. Внутренние органы отравленных рыб растирают в ступке с сахарным песком и скармливают комнатным мухам. Отравление рыб пестицидами подтверждается, если все мухи погибают с типичными признаками судорог и параличей.
Метод водных взвесей заключается в выдерживании (экспонировании) личинок комаров, дафний, циклопов, инфузорий или рыб в водных суспензиях, эмульсиях или водных растворах ядохимикатов.
Парентеральный метод. Основан на подкожном или внутрибрюшном введении экстрактов или водных смывов с исследуемых объектов белым мышам.
В качестве дополнительного биологического исследования токсичности водной среды можно использовать индикаторы сапробности (см. приложение 5).
Биологический метод исследования позволяет установить токсичность водной среды, но не дает возможности определить химическую природу и количество токсиканта в исследуемом объекте.
Органолептические исследования основаны на свойстве многих химических веществ издавать запахи, которые определяют по пятибалльной системе. Так, органолептически могут быть определены фенол и его производные: монохлорфенол и гваякол, мононитробензол, бутилбензол мононитротолуол, толуидин, хинолин, масляная кислота, нафтол, нафтиламин и др.; нефть и продукты ее перегонки (бензин, керосин, соляровое масло и др.); смолы и дегти, канифоль; терпены, камфора, тимол, ментол, эфирные масла и хвои, смоляные кислоты; альдегиды; формальдегид, параформалин, метальдегиды и др.; пестициды и фосфорорганические соединения.
При проведении органолептических исследований необходимо учитывать роль ряда факторов, в частности температуру, состав воды, ее хлорирование и другие показатели, способные влиять на органолептические свойства воды.
Концентрация большинства сильно пахнущих веществ, определяемых органолептически, как правило, находится ниже границы, при которой эти вещества оказывают токсическое действие. Это обстоятельство весьма важно для ветеринарно-санитарной экспертизы.
Органолептическое исследование мяса рыб проводят пробой варки. Для этого в колбу помещают мелко нарезанные кусочки мяса рыбы, заливают водой, колбу закрывают стеклом и нагревают до кипения. После закипания бульона стекло приподнимают и определяют запах исследуемых рыб. Учитывают места локализации запахов. Установлено, что запах и привкус концентрируются в большом проценте в тканях, богатых жиром (нервная, жировая), в брюшной полости и на боковой линии рыб, в то время как в хвостовой части запахов значительно меньше. Методом дистилляции нервной и жировой ткани можно сконцентрировать запахи, что позволит повысить порог их восприятия.
При гибели рыб в естественных водоемах необходимо использовать возможно более широкий набор тестов, позволяющих выявить природу токсиканта по функциональному состоянию организации. Одни яды вызывают изменения в центральной нервной системе, другие - в крови (гемолитические яды), третьи - в ферментных системах.
Гематологические исследования позволяют установить качественные и количественные изменения форменных элементов и лейкоцитарной формулы крови, а также осмотической резистентности эритроцитов под влиянием ряда токсических веществ. Форменные элементы крови подвергаются деформации, массовому разрушению, изменениям оболочки (сморщивание, разрушение, изменение порозности), цитоплазмы (набухание, изменение зернистости, вакуолизации и др.) и ядра (изменение структуры и окраски, кариорексис, деление и выталкивание ядер и др.). Кровь под влиянием гемолитических ядов наполняется амитотически делящимися формами эритроцитов, патологическими ядерными и безъядерными тельцами эритроцитного и лимфоидного происхождения. Регистрируются анизацитоз, пойкилоцитоз, шистоцитоз, полихромазия и другие патологические формы эритроцитов.
Биохимические исследования. Чувствительными индикаторами, отражающими изменения деятельности различных функциональных систем под влиянием токсических веществ, являются повышенное содержание сахара в крови и гликогена в печени, белковый спектр сыворотки крови, активность ферментов и др. Так, биохимическим методом может осуществляться диагностика фосфорорганических соединений (ФОС). Показателем наличия ФОС в исследуемом объекте является антихолинэстеразный эффект. Предел чувствительности биохимического метода для ФОС равен 1·10-6 - 1·10-7 (по Хестрину).
При угнетении активности холинэстеразы на 20 - 30% отмечается легкая степень отравления, на 50 - 60% - средняя и на 80% и более - тяжелая степень отравления.
Определение хлорорганических соединений также может осуществляться биохимическим методом. При отравлении ими отмечают гипергликемию и снижение гликогена в печени.
В диагностике отравлений рыб определенное значение могут иметь гидробиологические исследования: исчезновение чувствительных видов и изменение биоценозов донной фауны, изучение экологических особенностей мест обитания разных видов проходных, полупроходных и туводных рыб (мест кормления, преднерестовые концентрации, время и пути преднерестовых миграций).
Составление заключения. Диагноз на отравление рыб ставят на основании анамнестических, клинических, патологоанатомических данных и результатов лабораторных исследований. После этого принимают меры по устранению источника загрязнения.
Охрана водоемов от загрязнений включает комплекс мероприятий организационного, технико-экономического и законодательного порядка. Регламентация сброса вредных сточных вод в водоемы и разработка профилактических мероприятий по охране их от загрязнений должны основываться на глубоком научном исследовании источников загрязнения и их токсикологической значимости, определении предельно допустимых концентраций вредных веществ и разработке эффективных методов очистки сточных вод.
Анализ материалов по отравлениям рыб, характеристике источников загрязнений и экономическому ущербу показывает, что на первом месте стоят промышленные сточные воды. Отравление рыб происходит главным образом вследствие сброса недоочищенных или неочищенных сточных вод. Поэтому основная задача - контроль за сбросом сточных вод.
Значительную угрозу для рыбного хозяйства представляют также минеральные удобрения и пестициды, применяемые в сельском хозяйстве, которые могут попадать в водоемы при смыве дождевыми и талыми водами с обработанных полей или вследствие неправильного хранения на складах, а также при сносе их воздушной волной в период авиаобработок и т.п.
Профилактика отравлений гидробионтов в этих случаях должна основываться на правильном хранении пестицидов и удобрений, соблюдении правил их применения и контроле за наличием остаточных количеств во внешней среде.
Категорически запрещается применять вблизи рыбохозяйственных водоемов такие пестициды, как ДДТ и его аналоги, гексахлоран, альдрин, дильдрин, гептахлор, полихлорпинен, полихлоркамфен. В районах массового применения пестицидов необходимо периодически проверять возможность накопления их остатков в воде, рыбе и других объектах, для чего следует направлять пробы для исследования в ветеринарные лаборатории.
Яды локального действия разрушают респираторный эпителий жабр вплоть до полного отделения его от нитей жаберных пластинок, иногда вызывают кровотечение из жабр, а также изменения со стороны пигментных клеток - хроматофоров. Кожные покровы и жабры под действием ядов обильно покрываются слизью, создающей препятствие газообмену. В результате в организме рыб возникает недостаток кислорода и накапливается углекислота, увеличивается частота и глубина дыхания. Удушье у рыб проявляется в виде захватывания пузырьков воздуха на поверхности воды (рыба принимает диагональное положение - головой к поверхности воды). Гибнет с широко раскрытым ртом и жабрами.
К ядам локального действия относятся: хлор, перекись водорода, перманганат калия, озон, неорганические кислоты и щелочи, соли тяжелых металлов, формальдегид, органические кислоты, органические красители, дубильные вещества, детергенты и др.
Нервно-паралитические яды вызывают быструю потерю рефлекса равновесия, спиралеобразное плавание толчками, беспорядочные броски, стремление выпрыгнуть из воды. Периодические клонические судороги боковой мускулатуры вызывают плавательные толчки. Рыбы сильно возбуждены: у них отмечают нистагматическое дрожание глаз и резкое усиление судорог от внешнего раздражения. Судороги могут длиться несколько минут или даже часов и периодически сменяться спокойным состоянием. В периоде покоя рыба лежит вытянувшись, с плотно закрытым или широко раскрытым ртом и веерообразно расширенными плавниками. Иногда у рыб можно наблюдать вялость, угнетение и параличи без стадии возбуждения.
К нервно-паралитическим ядам относятся: аммиак и соли аммония, углекислоты, некоторые щелочные и щелочноземельные металлы и прочие неорганические соединения (фтор, фосфор), нефть и нефтепродукты, фенолы, смолы и дегти, алкалоиды, сапонины, терпены, некоторые вещества растительного и животного происхождения (продукты выщелачивания древесины, токсины гидробионтов), пестициды (хлор- и фосфорорганические, производные карбаминовой кислоты, ряд гербицидов и альгицидов).
Яды протоплазматического действия вызывают расстройство обмена веществ и незаметно наступающую смерть. В эту группу входят фтор, цианиды, мочевина, меркаптаны.
Гемолитические яды разрушают эритроциты, специфически действуют на гемоглобин, в результате чего плазма крови окрашивается в красный цвет. К ним относятся: аммиак и соли аммония, свинец, цианиды, сапонины, селен, некоторые ФОС, диурон, токсины сине-зеленых водорослей.
Яды наркотического действия вызывают у рыб наркоз без стадии возбуждения. Сюда относятся: углеводороды (этилен, пентан и др.), алкилгалогениды (хлороформ, четыреххлористый углерод, дихлорэтан, трихлорэтан), алкоголи, эфиры, кетоны, альдегиды (параформальдегид, хлоралгидрат, параальдегид, альдол) и др.
Энзиматические (ферментативные) яды угнетают активность ацетилхолинэстеразы. В организме накапливается ацетилхолин, который вначале возбуждает организм, а затем вызывает полный блок холинергетических систем.
К энзиматическим ядам относятся пестициды из группы ФОС, производные карбаминовой кислоты, многие гербициды и альгициды, фториды, цианиды, азид натрия, сульфат натрия, гидроксиламин, некоторые детергенты меркаптаны.
Многие из вышеперечисленных веществ обладают комбинированным действием. Они действуют локально и резорбтивно. Аммиак и соли аммония обладают локальным, нервно-паралитическим и гемолитическим действием; цианиды - ферментативным, гемолитическим действием, цианиды - ферментативным, гемолитическим, протоплазматическим и незначительно локальным; фтор - нервно-паралитическим и локальным; формальдегид - нервно-паралитическим и локальным; сапонины - нервно-паралитическим, локальным, гемолитическим и т.д. Характер действия часто зависит от концентрации вещества. В высоких концентрациях, например фенолы, обладающие нервно-паралитическим действием, локально действуют прижигающе, неорганические кислоты в низких концентрациях на нервную систему и кровь - резорбтивно.
ПРИ ОТРАВЛЕНИИ РЫБ НАИБОЛЕЕ РАСПРОСТРАНЕННЫМИ
ТОКСИЧЕСКИМИ ВЕЩЕСТВАМИ
Токсическое вещество | Клинические признаки | Патоморфологические изменения | Токсическая концентрация (мг/л) | Примечание |
Неорганические кислоты | Рыбы совершают вялые плавательные движения по кругу, принимают диагональное положение - головой вверх, вздрагивают, опрокидываются на бок. В результате нарушения газового обмена снижается частота дыхания и наступает удушье. В низких концентрациях кислоты вызывают гемолиз или агглютинацию эритроцитов | Обильное наличие слизи на коже и жабрах. Жаберные крышки плотно прижаты. Кожа молочного цвета с участками покраснения, особенно на брюшке. Вторичное поражение - сапролегнией. Гистологически отмечают вакуолизацию, гиперсекрецию, затем дистрофию и некробиоз жаберного эпителия | Наиболее чувствительны карпы, гибнут при pH 4,8 - 5,0 | Жаберная слизь при отравлении кислотами и щелочами сохраняет реакцию в течение нескольких часов, что можно установить лакмусовыми бумажками |
Щелочи | Картина отравления в основном та же, что и при воздействии неорганических кислот. В концентрированных растворах щелочей мутнеет роговица. В ряде случаев наблюдаются судороги, а также кровотечения из жабр. Дыхание ускорено, смерть наступает от удушья | Количество слизи на коже и жабрах больше, чем при действии кислот; слизь не свертывается, прозрачная, покрывает все тело. Наблюдается слизистая дистрофия и некробиоз клеток кожи, а также колликвационный некроз участков кожи | Пороговая величина pH для форели 9,2; для окуня, ерша 9,2; для плотвы 10,4; для щуки, карпа 10,8 | |
Щелочные и щелочноземельные металлы (Zi, Na, K, Be, Mg, Ca, Cr, Ba) | Оказывают нервное, протоплазматическое и в высоких концентрациях локальное действие. Хлористый натрий в гипертонических концентрациях вызывает паралич нервно-мышечного аппарата, локальное разрушение жаберного эпителия. При отравлении солями натрия тело рыб приобретает темное окрашивание, а солями калия - светлое. Нервное действие проявляется кругообразным плаванием, переходящим в стремительное и толчкообразное, затем наступает состояние, подобное наркотическому | Соли калия разрушают жаберный эпителий, который сморщивается, слущивается и лизируется, что ведет к асфиксии. Хлористый натрий вызывает лизис протоплазмы эритроцитов; под микроскопом в поле зрения видны только ядра | Токсическая концентрация: NaCl - 13,0 KCl - 1,3 MgCl - 15,0 | |
Тяжелые металлы и их соли (Mn, Ni, Cr, Zn, Al, Cd, Pb, Fe, Cu, Co, Ag) | Беспокойство, толчкообразное плавание, опрокидывание на бок, затем снижение реакции на внешнее раздражение; обильное слизевыделение, расстройство газообмена - вначале увеличение, затем замедление дыхательного ритма. Гидроокиси железа и марганца отлагаются на икре, а также на жабрах, вызывая асфиксию. Соли свинца обладают гемолитическим действием. Трехвалентное железо, сульфат хрома, хромовые кислоты, бихромат калия, гидролизуясь, снижают pH и оказывают действие, подобное кислотам | На коже и жабрах толстая оболочка из коагулированной слизи. Никель вызывает темную окраску жабр. Шестивалентный хром вызывает скопление в брюшной полости оранжево-желтого цвета жидкости. Гистологически отмечается сильное разрушение респираторного эпителия (увеличение и некротический распад жаберной ткани). Аналогичные изменения в эпидермисе кожи. В коагулированной слизи обнаруживаются отторгнутые эпителиальные клетки | Токсическая концентрация: Co - 90,0 Ni - 25 - 45,0 Ag - 15 - 20,0 Pb - 0,2 - 10,0 Zn - 0,3 - 2,0 Cu - 0,8 - 1,0 Hg - 0,8 - 1,0 Cr - 10,0 - 15,0 | Все соли тяжелых металлов кумулируются в иле, планктоне, бентосе, растениях и водорослях. В больших количествах они локализуются: Pb, Cd, Ni, Mn - в слизи Co, Hg - в жабрах Mg, Cd - в кишечнике |
Соединения фтора (фтористый и кремнефтористый натрий, плавиковая кислота) | Симптомы ярко проявляются при высоких токсических концентрациях: сильное беспокойство, судорожное или плавание в наклонно-боковом положении, кружение вокруг оси, учащенное дыхание. При подостром и хроническом отравлениях отмечена общая водянка тела, ерошение чешуи, пятнистые кровоизлияния у основания плавников, слабая экзофтальмия. Кровь свертывается; отмечается лейкопения, увеличение количества нейтрофилов, полиморфноядерных и моноцитов, резкое снижение кальция в крови | Трупы ослизнены, кровь несвернувшаяся, изменения на коже (см. клинику). Жабры кровенаполнены, кровеносные капилляры варикозно расширены, отмечается их разрыв. Внутренние органы кровенаполнены. В почках дистрофия эпителия канальцев, кариопикноз; в печени - зернисто-жировая дистрофия | Токсическая концентрация: NaF - 350,0 Na2SiF6 - 22,0 | Соединения фтора при остром отравлении локализуются в жабрах и мышцах, при хроническом - в костях |
Хлор | После начального периода покоя рыбы возбуждены, выпрыгивают из воды, совершают круговые вращательные движения, затем становятся вялыми. Гибель наступает от асфиксии | Жабры и кожа сильно ослизнены. Внешние покровы бледные. Жабры светло-серые, кончики в виде светлой полоски шириной 1 - 2 мм. При длительном воздействии хлора респираторный эпителий разрушается до оголения хрящевых лучей | Токсическая концентрация - 0,05 - 0,2 | Хлор в рыбах не обнаруживается. Исследуют воду |
Аммиак и соли аммония (перхлорат аммония, хлористый и сернокислый аммоний) | Вначале незначительное возбуждение, затем очень сильные судороги, рыба мечется в воде и даже выпрыгивает на поверхность, плавники веерообразно раскрыты. Дыхание замедлено. Рыба гибнет с широко раскрытыми жаберными крышками и ртом; мышцы тела сильно напряжены. От сильных судорог иногда возникает кровотечение из жабр. Степень проявления клинических признаков зависит от концентрации и вида соединений | Наличие большого количества слизи на коже и особенно на жабрах, прижигание или набухание жаберных лепестков. В брюшной полости кровянистый экссудат, паренхима печени бледная, с локальными геморрагиями, сосуды кровенаполнены. Стенка кишечника с пятнистыми кровоизлияниями, местами истончена. Гистологически отмечают дистрофию и некробиоз респираторного эпителия жабр и клеток эпидермиса, дистрофию в печени и почках. Соли аммония вызывают менее выраженные изменения. Перхлорат вызывает резкие изменения в щитовидной железе (десквамацию эпителия), зернистость фолликулов и др. | Токсичность аммиака 0,2 - 1,0 | Аммиак определяется лакмусовыми бумажками, посинение красной и почернение свинцовой бумажек указывает на присутствие аммиака |
Сероводород и сульфиды | Опасны тем, что в их присутствии в воде резко снижается содержание кислорода. Сами по себе они также вызывают отравление. Дыхание рыб аритмичное, замедленное, может наступить паралич, тело покрывается опалесцирующей слизью. Перенесенная в свежую воду рыба быстро поправляется. Сульфиды нарушают клеточное дыхание | Данных нет | Токсичность сероводорода - 1,0 - 5,0; сульфида натрия - 50,0 | |
Углекислота | Беспокойство, одышка, затем расстройство координации движения, опрокидывание на бок и спину, наркотическое состояние. Перенесенные в свежую воду особи быстро поправляются | У погибших рыб жаберные крышки плотно прижаты к телу (при гибели от удушья жаберные крышки широко раскрыты) | Токсическая концентрация - 120 - 140 | |
Цианиды и дериваты цианидов | Очень распространенная группа загрязнителей. Вызывают повышение частоты и глубины дыхания, частичную потерю равновесия, затем ослабление дыхания и смерть. Характерный клинический признак отравления - то потемнение, то посветление кожного покрова. Рыбы, перенесенные в свежую воду в момент потери плавательных движений, быстро выздоравливают. Цианиды блокируют дыхательные ферменты, вызывая асфиксию | Трупы длительное время не подвергаются изменениям. Кровь погибших рыб медленно свертывается, в брюшной полости у них обнаруживают кровянистый транссудат. Паренхиматозные органы набухшие, мягкой консистенции. В селезенке - сгустки крови | Токсическая концентрация - 0,5 | Синильная кислота в теле рыб разлагается, поэтому ее не удается обнаружить |
Нефть и нефтепродукты | Клиника отравления характерна для действия нервно-паралитических ядов. Нарушается газообмен, что ведет к асфиксии | Тоненькая пленка на жаберных лепестках. Привкус нефтепродуктов в мясе рыб уже при концентрации 0,1 мг/л. Во всех органах расстройство кровообращения (полнокровие и эритродиапедезы); в жабрах и кишечнике наличие воспалительных и некробиотических изменений; в паренхиме печени, почек и миокарде выраженные дистрофические изменения; во внутренних органах и иногда в жабрах отложение желтого гематогенного пигмента | Токсическая концентрация - 1,5 | |
Фенолы | Вызывают нервно-паралитическое действие: сильное возбуждение, беспокойство, повышение чувствительности к раздражению, беспорядочное стремительное плавание, расстройство координации, длительное плавание в боковом положении, клонические судороги, вызывающие импульсивное (толчкообразное) плавание на боку. Дыхание вначале учащенное, затем замедленное. Судороги постепенно прекращаются, наступает угнетение и смерть от удушья | Изменения в жабрах и на внешних покровах бывают редко, хотя при высоких концентрациях фенолов отмечают сильное ослизнение кожи и жабр, а также обширные кровоизлияния в области грудных и брюшных плавников. Кровь у отравленных рыб медленно свертывается и становится густой. В брюшной полости отмечается скопление кровянистого транссудата. Печень грязно-серая, иногда мраморно окрашена, дряблой консистенции. Почки также грязно-серой окраски, дряблые. В желудочно-кишечном тракте жидкость соломенно-желтого цвета. Гистологически в печени, почках, сердце отмечается дистрофия, а также отложение гематоидина | Токсическая концентрация - 10,0 - 20,0 | |
Меркаптаны | Вначале повышенная чувствительность, судороги, дрожание плавников, опрокидывание, затем наступает резкое снижение чувствительности на раздражение | Мясо погибших рыб приобретает смолистый запах уже в концентрации 0,01 мг/л. Данных по патанатомии нет | Токсическая концентрация - 0,5 | |
Мочевина | Рыбы спокойны, кожные покровы и жабры сильно покрываются слизью, дыхание замедленно и смерть наступает незаметно. При расщеплении мочевины образуется аммиак | Жабры погибших рыб засорены, вследствие чего респираторный эпителий дистрофирован. В гипертонических растворах отмечается обезвоживание организма | Токсическая концентрация - 1000,0 | Количественное определение по аммиаку |
Пентахлорфенол и пентахлорфенолат натрия | Беспокойство, стремление выпрыгнуть из воды, опрокидывание на спину, часто отмечается кровотечение изо рта и жабр, захватывание воздуха, учащение дыхательного ритма | Многочисленные кровоизлияния во внутренних органах и жабрах | Токсическая концентрация - 0,4 | |
Сапонины | Светлое окрашивание туловища, расстройство дыхания, вначале беспокойство, а затем сильное возбуждение и обильное слизевыделение, потеря равновесия, параличи | Патологоанатомические признаки не характерны и слабо выражены. Отмечают разрушение жаберного эпителия и гемолиз эритроцитов | Токсическая концентрация - 2,0 - 5,0 | Качественная реакция |
Терпены | Нервно-паралитические симптомы с удушьем. Дыхание прерывистое, гибель наступает от паралича дыхания | Изменения во внутренних органах и жабрах незначительные. Мясо приобретает запах камфоры | Токсическая концентрация - 50,0 | Определяют органолептически и аналитически |
Детергенты (моющие вещества) | Увеличение потребления кислорода в 2 - 3 раза, вначале повышение, затем понижение частоты дыхания, нарушение равновесия, перевертывание на бок. Рыба гибнет от удушья с широко раскрытыми жаберными крышками и ртом. При низких концентрациях понижается резистентность организма, что ведет к развитию сапролегнии | Тело обильно покрыто слизью, плавники часто разрушены из-за разроста сапролегнии. Жабры покрасневшие и часто воспалены. Респираторный эпителий в состоянии дистрофии и частично некробиоза. Во внутренних органах существенных изменений не отмечается | Обнаруживают в жабрах, кишечнике и гонадах | |
Пестициды: 1) хлорорганические (ДДТ, ГХЦГ, гептахлор, альдрин, ПХП, и др.) | Оказывают на рыб нервно-паралитическое действие. Вначале вызывают возбуждение, беспокойство, нарушение равновесия и координации движения - плавание по кругу, затем сильные судороги. Перед гибелью наступают угнетение и параличи | Трупы при внешнем осмотре не имеют существенных изменений. Отмечается повышенное ослизнение кожи, в жабрах вакуолизация и частичный распад эпителия, в печени при малых концентрациях зернистая дистрофия, при смертельных некробиоз, в почках атрофия канальцевого эпителия, в кишечнике катаральное воспаление | Токсические концентрации: ДДТ 0,05 - 0,2; ГХЦГ 0,03 - 0,2; альдрин 0,004 - 0,008; ПХП 0,15 | Локализуются в висцеральном жире, пилорических придатках, гонадах и др. |
2) фосфорорганические (хлорофос, метилнитрофос - МНФ, фосфамид, трихлорметафос-3 - ТХМ-3) | Симптомы отравлений однотипны, отличаются по степени выраженности в зависимости от препарата и концентрации его в воде. Более тяжелые признаки отравления вызывают МНФ и ТХМ-3. Отмечают вначале возбуждение, беспокойство, стремительное движение и выпрыгивание рыб из воды, повышенную чувствительность к раздражителям, затем тремор мускулатуры и судороги. Возбуждение сменяется угнетением, наступает потеря равновесия, нарушение координации движения, понижение чувствительности, коматозное состояние. При интоксикации фосфамидом стадия возбуждения отсутствует. При хроническом отравлении клиническая картина сглажена, отмечается угнетение, исхудание, ослабление или потеря аппетита. В крови обнаруживаются резкая нейтрофилия, снижение активности холинэстеразы и др. | При вскрытии у павших и вынужденно убитых рыб отмечается повышенное ослизнение поверхности тела, побледнение жабр, повышенное кровенаполнение внутренних органов, особенно печени; кишечник пустой; ощущается запах ФОС. При хроническом отравлении - истощение, общая анемия, гидремия, побледнение внутренних органов, в кишечнике студневидная прозрачная слизь. Гистологически обнаруживается отек жаберных лепесточков, набухание, отслоение респираторного эпителия и его дистрофия, иногда некробиоз печеночных клеток, в почках иногда зернистая дистрофия эпителия канальцев и кариопикноз в клетках гемопоэтической ткани | Токсические концентрации: хлорофоса - 100,0; МНФ - 15,3; ТХМ-3 - 220,0; фосфамида - 40,3 | Диагностика комплексная: по клинике, патоморфологии и хроматографическому определению ФОС |
3) карбаматы (севин) | Стадия возбуждения отсутствует, наблюдается резкое угнетение, парезы и параличи, расстройство координации плавания, заглатывание воздуха, асфиксия. Реакция на корм отсутствует. При хроническом отравлении исхудание, вялость, поражение сапролегнией, общая анемия | Внешние покровы и жабры без существенных изменений, во внутренних органах слабо выраженная гиперемия. При хроническом отравлении - анемия внутренних органов, исхудание. Гистологически обнаруживается: в жабрах слабый отек лепесточков, очаговое набухание и отслоение эпителия; в печени, кроме повышенного наполнения сосудов, зернистая дистрофия и некробиоз отдельных клеток; в селезенке гемосидероз | Токсическая концентрация - 28,5 | |
4) гербициды (монурон, диурон, атразин и др.) | У рыб отмечают нервные явления, сходные с таковыми при отравлении другими пестицидами: возбуждение или угнетение, расстройство координации плавания, парезы, параличи и др. При отравлении диуроном наблюдается снижение количества эритроцитов и гемоглобина, лейкопения, распад клеток крови | Отмечается повышенное ослизнение кожи и жабр, редко пятнистые кровоизлияния на коже. В печени, почках и селезенке встречаются множественные кровоизлияния и зернистая дистрофия | Токсические концентрации: монурона 2,0, диурона 0,25 |
Примечание. В качестве токсической взята концентрация, вызывающая гибель 50% рыб (в основном карпов) при остром отравлении. Из клинических и патоморфологических признаков приведены только наиболее общие. Каждый препарат имеет некоторые особенности проявления отравлений.
Компоненты | Метод консервирования | Начало анализа | |||
добавка H2SO4 (мл/л) | добавка HNO3 (мл/л) | добавка CHCl3 (мл/л) | хранение при температуре 3 - 4° | ||
Агрессивная CO2 | Не консервируется | + | Сразу | ||
Азот общий | 1 | - | 2 - 4 | - | Ранее 24 часов |
Азот органический | 1 | - | 2 - 4 | - | То же |
Аммиак | 1 | - | 2 - 4 | + | Сразу |
Анионоактивные синтетические моющие вещества | - | - | 2 - 4 | - | Ранее 24 часов |
Биохимическое потребление кислорода | Не консервируется | + | То же | ||
Взвешенные вещества | Не консервируются | + | Сразу (ранее 24 часов) | ||
Железо | - | 5 | - | - | - |
Жиры | 2,5 | - | - | - | Сразу |
Жесткость | Не консервируется | + | - | ||
Запах | " | + | Сразу | ||
Кальций | " | - | - | ||
Карбонаты | " | + | Сразу | ||
Кислород | Консервирование включено в ход определения | - | " | ||
Кислотность | Не консервируется | + | " | ||
Магний | " | - | " | ||
Марганец | - | 5 | - | - | - |
Мутность | - | - | 2 - 4 | - | Ранее 24 часов |
Нитраты | 1 | - | 2 - 4 | + | То же |
Нитриты | 1 | - | 2 - 4 | + | Сразу |
Общее содержание примесей | Не консервируется | + | Не позже чем через 3 дня | ||
Окисляемость | 1 - 10 | - | - | + | Сразу (ранее 24 часов) |
pH, (H+), (OH-) | Не консервируется | + | Сразу | ||
Привкус | " | + | " | ||
Прозрачность | " | + | Сразу (ранее 24 часов) | ||
Растворенные вещества | Не консервируются | + | То же | ||
Смола | 2,5 | - | - | - | Сразу |
Соленость | Не консервируется | + | - | ||
Сульфаты | Не консервируются | + | - | ||
Сульфиды и сероводород | А. Не консервируются Б. В отдельную бутыль прибавляют 10 мл 10%-ного раствора ацетата кадмия или цинка (на 1 л) | + | Сразу | ||
Сульфиты | А. Не консервируются | + | Сразу | ||
Б. В отдельную бутыль прибавляют 0,2 мл 20%-ного раствора NaOH и 2 мл глицерина (на 100 мл) | - | - | |||
Удельная электропроводимость | Не консервируется | - | Ранее 24 часов | ||
Фенолы | А. При концентрации ниже 0,5 мг/л не консервируются | + | Сразу | ||
Б. При более высокой концентрации прибавляют 4 мл 20%-ного раствора NaOH | - | Ранее 48 часов | |||
Фосфаты | А. Не консервируются | - | Сразу | ||
Б. - | 2 - 4 | - | Ранее 24 часов | ||
Фториды | Отбор в полиэтиленовые бутыли | ||||
Хлориды | А. Не консервируются | - | - | ||
Б. - | 2 - 4 | - | - | ||
Цианиды | А. Не консервируются | - | Сразу | ||
Б. Добавляют щелочь до pH 11 | + | - | |||
Пробы, содержащие цианиды, нельзя консервировать кислотами | |||||
Щелочность | Не консервируется | - | Сразу (ранее 24 часов) | ||
Экстрагируемые вещества | Не консервируются | - | Сразу | ||
Примечание. При определении различных форм железа пробы консервируют ацетатными буферными растворами.
Растворенный в воде кислород является одним из главных гидрохимических показателей санитарного состояния водоема, обусловливающих самоочищение воды. Снижение концентрации кислорода сопровождается активацией процессов, денитрофикацией и сероводородным брожением, увеличением растворимости органических веществ донных отложений. Резкий дефицит кислорода в водоеме с образованием сероводорода, аммиака, свободной углекислоты вызывают сточные промышленные, коммунально-бытовые воды и особенно пестициды. В результате окисления органических веществ и резкого снижения вследствие этого кислорода наблюдаются заморы рыб.
Содержание кислорода в воде, вызывающее угнетение дыхания и гибель рыб (по Т.И. Привольневу), следующее, мг/л:
Вид рыб | Начало угнетения дыхания | Начало гибели |
Стерлядь | 7 - 7,5 | 3,5 |
Нельма | 6 - 7 | 4 - 4,5 |
Муксун | 4,5 - 5,0 | 1,5 - 2,0 |
Пелядь | 3,5 - 4,0 | 1 - 1,5 |
Сиг ладожский | - | 1,6 - 5,2 |
Форель ручьевая | - | 1,1 - 1,5 |
Форель радужная | - | 0,8 - 1,2 |
Налим | - | 1,4 - 3,2 |
Лещ | 2 - 2,5 | 0,4 - 0,5 |
Судак | 1,5 - 2,0 | 0,5 - 0,8 |
Окунь | 2,0 - 3,0 | 0,2 - 0,6 |
Язь | 3 - 4 | 0,5 |
Плотва | 2 - 3 | 0,7 |
Щука | 2 - 3 | 0,3 - 0,6 |
Карп | 1,5 - 2,0 | 0,2 - 0,3 |
Линь | 1 - 2 | 0,1 - 0,2 |
Карась | 1 - 2 | 0,1 |
Если в водоем поступают сточные воды, то судить о санитарном состоянии водоема только по содержанию кислорода в воде нельзя. Необходимо учитывать следующие гидрохимические показатели.
Окисляемость является важным санитарно-гигиеническим показателем загрязненности воды органическими веществами.
Содержание углекислоты (CO2) в воде очень резко возрастает при поступлении в водоем сточных вод. Свободная углекислота является одним из продуктов распада нестойких органических веществ бытовых сточных вод. При этом снижается содержание растворенного в воде кислорода, появляется сероводород, и вследствие этого погибают многие гидробионты. На глубине количество CO2 в воде увеличивается преимущественно за счет гниения.
Концентрация железа в воде тесно коррелирует с содержанием углекислоты. Способность закисного железа легко переходить в окисную форму и при этом связывать растворенный в воде кислород может сопровождаться массовой гибелью рыб и других гидробионтов.
Важным гидрохимическим показателем является наличие в воде аммиака, нитритов и нитратов. По содержанию этих веществ судят об органическом загрязнении вод, степени их минерализации и токсичности.
Аммиак содержится в воде в виде аммонийных солей. Присутствие их в воде обычно указывает на загрязнение ее разлагающимися органическими веществами животного происхождения (альбуминоидный аммиак). Но во многих болотных водах аммонийные соли нередко являются продуктом восстановления азотнокислых солей при отсутствии какого-либо загрязнения водоема. Здесь речь идет о солевом аммиаке. Косвенным доказательством органического происхождения аммиака является присутствие в воде одновременно нитритов, хлоридов и высокая окисляемость. Подтверждением органического происхождения нитритов может быть высокое их количество, постоянство содержания в воде, наличие в воде сопутствующего им аммиака, хлоридов и проч.
Присутствие нитратов (азотнокислых солей) в воде в большинстве случаев указывает на полную минерализацию азотсодержащих органических веществ. Подобное происхождение нитратов должно подтверждаться отсутствием в воде аммиака и нитратов; наличие же последних указывает на то, что этот процесс еще продолжается.
Хлориды в воде при наличии аммиака и нитритов служат показателем загрязнения воды коммунальными стоками.
Сульфаты могут быть минерального и органического происхождения. Резкие колебания концентрации сульфатов в воде свидетельствуют об их органическом происхождении.
Присутствие сероводорода в воде указывает на распад органических веществ, содержащих серу или сульфаты.
Жесткость воды зависит от растворенных в ней солей кальция и магния. За один градус жесткости принимают количество солей кальция и магния, эквивалентных 10 мг CaO в 1 л воды. Повышение жесткости обычно связано с обогащением воды CO2, образующейся в результате минерализации органических веществ.
Гидрохимический состав воды для прудового рыбоводства
Цветность - 15 - 30 | Азот альбуминоидный (мг NH4/л) - 0,5 - 1,5 |
Прозрачность - слегка мутная | Аммиак солевой (мг NH3/л) - 0,5 - 1,0 |
Кислород (мг/л) - 5 - 8 | Нитриты (мг NO2/л) - 0,5 - 1,5 |
Окисляемость (мг O2/л): | |
летом - 20 - 30 | Нитраты (мг NO3/л) - 1 - 2 |
зимой - 15 - 20 | Фосфаты (мг P2O5/л) - 0,1 - 0,4 |
Углекислота (мг CO2/л) - 10 - 20 | Железо общее (мг Fe/л) - 1 - 2 |
Сероводород (мг H2S/л) - следы | Хлориды (мг Cl/л) - 5 - 10 |
Щелочность - 1,8 - 2,0 | Сульфаты (мг SO4/л) - 20 - 30 |
Жесткость общая (в немецких градусах) - 5° и выше |
Определение pH универсальным индикатором. В фарфоровую чашку (палетку) наливают 1 - 2 мл исследуемой воды и смешивают ее с 1 - 2 каплями универсального индикатора. Окраску смеси сравнивают с бумажной цветной шкалой и устанавливают pH.
Аммиак. В пробирку, предварительно сполоснутую исследуемой водой, наливают 10 мл воды и прибавляют 0,3 мл 50%-ного раствора сегнетовой соли и 0,3 мл реактива Несслера. Через 10 минут количественное содержание аммиака определяют приближенно по следующей таблице:
Окрашивание сбоку | Окрашивание сверху | Содержание аммиака (мг/л) |
Нет | Нет | Меньше 0,04 |
Нет | Слабое, слабо-желтое | 0,08 |
Слабое, слабо-желтое | Слабо-желтое | 0,2 |
Слабо-желтое | Желтоватое | 0,4 |
Слабо-желтоватое | Светло-желтое | 0,8 |
Светло-желтоватое | Желтое | 2,0 |
Желтое | Интенсивно желтое, буроватое | 4,0 |
Интенсивно бурое, раствор мутный | Бурое, раствор мутный | 8,0 |
Мутноватое, резко-желтоватое | То же | 20,0 |
Хлор. В пробирку наливают 10 мл исследуемой воды, прибавляют 1 - 2 капли аммиака (NH3) и 2 - 4 капли 10%-ного раствора азотнокислого серебра (AgNO3). При наличии хлора появляется белая муть и выпадает творожистый осадок.
Медь. К 20 мл исследуемой воды прибавляют 1 мл 40%-ного раствора цитрата аммония, 2 мл 0,1 н. раствора комплекса III (37,2 г двунатриевой соли этилендиаминтетрауксусной кислоты растворяют в 1 мл дистиллированной воды и добавляют 2 мл 1%-ного раствора диэтилдитиокарбамината натрия). Появление коричневого осадка указывает на присутствие меди (десятые доли мг/л), коричневая муть появляется при содержании 0,05 мг/л меди. После добавления 2 мл хлороформа и встряхивания слой хлороформа должен приобрести желто-коричневую окраску (0,02 мг/л меди). Помутнение раствора с образованием белого осадка или желтой окраски не является доказательством присутствия меди.
Цинк. К 50 мл исследуемой воды добавляют несколько капель концентрированной соляной кислоты и после перемешивания с примерно 20 мл ацетатного буфера (10%-ный раствор ацетата натрия) доливают 3 мл раствора тиосульфата натрия (готовят растворением 50 г Na2S2O3·5H2O в 30 мл дистиллированной воды) и 3 мл рабочего раствора дитизона (приготовление см. ниже). Смесь тщательно встряхивают. В присутствии цинка цвет органического слоя с дитизоном переходит в фиолетовый или красный.
Приготовление основного раствора дитизона. 50 г дитизона растворяют в 100 мл четыреххлористого углерода в делительной воронке, добавляют 200 мл дистиллированной воды и 5 - 10 мл концентрированного раствора аммиака. Смесь перемешивают в течение двух минут. После разделения слоев четыреххлористый углерод сливают. В делительную воронку снова прибавляют 20 мл четыреххлористого углерода, смесь взбалтывают, дают постоять и сливают слой органического растворителя. В воронку еще раз добавляют 200 мл четыреххлористого углерода и разбавленную соляную кислоту до явно кислой реакции. Смесь встряхивают до тех пор, пока выделенный дитизон не перейдет в четыреххлористый углерод. Слой растворителя сливают в другую воронку и промывают 3 раза порциями по 50 мл дистиллированной воды. После этого раствор дитизона переливают в коричневую склянку и осторожно наливают сверху 0,5%-ный раствор серной кислоты (H2SO4), содержащей 0,5% сернокислого гидразина (NH2NH2·H2SO4). Раствор хранят на холоду в темноте (устойчив в течение нескольких месяцев).
Рабочий раствор: к одной объемной части основного раствора добавляют 9 частей четыреххлористого углерода. Хранить так же, как основной (устойчив в течение одной недели).
Ртуть. В пробирку с 10 мл исследуемой воды прибавляют 5 мл ацетатного буферного раствора (57 мл ледяной уксусной кислоты и 82 г ацетата натрия - CH3COONa·3H2O растворяют в дистиллированной воде, доводя объем до 1 мл), 5 мл 0,1 н. раствора комплексона III (см. Определение меди), 5 мл 0,1 н. раствора роданида калия (9,72 г роданида калия растворяют в дистиллированной воде, доводя объем до 1 мл) и после перемешивания доливают 2 мл рабочего хлороформного раствора дитизона. Содержимое пробирки хорошо встряхивают. В присутствии ртути окраска хлороформного раствора переходит из зеленой в оранжевую. Основной раствор дитизона готовят так же, как при определении цинка, только здесь вместо четыреххлористого углерода берут хлороформ. Рабочий раствор получают путем смешивания одного объема основного раствора четырьмя объемами хлороформа.
Свинец. К 10 мл исследуемой воды прибавляют 1 мл 25%-ного раствора тартрата калия и натрия (сегнетовой соли), 0,5 мл 25%-ного раствора натрия и 0,5 мл 10%-ного раствора цианида калия. Смесь перемешивают. Прибавляют 1 мл свежеприготовленного 5%-ного раствора сульфида натрия. В присутствии свинца появляется желтая окраска, а при больших концентрациях - коричневая. Чувствительность определения 0,3 мг свинца в 1 л воды.
Хром (общее содержание хрома). К 10 мл исследуемой воды прибавляют 1 мл 30%-ного раствора NaOH и 1 мл 3%-ного раствора перекиси водорода, смесь кипятят 5 минут (смесь 1). Отдельно в пробирке готовят смесь 2 - 2 мл 3%-ного раствора перекиси водорода, 1 мл 30%-ного раствора H2SO4 и 2 мл эфира. К этой смеси приливают около 1 мл охлажденной после кипячения смеси 1 и перемешивают взбалтыванием. В присутствии хрома слой эфира приобретает синюю окраску.
Никель. К 20 мл исследуемой воды прибавляют 2 мл 3%-ного раствора перекиси водорода (H2O2) и раствор аммиака до щелочной реакции. Смесь кипятят и выпавший осадок отфильтровывают. К фильтрату добавляют 2 мл 1,2%-ного раствора диметилглиоксима и нагревают до кипения. При наличии малого количества никеля появляется желтая окраска; если концентрация никеля превышает 2,5 мг/л, то выпадает красный осадок.
Мышьяк. В пробирку с исследуемой водой прибавляют несколько капель концентрированной серной кислоты и на кончике ножа вносят немного порошкообразного цинка. Пробирку закрывают ватной пробкой, смоченной в растворе нитрата свинца, и на вату кладут кристаллик нитрата серебра, смоченного водой. В присутствии мышьяка нитрат серебра сначала окрасится в желтый цвет, потом почернеет. Положительный результат реакции получается при концентрации мышьяка, превышающей 0,1 мг/л. Определению мешает сероводород.
Фтор (используют реакцию, основанную на коррозии и несмачиваемости стекла при воздействии на него фтора).
Обнаружение фтора проводят в реактивной трубке, изогнутой в два колена, одно длиной 70 - 80 мм, другое - 35 - 40 мм, диаметр трубки 8 - 10 мм.
Берут 1 - 2 капли исследуемой жидкости и вносят в короткое колено реактивной трубки, наполненной 2 - 2,5%-ным раствором двухромовокислого калия в концентрированной серной кислоте, перемешивают и наблюдают за появлением несмачиваемости стекла в коротком колене, наклоняя трубку из одной стороны в другую. При наличии фтора происходит коррозия стенок трубок в коротком колене и возникает явление несмачиваемости стекла, а желтая пленка жидкости при наклоне трубки сползает со стенок вслед за реактивом.
В капле раствора обнаруживается 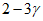 фтора. Реактивную трубку можно использовать только в одном опыте.
фтора. Реактивную трубку можно использовать только в одном опыте.
Железо. К 10 мл исследуемой воды прибавляют две капли концентрированной соляной или серной кислоты и несколько кристаллов персульфата аммония или 1 - 2 капли 3%-ного раствора перекиси водорода. После взбалтывания прибавляют 0,2 мл (4 капли) 50%-ного раствора роданистого аммония или роданистого калия.
Окрашивание при рассматривании сбоку | Окрашивание при рассматривании сверху вниз | Содержание (мг/л) |
Окрашивания нет | Окрашивания нет | Меньше 0,05 |
Едва заметное желтовато-розовое | Чрезвычайно слабое желтовато-розовое | 0,1 |
Очень слабое желтовато-розовое | Слабое желтовато-розоватое | 0,25 |
Слабое желтовато-розоватое | Светлое желтовато-розоватое | 0,5 |
Светлое желтовато-розовое | Желтовато-розовое | 1,0 |
Сильное желтовато-розовое | Желтовато-красное | 2,0 |
Светлое желтовато-красное | Ярко-красное | 5,0 |
Марганец. Пробы воды объемом 10 - 50 мл подкисляют несколькими каплями 25%-ной азотной кислоты и прибавляют по каплям 5%-ный раствор азотнокислого серебра (AgNO3) до тех пор, пока продолжается помутнение. Затем всыпают 0,5 г персульфата аммония или персульфата калия и раствор нагревают до кипения. В присутствии марганца в количестве от 0,1 мг/л и выше раствор окрашивается в бледно-розовый цвет.
Фенолы. А. Для качественного определения низких концентраций фенола используется образование хлорфенольного запаха при хлорировании воды. В 200-миллиметровую коническую колбу вносят 100 мл исследуемой воды и прибавляют хлорной воды из расчета 0,5 мг хлора на 1 л. Затем определяют наличие запаха на холоду и после нагревания. Появление специфического аптечного запаха указывает на присутствие фенольных соединений.
Б. В пробирку с 2 мл формалинсерной кислоты (1 мл H2SO4 + 1 капля формалина) осторожно по стенке наслаивают исследуемую воду. При наличии в воде карболовой кислоты (фенола) в месте соприкосновения растворов образуется красное кольцо.
Сероводород. Бутыль, наполненную на 3/4 объема исследуемой водой, закрывают пробкой со свинцовой бумажкой, смоченной дистиллированной водой. Потемнение бумажки указывает на присутствие сероводорода. При отрицательной реакции воду подкисляют. Потемнение бумажки при подкислении воды указывает на присутствие связанного сероводорода.
Мочевина. К капле исследуемой воды прибавляют 1 - 2 капли концентрированной азотной кислоты. При наличии мочевины выкристаллизовывается азотнокислая мочевина - CO (NH2)2·HNO3 в виде шестигранников и ромбических пластинок, лежащих кучками или черепицеобразно.
Синильная кислота. В колбочку с 10 - 15 мл исследуемой воды добавляют 3 - 5 мл 10%-ного раствора винной кислоты (можно заменить щавелевой).
Колбочку закрывают часовым стеклом, на нижнюю поверхность которого наносят висячую каплю 2%-ного раствора нитрата серебра. При наличии синильной кислоты капля на часовом стекле мутнеет от образования и выпадения нерастворимого цианистого серебра. Под микроскопом можно увидеть спутанные, разной величины тончайшие иглы цианистого серебра.
При биологическом контроле качества воды или проверке ее на токсичность большое значение имеют индикаторы сапробности.
Сапробность - это комплекс физиологических свойств организма, обусловливающий его способность развиваться в воде в разной степени загрязненности, содержащей то или иное количество органических веществ. При наличии в воде промышленных загрязнителей обычно наблюдается вторичное повышение сапробности.
Принцип санитарно-биологического анализа заключается в том, что при поступлении в водоем сточных вод ряд гидробионтов гибнет, вследствие этого возникают специфические сообщества организмов, характеризующие различную степень загрязнения пресных вод, преимущественно хозяйственно-бытовыми, а не промышленными стоками.
Систему сапробности подразделяют на четыре группы: катаробную (питьевые воды), лимпосапробную, эусапробную (хозяйственно-бытовые и промышленные сточные воды, подвергающиеся бактериальному разложению) и транссапробную (сточные воды, загрязнения которых не подвергаются бактериальному разложению). При поступлении в водоемы сточных вод возникают последовательно следующие зоны загрязнения: полисапробная, альфа-мезосапробная, бета-мезосапробная и олигосапробная.
Полисапробная зона характеризуется большим содержанием нестойких органических веществ и наличием продуктов их анаэробного распада (метан, сероводород), отсутствием кислорода, содержанием большого количества органического детрита, сохранением восстановительных процессов. Железо находится в форме FeS, ил имеет черную окраску с запахом сероводорода. В этой зоне в массе развиваются растительные организмы с гетеротрофным типом питания: сапрофитные бактерии, нитчатые бактерии (Sphaerotibus), серные бактерии (Beggiotoa, Thiothrix), бактериальные зооглеи (Zooglea ramigera), простейшие инфузории, бесцветные жгутиковые.
Альфа-мезосапробная зона. В этой зоне происходит аэробный распад органических веществ с образованием аммиака, кроме того, содержится много свободной углекислоты и небольшое количество кислорода. В воде и донных отложениях протекают окислительно-восстановительные процессы, железо находится в закисной и окисной формах, ил имеет сероватую окраску. В этой зоне развиваются организмы, обладающие большой выносливостью к недостатку кислорода и большому содержанию углекислоты. Преобладают растительные организмы с гетеротрофным и миксотрофным питанием. Обильно развиваются бактериальные зооглеи, нитчатые бактерии, грибы, из водорослей - осциллятории, стигеоклониумы; из животных организмов - инфузории (Carchesium), встречаются коловратки (Brachionus), много окрашенных и бесцветных жгутиковых. В иле содержится значительное количество тубифицид и личинок хирономид.
Бета-мезосапробная зона отмечается в водоемах, почти освободившихся от нестойких органических веществ (полная минерализация). Концентрация кислорода и угольной кислоты сильно колеблется в течение суток, в дневные часы содержание кислорода в воде доходит до пересыщения, и углекислота может полностью исчезнуть. В ночные часы наблюдается дефицит кислорода в воде. В иле много органического детрита, интенсивно протекают окислительные процессы, ил желтой окраски. В этой зоне большое разнообразие животных и растительных организмов, наблюдается цветение воды многими представителями фитопланктона. В иле - черви, личинки хирономид, моллюски.
Олигосапробная зона характеризует практически чистые водоемы с незначительным содержанием нестойких органических веществ, а также с небольшой минерализацией. Содержание кислорода и углекислоты не претерпевает заметных колебаний в дневные и ночные часы. Цветение водорослей, как правило, не наблюдается. В донных отложениях мало органического детрита, автотрофных микроорганизмов и бентосных животных (черви, личинки хирономид и моллюски). Показателем чистоты воды в этой зоне являются некоторые водоросли (Thorea, Batrachosperum) и водные мхи.
ПЕРЕЧЕНЬ
ПРЕДЕЛЬНО ДОПУСТИМЫХ КОНЦЕНТРАЦИЙ ВРЕДНЫХ ВЕЩЕСТВ
ДЛЯ ВОДЫ РЫБОХОЗЯЙСТВЕННЫХ ВОДОЕМОВ
(УТВЕРЖДЕН ГЛАВРЫБВОДОМ МРХ СССР 9 ИЮНЯ 1971 Г.)
Наименование ингредиентов | Лимитирующий показатель | Предельно допустимая концентрация (мг/л) |
Аммиак | Токсикологический | 0,05 |
Бензол | " | 0,5 |
Борная кислота | " | 0,1 (0,017B''') |
Гексахлоран | " | Отсутствие |
ДДТ технический | " | Отсутствие |
ДДТ в соляровом масле | " | Отсутствие |
ДНС (динатриевая соль моноалкилсульфоянтарной кислоты - на основе вторичных спиртов и малеинового ангидрида) | " | 0,2 |
Диссольван 44 | " | 0,9 |
Кадмий (Cd") | " | 0,005 |
Кобальт (Co") | " | 0,01 |
Лак битумный | " | 5,0 |
Лак пекосмоляной | " | 1,0 |
Масло соляровое | " | 0,01 |
Магний (Mg") | " | 50,0 |
Медь (Cu") | " | 0,01 |
Мышьяк | Токсикологический | 0,05 |
МЛ-6 - моющий препарат (смесь сульфоната, сульфонала, ДБ, уайт-спирита) | " | 0,5 |
Никель (Ni") | " | 0,01 |
ОЖК (оксилированные жирные кислоты) | " | 3,9 |
ОП-7 | " | 0,3 |
ОП-10 | " | 0,5 |
Проксамин 385 | " | 7,5 |
Петролатум | " | 6,5 |
Полихлорпинен | " | Отсутствие |
Свинец (Pb") | " | 0,1 |
Сероуглерод | " | 1,0 |
Смолистые вещества хвойных пород древесины | " | Ниже 2,0 |
Сульфонат на керосиновой основе (натриевая соль алкилсульфокислот) | " | 0,5 |
Сульфат на синтине (натриевая соль алкилсульфокислот) | " | 1,0 |
Сульфонал НП-5 (натриевая соль алкилсульфокислот с алкильными остатками) | " | 0,5 |
Сульфонол хлорный | " | 0,1 |
Сульфонол НП-1 | " | 0,2 |
Сульфонол НП-3 | " | 0,1 |
Танниды | " | Ниже 10,0 |
Тетраборат натрия | " | 0,05 (0,006B''') |
Хлор свободный (Cl') | Токсикологический | Отсутствие <*> |
Цинк (Zn''') | " | 0,01 |
Цианиды | " | 0,05 |
Хлорид аммония | " | 1,2 |
Сульфат аммония | " | 1,0 |
Нитрат аммония | " | 0,5 |
Перхлорат аммония | " | 0,008 |
Алкилсульфонат | Санитарно-токсикологический | 0,5 |
Алкилсульфат первичный | То же | 0,2 |
ДНС на основе вторичных спиртов из вторых неомыляемых (паста) | " | 0,2 |
ДБ - препарат (полигликолевые эфиры) | " | 0,3 |
Сульфоспирты из двух неомыляемых | " | 0,1 |
Дипроксамин 157 | Органолептический | 3,2 |
НЧК (нейтрализованный черный контакт) | " | 0,01 |
Ксилол | " | 0,05 |
Стирол | " | 0,1 |
Толуол | " | 0,5 |
Проксанол 305 | " | 6,3 |
Латокс синтетический | Рыбохозяйственный | 1,6 |
Нефть и нефтепродукты в растворенном и эмульгированном состоянии | " | 0,05 |
Фенолы | " | 0,001 |
--------------------------------
Примечания. 1. Предельно допустимые концентрации указанных веществ к воде как речных, так и морских рыбохозяйственных водоемов.
2. При спуске сточных вод, содержащих загрязняющие вещества одного лимитирующего показателя вредности, концентрация каждого из них с учетом загрязнений такого же ЛПВ, поступивших в водоем от вышерасположенных сбросов, должна определяться следующим правилом: сумма отношения концентраций, загрязняющих веществ одного ЛПВ в расчетном пункте водоема к предельно допустимым концентрациям соответствующих веществ не должна превышать единицы.
3. Возможность сброса в рыбохозяйственные водоемы со сточными водами веществ, ПДК которых для водных организмов не установлена, согласовывается с органами рыбоохраны в каждом конкретном случае.
4. На участках массового нереста, зимовальных ям и нагула рыб спуск сточных вод не разрешается. Возможность устройства выпуска их вблизи данных участков, а также условия смешения сточных вод с водой водоема в каждом отдельном случае устанавливаются органами рыбоохраны.
5. Состав и свойства воды рыбохозяйственных водоемов должны удовлетворять рыбохозяйственным требованиям в зависимости от условий смешения, либо непосредственно в месте выпуска при организации их максимально возможного смешения, либо при отсутствии рассеивающего выпуска в створе, определяемом в каждом конкретном случае органами рыбоохраны, но не далее чем в 500 м от места выпуска.
6. Предельно допустимые концентрации некоторых вредных веществ в воде рыбохозяйственных водоемов, помещенные в приложении 4 к "Правилам охраны поверхностных вод от загрязнения сточными водами", а также "Предельно допустимые концентрации некоторых вредных веществ в воде рыбохозяйственных водоемов", утвержденные Главрыбводом 10/XI 1967 г. N 30-1-11 и 8/XII 1968 г. N 30-1-11, считать утратившими силу.