СПРАВКА
Источник публикации
СПб.: Издательство "Лань", 2015
Примечание к документу
Название документа
"Методические указания по лабораторной диагностике катаральной лихорадки крупного рогатого скота, овец и коз"
(утв. Госагропромом СССР 11.06.1986 N 432-5)
"Методические указания по лабораторной диагностике катаральной лихорадки крупного рогатого скота, овец и коз"
(утв. Госагропромом СССР 11.06.1986 N 432-5)
Содержание
11 июня 1986 г. N 432-5
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ КАТАРАЛЬНОЙ ЛИХОРАДКИ
КРУПНОГО РОГАТОГО СКОТА, ОВЕЦ И КОЗ
1.1. Лабораторные методы исследования на катаральную лихорадку крупного рогатого скота, овец и коз включают в себя следующие:
- патогистологическое исследование;
- выделение вируса на культуре клеток и куриных эмбрионах с последующей идентификацией в реакции иммунофлуоресценции (ИФ);
- выявление группоспецифических антител в сыворотках крови больных или переболевших животных в РДСК, РДП;
- постановку биологической пробы на овцах (в сомнительных случаях).
Выделение и идентификацию вируса, исследования сывороток крови животных ветеринарные лаборатории проводят группоспецифическими методами. Окончательное титрование вируса по 23 серологическим вариантам в реакции нейтрализации проводят во Всесоюзном научно-исследовательском институте ветеринарной вирусологии и микробиологии (ВНИИВВиМ).
1.2. В лабораторию для исследования на катаральную лихорадку направляют:
- кусочки селезенки и лимфатические узлы от павших или убитых животных в свежем виде или консервированные 30%-ным раствором глицерина, приготовленным на фосфатно-буферном растворе (pH 7,2...7,4);
- пробы крови от больных животных, взятые в период температурной реакции во флаконы в количестве 10 мл, пробы стабилизируют равным объемом антикоагулянта - раствором Эдингтона следующего состава: щавелевокислый калий - 5 г, карболовая кислота - 5 г, глицерин - 500 мл, дистиллированная вода - 500 мл;
- кусочки скелетных мышц, сердца, языка, губ, стенок книжки и рубца, фиксированные 10%-ным раствором формалина для патологогистологического исследования, а также нефиксированные кусочки лимфатических узлов, селезенки, легких, печени и почек с надпочечниками;
- сыворотку крови для серологических исследований от больных или переболевших животных в количестве 2...3 мл.
Патологический материал для вирусологических исследований отбирают не позднее, чем через два часа после гибели животных, в стерильные флаконы или пробирки и доставляют в лабораторию в термосе со льдом.
Сыворотку крови для серологических исследований можно сохранять при температуре -20 °C и ниже. Консервирование сывороток химическими реактивами не допускается.
2.1. Для гистологического исследования готовят парафиновые срезы из фиксированных 10%-ным раствором формалина кусочков скелетных мышц, сердца, языка, губ, стенок книжки и рубца и окрашивают гематоксилин-эозином.
Для выявления внутриклеточных цитоплазматических включений берут кусочки лимфатических узлов, селезенки, легких и почек с надпочечниками, фиксируют их в жидкости Карнуа (спирт этиловый - 60 мл, хлороформ - 30 мл, ледяная уксусная кислота - 10 мл) и заливают в парафин. Срезы окрашивают метиловым зеленым - пиронином или ШИК-реакцией.
При исследовании гистологических препаратов необходимо иметь в виду, что в случае заболевания животных катаральной лихорадкой обнаруживают резко выраженные поражения микроциркуляторного русла в скелетных мышцах и мышечных волокнах сердца, языка, губ - колбовидное набухание, гомогенизацию, губчатый распад, лизис и некроз; в межмышечной соединительной ткани - сильный отек, кровоизлияния и лимфоидно-гистиоцитарный инфильтрат; в стенках книжки и рубца - некроз покровного эпителия и основы слизистой оболочки, а также отек, диффузные кровоизлияния и лимфоидный инфильтрат в соединительной ткани подслизистого слоя.
При окраске специальными методами срезы просматривают под микроскопом с иммерсионной системой, причем в цитоплазме ретикулярных клеток и макрофагов лимфатических узлов и селезенки, в клетках легких, печени, почках и надпочечников могут быть найдены цитоплазматические включения округлой или овальной формы красного цвета (метод Браше), пурпурного или лилово-красного (ШИК-реакция). Часто обнаруживают значительное уменьшение количества лимфоцитов в селезенке и лимфатических узлах (опустошение).
2.2. По обнаруженным характерным патологогистологическим изменениям и тельцам-включениям ставят предварительный диагноз на катаральную лихорадку овец.
3.1.1. Для проведения исследований из патологического материала (селезенки, лимфатических узлов) готовят 10%-ную суспензию на фосфатном буферном растворе (pH 7,4...7,6) или на питательной среде с 0,5% гидролизата лактальбумина, к которой добавляют 1000 ЕД пенициллина и 500 мкг стрептомицина на 1 мл. Патологический материал, консервированный глицерином, предварительно отмывают в фосфатном буферном растворе (pH 7,4...7,6).
Приготовленную суспензию центрифугируют 30 мин при 2000...3000 об/мин. Надосадочную жидкость сливают в стерильную пробирку, помещают в холодильник и выдерживают при 2...4 °C в течение 3...4 ч. Затем делают высевы на питательные среды (МПБ, МПА) для исключения бактериального загрязнения.
Через сутки, при отсутствии роста микрофлоры на питательных средах, надосадочную жидкость используют для заражения клеточных культур и куриных эмбрионов.
3.1.2. Пробы крови с антикоагулянтом центрифугируют 10 мин при 1000 об/мин. Осадок эритроцитов трижды промывают стерильным физиологическим раствором (pH 7,2...7,4), затем готовят 20%-ную суспензию эритроцитов на фосфатном буферном растворе (pH 7,4...7,6) для заражения культур клеток и куриных эмбрионов.
3.2.1. Выделяют вирус на первично-трипсинизированной культуре клеток почки ягнят (ПЯ) или перевиваемой линии клеток ВНК-21.
3.2.2. В матрасы на 100 мл (не менее 5) с культурой клеток ПЯ или ВНК-21 после удаления ростовой среды вносят 2...3 мл суспензии исследуемого материала и равномерно распределяют ее по монослою клеток.
Матрасы помещают в термостат на 1 ч при 37 °C, после чего вносят поддерживающую среду в количестве 10...15 мл (для культуры клеток ВНК-21 - среду Игла с двойной концентрацией аминокислот; для ПЯ - 0,5%-ный раствор гидролизата лактальбумина без сыворотки).
Контролем служат матрасы с незараженной культурой клеток, в которых ростовая среда заменена поддерживающей.
3.2.3. Матрасы, зараженные исследуемым материалом, и контрольные помещают в термостат при 37 °C. Для учета цитопатического действия вируса (ЦПД) проводят ежедневно микроскопическое исследование клеточных культур в течение 7 дней.
3.2.4. Цитопатическое действие вируса в культуре клеток ВНК-21 можно обнаружить через 36...40 ч по наличию округлых клеток, с последующим разрушением всего монослоя. ЦПД вируса в культуре клеток ПЯ проявляется на 6...7-й день зернистостью, округлением клеток, образованием тяжей, отслоением клеток от стекла.
В контрольных незараженных культурах цитопатические изменения должны отсутствовать.
3.2.5. При выявлении в культурах ЦПД отбирают из матрасов культуральную жидкость в объеме 0,4 мл для заражения монослоя клеток аналогичной культуры, выращенных на стеклянных пластинках (стеклышках), в пробирках или пенициллиновых флаконах. После выдерживания зараженных культур в термостате при 37 °C в течение 72 ч стеклышки извлекают, высушивают на воздухе, фиксируют 10 мин в охлажденном при температуре -20 °C ацетоне и используют для идентификации вируса в иммунофлуоресценции.
3.2.6. При отсутствии цитопатического действия вируса (ЦПД) проводят два последовательных пассажа в аналогичной клеточной культуре.
3.3. Выделение вируса на куриных эмбрионах.
3.3.1. Для выделения вируса на куриных эмбрионах (КЭ) суспензию исследуемого материала (см. п. 3.1) вводят 8...9-дневным КЭ в желточный мешок в дозе 0,2...0,3 мл или 13...14-дневным КЭ внутривенно в дозе 0,1...0,2 мл. Каждым материалом заражают не менее 5 эмбрионов.
3.3.2. Зараженные куриные эмбрионы помещают в термостат при 33,5 °C и выдерживают в течение 5 дней. В этот период эмбрионы овоскопируют два раза в сутки. Куриные эмбрионы, погибшие в течение первых 24 ч, уничтожают (неспецифическая гибель), остальные эмбрионы после гибели и все оставшиеся живыми на 5-е сутки после заражения охлаждают в холодильнике 2...4 ч при 2...4 °C, затем их вскрывают и исследуют зародыш на наличие макроскопических изменений. Характерными для возбудителя катаральной лихорадки является вишнево-красная окраска погибших куриных эмбрионов с многочисленными кровоизлияниями на голове и туловище.
3.3.3. Для идентификации выделенного вируса готовят 10%-ную суспензию из эмбрионов (без головы) и заражают клеточные культуры (см. п. 3.2.5).
3.3.4. При сохранении жизнеспособности эмбрионов или отсутствии характерных изменений у погибших проводят два последовательных пассажа на КЭ, используя 10%-ную суспензию (см. п. 3.3.3).
3.4. Идентификация вируса.
3.4.1. Для идентификации вируса пользуются прямым и непрямым методом иммунофлуоресценции.
3.4.2. При прямом методе на стеклянные пластинки (стеклышки) с зараженной культурой клеток наносят специфическую флуоресцирующую сыворотку в рабочем разведении. Препараты помещают во влажную камеру на 30 мин при 37 °C, затем их промывают в двух сменах фосфатного буферного раствора по 10 мин.
В качестве контроля окрашивают стеклышки с незараженной культурой клеток.
3.4.3. При непрямом методе на стеклышки с зараженной культурой клеток наносят специфическую (немеченую) сыворотку катаральной лихорадки в рабочем разведении. Для контроля на часть препаратов наносят нормальную сыворотку овцы.
Препараты помещают во влажную камеру и выдерживают в термостате 30 мин при 37 °C, затем дважды их промывают физиологическим раствором (pH 7,2...7,4) по 10 мин и после подсушивания наносят антивидовую флуоресцирующую сыворотку в рабочем разведении. Окрашивают их во влажной камере 30 мин при 37 °C. После промывания препаратов в двух сменах фосфатного буферного раствора (pH 7,2...7,4) их подсушивают и просматривают в люминесцентном микроскопе.
3.4.4. При положительном результате в препаратах обнаруживают ярко светящиеся зелено-желтым цветом гранулы, конгломераты в цитоплазме и перинуклеарной зоне или такой же интенсивности диффузное свечение всей или большей части цитоплазмы.
В контрольных препаратах аналогичное свечение должно отсутствовать.
3.4.5. Метод иммунофлуоресценции является группоспецифическим и им может быть идентифицирован любой возбудитель из 23 серологических антигенных вариантов.
Для окончательного установления типа возбудителя применяют реакцию нейтрализации (во ВНИИВВиМ).
4.1. Для постановки биологической пробы используют овец породы "прекос" 6...8-месячного возраста из хозяйства, благополучного по инфекционным болезням.
Перед заражением исследуют сыворотку крови овец на наличие антител к вирусу катаральной лихорадки в РДСК и РДП.
4.2. Биопробу ставят на двух овцах, которым вводят суспензию исследуемого материала внутривенно в дозе 10 мл.
4.3. Результаты биологического исследования считают положительными в случае повышения температуры (до 41...42 °C) у овец на 5...7-й день после заражения; появления гиперемии слизистых оболочек рта и носа, отека губ, языка; эрозии в уголках губ, на деснах, языке; угнетения; поражения конечностей; цианоза слизистых оболочек и языка у отдельных овец, выпадения шерсти.
4.4. При отсутствии характерных клинических симптомов заболевания катаральной лихорадкой от зараженных овец берут пробу крови в период температурной реакции (или на 5...7-е сутки после заражения) для выделения вируса на культуре клеток (см. п. 3.2) и через 2...3 недели после заражения исследуют сыворотки крови в РДСК, РДП для обнаружения специфических антител.
5.1. Реакция длительного связывания комплемента (РДСК) и реакция диффузионной преципитации в агаровом геле (РДП) - групповые специфические методы, применяемые для обнаружения антител к вирусу катаральной лихорадки в сыворотке крови овец, коз и крупного рогатого скота, переболевших данной болезнью (ретроспективная диагностика).
У крупного рогатого скота серологическая реакция на вирус может быть слабой, поэтому при постановке РДСК антиген берут в меньшем разведении.
5.2. Реакция длительного связывания комплемента.
5.2.1. Компоненты реакции:
- сыворотки испытуемые и контрольные (специфическая и контрольная);
- антигены - специфический и нормальный;
- эритроциты барана - 2%-ная взвесь;
- гемолитическая сыворотка (гемолизин) биофабричного производства;
- комплемент - биофабричного производства или свежая сыворотка морской свинки;
- 0,85%-ный раствор химически чистого хлорида натрия на дистиллированной воде, pH 7,2...7,4.
Испытуемые сыворотки разводят физиологическим раствором в отношении 1:8, контрольные - до рабочего разведения, указанного на этикетке. Разведенные сыворотки мелкого рогатого скота инактивируют 30 мин при 60 °C, крупного рогатого скота - при 58 °C.
Проросшие и гемолизированные сыворотки для исследования непригодны.
Специфический и нормальный антигены разводят физиологическим раствором до объема, указанного на этикетке. При исследовании сывороток крупного рогатого скота рабочее разведение антигенов в два раза ниже указанного на этикетке.
Эритроциты барана отмывают физиологическим раствором путем центрифугирования при 2500...3000 об/мин в течение 10 мин до полной прозрачности надосадочной жидкости и готовят 2%-ную взвесь из осадка.
Гемолизин используют в четырехкратном титре. Так, при титре гемолизина 1:3000 его рабочее разведение 1:750.
Для приготовления гемолитической системы гемолизин в рабочем разведении смешивают с равным объемом 2%-ной взвеси эритроцитов и выдерживают 20...30 мин при комнатной температуре.
Комплемент титруют в гемолитической системе перед каждой постановкой реакции. Для этого берут 10 пробирок. В первую вносят 5,4 мл, а в остальные по 1 мл физиологического раствора. Затем в первую пробирку добавляют 0,6 мл разведенного до первоначального объема комплемента, хорошо перемешивают и переносят 5 мл во вторую пробирку, из второй - 5 мл в третью и т.д. Получают ряд последовательных разведений комплемента от 1:10 до 1:51,5. Для определения титра комплемента из каждого его разведения переносят по 0,1 мл в соответствующую пробирку основного ряда.
Схема приготовления разведений и титрования комплемента дана в таблице 12.
Таблица 12
Номера пробирок | ||||||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
Физиологический раствор в мл | 5,4 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 |
Комплемент, разведенный до нативного состояния | 0,6 во все пробирки последовательно переносят по 5 мл | |||||||||
Полученные разведения комплемента | 1,10 | 1,12 | 1/14,4 | 1/17,3 | 1/20,7 | 1/24,8 | 1/29,8 | 1/35,8 | 1/42,9 | 1/51,5 |
Комплемент в разведениях | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 |
Физиологический раствор | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 |
Гемолитическая система | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 |
Водяная баня при 37...38 °C 15 мин | ||||||||||
Результат титрования | ПГ | ПГ | ПГ | ПГ | ПГ | ПГ | ЧГ | ЧГ | ЗГ | ЗГ |
Обозначения: ПГ - полный гемолиз; ЧГ - частичный гемолиз; ЗГ - задержка гемолиза.
Титром комплемента считают наибольшее его разведение, дающее полный гемолиз эритроцитов. Рабочее разведение соответствует разведению комплемента в четвертой пробирке влево от последней пробирки с полным гемолизом. В приведенном примере титр комплемента - 1:29,8; рабочее разведение для главного опыта - 1:14,4.
Расчет количества чистого комплемента, необходимого для постановки главного опыта, делают по формуле
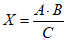 ,
,где A - доза комплемента для главного опыта; B - количество пробирок главного опыта; C - рабочее разведение комплемента.
Например, для постановки реакции в 100 пробирках требуется неразделенного комплемента:
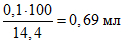 .
.Количество разведенного комплемента для всей реакции составляет 10 мл (0,1·100), следовательно к 0,69 мл комплемента добавляют 9,31 мл физиологического раствора.
5.2.3. Постановка главного опыта.
Реакцию ставят в объеме 0,5 мл в пробирках Флоринского. Каждую разведенную инактивированную сыворотку (см. п. 5.2.2) разливают в три пробирки по 0,1 мл. В каждую первую пробирку добавляют 0,1 мл специфического антигена, во вторую - 0,1 мл нормального антигена, в третью - 0,1 мл физиологического раствора. Затем во все пробирки вносят по 0,1 мл комплемента в рабочем разведении и реакцию помещают на холод при +2...-4 °C на 18...20 ч. После реакцию выдерживают в течение 15...20 мин при комнатной температуре и в каждую пробирку добавляют по 0,2 мл гемолитической системы, пробирки встряхивают и помещают на водяную баню при 37...38 °C на 15...20 мин.
Одновременно с главным опытом ставят следующие контроли: позитивной и негативной сывороток в разведениях, указанных на этикетке по схеме главного опыта; специфического и нормального антигенов - на антикомплементарность.
Схема постановки главного опыта и контролей представлена в таблице 13.
Таблица 13
N п/п | Компоненты реакции | N пробирок | Контроли | |||||||||
Позитивной сыворотки | Негативной сыворотки | Антикомплементарности антигена | ||||||||||
1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | Специфический | Нормальный | ||
1 | Испытуемая сыворотка в разведении 1:8 | 0,1 | 0,1 | 0,1 | - | - | - | - | - | - | - | - |
2 | Позитивная сыворотка в рабочем разведении | - | - | - | 0,1 | 0,1 | 0,1 | - | - | - | - | - |
3 | Нормальная сыворотка в рабочем разведении | - | - | - | - | - | - | 0,1 | 0,1 | 0,1 | - | - |
4 | Антиген специфический в рабочем разведении | 0,1 | - | - | 0,1 | - | - | 0,1 | - | - | 0,1 | - |
5 | Антиген нормальный в рабочем разведении | - | 0,1 | - | - | 0,1 | - | - | 0,1 | - | - | 0,1 |
6 | Физиологический раствор | - | - | 0,1 | - | - | 0,1 | - | - | 0,1 | 0,1 | 0,1 |
7 | Комплемент в рабочем разведении | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 |
18...20 ч при +2...4 °C и 15...20 мин при комнатной температуре | ||||||||||||
8 | Гемолитическая система | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0.2 | 0,2 | 0,2 | 0,2 |
15...20 мин на водяной бане при 37...38 °C | ||||||||||||
5.2.4. Результаты реакция учитывают через 25...30 мин после выемки штативов из водяной бани.
Результаты реакции считают действительными при следующих показаниях контролей:
- задержка гемолиза - в пробирке с позитивной сывороткой и специфическим антигеном;
- полный гемолиз - в пробирках с позитивной и негативной сыворотками без антигенов и с нормальным антигеном, негативной сывороткой со специфическим антигеном, а также в контролях антигенов на антикомплементарность.
5.2.5. Оценку результатов реакции проводят по степени задержки гемолиза эритроцитов и выражают крестами: ++++ (4 креста) - отсутствие гемолиза, надосадочная жидкость прозрачная; +++ (3 креста) - гемолиз 25% эритроцитов; ++ (2 креста) - гемолиз 50% эритроцитов; + (1 крест) - гемолиз 75% эритроцитов; - (минус) - полный гемолиз эритроцитов, осадок отсутствует.
5.2.6. Реакцию считают:
- положительной - при задержке гемолиза эритроцитов на 3...4 креста;
- сомнительной - при задержке гемолиза на 2 креста;
- отрицательной - при задержке гемолиза на 1 крест или полном гемолизе эритроцитов.
5.2.7. При получении сомнительных результатов сыворотку крови от таких животных исследуют повторно через 14...21 день. При повторном получении сомнительной реакции результат исследования считают отрицательным.
5.3. Реакция диффузионной преципитации.
5.3.1. Преципитирующие антитела обнаруживают в сыворотке крови в течение года с момента переболевания.
5.3.2. Компоненты реакции и подготовка их к работе:
- специфический преципитирующий антиген, приготовленный из аттенуированного штамма вируса катаральной лихорадки, выпускается в лиофилизированном состоянии. Перед применением антиген разводят физиологическим раствором или дистиллированной водой до исходного объема и готовят рабочее разведение, как указано на этикетке;
- нормальный антиген, приготовленный из неинфицированных клеточных культур, используют в тех же разведениях, что и специфический;
- испытуемые сыворотки от больных или переболевших животных должны быть прозрачными, без примеси эритроцитов. При длительном хранении сывороток (не более 6 мес.) допускается консервирование их замораживанием;
- специфическая и нормальная контрольные сыворотки, которые разводят физиологическим раствором или дистиллированной водой до исходного объема, указанного на этикетке;
- агар "Дифко", отечественный или японский агар-агар.
Агар-агар промывают проточной водопроводной водой в течение 24 ч, затем дистиллированной - в течение того же времени. После промывания агар отжимают и высушивают на стекле до первоначального веса.
Для постановки РДП готовят 1%-ный агаровый гель на физиологическом растворе с добавлением риванола (10 мг на 1 л геля).
Расплавленный агаровый гель разливают в чашки Петри, установленные в строго горизонтальном положении слоем в 0,4...0,5 см и дают застыть. В затвердевшем агаре с помощью штампа делают лунки диаметром 7 мм, расстояние между краями лунок 3 мм. На одной чашке Петри можно расположить 4 фигуры по 7 лунок в каждой (1 в центре, 6 вокруг). Агар из лунок удаляют с помощью вакуума, пастеровской пипетки или пинцета.
5.3.3. Постановка реакции.
Каждую сыворотку испытывают одновременно со специфическим и нормальным антигенами. Сыворотки и антигены разливают в объеме 0,05 мл. Специфический антиген вносят в центральную лунку одной из фигур, нормальный - в центральную лунку соседней фигуры. Испытуемые сыворотки вносят в периферические, аналогично расположенные лунки обоих фигур. Одновременно в одной из чашек ставят контроли специфической и нормальной сыворотки с обоими антигенами.
В каждой чашке Петри можно исследовать 12 сывороток со специфическим и нормальным антигенами (см. рис. 8).
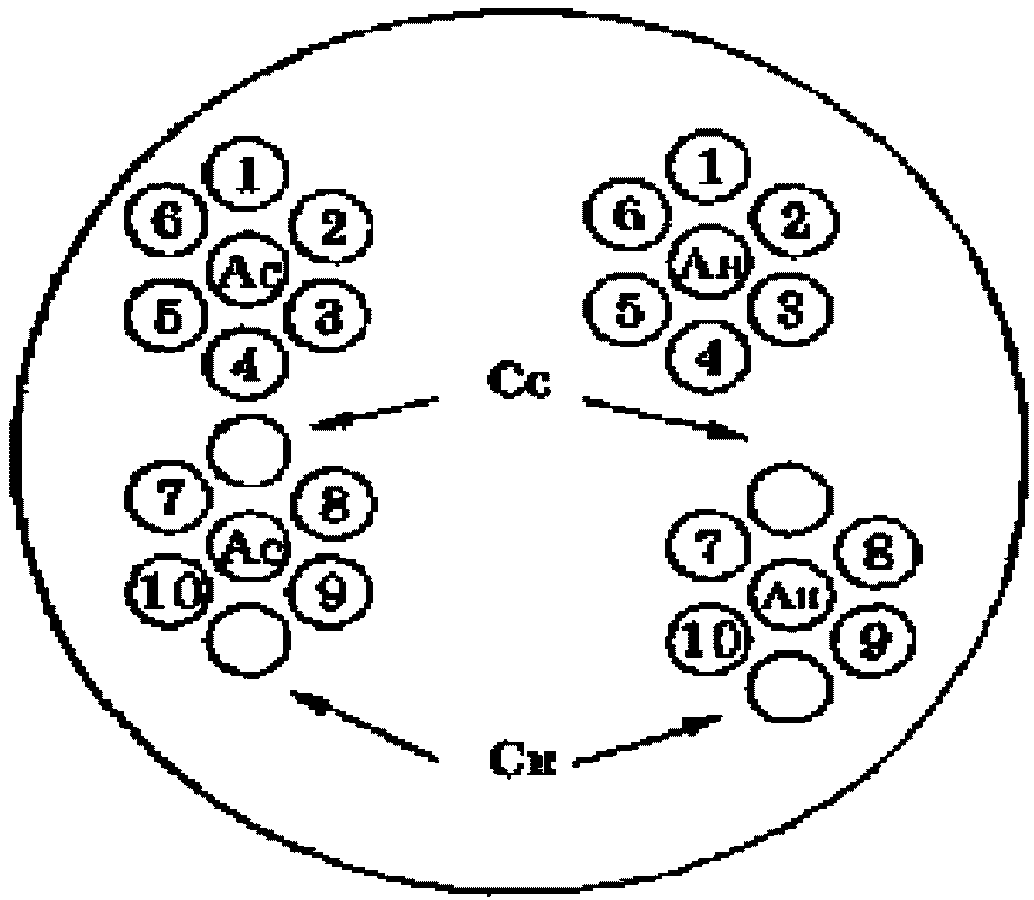
Схема расположения лунок в чашке Петри и заполнения их
диагностикумами и испытуемыми сыворотками
при постановке РДП:
Ас - антиген специфический; Ан - антиген нормальный;
Сс - сыворотка специфическая; Сн - сыворотка нормальная;
1...10 - сыворотки испытуемые.
После внесения компонентов чашки закрывают крышками и выдерживают 24...48 ч при комнатной температуре.
5.3.4. Учет и оценка результатов РДП.
Реакцию учитывают через 24...48 ч в проходящем свете.
Показания реакции считают действительными при получении следующих результатов контролей: наличие линии преципитации между лунками со специфическими антигеном и сывороткой и отсутствие такой линии между лунками с нормальным антигеном и контрольными сыворотками (специфической и нормальной), а также специфическим антигеном и нормальной сывороткой.
Реакцию с испытуемой сывороткой считают положительной при наличии линии преципитации между лунками со специфическим антигеном и данной сывороткой и отсутствии такой линии между лунками с этой же сывороткой и нормальным антигеном.
При отрицательной реакции линия преципитации между испытуемой сывороткой и специфическим антигеном отсутствует.
6.1. Диагноз на катаральную лихорадку крупного рогатого скота, овец, коз ставят на основании комплекса эпизоотологических, клинических, патологоанатомических данных, а также результатов вирусологических, патологогистологических и серологических исследований.
Патологогистологические и серологические исследования необходимы для постановки предварительного диагноза.
Окончательный диагноз на катаральную лихорадку устанавливают на основании выделения, идентификации и типирования вируса.
6.2. Сроки исследований:
- патологогистологических - 12 дней;
- вирусологических - 10...30 дней;
- серологических - 4 дня;
- биологической пробы - 7...20 дней.
к Методическим указаниям по лабораторной
диагностике катаральной лихорадки
крупного рогатого скота и овец
КАТАРАЛЬНАЯ ЛИХОРАДКА ОВЕЦ, КРУПНОГО РОГАТОГО СКОТА
(СПРАВКА)
1. Эпизоотологические данные.
В естественных условиях к вирусу катаральной лихорадки восприимчивы овцы, особенно в молодом возрасте (от 6 мес. до 1 года). Овцы европейских пород более чувствительны, чем животные африканских и азиатских пород. Крупный рогатый скот, буйволы, козы и другие жвачные животные длительное время могут быть вирусоносителями, не проявляя клинических признаков болезни.
Возбудитель от больных животных к здоровым передается кровососущими насекомыми (мокрецы). Заболевание отмечается в период активного лёта кровососущих насекомых (летне-осенний) в местах их массового обитания (природный очаг). Болезнь чаще встречается в долинах, вблизи рек, водоемов. Обычно погибает от 2 до 30% овец, но иногда летальность достигает 90...100%.
2. Клинические признаки.
Инкубационный период болезни при естественном заражении 6...8 дней, при экспериментальном - 4...5 сут. При остром течении болезни отмечают лихорадку (40,5...42 °C), гиперемию слизистой оболочки ротовой и носовой полостей; кровоизлияния, эрозии и язвы на слизистой губ, языка, десен, щек; повышенную саливацию ("влажный рот"), водянистые с переходом в слизисто-гнойные истечения из носа, отек век, ноздрей, губ, подчелюстного пространства, шеи и груди; резкое опухание и багрово-синее окрашивание языка, иногда выпадение его через беззубый край, ихорозный запах изо рта; диарею.
У переболевших овец иногда наблюдают хромоту (воспаление венчика), искривление шеи и выпадение шерсти.
При подостром течении отмечают сильное истощение, слабость и медленное выздоровление.
При абортивной форме выявляют кратковременное повышение температуры тела и быстро проходящую гиперемию слизистой оболочки ротовой полости.
3. Патологоанатомические изменения.
Характерными являются следующие патологоанатомические признаки:
- студенистый отек подкожной клетчатки губ, ноздрей, век, щек, подчелюстного пространства, шеи, подгрудка, паха;
- диффузное помутнение роговой оболочки глаза (кератит);
- цианоз и изъязвление слизистой оболочки языка, губ и десен;
- отек языка, кровоизлияния, эрозии и очаги некроза на его латеральной поверхности;
- пятнисто-полосчатые кровоизлияния и отек скелетных мышц (преимущественно в области шеи, плеч, спины и поясницы);
- множественные кровоизлияния, эрозии и язвы на слизистой оболочке рубца, кровоподтеки и кровоизлияния на границе книжки с сеткой, некротическое изъязвление слизистой оболочки дна (жолоба) книжки;
- множественные кровоизлияния в сердце, легких, печени, почках, сычуге, кишечнике, лимфатических узлах и селезенке.
Катаральную лихорадку необходимо дифференцировать от болезни Найроби, ящура, оспы, контагиозной эктимы и некробактериоза.