СПРАВКА
Источник публикации
Документ опубликован не был
Примечание к документу
Название документа
"Методические указания по лабораторной диагностике европейского гнильца пчел"
(утв. Госагропромом СССР 15.08.1986 N 433-6)
"Методические указания по лабораторной диагностике европейского гнильца пчел"
(утв. Госагропромом СССР 15.08.1986 N 433-6)
Начальник Главного управления
ветеринарии Государственного
агропромышленного комитета СССР
А.Д.ТРЕТЬЯКОВ
15 августа 1986 г. N 433-6
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ ЕВРОПЕЙСКОГО ГНИЛЬЦА ПЧЕЛ
1.1. Европейский гнилец (доброкачественный гнилец, гнилец открытого расплода) - инфекционная болезнь открытого, а при хроническом течении и печатного расплода.
Чаще расплод погибает весной и в первую половину лета. Пораженные личинки поворачиваются в ячейках кверху спиной, распрямляются, становятся мутно-белыми, сморщиваются и погибают. Погибшие личинки разлагаются, превращаясь в массу коричневого цвета с кислым гнилостным запахом. Высохшая масса образует коричневые корочки, легко извлекаемые из ячеек.
1.2. Европейский гнилец имеет полимикробную этиологию. Основными возбудителями являются: Melissococcus pluton (Str. pluton), Str. liquifaciens (Str. apis), Bac. alvei, Bac. laterosporus (Bac. orpheus).
1.3. Диагноз ставят на основании эпизоотологических данных, характерных признаков поражения расплода и результатов лабораторного исследования.
1.4. Для исследования в лабораторию направляют образцы сотов размером 10 x 15 см с больными и погибшими личинками (в случае гибели открытого расплода образец должен содержать неразложившиеся личинки). Образцы пересылают в фанерном или деревянном ящике, отделяя их друг от друга и от стенок ящика деревянными планками. Соты нельзя обертывать бумагой.
Заплесневевший материал для исследования непригоден.
1.5. Исследование на европейский гнилец включает микроскопию мазков из патологического материала и выделение культур возбудителей с последующей их идентификацией.
2.1. Из ячеек сотов стерильным пинцетом извлекают 10 - 15 погибших личинок или корочек, помещают в ступку, заливают 5 мл стерильного физиологического раствора и растирают до получения однородной суспензии (корочки предварительно размачивают в стерильном физиологическим растворе в течение 15 - 20 минут).
Из полученной суспензии готовят мазки, высушивают их на воздухе, фиксируют на пламени горелки и окрашивают по Граму и 2%-ным спиртовым раствором карболового фуксина в течение 1,5 - 2 минут.
2.2. При микроскопическом исследовании недавно погибших личинок чаще обнаруживают грамположительные ланцетовидные кокки Melissococcus pluton, окруженные капсулой и расположенные одиночно, попарно или в виде характерных скоплений - "розетками". Реже обнаруживают короткие цепочки грамположительных кокков Str. liquifaciens, расположенные частоколом споры Bac. alvei, а также одиночные споры и грамположительные палочки Bac. laterosporus.
3.1. Патологический материал, подготовленный как указано в п. 2.1., высевают на среды Бейли или Черепова в чашках (см. приложение 1), а также в МПБ и на МПА.
Посевы на среде Бейли или Черепова инкубируют в анаэробных условиях при температуре 34 - 35 °C в течение 5 сут, на МПА и МПБ - в аэробных условиях в течение 24 - 48 ч при этой же температуре.
3.2. Посевы на среде Бейли или Черепова просматривают через 4 - 5 сут инкубирования. Melissococcus pluton образует круглые, мелкие (диаметром 1,0 - 1,5 мм) выпуклые зернистые колонии жемчужно-белого цвета.
В мазках из типичных колоний обнаруживают ланцетовидные грамположительные кокки в виде скоплений "розетками", окруженных капсулой.
При обнаружении роста возбудителя культуру пересевают на среды Гисса для определения ферментативных свойств (см. приложение 2).
Melissococcus pluton ферментирует глюкозу с образованием кислоты без газа, не сбраживает маннит и сорбит.
3.3. При просмотре роста на обычных питательных средах обращают внимание на интенсивность помутнения, образование осадка или пленки в МПБ, форму и цвет колоний на МПА.
3.3.1. Str. liquifaciens через 24 ч инкубирования вызывает равномерное помутнение МПБ. На МПА образует мелкие прозрачные колонии или налет, легко снимающийся петлей.
В мазках из типичных колоний стрептококки располагаются короткими цепочками.
При обнаружении на МПА и в МПБ роста, характерного для Str. liquifaciens, делают дробный пересев на 2 - 3 чашки с глюкозо-кровяным агаром и среды Гисса.
Str. liquifaciens разлагает с образованием кислоты без газа глюкозу, маннит, сорбит и не обладает гемолитической активностью.
3.3.2. Bac. alvei через 24 ч инкубирования в МПБ образует помутнение, слизистый осадок, сероватую нестабильную пленку, при встряхивании опадающую на дно пробирки.
На МПА образует крупные прозрачные неправильной формы колонии (в виде "оленьих рогов") с блестящей поверхностью.
В мазках из типичных колоний обнаруживают грамположительные палочки.
При обнаружении на МПА и в МПБ роста, характерного для Bac. alvei делают дробный пересев на 2 - 3 чашки с глюкозо-кровяным агаром и среды Гисса, а также определяют способность восстанавливать нитраты, каталазную активность и характер гемолиза.
Bac. alvei разлагает мальтозу и сахарозу с образованием кислоты, не разлагает арабинозу, не восстанавливает нитраты, каталазоположителен, вызывает  .
.
 .
.3.3.3. Bac. laterosporus через 24 ч инкубирования в МПБ дает равномерное помутнение, через 48 ч образуется осадок, а бульон просветляется.
На МПА образует мелкие колонии с ровными краями, серовато-белого цвета с металлическим блеском. К 48 ч образует пышные серовато-белые наложения.
В мазках из типичных колоний обнаруживают крупные грамположительные палочки, расположенные одиночно. Вегетативные формы подвижны. Образует характерные споры, при этом палочка изгибается, близко примыкая к споре.
Идентификацию выделенных культур Bac. laterosporus проводят на основании результатов определения ферментативных свойств, способности восстанавливать нитраты, каталазной и гемолитической активности.
Bac. laterosporus ферментирует мальтозу с образованием кислоты без газа, не ферментирует сахарозу, арабинозу, нитраты восстанавливает в нитриты, каталазоположителен, вызывает 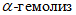 .
.
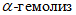 .
.3.4. Идентификация выделенных культур.
3.4.1. Ферментативные свойства культур возбудителей европейского гнильца изучают на средах Гисса с углеводами (Melissococcus pluton - в анаэробных условиях). Посевы инкубируют в течение 2 - 3 сут, после чего проводят учет результатов.
3.4.2. Гемолитическую активность определяют на глюкозо-кровяной среде. Посев делают дробно на 2 - 3 чашки со средой. Учет проводят через 2 - 3 сут инкубирования посевов в термостате при 34 - 35 °C.
3.4.3. Восстановление нитратов в нитриты. Выделенную культуру засевают в бульон с 1% нитрата калия. Через 48 - 72 ч инкубации в пробирку вносят 0,5 мл 0,5%-ного водного раствора крахмала и такое же количество 0,5%-ного водного раствора иодистого калия. После перемешивания добавляют одну каплю 5%-ного раствора серной кислоты и снова перемешивают. В присутствии нитрита калия цвет среды становится темно-синим.
3.4.4. Каталазную активность выделенных культур определяют следующим образом: на предметное стекло наносят каплю 3%-ного раствора перекиси водорода и вносят в нее петлей суточную культуру возбудителя. При наличии каталазы наблюдается выделение пузырьков газа.
4. Диагноз на европейский гнилец считается установленным при обнаружении одного или ассоциации возбудителей европейского гнильца с характерными для них свойствами.
5. Срок исследования до 8 дн.
к Методическим указаниям
по лабораторной диагностике
европейского гнильца пчел
ЕВРОПЕЙСКОГО ГНИЛЬЦА ПЧЕЛ
1. Среда Бейли. К 1 л дистиллированной воды добавляют по 10 г порошка глюкозы, растворимого крахмала и экстракта дрожжей и 13,6 г фосфорнокислого однозамещенного калия. Компоненты растворяют, добавляют 20 г агар-агара, смесь нагревают до его расплавления и доводят pH среды до 6,6. Среду стерилизуют в автоклаве при давлении 0,5 атм дробно в течение трех дней по 20 мин.
2. Среда Черепова. 300 г очищенных клубней картофеля (обязательно удалить глазки) варят в течение 15 - 20 мин в 1 л водопроводной воды, не допуская разваривания клубней. Отвар фильтруют через ватно-марлевый фильтр и доводят водой до первоначального объема. В отвар добавляют 20 г агар-агара и 3 г пептона, нагревают и тщательно перемешивают. Смесь стерилизуют в автоклаве при 1 атм в течение 20 мин, охлаждают до 45 - 50 °C добавляют 3% экстракта пекарских дрожжей и 3% глюкозы, доводят pH до 6,8. Среду стерилизуют в аппарате Коха в течение трех дней по 30 мин или в автоклаве при 0,5 атм три дня по 15 мин.
3. Глюкозо-кровяной агар. На основе МПБ готовят МПА с содержанием 3% агара (pH 7,2 - 7,4). Среду разливают в колбы по 100 мл и стерилизуют при 1 атм 30 минут.
По мере надобности агар расплавляют в кипящей водяной бане, охлаждают до 48 - 50 °C и добавляют 2% глюкозы и 15 - 20 мл свежевзятой стерильной дефибринированной крови лошади, барана или крупного рогатого скота. Смесь осторожно перемешивают, не допуская образования пены и разливают в чашки. После застывания среду выдерживают в термостате 4 - 6 часов для подсушивания.
к Методическим указаниям
по лабораторной диагностике
американского гнильца, европейского
гнильца и парагнильца пчел
ПЧЕЛИНОГО РАСПЛОДА
Возбудитель | Восстановление нитратов | Каталазная активность | Ферментация углеводов | Характер гемолиза | ||
мальтоза | сахароза | арабиноза | ||||
Bac. larvae | + | - | - | - | - | нет |
Bac. alvei | - | + | + | + | - | |
Bac. laterosporus (Bac. orpheus) | + | + | + | - | - | |
Bac. paraalvei | - | + | + | + | - | нет |