СПРАВКА
Источник публикации
Документ опубликован не был
Примечание к документу
Название документа
"Методические указания по лабораторной диагностике стафилококкоза животных"
(утв. Госагропромом СССР 29.07.1987)
"Методические указания по лабораторной диагностике стафилококкоза животных"
(утв. Госагропромом СССР 29.07.1987)
Утверждаю
Председатель
Главного управления ветеринарии
Государственного агропромышленного
комитета СССР
А.Д.ТРЕТЬЯКОВ
29 июля 1987 года
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ СТАФИЛОКОККОЗА ЖИВОТНЫХ
1.1. Стафилококкоз - инфекционная болезнь сельскохозяйственных животных, пушных зверей и птиц, характеризующаяся гнойно-воспалительными процессами в различных органах и тканях, артритами, маститами, эндометритами, а в некоторых случаях - сепсисом со смертельным исходом.
1.2. Возбудитель болезни - Staphylococcus aureus - крупные неподвижные грамположительные кокки, располагающиеся неправильными скоплениями, а также одиночно или попарно.
1.3. Диагноз на стафилококкоз устанавливают по результатам лабораторного исследования с учетом клинических данных.
1.4. Лабораторная диагностика стафилококкоза включает микроскопию мазков, выделение культур стафилококков с последующей их идентификацией и изучением патогенных свойств.
1.5. Для исследования в лабораторию посылают трупы мелких животных и птиц целиком, от трупов крупных животных направляют части паренхиматозных органов, головной мозг, кровь из сердца; от больных животных, в зависимости от клинических признаков - абортированные плоды, истечения из шейки матки, содержимое абсцессов, синовиальную жидкость на воспаленных суставов.
1.6. Патологический материал для исследования на стафилококковую инфекцию берут от животных, не подвергавшихся лечению антибиотиками, сульфаниламидными или нитрофурановыми препаратами в течение последних 10 дней.
2.1. Из доставленного материала готовят мазки и окрашивают их по Граму.
В мазках обнаруживают крупные грамположительные кокки, располагающиеся скоплениями в виде гроздьев, в мазках из гноя могут быть парные кокки, короткие цепочки.
3.1. Высевы из патологического материала делают в МПБ, на МПА или молочно-солевой агар (pH сред 7,2 - 7,4). Высевы можно проводить и на кровяной агар.
Посевы инкубируют при температуре 37 - 38 °C в течение 18 - 20 ч.
3.2. В МПБ отмечают интенсивное равномерное помутнение среды, на дне пробирки - рыхлый осадок. Иногда появляется пристеночное серовато-белое кольцо или пленка.
На МПА и молочно-солевом агаре стафилококки образуют круглые, мелкие с ровными краями, выпуклые колонии белого, кремового, золотисто- или лимонно-желтого цвета.
3.3. У выделенных культур изучают морфологические, культуральные биохимические и патогенные свойства.
3.4. Для изучения биохимических и гемолитических свойств суточную культуру стафилококка пересевают в среды Гисса с глюкозой, лактозой, мальтозой, сахарозой, маннитом, дульцитом и на глюкозо-кровяной агар Цейсслера.
S. aureus ферментирует с образованием кислоты без газа глюкозу, маннит, мальтозу, сахарозу, не ферментирует лактозу и дульцит, на глюкозо-кровяном агаре Цейсслера образует 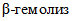 .
.
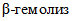 .
.4.1. Определение патогенности проводят в реакции плазмокоагуляции, по дермонекротической пробе или биопробой на цыплятах.
4.2. Постановка реакции плазмокоагуляции.
В реакции используют сухую кроличью плазму, выпускаемую предприятиями Минздрава СССР. Для работы сухую плазму разводят согласно прилагаемому наставлению.
При необходимости приготовления плазмы в лаборатории у кролика берут кровь из ушной вены или сердца в пробирку с 5%-ным раствором лимонно-кислого натрия (2 мл раствора на 8 - 10 мл крови). Цитратную кровь центрифугируют: при 3000 об/мин в течение 10 мин, затем плазму отсасывают и переносят в стерильные пробирки, которые закрывают пробками и хранят в холодильнике до 3 нед. Перед употреблением плазму разводят стерильным физиологическим раствором 1:5.
Подготовленную для исследования плазму разливают по 0,5 мл в стерильные уленгутовские пробирки по количеству изучаемых культур. Затем в пробирку вносят 2 капли бульонной или одну петлю агаровой 18 - 24-часовой культуры. Одновременно ставят контроль плазмы без добавления культуры.
Пробирки помещают в термостат при температуре 37 - 38 °C. Учет реакции проводят через каждый час в течение 5 - 6 часов. При отсутствии коагуляции пробирки выдерживают при комнатной температуре 18 ч.
При положительной реакции плазмокоагуляции образуется сгусток, который не выпадает из пробирки при наклоне. В случае, когда коагулирована не вся плазма, сгусток плавает в ней.
4.3. Дермонекротическую пробу ставят на кроликах (лучше белой масти) массой 2 - 2,5 кг. Накануне у кролика на боку в 2 местах выстригают шерсть на площади 2x2 см. Суточную бульонную культуру вводят внутрикожно в выстриженные участки кожи в дозе 0,2 мл.
При положительном результате на месте введения культуры через сутки появляется покраснение, на вторые сутки кожа темнеет и образуется некроз.
Наблюдение за кроликами ведут в течение 4 дн.
4.4. При выделении от птиц культур стафилококков, не обладающих плазмокоагулирующими свойствами, их патогенность определяют на 1 - 2-суточных цыплятах.
Суточную бульонную культуру в дозе 0,1 мл вводят 2 цыплятам интраорбитально во внешний угол глазницы между глазным яблоком и краем орбиты.
Гибель цыплят наступает на 3 - 5 сут.
Культуру считают патогенной при выделении ее из паренхиматозных органов и костного мозга павших цыплят.
Наблюдение за цыплятами ведут в течение 5 сут.
5. Лабораторный диагноз считают установленным при выделении из патологического материала культуры со свойствами, характерными для S. aureus, и установления ее патогенных свойств.