СПРАВКА
Источник публикации
Документ опубликован не был
Примечание к документу
Название документа
"Методические указания по бактериологическому исследованию молока и секрета вымени коров"
(утв. Минсельхозом СССР 30.12.1983 N 115-69)
"Методические указания по бактериологическому исследованию молока и секрета вымени коров"
(утв. Минсельхозом СССР 30.12.1983 N 115-69)
Содержание
Начальник Главного управления
ветеринарии Министерства
сельского хозяйства СССР
А.Д.ТРЕТЬЯКОВ
30 декабря 1983 г. N 115-69
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО БАКТЕРИОЛОГИЧЕСКОМУ ИССЛЕДОВАНИЮ МОЛОКА
И СЕКРЕТА ВЫМЕНИ КОРОВ
Настоящие методические указания разработаны Всесоюзным научно-исследовательским институтом ветеринарной санитарии.
1.1. Настоящие Методические указания определяют методы и сроки исследования молока и секрета вымени коров; являются обязательным минимумом для ветеринарных лабораторий и диагностических отделов НИВС и НИВИ при диагностике мастита коров.
1.2. Приведенный в настоящих Указаниях набор питательных сред, применяемых при бактериологическом исследовании, является минимальным; сроки для каждого исследования (сообщения их результатов и заключений) считаются предельными.
1.3. Исследования молока (секрета) коров в ветеринарных лабораториях выполняют в порядке его поступления.
В целях равномерной загрузки лабораторий массовые исследования на мастит проводят по соответствующему календарному плану, согласованному с главным ветеринарным врачом района.
1.4. О результатах исследования лаборатории должны сообщить организациям, учреждениям, хозяйствам и предприятиям, приславшим материал, не позднее, чем в сроки, установленные настоящими указаниями.
В заключении указывается название возбудителя, его чувствительность к антибиотикам и рекомендации по лечению. В необходимых случаях дают указания о присылке материала для дополнительного исследования.
ИС МЕГАНОРМ: примечание. Взамен ГОСТ 13928-68 Постановлением Госстандарта СССР от 13.09.1984 N 3213 с 1 января 1986 года введен в действие ГОСТ 13928-84. |
2.1.1. Отбор проб молока сборного и подготовку его к исследованию проводят по ГОСТ 3622-68 и ГОСТ 13928-68.
2.1.2. Для бактериологического исследования молока на мастит отбирают пробы из четвертей вымени, реагирующих на быстрый маститный тест - мастидин или димастин и дающих положительную пробу отстаивания.
Пробы отбирает ветеринарная служба хозяйства один раз в месяц в период лактации и по мере запуска коров.
2.1.3. Молоко (секрет) для бактериологического исследования на мастит отбирают из четверти вымени с соблюдением правил асептики. Для этого перед взятием пробы молока соски вымени коров и руки дояров протирают ватным тампоном, смоченным 70% спиртом (этиловым или денатурированным), и отбирают в конце дойки 5 - 10 мл альвеолярного молока. При взятии пробы следят за тем, чтобы сосок не касался края пробирки. При повторном взятии пробы с целью подтверждения диагноза на мастит могут быть использованы как цистернальное, так и альвеолярное молоко.
2.1.4. Для выявления бактерионосителей среди животных, предназначенных для комплектования стада фермы и комплексов, отбирают пробы цистернального молока после сдаивания первых 2 - 3 струек.
2.2.1. Пробы молока после их отбора доставляют в лабораторию так, чтобы оно не смачивало пробки. Доставка должна осуществляться в течение 3 - 4 часов с момента взятия проб в специальных емкостях, обеспечивающих температуру не выше 8 - 10 °C, или в термосах со льдом.
2.3.1. Пробы молока на наличие возбудителей мастита исследуют сразу после доставки их в лабораторию. Оставшееся молоко хранят при температуре не выше 6 °C.
2.3.2. Посев молока проводят на МПА с 5% цитратной крови крупного рогатого скота (рецепт 1) и на дифференциально-диагностические среды с целью выделения золотистого стафилококка, стрептококков различных серологических групп, эшерихий, синегнойной палочки, грибов рода Candida.
2.3.3. При первичном обследовании стада, особенно с большим поголовьем или с большим процентом выделения коров с раздражениями вымени, рекомендуется взятые образцы молока с соблюдением правил асептики из реагирующих четвертей вымени, высевать на мясопептонный агар с 5% крови крупного рогатого скота. Посевы инкубируют в термостате при температуре 37 °C в аэробных условиях в течение 24 часов. В случае отсутствия роста посевы выдерживают еще 24 - 48 часов.
2.3.4. Для идентификации выросших культур изучают и культуральные свойства. Крупные выпуклые колонии, вне зависимости от наличия зоны гемолиза, ориентировочно относят к стафилококкам; мелкие росинчатые - к стрептококкам; серые круглые колонии блестящие плоские обычно указывают на рост бактерий группы кишечной палочки. Появление колоний с зеленым оттенком дает основание предполагать наличие синегнойной палочки.
Слизистые гладкие или матовые колонии характерны для споровой микрофлоры, что свидетельствует о загрязнении молока при отборе пробы.
2.3.5. Из колоний, одинаковых по морфологическим свойствам, делают мазки, окрашивают по Граму и микроскопируют.
При исследовании молока на наличие возбудителей мастита могут быть использованы также элективные среды.
Для выделения золотистого стафилококка - ДНК азно-новокаиновый агар, солевой агар, для стрептококков - среда Карташовой, для бактерий группы кишечной палочки - среда КОДА, для псевдомонад - МПБ, для грибов рода Candida - среда элективная дифференциально-диагностическая.
2.3.6. С целью исключения выделения случайных микроорганизмов, исследование образцов молока через 5 - 7 дней повторяют с применением элективных сред.
К возбудителям мастита относят бактерии с идентичными культуральными свойствами, которые выделены при повторном исследовании.
2.3.7. Допускается также производить первичный высев молока при обследовании стад на мастит на вышеуказанные среды в два этапа: в начале на среды для выделения золотистого стафилококка и стрептококков, так как им принадлежит преимущественная роль при возникновении мастита микробной этиологии. В случае получения отрицательных результатов, пробы высевают через 24 часа на другие питательные среды.
2.3.8.1. Для выделения и количественного учета золотистого стафилококка из молока от одного животного (из удоя или отдельных четвертей вымени), а также из сборного молока и молочных продуктов используют ускоренный метод, который основан на применении элективной, дифференциально-диагностической среды - ДНК - новокаинового агара (рецепт 2).
Элективные свойства среды обусловлены ингибирующим действием на постороннюю микрофлору новокаина, дифференцирующие - добавлением натриевой соли дезоксирибонуклеиновой кислоты, позволяющей идентифицировать золотистый стафилококк по его дезоксирибонуклеазной активности.
Проведение исследований. Из доставленных проб молока готовят разведения 1:10 и 1:100 на стерильном физиологическом растворе.
В чашку Петри с ДНК - новокаиновым агаром (рецепт 2) вносят 0,1 мл молока из разведения 1:100 и равномерно распределяют стеклянным шпателем по всей поверхности питательной среды.
Засеянные чашки помещают в термостат крышками вниз и инкубируют при 37 - 38° в течение 22 - 24 часов. На ДНК - новокаиновом агаре золотистый стафилококк растет в виде крупных круглых колоний с ровными краями.
Для выявления ДНК-азной активности золотистого стафилококка поверхность среды в чашках с выросшими культурами заливают 5 - 7 мл 1 N раствора соляной кислоты. Чашки с кислотой выдерживают 2 - 3 минуты, за которые вокруг колоний образуются круглые зоны просветления. Затем кислоту осторожно сливают и приступают к учету результатов исследования. В том случае, если культура стафилококка была выделена на кровяном агаре, то ДНК-азная активность может быть определена путем пересева на ДНК-агар (рецепт 4)
Определение ДНК-азной активности может быть проведено при выращивании изолированной культуры.
Учет результатов исследования. Чашки просматривают в проходящем свете. Обнаружение колоний, окруженных зоной просветления с четкими границами, указывает на наличие в исследуемом материале золотистого стафилококка.
Для определения количества золотистого стафилококка в 1 мл исследуемого материала подсчитывают колонии с зонами просветления по всей поверхности среды, и полученное число колоний умножают на 10 (т.к. высевали 0,1 мл) и на степень разведения материала.
Например: Высеяно 0,1 мл молока из разведения 1:100.
В результате подсчета получено 15 колоний.
Следовательно в 1 мл молока - 15000 микробных клеток золотистого стафилококка (15x10x100).
2.3.8.2. При высеве образцов на кровяной агар учитывают рост выпуклых колоний с гладкой или шероховатой поверхностью, в которых при микроскопии обнаружены грамположительные кокки, расположенные в виде гроздеподобных скоплений, тетрами или одиночно, выделенную культуру относят к стафилококкам и проверяют на каталазную активность. Для этого часть колоний растирают в капле 10%-ной перекиси водорода, нанесенной на предметное стекло. Каталазоположительные стафилококки содержат фермент каталазу, которые при контакте с перекисью водорода образуют интенсивное газообразование. Одновременно по изменению кровяного агара учитывают гемолитические свойства стафилококков. На кровяном агаре с эритроцитами крупного рогатого скота растут стафилококки, обладающие 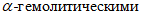 свойствами (прозрачная зона вокруг колоний),
свойствами (прозрачная зона вокруг колоний), 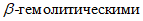 свойствами (матовая зона гемолиза), чаще со смешанным
свойствами (матовая зона гемолиза), чаще со смешанным 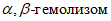 ; иногда зона гемолиза отсутствует.
; иногда зона гемолиза отсутствует.
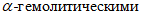 свойствами (прозрачная зона вокруг колоний),
свойствами (прозрачная зона вокруг колоний), 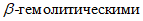 свойствами (матовая зона гемолиза), чаще со смешанным
свойствами (матовая зона гемолиза), чаще со смешанным 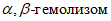 ; иногда зона гемолиза отсутствует.
; иногда зона гемолиза отсутствует.2.3.8.3. Для определения плазмокоагуляции стафилококков, делают высев полученной культуры в пробирки с мясо-пептонным бульоном и через 3 часа выращивания в термостате при 37 °C ставят реакцию плазмокоагуляции с цельной или сухой плазмой крови кролика.
Плазму крови кролика разводят стерильным физиологическим раствором в соотношении 1:5 и разливают в агглютинационные пробирки по 0,5 мл. Бульонную культуру стафилококка по 0,1 мл (2 капли) вносят в пробирки с разведенной плазмой. Для контроля в одну пробирку с плазмой не вносят культуру, а в другую - засевают заведомо плазмокоагулирующий стафилококк. Пробирки помещают в термостат при 37 °C и через каждый час в течение трех часов, затем через 18 и 24 часа учитывают результаты.
При положительной реакции плазмокоагуляции образовавшийся сгусток не выпадает из пробирки при наклоне или плавает в плазме.
2.3.8.4. Определение отношения к манниту в анаэробных условиях. 3 - 4 капли испытуемой бульонной культуры стафилококка высевают в пробирку с 0,15%-ным полужидким агаром, содержащим 0,5% маннита и индикатор Андреде, под вазелиновым маслом (рецепт 5). Посевы инкубируют при температуре 37 °C. Результат учитывают через каждые 24 часа. Окончательный результат через 5 суток. Изменение цвета индикатора (появление розового окрашивания) указывает на ферментацию маннита в анаэробных условиях, что является дифференцирующим характерным признаком для золотистого стафилококка.
2.3.8.5. Фаготипирование стафилококка.
Постановка реакции. Поскольку фаги высушивают в объеме 0,1 мл, то при добавлении 1 мл МПБ (с 0,4% глюкозы и 0,2% CaCl2) получают основное разведение 10-1 (1:10). Из этого основного разведения готовят два рабочих разведения, соответствующие 1 тест-разведению (ТР) и 100 ТР. Разведение, соответствующее 1 ТР, указано на этикетке фага.
Бактериофаги в жидком состоянии следует хранить при температуре 4 °C. Основное разведение фагов 10-1 при таком способе хранения можно использовать в течение 1,5 - 2 месяцев. Разведение, соответствующее 1 ТР, следует готовить заново каждые 7 дней из основного разведения 10-1.
Методика фаготипирования. Суточную агаровую культуру испытуемого штамма засевают в 2,5 мл бульона Хоттингера, Мартена или мясо-пептонного бульона (pH 7,2 - 7,4) и выращивают 3 - 4 часа при 37° (до появления заметной мути). Одновременно готовят чашки с 1,2%-ным агаром, приготовленным на бульоне Хоттингера, содержащего 200 мг аминного азота, 0,4% глюкозы и 0,02% CaCl2 (рецепт 6)
По 25 - 30 мл расплавленного агара разливают в чашки Петри и после застывания его подсушивают 30 - 40 минут при 37°. Выросшую трехчасовую бульонную культуру стафилококка вносят пастеровской пипеткой в чашки и орошают поверхность агара. Избыток культуры отсасывают пипеткой и удаляют, агар вновь подсушивают 30 - 40 минут при 37°.
Дно засеянной чашки расчерчивают карандашом на квадраты по трафарету соответственно числу используемых фагов и в каждый квадрат засеянной среды пастеровской пипеткой с тонко оттянутым концом вертикально наносят каплю соответствующего фага. Один квадрат оставляют для контроля без фага. После нанесения каждого фага пастеровскую пипетку выбрасывают. После подсыхания капель фага чашки переворачивают вниз и инкубируют 5 - 7 часов при температуре 37°, а затем оставляют на 18 - 20 часов при комнатной температуре. Для нанесения фагов на чашки с агаром может быть использован специальный аппарат для фаготипирования стафилококков. Аппарат состоит из 25 металлических стержней, вмонтированных в квадратную пластинку, соединенную с поршнем. Основанием прибора служит площадка из органического стекла, на которой находится свободно передвигающаяся вторая площадка с гнездом для фиксирования засеваемой чашки и пластинки из фторопласта с резервуаром для фагов. В резервуары стерильной фторопластовой пластинки, помещенной в стерильную чашку Петри, наливают по 3 - 5 капель фагов (всегда в одном порядке). Чашку с агаром и пластинку с фагами помещают на подвижную пластинку. Поочередным передвижением площадки устанавливают под металлическими стержнями сначала пластинку с фагами, а затем чашку с агаром. Опуская и поднимая стержни с помощью поршня, переносят капли фагов на чашку с агаром, едва касаясь его поверхности. Чашки меняют в зависимости от числа типируемых культур.
Чашки с фагами оставляют на столе на 30 - 40 минут и затем их орошают 4-часовой бульонной культурой стафилококков. После подсыхания культур чашки переворачивают крышкой вниз и инкубируют 18 - 20 часов при 30 °C или 5 - 6 часов при 37 °C и оставляют до следующего утра при комнатной температуре.
Фаготипирование штаммов начинают с 1 ТР (тест-разведения). Штаммы, которые не лизировались хотя бы одним фагом, на следующий день типируют повторно со 100 ТР.
Учет и регистрация результатов. Степень лизиса культуры разными разведениями фага регистрируют по следующей схеме: (++++) - сливной полный лизис, (+++) - полусливной лизис (незначительный рост культуры в зоне лизиса), (++) - наличие в месте нанесения капли фага свыше 50 пятен лизиса, (+) - от 20 до 50 пятен лизиса, (-) - полное отсутствие лизиса. Для упрощения схемы учета степени лизиса обозначения ++++, +++, ++ и называемые "сильной реакцией", можно регистрировать одним обозначением ++.
Штамм считается типируемым, если хотя бы один фаг вызвал сильную реакцию. Если при типировании культуры фагом 1 ТР получены только слабые реакции или лизис полностью отсутствует, то такой штамм типируют повторно фагом в 100 ТР или считают нетипируемым, (если его типировали 100 ТР). Результаты типирования регистрируют, записывая против названия штамма разведение фагов, с помощью которых был получен положительный результат (1 ТР или 100 ТР), а также номера фагов, обусловивших сильную реакцию. Отдельно в скобках следует записать наличие слабых реакций, если таковые имелись.
Стафилококковые штаммы чаще лизируются не одним, а несколькими фагами, что дает для каждого штамма характерную фагомозаику.
Если культуры стафилококка при типировании в один и тот же день дают мозаики, различающиеся на одну сильную реакцию, их следует считать идентичными; если разница составляет две и более сильные реакции, штаммы следует признать разными.
2.3.8.6. Оценка результатов.
Стафилококки, обладающие гемолитической активностью, плазмокоагулирующими свойствами, разлагающие маннит в аэробных и анаэробных условиях, фаготитруемые относят к золотистым - Staph aureus
Срок лабораторного исследования идентификации стафилококков - 3 дня, при необходимости фаготипирования и определения отношения к манниту - 5 дней.
2.3.9.1. Для выделения стрептококков используют среду Карташовой (рецепт 7), на которую высевают 1 мл исследуемого молока или пересевают выросшие на кровяном агаре росинчатые колонии. После 18 - 24 часов инкубирования посевов при 37 °C из пробирок с измененным цветом среды делают мазки и окрашивают их по Граму.
2.3.9.2. Одним из отличительных признаков бактерий рода стрептококков от стафилококков является каталазная активность. Стрептококки - каталазоотрицательные, не содержат фермент-каталазу. Для определения каталазной активности исследуемую культуру отвивают на косячок сывороточного агара (рецепт 8), выращивают в течение 24 - 48 часов. Выросшую культуру снимают петлей и растирают в капле 10%-ной перекиси водорода (перегидроль разводят в соотношении 1:3) на предметном стекле. Выделение газа, в отличие от стафилококков, у стрептококков не наблюдается.
2.3.9.3. Наличие гемолитических свойств стрептококков определяют путем посева на кровяной агар (рецепт 1), который используют одновременно и для определения гемолитических свойств стафилококков. Большинство выделяемых из молока стрептококков дают непрозрачную (матовую) зону гемолиза. Дальнейшую идентификацию стрептококков ведут по таблице (приложение 2). Для определения свойств устойчивости к желчи культуру стрептококков выращивают предварительно на МПБ с 1% глюкозы (рецепт 9), а затем вносят 1 мл культуры в пробирки с 5 мл МПБ, содержащего 40% желчи (рецепт 10) и ставят в термостат при температуре 37 °C на 24 часа. Полное просветление бульона указывает на лизис культуры, помутнение - на рост. Терморезистентность стрептококков определяют путем прогрева бульонной культуры стрептококка при 60 °C в течение 30 минут. Пробирки с бульонной культурой ставят в водяную баню с указанным температурным режимом. После прогрева культуру высевают на МПБ и инкубируют в термостате в течение 24 - 48 часов. Наличие роста в бульоне указывает на терморезистентность культуры. Кроме того, проверяется способность роста на МПБ с содержанием 0,5% сорбита и на МПБ с pH 9,6.
2.3.9.4. Для определения способности культуры обесцвечивать метиленовый голубой производят посев культуры в пробирку с молоком, содержащим этот индикатор в концентрации 1:1000 (рецепт 11). Посевы инкубируют в термостате в течение 24 часов при температуре 37 °C.
2.3.9.5. Постановка КАМП-теста. Суточную культуру 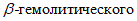 стафилококка высевают на агар с 5% крови крупного рогатого скота (рецепт 1). Посев делают петлей сплошной линией по диаметру чашки. Перпендикулярно к линии посева стафилококка, не доходя 5 - 6 мм, высевают ровным штрихом испытуемую культуру стрептококков. На одной чашке можно проверить 5 - 10 культур. Чашки помещают в термостат на 24 часа при 37 °C. КАМП-тест считают положительным, если четко выражена зона гемолиза испытуемого стрептококка в виде усеченного треугольника или полукруга в зоне
стафилококка высевают на агар с 5% крови крупного рогатого скота (рецепт 1). Посев делают петлей сплошной линией по диаметру чашки. Перпендикулярно к линии посева стафилококка, не доходя 5 - 6 мм, высевают ровным штрихом испытуемую культуру стрептококков. На одной чашке можно проверить 5 - 10 культур. Чашки помещают в термостат на 24 часа при 37 °C. КАМП-тест считают положительным, если четко выражена зона гемолиза испытуемого стрептококка в виде усеченного треугольника или полукруга в зоне 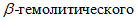 стафилококка. При необходимости серологической идентификации выделенных штаммов стрептококков, последние направляют в научно-исследовательские учреждения.
стафилококка. При необходимости серологической идентификации выделенных штаммов стрептококков, последние направляют в научно-исследовательские учреждения.
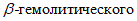 стафилококка высевают на агар с 5% крови крупного рогатого скота (рецепт 1). Посев делают петлей сплошной линией по диаметру чашки. Перпендикулярно к линии посева стафилококка, не доходя 5 - 6 мм, высевают ровным штрихом испытуемую культуру стрептококков. На одной чашке можно проверить 5 - 10 культур. Чашки помещают в термостат на 24 часа при 37 °C. КАМП-тест считают положительным, если четко выражена зона гемолиза испытуемого стрептококка в виде усеченного треугольника или полукруга в зоне
стафилококка высевают на агар с 5% крови крупного рогатого скота (рецепт 1). Посев делают петлей сплошной линией по диаметру чашки. Перпендикулярно к линии посева стафилококка, не доходя 5 - 6 мм, высевают ровным штрихом испытуемую культуру стрептококков. На одной чашке можно проверить 5 - 10 культур. Чашки помещают в термостат на 24 часа при 37 °C. КАМП-тест считают положительным, если четко выражена зона гемолиза испытуемого стрептококка в виде усеченного треугольника или полукруга в зоне 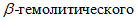 стафилококка. При необходимости серологической идентификации выделенных штаммов стрептококков, последние направляют в научно-исследовательские учреждения.
стафилококка. При необходимости серологической идентификации выделенных штаммов стрептококков, последние направляют в научно-исследовательские учреждения.Оценка результатов исследований производится по таблице приложения-2
Срок лабораторного исследования на стрептококк - 3 дня.
Образцы молока или колоний с кровяного агара, морфологические свойства которых напоминают БГКП, высевают на среду КОДА (рецепт 12) и помещают в термостат при 37 °C на 24 часа. Изменение цвета среды из фиолетового в зеленый свидетельствует о наличии в пробах молока БГКП. Для идентификации бактерий рода эшерихий производят посев из пробирок с измененным цветом на среду Симмонса (цитратный тест) и пептонную воду (для реакции на индолообразование). На среде Симмонса эшерихии не растут, а следовательно не изменяют цвета. При определении индолообразования покраснение фильтровальной бумажки, пропитанной реактивом Эрлиха - Бомэ, находящейся в пробирках с посевами на пептонной воде, свидетельствует о наличии эшерихий, в классической реакции - образование розового (индольного) кольца на границе двух жидкостей: эфирной вытяжки и реактива Эрлиха - Бомэ.
Посевом со среды КОДА на среду Олькеницкого (рецепт 13) можно идентифицировать эшерихий, бактерий рода энтеробактер от сальмонелл и протея.
Посев на среду Олькеницкого в пробирках производят петлей по поверхности скоса среды и внутрь столбика. Посевы культивируют в термостате при 37 °C в течение 24 часов. Изменение цвета (глюкоза + лактоза +) столбика и скоса среды Олькеницкого из красного в желтый при отсутствии почернения внутри столбика свидетельствует о росте бактерий из рода эшерихий. Изменение скоса среды и столбика в малиновый цвет (мочевина +) и почернение внутри столбика (сероводород +) указывает на рост протея. Изменение скоса в красный, столбика в желтый цвет и почернение внутри столбика указывает на рост сальмонелл.
В случае необходимости дальнейшей идентификации БГКП следует пользоваться таблицей приложения 3. Срок лабораторного исследования - 3 дня.
Образцы молока или колонии с кровяного агара, при микроскопии которых обнаружены грамотрицательные палочки, высевают на МПА и МПБ, культивируют в термостате при 37 °C в течение 24 - 48 часов. Появление сине-зеленого окрашивания МПБ и МПА, рост гладких плоских колоний с ровными или изрезанными краями указывает на рост синегнойной палочки. Pseudomonas aeroginosa вырабатывает сине-зеленый пигмент пиоционин, за счет которого происходит окрашивание питательных сред. Имеются отдельные виды синегнойной палочки, которые не вырабатывают пиоционин. Pseudomonas aeroginosa не всегда активно вырабатывает пигмент. Пигментообразование можно наблюдать лишь на 2 - 3 сутки. Поэтому посевы на МПБ и МПА следует дополнительно просматривать через 48 - 72 часа. Сине-зеленое окрашивание МПБ лучше проявляется, если пробирку с МПБ встряхнуть и обеспечить доступ кислорода.
Из МПБ и МПА делают мазки и окрашивают их по Граму.
Pseudomonas aeroginosa представляет собой короткую, тонкую грамотрицательную палочку.
При обнаружении в мазках грамотрицательных палочек и изменение цвета сред в сине-зеленый ставят реакцию для обнаружения пиоционина. Для этого в пробирку с МПБ добавляют 1 мл хлороформа, пробирку встряхивают, хлороформ приобретает зеленый цвет и опускается на дно.
У пигментообразующих сапрофитных бактерий в хлороформе пигмент не растворяется.
Принадлежность выделенной культуры к Ps. aeroginosa подтверждают следующими признаками. Синегнойная палочка может расти при температуре от +15 до +43 °C, способна расти при пересеве в физиологическом растворе, вызывает гидролиз желатины, свертывание молока, не растет на среде Китт-Тароцци, не ферментирует углеводы за исключением глюкозы, индол не образует, выделяет аммиак, гидролизует мочевину. Реакция на каталазу - положительная.
Срок лабораторного исследования - 3 дня.
Из доставленных в лабораторию проб молока делают высевы по 0,1 - 0,3 мл на чашки Петри со средой (рецепт 14). Посевы делают на 2 чашки Петри. Высеянный материал равномерно, не повреждая среды, растирают по всей поверхности ее стерильным шпателем, делая круговое движение.
Засеянные чашки помещают в термостат вверх дном при температуре 37 °C на 18 - 20 часов.
Контролем служит посев культуры этого гриба на ту же самую элективную дифференциально-диагностическую среду.
После инкубации чашки Петри просматривают и проводят второй этап микологического исследования. Для чего проводят микроскопию окрашенных препаратов по Граму или другим методом для проверки чистоты культуры и изучения морфологии, а также пересев из колонии в пробирки на ту же самую среду для выделения чистой культуры и выявления псевдомицелия. Чашки Петри с выросшими культурами оставляют далее при комнатной температуре. Засеянные пробирки выдерживают при 37 °C 24 часа, затем оставляют на 2 суток при комнатной температуре (18 - 22° C). После этого выросшие колонии микроскопируют.
Первичный учет результатов делают через 20 часов инкубации материала, а окончательный учет - на 4-й день исследования
Для идентификации грибов до рода достаточно определения псевдомицелия. В большинстве случаев псевдомицелий на элективной дифференциально-диагностической среде определяет через 20 часов путем микроскопии окрашенных препаратов, а когда это не удается, на 4 день исследования. Кроме псевдомицелия обнаруживают почкующиеся клетки (споры, истинный мицелий, а иногда и хламидоспоры).
Колонии грибов рода Candida гладкие, морщинистые, плоские, беловато-серые, кремо-беловатые, кремовые, мягкой консистенции, кожистые.
Срок лабораторного исследования - 4 дня.
Для определения чувствительности микроорганизмов к антибиотикам должны быть использованы:
- МПА или агар Хоттингера - рецепт 15 (для стафилококков, кишечной палочки, псевдомонад);
- сывороточный МПА - рецепт 10 (для стрептококков).
Добавление сыворотки обеспечивает рост стрептококков
Сыворотку вносят в расплавленный и охлажденный до 37 °C МПА.
Среду разливают по 20 мл в стерильные чашки Петри, расположенные на горизонтальной поверхности.
Выделенные культуры выращивают на одной из указанных сред, смывают стерильным физиологическим раствором и готовят бактериальную взвесь с концентрацией 1 млрд микробных тел в 1 мл. Это соответствует 10 ед. по оптическому стандарту.
На поверхность среды наливают 1 мл взвеси культуры, орошают ею всю поверхность. Наклонив чашку, излишек культуры отсасывают пастеровской пипеткой. Чашки с посевами подсушивают при комнатной температуре в течение 40 минут, после чего на поверхность засеянной среды накладывают диски с антибиотиками.
Диски раскладывают стерильным пинцетом на расстоянии 2 см от края чашки и слегка прижимают к агару. Каждая чашка может служить для испытания 5 - 6 видов антибиотиков.
Для лучшей диффузии антибиотика в агар чашки с засеянной культурой и разложенными дисками выдерживают в течение 2 часов при комнатной температуре, затем помещают в термостат при температуре 37 °C вверх дном.
Результаты учитывают через 16 - 18 часов, для чего определяют линейкой диаметр зоны задержки роста микробов вокруг бумажных дисков, включая и размер дисков.
Отсутствие зоны задержки роста микробов вокруг диска указывают на то, что испытуемая культура не чувствительна к данному виду антибиотика.
2.3.14. Ускоренный (пробирочный) метод определения чувствительности микрофлоры молока к антибиотикам (метод ориентировочный, без выделения микроорганизмов).
Исследуемое молоко с соблюдением стерильных условий разливают по 2 мл в стерильные пробирки. Пробирок должно быть на две больше, чем дисков с антибиотиками.
В одной из пробирок определяют реакцию (pH) молока, добавляя в него 0,1 мл 0,5%-ного спиртово-водного раствора индикатора (0,5 г бромтимолблау растворяют в начале в 50 мл спирта, затем доливают 50 мл дистиллированной воды. В зависимости от pH молока смесь окрашивается от желтого, салатового, зеленого (кислое молоко) до синего цвета (щелочное молоко). Записав результат (цвет смеси), данную пробу исключают из опыта. В оставшиеся пробирки (кроме одной) добавляют по одному диску различных антибиотиков.
Все пробирки с молоком выдерживают при 37 °C в течение 18 - 20 часов в термостате или автоматически регулируемой водяной бане, после чего во всех пробирках проверяют кислотность молока раствором бромтимолблау.
Если кислотность молока в пробирке без антибиотиков до опыта и после выдерживания в течение 18 - 20 часов в термостате одинакова, значит бактерий в молоке нет. При наличии микрофлоры кислотность молока в пробирке без антибиотиков после выдерживания в термостате увеличивается. В этом случае проверяется кислотность молока в пробирках с антибиотиками.
Если кислотность молока с тем или иным антибиотиком (после выдерживания в термостате) не выше первоначальной (до выдерживания в термостате), значит, бактерии, находящиеся в молоке, высокочувствительны к данному антибиотику. Если кислотность молока в пробирках с антибиотиками после выдерживания в термостате увеличивается, значит находящиеся в молоке бактерии устойчивы к данному антибиотику и причем выше кислотность молока, тем устойчивее микроорганизмы к антибиотику.
2.3.15.1. Подсчет с помощью электронных счетчиков ("Культер", целлоскоп, "Фоссоматик").
2.3.15.2. Камерный метод.
Для подсчета соматических клеток в молоке используют счетную камеру Фукса - Розенталя. При отсутствии ее можно использовать камеру Горяева, Тома, Предтеченского, Бюркера.
Для растворения жировых шариков, в молоко добавляют солюбилизирующий раствор, который готовят в следующем порядке. Синтанол ДС-10 расплавляют в водяной бане, отмеривают в колбу 1 мл, смешивают с 12,5 мл этилового спирта, добавляют 1 мл формальдегида и доливают 0,9%-ным раствором хлористого натрия до 100 мл. Полученный солюбилизирующий раствор прогревают при 60 °C в течение 20 минут, после чего добавляют 1 мл насыщенного спиртового раствора основного фуксина и фильтруют через бумажный фильтр. В связи с тем, что при длительном хранении краситель выпадает из раствора в осадок, его добавляют к солюбилизирующему раствору непосредственно перед применением, а солюбилизирующий раствор в герметическом сосуде сохраняется длительное время.
Для подсчета клеток в пробирки, содержащие 4,9 мл солюбилизирующего раствора с красителем, добавляют 0,1 мл молока, тщательно перемешивают и прогревают 30 минут на водяной бане при 80 °C. После перемешивания каплю жидкости вносят под притертое покровное стекло счетной камеры.
Подсчет клеток ведут под микроскопом при объективе 10x - 20x. В поле зрения на прозрачном фоне видны четко окрашенные клетки, легко поддающиеся подсчету. Если при этом выявлено повышенное содержание соматических клеток в сборном молоке (от 500 тыс./мл до 1 млн. и более), то всех лактирующих коров стада исследуют на мастит по общепринятой схеме.
Подсчет клеток с помощью камеры Фукса - Розенталя проводят на площади всей камеры. Полученное количество клеток в камере умножают на коэффициент 15625, что соответствует количеству соматических клеток в 1 мл молока. При использовании камеры Горяева подсчет соматических клеток ведут в 100 больших квадратах. В этом случае полученное количество клеток умножают на коэффициент 125000.
2.3.15.3. Метод Прескота и Брида.
Чистое предметное стекло кладут на лист бумаги, расчерченный на квадраты, сторона квадрата 1 см. Пробу молока (секрета) тщательно смешивают, затем микропипеткой наносят на каждый квадрат предметного стекла 0,005 мл молока (секрета) и тщательно распределяют на площади квадрата. Мазок высушивают на воздухе, фиксируют метиловым спиртом или спирт-эфиром (лучше изобутиловым спиртом) в ванночке при вертикальном положении мазка, окрашивают 15 - 20 минут по Романовскому - Гимза (на 1 мл дистиллированной воды 1 - 2 капли краски). Вместо метода по Романовскому - Гимза можно окрашивать мазки по Ньюмансу раствором следующего состава: спирт абсолютный - 50 мл, ледяная уксусная кислота - 20 мл, хлороформ - 50 мл, фуксин основной - 0,1 г, метиленовая синь - 1,0 г. Краски растворяют в смеси спирта и хлороформа, нагретой до 50°. После охлаждения до комнатной температуры в раствор добавляют ледяную уксусную кислоту и выдерживают в течение 18 часов, а затем используют для окрашивания. После окрашивания препарат сушат и промывают трехкратно теплой водой (37 - 40 °C). Мазок тщательно высушивают и просматривают под микроскопом. В каждом мазке просматривают 100 полей зрения. Подсчитанное количество клеток умножают на коэффициент для подсчета с учетом объектива и окуляра (для микроскопа МБ-1 при объективе 90 и окуляре 7 этот коэффициент равен 6260; при окуляре - 10 - 10200; при окуляре 15 - 33200).
При содержании соматических клеток в 1 мл молока от 800 тыс. - 1 млн. и более, а также выделении патогенной микрофлоры животное считают подозрительным в заболевании маститом. Окончательный диагноз устанавливают на основании клинических признаков и других тестов (проба с димастином, мастидином и проба отстаивания).
РЕЦЕПТЫ ПИТАТЕЛЬНЫХ СРЕД
Для приготовления кровяного агара у здоровой коровы из яремной вены берут 250 мл крови в стерильную колбу, в которую предварительно вносят 50 мл стерильно приготовленного 5% раствора лимоннокислого натрия. По мере взятия кровь в колбе смешивают с лимоннокислым натрием путем встряхивания. Полученную цитратную кровь проверяют на стерильность путем посева на МПБ и только после этого используют для приготовления кровяного агара. Цитратная кровь при необходимости может сохраняться в условиях холодильника в течение 10 - 14 дней. Мясопептонный агар расплавляют в колбе, затем охлаждают до 45 °C и стерильной пипеткой вносят в него 10 - 15% цитратной крови, равномерно смешивая, после чего разливают в чашки Петри по 15 мл. Застывший агар помещают в термостат при температуре 37 °C на 24 часа для проверки на стерильность.
Для приготовления кровяного агара может быть использована также дефибринированная кровь барана.
К 150 мл расплавленного стерильного 2%-ного МПА (pH 8,6) добавляют 150 мг ДНК, предварительно растворенной в 10 мл (подщелоченной 2 каплями 10%-ного раствора едкого натра) дистиллированной воды, и 3 г (2%) новокаина.
После перемешивания среду прогревают в течение 30 минут в кипящей водяной бане.
К остывшей до 45 - 50 °C среде добавляют 7 - 8 мл (5%) сыворотки крови крупного рогатого скота и 1,2 мл 10%-ного раствора хлористого кальция, перемешивают и разливают в чашки Петри.
Примечание: ДНК-натриевая соль выпускается научно-производственным объединением "Биохимреактив" Латвийской ССР г. Олайне.
Дифференциально-диагностическая среда (Рецепт 3)
На 1 л дистиллированной воды берут: МПА - 15 г, пептон - 10 г, NaCl - 75 г, маннит - 10 г, фенол-рот - 0,025 г, pH - 7,4.
стафилококков. (Рецепт 4)
К 150 мл расплавленного 2%-ного МПА (pH 8,6) добавляют 150 мг ДНК, растворенной в 10 мл дистиллированной воды, с 2 каплями 10%-ного едкого натрия, среду прогревают 30 мин в кипящей водяной бане, затем охлаждают до 50 - 60 °C и добавляют 1,2 мл 10%-ного стерильного хлористого кальция и 13 - 14 мл (8 - 9%) сыворотки КРС или 8 мл (5%) дрожжевого экстракта.
стафилококков. (Рецепт 5)
К полужидкой пептонной среде (1% пептона, 0,5% хлорида натрия, 0,15% агар-агара) pH 7,4, после ее расплавления, добавляют 0,5% маннита и 1% индикатора Андреде, перемешивают, разливают в пробирки по 10 мл. Стерилизуют при 0,5 атм 30 минут, после чего наслаивают стерильное вазелиновое масло высотой 1 см.
Для приготовления 1 л среды требуются: агар-агара - 12 г, гидролизата Хоттингера - 200 мл, свежей мясной воды - 400 мл, водопроводной воды - 400 мл, глюкозы - 4 г, хлористого кальция - 0,2 г (последний добавляют непосредственно к готовой расплавленной среде перед разливом ее в чашки Петри - 2 мл 10% стерильного раствора).
К 500 мл готового стерильного мясо-пептонного бульона добавляют 2,5 г лактозы, 1 мл спиртово-водного раствора 1:100 бромкрезолпурпура (после растворения 1 г порошка в 50 мл спирта добавляют 50 мл дистиллированной воды). Колбу со средой ставят в холодную водяную баню доводят до кипения и кипятят 5 - 7 минут. Охлаждают среду до 50 - 55 °C и добавляют 50 мл сыворотки и 50 ЕД/мл неомицина. Среду разливают в стерильные пробирки по 50 мл.
МПА - 95 мл
Стерильная сыворотка лошади - 5 мл без консерванта
Глюкоза - 1 г
pH - 7,4.
Глюкозу вносят в МПА перед стерилизацией. Среду стерилизуют при 0,5 атм в течение 30 минут. Перед внесением сыворотки агар расплавляют и охлаждают до 45 °C, вносят асептически сыворотку, перемешивают и разливают в чашки или пробирки.
В 100 мл МПБ добавляют 1 г глюкозы среду стерилизуют при 0,5 атм в течение 30 минут. pH среды должен быть 7,2 - 7,4.
К 90 мл стерильного МПБ, pH 7,4, добавляют асептически 10 мл стерильной бычьей желчи, перемешивают, разливают в пробирки и стерилизуют при 0,5 атм 20 минут.
0,2 г метиленового голубого растворяют в 20 мл горячей дистиллированной воды, раствор пропускают через бумажный фильтр и стерилизуют при 0,5 атм 20 минут. К стерильному обезжиренному молоку добавляют 1% приготовленного раствора.
Среда выпускается в виде порошка Дагестанским НИИ питательных сред и готовится в соответствии с инструкцией.
К 100 мл стерильного питательного агара добавляют 1 г лактозы, 0,02 г соли Мора, 0,03 г гипосульфита, 1 г сахарозы, 0,1 г глюкозы, 1 г мочевины и 0,4 мл 0,4%-ного раствора фенолового красного. Предварительно растворяют соль Мора с гипосульфитом в одной пробирке с небольшим количеством воды, а в другой - мочевину с углеводами. После растворения все смешивают с агаром и профильтровывают через стерильную марлю. Стерилизуют текучим паром 3 дня подряд по 20 минут. Горячую среду скашивают, оставляя столбик высотой 2 см. Среда прозрачная, имеет красный цвет с коричневым оттенком.
для выделения и идентификации грибов рода Candida (ЭДДС).
(Рецепт 14)
Элективная дифференциально-диагностическая среда для выделения и идентификации грибов рода Candida обусловлена введением карамели (солод поджаренный при 150 - 170 °C в течение 2,5 час.), что дает обогащение минерального состава среды.
В качестве субстрата употребляется фильтрат сусла, имеющего углеводов 15 - 17° по Баллингу, и расплавленный в дистиллированной воде агар-агар.
18 - 20 г агар-агара растворяют при кипячении в 500 мл дистиллированной воды, затем добавляют до 1 л фильтрат сусла, имеющего карамели 6 - 8%. После установления pH 6,6 - 6,8 среду разливают в колбы и автоклавируют в автоклаве при 1 атм - 15 минут. Для проверки на стерильность среду ставят в термостат на 24 часа при 37 °C. По истечении этого срока ее нагревают до 100 °C и остывшую до 47 - 50 °C разливают в чашки Петри или в пробирки. Чашки со средой можно хранить в холодильнике в течение 15 - 30 дней, защитив от высыхания путем помещения чашек в целлофановые мешки.
Среда из триптического перевара мяса (перевара Хоттингера) с содержанием 120 - 140 мг% аминного азота и 1 - 2% агара, pH среды 7,2 - 7,4.
Серологическая группа | Наименование стрептококка | Гемолиз | КАМП-тест | Среда Карташовой | МПБ с 6,5% NaCl | МПБ с 40% желчи | 60° 30 минут | Молоко с метиленовым голубым 1:1000 | МПБ с 0,5% сорбита | МПБ с pH 9,6 | |
A | Str. pyogenes | - | + | - | + | - | - | - | - | - | - |
B | Str. agalactiae | +/- | +/- | + | + | - | +/- | - | - | - | - |
C | Str. dysgalactiae | + | - | - | + | - | - | - | - | +/- | - |
E | Str. uberis | - | + | - | + | - | +/- | - | - | +/- | - |
Д | Str. faecalis | - | +/- | - | + | + | + | + | + | +/- | + |
N | Str. lactis | +/- | +/- | - | - | - | +/- | - | +/- | - | - |
N | Str. cremoris | +/- | - | - | - | - | - | - | +/- | - | - |
из семейства Enterobacteriaceae.
Род | Лактоза | Индол | Метилрот | Реакция Фогес - Проскауэра | Усвоение цитрата | Образование сероводорода | Разложение мочевины | Разложение желатины | Маннит |
Escherichia | + или x | + реже (-) | + | - | - | - | - | - | + |
Citrobacter | + | - или x | + | - | + | + | - или (+) | - | + |
Enterobacter | + | - или x | - | + | + | - | - | - | + |
Обозначения: + - положительный результат через 24 - 48 часов; x - запоздалый или непостоянный положительный результат; (-) - отрицательный результат; (+) - слабоположительная реакция (ферментация углевода слабая, желатина разжижается слабо и т.д.). | |||||||||