СПРАВКА
Источник публикации
М.: Россельхозакадемия, 1994
Примечание к документу
Название документа
"Методические рекомендации по микробиологическому исследованию молока и секрета вымени коров для диагностики мастита"
"Методические рекомендации по микробиологическому исследованию молока и секрета вымени коров для диагностики мастита"
Содержание
ПО МИКРОБИОЛОГИЧЕСКОМУ ИССЛЕДОВАНИЮ МОЛОКА И СЕКРЕТА
ВЫМЕНИ КОРОВ ДЛЯ ДИАГНОСТИКИ МАСТИТА
Методические указания разработаны доктором ветеринарных наук, профессором В.М. Карташовой (ВНИИ ветеринарной санитарии, гигиены и экологии) и кандидатом ветеринарных наук Л.А. Тарановой (Республиканская научно-производственная лаборатория РФ)
Утверждены секцией "Ветеринарная санитария, гигиена и экология" Отделения ветеринарной медицины Россельхозакадемии.
Методические указания предназначены для научно-исследовательских учреждений, ветеринарных лабораторий, занимающихся вопросами диагностики и лечения маститов.
Ответственный за выпуск - главный специалист Отделения ветеринарной медицины Россельхозакадемии, кандидат ветеринарных наук В.Н. Скира
1.1. Настоящие Методические указания включают методы исследования молока и секрета вымени коров при диагностике мастита и содержат современные, доступные для практического использования микробиологические методики с подробным изложением (в приложении) рецептов питательных сред.
1.2. Исследования молока (секрета вымени) коров в ветеринарных лабораториях выполняются по мере необходимости.
В целях равномерной загрузки лабораторий массовые исследования на мастит проводят в соответствии с календарным планом, согласованным с Главным ветеринарным врачом района.
1.3. Наиболее частыми возбудителями мастита коров являются St. aureus, Str. agalactiae, E. coli, Pseudomonas aeruginosa, Corynebacterium bovis, Corinebacterium renale, Mycoplasma, Nocardia asteroides, Candida albicans.
1.4. Результаты исследования патологического материала лаборатории сообщают хозяйствам в сроки, установленные настоящими Методическими указаниями.
В заключении экспертизы указывают название возбудителя, его чувствительность к антибиотикам и рекомендации по лечению. В необходимых случаях указывают на повторное направление материала для дополнительного исследования.
2.1.1. Отбор молока (секрета) для микробиологического исследования проводят ветеринарные специалисты хозяйств от коров с клинической и субклинической формами мастита в соответствии с "Рекомендациями по борьбе с маститом", утвержденными ГУВ МСХ СССР 1 июля 1983 г.
2.1.2. Для микробиологического исследования отбирают пробы секрета из пораженных четвертей вымени или пробы молока из четвертей, реагирующих на быстрый маститный тест (БМТ) - мастидин и дающих положительную пробу отстаивания.
2.1.3. Молоко (секрет вымени) для микробиологического исследования отбирают из четвертей вымени с соблюдением правил асептики. Перед взятием пробы молока соски вымени коров протирают ватным тампоном, смоченным 70° спиртом (этиловым или денатурированным), и выдаивают в конце дойки 5 - 10 см3 молока в стерильные пробирки с пробкой. При взятии пробы сосок не должен касаться края пробирки.
2.1.4. Для выявления бактерионосителей среди животных, предназначенных для комплектования стада фермы отбирают пробы молока у коров, давших положительную реакцию с мастидином (БМТ).
2.2.1. Взятые пробы молока доставляют в лабораторию не позднее 4 часов с момента взятия в специальных емкостях, обеспечивающих температуру не выше 8 - 10 °C, или в термосах со льдом.
на наличие возбудителей мастита
2.3.1. Пробы молока (секрета вымени) исследуют на наличие возбудителей мастита сразу после доставки их в лабораторию. Оставшееся молоко хранят для учета пробы отстаивания при температуре 4 +/- 2 °C.
2.3.2. Посев молока (секрета вымени) проводят пастеровской пипеткой в чашки Петри с плотной питательной средой с последующим растиранием материала по поверхности среды шпателем или стеклянной палочкой с оплавленным шаровидным концом, а также в пробирки с жидкими питательными средами.
2.3.3. Для диагностики мастита на первом этапе проводят исследование на наличие в молоке или секрете вымени стафилококков, стрептококков и энтеробактерий, на втором этапе при неудовлетворительном лечебном эффекте - псевдомонад, микоплазм, коринебактерий, грибов рода Кандида и Нокардия.
2.3.4. В случае необходимости обнаружения в молоке возбудителей сибирской язвы, листериоза, туберкулеза, бруцеллеза и др. пользуются соответствующими методическими указаниями по диагностике данных заболеваний.
2.3.5. Выделение и идентификация стафилококков
2.3.5.1. Для выделения стафилококков проводят посев материала на кровяной агар (рец. N 1), или кровяной агар с хлористым натрием (рец. N 2), или молочно-солевой агар (рец. N 3). При использовании кровяного агара с новокаином (рец. N 4), или ДНК-новокаинового агара (рец. N 5) учитывают степень контаминации молока золотистым стафилококком. Посевы инкубируют 24 часа при температуре 37 +/- 1 °C.
2.3.5.2. При просмотре культур на кровяном агаре учитывают рост крупных (2 - 4 мм) выпуклых колоний с гладкой блестящей или матовой поверхностью белого, кремового, желтого или лимонно-желтого цвета, окруженные прозрачной или полупрозрачной (иногда двойной) зоной гемолиза, или без гемолиза. Из изолированных колоний делают мазки, окрашивают их по Граму и микроскопируют.
2.3.5.3. При обнаружении в мазках кокков, расположенных одиночно, в виде гроздевидных скоплений или тетракокков, что характерно для стафилококков, выделенную культуру проверяют на каталазную активность и при получении положительной реакции относят к стафилококкам.
2.3.5.4. Для определения каталазной активности колоний растирают в капле 10% раствора перекиси водорода, нанесенной на предметное стекло. Стафилококки содержат фермент каталазу, которая при контакте с перекисью водорода вызывает интенсивное газообразование. Учитывая, что перекись водорода при хранении быстро разлагается, следует использовать свежеприготовленный раствор.
2.3.5.5. Гемолитические свойства стафилококков могут быть учтены при первичном росте на кровяном агаре. Однако ввиду возможности одновременного роста на кровяном агаре другой микрофлоры, в присутствии которой может угнетаться или наоборот усиливаться гемолитическая активность стафилококков, а также в случае наличия ингибирующих веществ (новокаин, хлористый натр) в составе кровяного агара, рекомендуется произвести пересев изолированных колоний на другую чашку с кровяным агаром без ингибиторов. На кровяном агаре с эритроцитами крупного рогатого скота или барана стафилококки вызывают гемолиз эритроцитов, образуя прозрачную зону вокруг колоний  , или непрозрачную зону
, или непрозрачную зону  , иногда смешанную
, иногда смешанную  зону; отдельные штаммы золотистых стафилококков не вызывают гемолиз эритроцитов.
зону; отдельные штаммы золотистых стафилококков не вызывают гемолиз эритроцитов.
 , или непрозрачную зону
, или непрозрачную зону  , иногда смешанную
, иногда смешанную  зону; отдельные штаммы золотистых стафилококков не вызывают гемолиз эритроцитов.
зону; отдельные штаммы золотистых стафилококков не вызывают гемолиз эритроцитов.2.3.5.6. Для определения плазмокоагулирующих свойств стафилококков, обусловленных наличием фермента коагулазы, ставят реакцию с цельной или сухой разведенной плазмой крови кролика. Для этого используют колонии стафилококков, выросшие на одной из питательных сред, или культуру, отвитую на МПА и выращенную при 37 +/- 1 °C в течение 18 - 24 ч.
Плазму крови кролика разводят стерильным физиологическим раствором в соотношении 1:5 и разливают в пробирки Флоринского по 0,5 см3. Сухую плазму разводят в соответствии с инструкцией по ее применению.
Культуру стафилококка снимают с агара бактериологической петлей и вносят в пробирки с разведенной плазмой. Для контроля одну пробирку с плазмой не засевают культурой, в другую засевают заведомо известной культурой плазмокоагулирующего стафилококка. Результаты учитывают через каждый час в течение 3-х часов, затем пробирки вынимают из термостата, выдерживают при комнатной температуре в течение 20 - 24 ч, после чего проводят окончательный учет результатов.
При положительной реакции плазмокоагуляции образовавшийся сгусток не выпадает из пробирки при ее наклоне или плавает в плазме. При отрицательном результате плазма остается жидкой и легко выливается из пробирки.
2.3.5.7. Определение ферментации маннита в анаэробных условиях.
3 - 4 капли испытуемой культуры стафилококка высевают в пробирку с 5 см3 0,15%-ным полужидким агаром, содержащим 0,5% маннита и индикатор Андреде под вазелиновым маслом (рец. N 6), Посевы инкубируют при температуре 37° +/- 1 °C. Результат учитывают через каждые 24 часа в течение 5 суток. Изменение цвета индикатора (появление розового окрашивания) указывает на ферментацию маннита в анаэробных условиях, что является дифференцирующим признаком для золотистого стафилококка.
2.3.5.8. Определение фосфатазной активности стафилококка
Для определения фосфатазы у стафилококковых культур проводят посев выделенной культуры в чашки Петри со средой, содержащей фенолфталеинфосфат натрия (рец. N 7), Посевы инкубируют при температуре 37 +/- 1 °C в течение 24 часов, после чего на крышку чашки с выросшей культурой вносят несколько капель 10%-ного водного раствора аммиака, чашку с культурой переворачивают дном кверху и закрывают крышкой с аммиаком. Под действием паров аммиака фосфатазоположительные культуры приобретают розовый оттенок, фосфатазо-отрицательные культуры - желтый или остаются без изменений.
2.3.5.9. Определение ДНК-азной активности стафилококков
Для определения фермента ДНК-азы проводят посев культуры стафилококка в чашки Петри со специальной средой (рец. N 5). Элективные свойства этой среды обусловлены ингибирующим действием новокаина на постороннюю микрофлору, дифференцирующие - наличием натриевой соли дезоксирибонуклеиновой кислоты, которая деполимеризуется под действием дезоксирибонуклеазы (ДНК-азы) стафилококка, что выявляется после обработки поверхности среды соляной кислотой.
Посев культур проводят в одну чашку до 12 - 16 культур стафилококков. Культуры засевают штрихами по радиусу или в виде бляшек в центр квадрата, подложив под чашку трафарет, расчерченный на квадраты. Посевы инкубируют при 37 +/- 1 °C в течение 24 ч. По окончании культивирования чашку с выросшими культурами вынимают из термостата, наливают в нее 5 - 7 см3 1 N раствора соляной кислоты и выдерживают (2 - 3 мин) при 22 +/- 2 °C до момента появления просветленной зоны вокруг колоний-бляшек или вдоль штрихов (реакция положительная). Затем кислоту осторожно сливают, чтобы не смыть культуру и учитывают результаты.
2.3.5.10. Дифференциацию кокковой микрофлоры, выделенной из молока или секрета вымени коров, проводят на основании тестов, указанных в таблице N 1.
Таблица 1

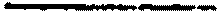 | тест основной |
 | тест дополнительный |
анаэробно | - анаэробные условия культивирования |
+ | - тест положительный |
- | - тест отрицательный |
2.3.5.11. Количественный учет золотистого стафилококка
При исследовании сборного молока для выделения и количественного учета стафилококков используют кровяной агар с новокаином. Если необходимо учесть количество только золотистого стафилококка, используют ДНК-новокаиновый агар. Из доставленных проб молока готовят разведения 1:100 в стерильном физиологическом растворе.
В чашку Петри с кровяным новокаиновым или ДНК-новокаиновым агаром (рец. 4, 5) вносят 0,1 см3 молока из разведения 1:100 и равномерно рассевают его стеклянным шпателем по всей поверхности питательной среды.
Засеянные чашки помещают в термостат крышками вниз и инкубируют при 37 +/- 1 °C в течение 22 - 24 ч. На ДНК-новокаиновом агаре золотистый стафилококк растет в виде крупных круглых колоний с ровными краями, на новокаиновом кровяном агаре - вокруг колонии выражена зона гемолиза. Чашки с ДНК-новокаиновым агаром заливают 1 N раствором соляной кислоты, затем просматривают в проходящем свете. Обнаружение колоний, окруженных зоной просветления с четкими границами, или зоной гемолиза (на кровяном агаре), указывает на наличие в исследуемом материале золотистого стафилококка.
Для определения количества золотистого стафилококка в 1 см3 исследуемого материала подсчитывают колонии с зонами просветления по всей поверхности среды и полученное число колоний умножают на 10 (объем посевного материала 0,1 см3) и на степень разведения материала.
Например: | высеяно 0,1 см3 молока из разведения 1:100. В результате подсчета получено 15 колоний. Следовательно, в 1 см3 молока - 15000 микробных клеток золотистого стафилококка (15x10x100). |
2.3.5.12. Оценка результатов
Стафилококки вида S. aureus, обладающие гемолитической активностью, плазмокоагулирующими свойствами или ДНК-азной активностью и разлагающие маннит в анаэробных условиях, относят к возбудителям мастита. В молоке коров, больных маститом, наиболее часто содержатся стафилококки видов S. aureus, S hemolyticus, S. epidermidis. Стафилококк вида S. saprophiticus является возбудителем мастита и может быть обнаружен в молоке как здоровых, так и больных коров вследствие его контаминации.
2.3.5.13. Фаготипирование стафилококка
В случае необходимости определения источника стафилококковой инфекции проводят фаготипирование культур стафилококков, выделенных из молока и секрета вымени коров, используя набор стафилококковых бактериофагов животного происхождения, выпускаемый Научно-исследовательским институтом эпидемиологии и микробиологии им. Н.Ф. Гамалеи. Фаготипированию подлежат культуры стафилококков, вызывающие гемолиз эритроцитов крупного рогатого скота и свертывание плазмы крови кролика.
Постановка реакции
Содержащиеся во флаконах лиофильно высушенные фаги в объеме 0,1 см3 ресуспендируют в 1 см3 МПБ (с 0,4% глюкозы и 0,2% хлористого кальция (CaCl2), получая основное разведение 10-1 (1:10). Из основного разведения фага готовят два рабочих разведения, соответствующие 1 тест-разведению (ТР) и 100 ТР. Разведение, соответствующее одному ТР, указано на этикетке.
Основное разведение фагов 10-1 хранят при температуре 4 °C и используют в течение 1,5 - 2 месяцев. Разведение фага, соответствующее 1 ТР, следует готовить заново через каждые 7 суток из основного разведения 10-1.
Методика фаготипирования
Суточную агаровую культуру испытуемого штамма стафилококка засевают в 2,5 см3 бульона Хоттингера, Мартена или мясо-пептонного бульона (pH 7,2 - 7,4) и выращивают 3 - 5 ч при 37 +/- 1 °C (до заметного помутнения среды). Одновременно готовят чашки с 1,2%-ным агаром Хоттингера, содержащего 200 мг % аминного азота; 0,45% глюкозы и 0,02% хлористого кальция. Хлористый кальций добавляют в среду, охлажденную до 45°, перед разливом в чашки (рец. N 9). В чашки Петри разливают по 15 см3 расплавленного агара и после застывания ее подсушивают 30 - 40 мин при 37 +/- 1 °C. Выросшую трехчасовую бульонную культуру стафилококка вносят пастеровской пипеткой в чашки и орошают поверхность агара. Избыток культуры отсасывают пастеровской пипеткой и удаляют, после чего агар вновь подсушивают 40 - 60 мин при 37 +/- 1 °C.
Дно засеянной чашки расчерчивают карандашом по стеклу на квадраты по трафарету соответственно числу используемых фагов. В каждый квадрат засеянной среды пастеровской пипеткой с тонко оттянутым концом или стандартной петлей наносят каплю соответствующего фага. Один квадрат оставляют для контроля без фага. После нанесения каждого фага петлю обжигают, пастеровскую пипетку утилизируют. После подсыхания капель фага чашки переворачивают дном кверху и инкубируют 5 - 6 ч при температуре 37 +/- 1 °C, а затем оставляют на 18 - 20 ч при комнатной температуре. Нанесение фагов на агар в чашки может быть проведено специальным аппаратом для фаготипирования стафилококков, который имеет 25 металлических стержней, вмонтированных в квадратную пластину, соединенную с поршнем. Основанием прибора служит площадка из органического стекла, на которой находится свободно передвигающаяся вторая площадка с гнездом для фиксирования засеваемой чашки и пластинки из фторопласта с резервуаром для фагов. В резервуары стерильной фторопластовой пластинки, помещенной в стерильную чашку Петри, наливают по 3 - 5 капель фагов (всегда в одном порядке). Чашку с агаром и пластинку с фагами помещают на подвижную пластинку. Поочередным передвижением площадки устанавливают под металлическими стержнями сначала пластинку с фагами, а затем чашку с агаром. Опуская и поднимая стержни с помощью поршня, переносят капли фагов на чашку с агаром, едва касаясь его поверхности. Чашки меняют в зависимости от числа типируемых культур. Чашки с фагами оставляют на столе на 30 - 40 мин и затем их орошают четырехчасовой бульонной культурой стафилококков. После подсыхания культур чашки переворачивают крышкой вниз, инкубируют 5 - 6 ч при 37 +/- 1 °C, а затем оставляют на 18 - 20 ч при комнатной температуре.
Для фаготипирования штаммов стафилококков вначале используют первое рабочее разведение, соответствующим 1 ТР. Культуры стафилококков, которые не лизировались хотя бы одним фагом, типируют повторно аналогичными фагами в разведении 100 ТР.
Учет и регистрация результатов
Степень лизиса культуры разными разведениями фага регистрируют по следующей схеме: (++++) - сливной полный лизис, (+++) - неполный сливной лизис (незначительный рост культуры в зоне лизиса), (++) - наличие в месте нанесения капли фага свыше 50 пятен лизиса (колоний фага), (+) - от 20 до 50 пятен лизиса, (+/-) - менее 20, (-) - полное отсутствие лизиса. Для упрощения схемы учета степени лизиса обозначения ++++, +++, ++ и называемые "сильной реакцией", можно регистрировать одним обозначением ++.
Одна и та же культура стафилококка чаще лизируется не одним, а несколькими фагами, что создает для каждого штамма характерную фагомозаику.
Штаммы считают типируемыми, если хотя бы один фаг вызвал реакцию с оценкой не менее ++. Если при типировании культуры фагом в разведении 1 ТР получена слабая реакция с оценкой + или +/-, то такой штамм типируют повторно фагом в разведении 100 ТР. Результаты фаготипирования культур регистрируют в виде таблицы, указывая название штамма стафилококка, номера и разведения фагов, с помощью которых был получен лизис культуры (1 ТР или 100 ТР).
Если культуры стафилококка лизируются одними и теми же фагами и составляют одну мозаику, их следует считать идентичными. В тех случаях, когда мозаика различается на 1,2 и более сильных реакций, следует исходить из следующего правила: если штаммы стафилококков при типировании в один и тот же день отличаются сильной реакцией по одному фагу, их следует считать идентичными, если разница составляет по двум и более фагам, штаммы следует признать разными.
Учет результатов проводится в соответствии с "Методическими указаниями по применению бактериофагов" (утв. Минздравом СССР 11.04.1976 г., согласовано с ГУВ МСХ СССР 16.09.1976 г.).
2.3.6. Выделение и идентификация стрептококков
2.3.6.1. Для выделения стрептококков из молока используют кровяной агар (рец. N 1) или одну из следующих элективных сред - среду Карташовой жидкую (рец. N 10), среду Карташовой плотную (рец. N 11), среду Эдвардса (рец. N 12).
На кровяном агаре стрептококки растут в виде мелких росинчатых или мелких непрозрачных колоний с небольшой зеленовато-бурой полупрозрачной зоной гемолиза или без гемолиза. В тонком слое 5 - 7%-ного кровяного агара зона гемолиза выражена более четко и может быть абсолютно прозрачной.
ИС МЕГАНОРМ: примечание. При публикации в официальном издании допущен типографский брак. Здесь и далее текст, не пропечатанный в официальном тексте документа, в электронной версии данного документа заменен символом "<...>". |
При росте стрептококков в жидкой среде Карташовой цвет среды за счет ферментации лактозы переходит из синего в зеленый. На дне и по стенкам пробирки образуется крошковидный осадок, бульон остается прозрачным или наблюдается слабое его помутнение. При использовании плотной среды на фоне синего агара вырастают мелкие прозрачные колонии <...>-формы, вокруг которых среда окрашивается в зеленый цвет.
На среде Эдвардса стрептококки растут в виде мелких (1 - 2 мм в диаметре) колоний бесцветные или серовато-синего цвета (рец. N 12).
2.3.6.2. В мазках из культур в жидких питательных средах стрептококки имеют вид цепочек различной длины, в мазках с плотных сред - стрептококки расположены попарно или в виде коротких цепочек.
Для дальнейшей дифференциации часть культуры пересевают на скошенный сывороточный агар.
2.3.6.3. Одним из характерных признаков стрептококков в отличие от стафилококков является отсутствие каталазной активности (каталазоотрицательные). Для определения каталазной активности выросшую на плотной среде культуру стрептококка снимают петлей и растирают в капле 10%-ной перекиси водорода (пергидроль разводят в соотношении 1:3) на предметном стекле. Выделение газа при растирании культуры стрептококков (в отличие от стафилококков) не происходит - реакция отрицательная.
2.3.6.4. Дифференциацию стрептококков проводят по тестам, указанным в таблице 2.
Таблица 2
Наименование <...> стрептококка | Серологич. группа | Гемолиз | КАМП-тест | Среда Карташовой | МПБ с 6,5% NaCl | МПБ с 40% желчи | Редуктаза X | Эскулин | Лактоза | Сорбит | Маннит | МПБ с Ph 9,<...> | v P | |
Str. pyogenes | A | - | + | - | + | - | - | - | - | + | - | - | - | - |
Str. agalactiae | B | +/- | +/- | + | + | - | +/- | - | - | + | - | - | - | + |
Str. disgalactiae | C | +/- | - | - | + | - | - | - | - | + | +/- | - | - | + |
Str. uberis | E | +/- | - | +/- | + | - | +/- | - | + | + | + | + | - | + |
Str. faecalis | Д | +/- | - | - | + | + | + | + | + | + | + | + | + | + |
Str. bovis | Д | +/- | - | - | + | +/- | + | + | +/- | + | - | + | + | |
Str. lactis | Н | +/- | - | - | - | - | - | + | + | +/- | - | +/- | - | + |
Str. cremoris | П | +/- | - | - | - | - | - | +/- | + | -/+ | - | + | - | + |
<...> - признак, постоянный для данного вида стрептококка
v P - Реакция Фогес-Проскауэра
X - редукция молока с метиленовым голубым 1:10000
В молоке коров больных маститом наиболее часто обнаруживают Str. agalactiae, Str. disgalactiae, Str. uberis. Стрептококки Str. lactis, Str. cremoris, Str. faecalis не являются возбудителями мастита и могут быть обнаружены в молоке как здоровых, так и больных коров вследствие его контаминации.
Для ускоренного обнаружения Str. agalactiae в первую очередь проводят постановку КАМП-теста, который положительный у данного вида стрептококка и может быть у Str. uberis.
2.3.6.5. Постановка КАМП-теста
Суточную агаровую или бульонную культуру гемолитического стафилококка засевают на кровяной агар с 7 - 8% дефибринированной или цитратной крови крупного рогатого скота (рец. N 1). Посев делают петлей в виде сплошной линии по диаметру чашки или круговой линии по периферии кровяного агара в чашке Петри. Перпендикулярно к линии диаметрального посева стафилококка или радиально к линии кругового посева, не доходя 5 - 6 мм, высевают ровными штрихами - полосками испытуемые культуры стрептококков.
На одной чашке можно проверять 8 - 10 и более культур. Посевы инкубируют 18 - 24 ч при температуре 37 +/- 1 °C. КАМП-тест считают положительным, если четко выражена прозрачная зона гемолиза в виде полукруга или усеченного треугольника, образованных при контакте зон гемолиза культуры стафилококка и испытуемых культур стрептококков.
Для целенаправленного выделения Str. agalactiae вместо подсеваемого  стафилококка в кровяной агар может быть добавлен коммерческий стафилококковый
стафилококка в кровяной агар может быть добавлен коммерческий стафилококковый  (3%). Пересев стрептококка проводят со среды Карташовой. При этом вокруг колонии агалактийного стрептококка при положительном КАМП-тесте образуется прозрачная зона гемолиза.
(3%). Пересев стрептококка проводят со среды Карташовой. При этом вокруг колонии агалактийного стрептококка при положительном КАМП-тесте образуется прозрачная зона гемолиза.
 стафилококка в кровяной агар может быть добавлен коммерческий стафилококковый
стафилококка в кровяной агар может быть добавлен коммерческий стафилококковый  (3%). Пересев стрептококка проводят со среды Карташовой. При этом вокруг колонии агалактийного стрептококка при положительном КАМП-тесте образуется прозрачная зона гемолиза.
(3%). Пересев стрептококка проводят со среды Карташовой. При этом вокруг колонии агалактийного стрептококка при положительном КАМП-тесте образуется прозрачная зона гемолиза.2.3.6.6. Для определения устойчивости к желчи культуру стрептококков выращивают в МПБ с 10% сывороткой или в МПБ с 1% глюкозы, затем 0,1 см3 культуры вносят в пробирки с 5 см3 МПБ, содержащего 40% желчи (рец. N 13), инкубируют при температуре 37 +/- 1 °C в течение 24 ч. Полное просветление бульона указывает на лизис культуры и отсутствие роста, помутнение - на рост.
2.3.6.7. Для определения редуцирующей способности культур стрептококков проводят посев культуры в пробирку с молоком, содержащим метиленовый голубой в концентрации 1:1000 (рец. N 14). Посевы инкубируют в течение 24 ч при температура 37 +/- 1 °C. Обесцвечивание метиленового голубого указывает на наличие редуктазы.
2.3.6.8. Терморезистентность стрептококков определяют путем прогрева бульонной культуры стрептококков при 60 °C в течение 30 мин. Пробирки с бульонной культурой ставят в водяную баню с указанным температурным режимом. После прогревания культуру высевают в МПБ и инкубируют в термостате 24 - 48 ч. Наличие роста указывает на терморезистентность культуры, что характерно для Str. faecalis. Кроме того проверяют способность роста в МПБ с pH 9,6, в МПБ с 6,5%-ным хлористым натром, а также ферментацию лактозы, сорбита и маннита. При использовании среды Карташовой, в состав которой входит лактоза, исключает необходимость постановки теста на ферментацию лактозы. Ферментативные свойства стрептококков изучают на средах Гисса (рец. NN 15, 16).
Ввиду возможности контаминации молока Str. faecalis, являющимся постоянным обитателем кишечника животных, используют посев на среду с теллуритом калия с концентрацией 0,07%. Str. faecalis устойчив к указанной концентрации теллурита калия и образует колонии черного цвета; Str. uberis от Str. agalactiae и Str. dysgalactiae, вызывающих инфекционный мастит коров, используют посев на кровяной или сывороточный агар, содержащий 0,1% эскулина.
Str. uberis растет на агаре с эскулином, Str. agalactiae и Str. dysgalactiae - не растет на этой среде.
При выделении гемолитических стрептококков, дающих отрицательный КАМП-тест, для дифференциации Str. pyogenes от указанных выше видов стрептококков применяют реакцию Фогес-Проскауэра (vP). Все виды стрептококков, выделяемых из молока, дают положительную реакцию vP, за исключением Str. pyogenes - группа A.
Для дифференциации Str. lactis и Str. cremoris, встречающихся в молоке здоровых, а также больных коров, в качестве дополнительного теста используют тест на образование аммиака при гидролизе аргинина. С этой целью производят посев на среду с аргинином (рец. N 30). Str. lactis гидролизует аргинин, Str. cremoris - не гидролизует.
При необходимости серологической идентификации выделенных штаммов стрептококков, последние направляют в научно-исследовательские учреждения или республиканскую ветеринарную лабораторию. Серологическую идентификацию штаммов проводят с применением групповых диагностических специфических сывороток в реакции агглютинации в соответствии с наставлением по их применению, утвержденным ГУВ Госагропрома СССР 30 июня 1987 г., или в реакции преципитации с полисахаридным антигеном, выделенным из культур (по методу Ландсфильд).
2.3.6.9. Оценка результатов
Оценку результатов исследования проводят в соответствии с данными таблицы 2. Срок лабораторного исследования - до 7 дней.
2.3.7. Выделение и идентификация энтеробактерий
2.3.7.1. Для выделения энтеробактерий из молока используют среду КОДА (рец. N 17), на которую высевают 0,1 - 0,2 см3 исследуемого молока. Посевы на среде КОДА инкубируют при 37 +/- 1 °C в течение 16 - 24 ч. Изменение цвета среды из фиолетового в зеленый свидетельствует о наличии в молоке энтеробактерий.
2.3.7.2. Для идентификации бактерий рода Echerichia проводят посев из пробирок с измененным (зеленым) цветом среды КОДА на среду Олькеницкого (рец. N 18). Для подтверждения ставят реакцию агглютинации.
Посев на среду Олькеницкого в пробирках проводят петлей на скошенную поверхность агара и внутрь столбика. Посевы инкубируют в термостате при 37 +/- 1 °C в течение 24 ч. Изменение цвета столбика (глюкоза +) и косяка (лактоза +) среды Олькеницкого из красного в желтый с образованием газа при отсутствии почернения внутри столбика свидетельствует о росте бактерий лактозоположительных энтеробактерий (Escherichia, Citrobacter, Enterobacter, Klebsiella).
В случае обнаружения роста культуры (осадок на дне пробирки) без изменения цвета среды КОДА или перехода цвета среды из фиолетового в сиреневый проводят посев культуры на плотные питательные среды (Эндо, Плоскирева) бактериологической петлей широкими штрихами для получения изолированных колоний.
2.3.7.3. Дифференциацию культур проводят в соответствии с тестами, предусмотренными таблицей N 3. Для этого проводят посев культур на среды Гисса (цветной ряд), цитратный агар Симонса (цитратный тест), (рец. N 19), среду Кларка (рец. N 20) для постановки реакции на кислотообразование с метил-ротом и реакции Фогес-Проскауэра, среду с мочевиной (рец. N 21), в бульон Хоттингера (рец. N 27), среду с сернокислым железом (для обнаружения сероводорода) (рец. N 25), желатин (рец. N 28). Для одновременного учета ферментации лактозы, глюкозы, мочевины и образования сероводорода можно пользоваться средой Олькеницкого.
Таблица 3
свойствам
N п/п | Тесты | Роды и виды бактерий | |||||||||||||
Escherichia coli | Citrobacter | Enterobacter | Klebsiella pneumonia | Salmonella | Proteus | Morganella morgani | Yersinia enterocolitica /22° - 25 C°/ | ||||||||
freundii | diversus | aerugenes | cloacae | vulgaris | mirabilis | myxsofaciens | |||||||||
Основные | |||||||||||||||
1. | Глюкоза | + | + | + | + | + | + | + | + | + | + | + | +(k) | ||
2. | Лактоза | + (-) | + (-) | + (-) | + (-) | + (-) | + | - | - | - | - | - | - | ||
3. | Сахароза | +/- | +/- | +/- | + | +/- | + | - | + | +/- | + | - | + | ||
4. | Маннит | + | + | + | + | + | + | + | - | - | - | - | + | ||
5. | Мальтоза | +/- | + | + | + | + | + | + | + | - | + | - | + | ||
6. | Рост на агаре Симонса | - | + | + | + | + | + | (+/-) | +/- | + | +/- | - | - | ||
7. | Образование индола | (+/-) | - | + | - | - | +/- | - | + | - | - | + | +/- | ||
8. | Образование сероводорода | - | + | - | - | - | - | (+/-) | + | + | - | - | - | ||
9. | Расщепление мочевины | - | +/- | + | - | + | + | - | + | + | + | + | + | ||
10. | Разжижение желатины | - | - | - | +/- | - (+) | - | - | + | + | + | - | - | ||
11. | Дезаминирование фенилаланина | - | - | - | - | - | - | - | + | + | + | + | - | ||
Дополнительные | |||||||||||||||
1. | Реакция с метилротом | + | + | + | - | - | +/- | + | + | + | + | + | + | ||
2. | Реакция Фогес-Проскауэра | - | - | - | + | + | +/- | - | - | +/- | + | - | + | ||
3. | Подвижность | +/- | (+/-) | (+/-) | + | + | - | (+/-) | + | + | + | (+/-) | + | ||
Обозначения: | + | - ферментация сахара (кг), образование индола, расщепление мочевины и т.д. | |||||||||||||
- | - отсутствие ферментации сахара, образования индола, расщепления мочевины и т.д. | ||||||||||||||
+/- | - различные показатели | ||||||||||||||
(-) | - отдельные штаммы не вызывают ферментации сахара, образования индола и т.д. | ||||||||||||||
(+) | - замедленное разжижение желатины | ||||||||||||||
2.3.7.4. Путем посева на среду Олькеницкого можно ориентировочно определить ряд ферментативных свойств бактерий. При ферментации лактозы скошенная часть среды становится желтой, при ферментации глюкозы - становится желтым столбик среды, почернение внутри столбика указывает на выделение сероводорода, окрашивание косяка и столбика в малиновый цвет - на гидролиз мочевины.
Указанные ниже виды энтеробактерий имеют четко выраженные изменения:
Escherichia coli | - столбик и косяк желтого цвета, почернения внутри столбика нет. |
Proteus vulgaris | - столбик и косяк малинового цвета, внутри столбика почернение. |
Citrobacter freundii | - столбик и косяк желтого цвета, внутри столбика почернение. |
2.3.7.5. Ферментацию углеводов на средах Гисса (рец. N 23, 24) учитывают по изменению цвета среды (появление розово-красного или малинового окрашивания) и образованию пузырьков газа в поплавке, или внутри столбика при использовании полужидких сред с индикатором ВР (рец. N 24).
2.3.7.6. Для постановки цитратного теста (определение способности бактерий ассимилировать соли лимонной кислоты) используют посев на среду Симонса (рец. N 19). Цитратный тест считают положительным при изменении цвета среды Симонса из оливкового в синий и наличии роста культуры.
2.3.7.7. Реакция с метил-ротом (интенсивность кислотообразования) - положительная, если при добавлении 3 - 5 капель 0,04% спиртового раствора метил-рота в среду Кларка (рец. N 20) с выращенной культурой среда окрашивается в розово-красный цвет. При отрицательной реакции цвет среды после добавления метил-рота остается желтым.
2.3.7.8. Реакция Фогес-Проскауэра на образование ацетилметилкарбинола. Исследуемую культуру засевают в среду Кларка (рец. N 20) и инкубируют при 37 +/- 1 °C в течение 48 ч, после чего переносят 1 см3 культуры в другую пробирку, добавляют 0,6 см3 5%-ного спиртового раствора  и тщательно перемешивают, затем добавляют 0,2 см3 40%-ного водного раствора KOH и вновь хорошо перемешивают. Пробирку просматривают через 3 - 5 минут. Положительный тест: окрашивание среды в интенсивный розовый или красный цвет.
и тщательно перемешивают, затем добавляют 0,2 см3 40%-ного водного раствора KOH и вновь хорошо перемешивают. Пробирку просматривают через 3 - 5 минут. Положительный тест: окрашивание среды в интенсивный розовый или красный цвет.
 и тщательно перемешивают, затем добавляют 0,2 см3 40%-ного водного раствора KOH и вновь хорошо перемешивают. Пробирку просматривают через 3 - 5 минут. Положительный тест: окрашивание среды в интенсивный розовый или красный цвет.
и тщательно перемешивают, затем добавляют 0,2 см3 40%-ного водного раствора KOH и вновь хорошо перемешивают. Пробирку просматривают через 3 - 5 минут. Положительный тест: окрашивание среды в интенсивный розовый или красный цвет.2.3.7.9. Для постановки теста на образование сероводорода используют посев на среды (рец. N 25), содержащие сернокислое железо.
Тест на сероводород-положительный, если при добавлении к бульонной культуре реактива Эрлиха (рец. N 22) или реактива Ковача (рец. N 25) верхний слой приобретает красно-малиновый цвет.
ИС МЕГАНОРМ: примечание. Нумерация пунктов дана в соответствии с официальным текстом документа. |
2.3.7.11. Если при посеве внутрь столбика желатины (рец. N 28) культура вызывает ее разжижение (по сравнению с контрольной незасеянной), считают, что тест на протеолитическую активность - положительный.
2.3.7.12. Тест на гидролиз мочевины - положительный, если цвет среды, содержащей мочевину (рец. N 21) при использовании в среде индикатора фенол-рот, из красного переходит в малиновый.
2.3.7.13. Образование фенилперувиновой кислоты определяют по тесту с фенилаланином путем посева культуры на скошенную поверхность агара, в состав которого входит фенилаланин (рец. N 29), среда не окрашена. На культуру, выросшую на скошенной поверхности агара, наливают 4 - 5 капель 10% раствора хлорида железа. В случае образования фенилпирувиновой кислоты появляется зеленый цвет.
2.3.7.14. В качестве дополнительных тестов используют тест на подвижность и тест на цитохромоксидазу (см. раздел 2.3.8.9).
Для определения подвижности проводят посев культуры в 0,3% полужидкий мясо-пептонный агар. Культуры, не обладающие подвижностью, растут по уколу. Периферическая часть среды остается прозрачной. Подвижные культуры дают диффузный рост, вызывая помутнение всего столбика агара (таблица 3).
2.3.8. Выделение и идентификация Pseudomonas aeruginosa
2.3.8.1. Для выделения P. aeruginosa из молока используют посев на кровяной агар или на одну из следующих элективных сред: ЦПХ-агар (рец. N 31), среду ГСМП (рец. N 32). Посевы молока инкубируют при 37 +/- 1 °C в течение 18 - 24 ч.
2.3.8.2. На различных плотных питательных средах суточные культуры P. aeruginosa имеют вид плоских круглых колоний, сливающихся между собой и образующих тонкий влажный налет на поверхности среды, который приобретает зеленую окраску. Встречаются слизистые колонии, в старых культурах могут быть обнаружены складчатые колонии. На элективных средах могут вырастать карликовые колонии.
На среде ГСМП P. aeruginosa растет в виде полупрозрачных округлых колоний серого цвета с перламутровым отливом, с более темным центром, ровными краями (встречаются колонии R-формы). Вокруг колоний образуется пигментированная зона от светло-зеленого до темно-зеленого цвета. На кровяном агаре вокруг колонии ярко выражена прозрачная зона гемолиза, колонии бурого цвета. При дифференциации от стафилококков, образующих гемолиз на кровяном агаре, следует учитывать, что колонии стафилококков, как правило, выпуклые, тогда как колонии P. aeruginosa плоские и имеют на кровяном агаре бурый цвет. Колонии эшерихий по морфологии сходны с P. aeruginosa, но не имеют пигмента.
2.3.8.3. Часть колоний пересевают в МПБ и на скошенный МПА, из оставшейся части готовят мазки и окрашивают их по Граму. Бактерии P. aeruginosa - мелкие прямые или слегка изогнутые грамотрицательные палочки, не образующие спор и капсул.
2.3.8.4. Все виды, входящие в род Pseudomonas как и представители Enterobacteriaceae, каталозоположительные. Дифференциальным признаком P. aeruginosa в отличие от других видов бактерий рода Pseudomonas является способность образования сине-зеленого пигмента - пиоцианина на элективных средах или при пересеве культур на МПА и в МПБ. С целью усиления пигментообразования используют пересев культуры на среду Кинга (рец. N 33).
Для определения пигмента пиоцианина к 24 ч бульонной культуре добавляют 2 см3 хлороформа, доводят pH до 7,8 - 8,0, после чего пробирку хорошо встряхивают. Синее окрашивание, опустившегося на дно пробирки хлороформа, свидетельствует о наличии пиоцианина.
2.3.8.5. При исследовании молока могут быть выделены P. aeruginosa и P. fluorescens. Наличие в исследуемой пробе P. fluorescens свидетельствует о погрешности асептического взятия пробы или контаминации молока при использовании недоброкачественной воды для обработки вымени. P. fluorescens образует флюоресцирующие пигменты флюоресцеин - темно-желтого или пурпурно-желтого цвета (в зависимости от состава или pH среды).
2.3.8.6. В сомнительных случаях для определения принадлежности выделенной культуры к роду Pseudomonas используют тест на обнаружение цитохромоксидазы, аргининдегидролазы, ферментацию глюкозы в анаэробных условиях. Тест на цитохромоксидазу и аргининдегидролазу ставят с помощью СИБ (система индикаторных бумажек) или других тест-систем, используемых для дифференциации бактерий (см. приложение).
2.3.8.7. Ферментация глюкозы в анаэробных условиях
Посев культуры проводят в пробирки со средой Гисса с глюкозой, в которые предварительно наслаивают 1 см3 стерильного вазелинового масла. В качестве контроля посев проводят на среду Гисса с глюкозой без масла. Pseudomonas в анаэробных условиях глюкозу не ферментируют.
2.3.8.8. Цитохромоксидазный тест
Культуру, выращенную на МПА в течение 24 часов, наносят бактериологической петлей в виде штриха на полоску индикаторной бумаги, пропитанную специальным составом (см. п. 2.3.8.9). При положительной реакции на месте нанесенной культуры через 1 - 2 мин. появляется синяя окраска.
Фильтровальную бумагу пропитывают смесью следующего состава: 3 части 1%-ного  , разведенного в 96° спирте, и 2 части свежеприготовленного 1%-ного водного раствора оксалита диметил-пара-фенилен-диамина (фото-проявитель Т-32).
, разведенного в 96° спирте, и 2 части свежеприготовленного 1%-ного водного раствора оксалита диметил-пара-фенилен-диамина (фото-проявитель Т-32).
 , разведенного в 96° спирте, и 2 части свежеприготовленного 1%-ного водного раствора оксалита диметил-пара-фенилен-диамина (фото-проявитель Т-32).
, разведенного в 96° спирте, и 2 части свежеприготовленного 1%-ного водного раствора оксалита диметил-пара-фенилен-диамина (фото-проявитель Т-32).Фильтровальную бумагу высушивают на воздухе, нарезают на полоски и хранят в герметически закрытом флаконе из темного стекла или флакон из светлого стекла заворачивают черной бумагой.
2.3.8.10. Определение активности дегидролазы аргинина
В пробирке с 0,3 см3 стерильного 0,85% раствора натрия хлорида в фосфатном буфере pH 5,5 +/- 0,1 суспендируют петлю суточной агаровой культуры, затем в эту взвесь погружают индикаторный диск с аргинином, заливают стерильным вазелиновым маслом 0,2 см3 и инкубируют в термостате при 37 +/- 1 °C. В качестве контроля используют диски с аргинином, погруженные в пробирки со стерильным 0,85% раствором натрия хлорида в фосфатном буфере, залитые стерильным вазелиновым маслом (0,2 +/- 0,05 см3).
В случае ферментации аминокислоты бумажный диск приобретает фиолетовый цвет, в отрицательном случае - желтый.
Используют "Системы индикаторные бумажные для идентификации микроорганизмов семейства Enterobacteriaceae", изготовленные Горьковским НИИ эпидемиологии и микробиологии (603000, г. Н. Новгород, ул. Грузинская, 44).
Для определения дегидролаз лизина и орнитина применяют диски с соответствующей аминокислотой или проводят посев на среду, содержащую ту или другую аминокислоту (рец. N 30).
2.3.9. Выделение и идентификация коринебактерий
2.3.9.1. Коринебактерии чаще приходится выделять при хроническом мастите с признаками уплотнений в паренхиме вымени, а также наличия гнойно-некротических очагов на коже вымени и поражения соскового канала.
2.3.9.2. Для выделения коринебактерий проводят посев исследуемого молока или секрета вымени коров на кровяной агар (рец. N 1) или среды с 0,1% теллуритом калия (рец. N 41, 42).
Молоко (секрет вымени) вносят пипеткой в количестве 2 - 3 капель на поверхность среды в чашку и тщательно растирают его шпателем. Для получения изолированных колоний бактерий рекомендуется молоко предварительно развести стерильным физиологическим раствором.
2.3.9.3. Отличительной особенностью культур коринебактерий является сильно выраженный полиморфизм.
Коринебактерии имеют различную форму колоний. На кровяном агаре они растут в виде колоний разных размеров бурого цвета с шероховатой поверхностью и неровными краями или образуют блестящие круглые колонии, врастающие в агар. Вокруг колоний образуется незначительная зона гемолиза. На средах, содержащих теллурит калия, колонии коринебактерий имеют темно-серый или черный цвет.
Коринебактерии образуют при росте на плотных средах гладкие, шероховатые и промежуточные формы колоний; при росте на МПБ может образовываться пленка.
Из изолированных колоний готовят мазки, окрашивают по Граму или метиленовой синькой Леффлера и микроскопируют.
2.3.9.4. Коринебактерии грамположительные, в мазках наряду с длинными слегка изогнутыми палочками, встречаются толстые, короткие палочки, расположенные парно, часто под углом друг к другу, что объясняется своеобразным типом деления клеток (путем излома). Иногда они могут располагаться скоплениями в виде пучков или тесно переплетенных между собой надломанных палочек. Характерным признаком коринебактерий является наличие утолщений или вздутий на концах палочек, придающих им булавовидную или клиновидную форму с утолщением на одном конце.
Ввиду наличия в цитоплазме клеток коринебактерий метахроматических гранул они имеют неравномерную окраску, что хорошо выявляется при окрашивании мазков метиленовой синькой по Леффлеру.
В отличие от других морфологически сходных грамположительных микроорганизмов коринебактерии не образуют спор, неподвижны.
2.3.9.5. Для дифференциации коринебактерий от стрептококков и других кокковых форм проводят пересевы в МПБ. Кокковидные формы коринебактерий в МПБ приобретают форму вытянутых палочек и часто образуют пленку, тогда как стрептококки сохраняют кокковую форму. Стрептококки, имеющие вид вытянутых диплококков, дают придонный рост и не образуют пленку.
В молоке коров, больных маститом, могут встречаться штаммы коринебактерий, не обладающие нитратредуцирующей способностью, не разжижающие желатин; не сбраживающие сахарозу и маннит, не вызывающие гидролиз крахмала.
Наиболее частыми возбудителями мастита являются виды C. renaie (сбраживающие глюкозы) и C. bovis (не сбраживающие глюкозы), при гнойном мастите чаще выделяют C. pyogenes bovis которые являются каталазоотрицательными и образуют растворимый гемолизин. Другие виды коринебактерий различаются между собой по ферментации мальтозы, трегалозы, глицерина, цистина, мочевины.
Кроме указанных видов коринебактерий на кровяном агаре и средах с теллуритом калия могут встречаться колонии Actinomyces pyogenes сходные по культурально-морфологическим и биохимическим признакам с C. bovis и C renale. В отличие от C. bovis и C. renale Actinomyces pyogenes обладает выраженной гемолитической активностью, у которых зона гемолиза вокруг колоний в 2 - 3 раза превышает их диаметр; они вызывают разжижение желатины и свернутой сыворотки. Actinomyces pyogenes растет в виде пленки на поверхности агара, что может наблюдаться также у C. bovis, C. renale, которые растут в виде слабобугристых, сухих колоний с неравномерно очерченными краями.
2.3.10. Выделение и идентификация микоплазм
2.3.10.1. Исследование молока (секрета вымени) коров на мастит, вызываемый микроорганизмами семейства Mycoplasmataceae, проводят при массовых заболеваниях коров-первотелок, а также в случае, когда заболевание коров не поддается лечению препаратами пенициллинового ряда и сульфаниламидными препаратами, несмотря на то, что выделенная ранее из молока этих же животных микрофлора чувствительна к указанным препаратам. Необходимость такого исследования основывается на устойчивости микоплазм к этим препаратам.
2.3.10.2. Для выделения микоплазм используют жидкие и плотные питательные среды с ингибиторами (рец. NN 34, 35).
В пробирки, содержащие 4 см3 жидкой питательной среды, стерильной пастеровской пипеткой или стеклянной палочкой вносят 1 - 2 капли молока или секрета вымени. Для посева на плотную питательную среду, разлитую в чашки Петри, молоко предварительно разводят жидкой питательной средой с ингибиторами или физиологическим раствором в соотношении 1:100. На одну чашку Петри с агаром засевают 4 пробы молока. Засеянные пробирки с жидкой питательной средой инкубируют не менее 5 сут при температуре 37 +/- 1 °C, ежедневно просматривая посевы.
2.3.10.3. Рост возбудителя в жидких питательных средах характеризуется опалесценцией, незначительным помутнением без образования пленки или осадка или изменением цвета среды с индикатором (феноловый красный) в оранжевый или соломенно-желтый цвет. По окончании инкубации 1 - 2 капли культуры переносят на плотную питательную среду без ингибиторов для получения культуры и ее последующей идентификации.
2.3.10.4. Чашки Петри с посевами как в первом, так и во втором случаях инкубируют в течение 5 сут при 37 +/- 1 °C во влажной камере. Для этого их помещают в эксикатор или полиэтиленовый пакет с увлажненной ватой. На агаре возбудитель формирует мелкие росинчатые колонии, которые просматривают под микроскопом при увеличении 80 - 100 раз. Колонии микоплазм имеют типичную форму "яичницы-глазуньи" с плотным, врастающим в агар центром и более светлой периферической зоной; нетипичные колонии - шероховатые, грануловидные.
При микроскопии культур необходимо различать следующие псевдоколонии: кристаллы солей, кусочки тканей, молочные клетки, капельки жира и другие артефакты. Псевдоколонии после проведения пересевов в жидкие питательные среды и повторном высеве на плотные среды не воспроизводятся.
2.3.10.5. Для приготовления мазков используют бульонную культуру, которую центрифугируют при 10 тыс. об/мин в течение 30 мин, надосадочную жидкость удаляют, из осадка делают мазки, которые окрашивают по Романовскому-Гимза и микроскопируют.
В мазках из культур возбудитель имеет вид полиморфных (округлых, овальных, дисковидных) сине-фиолетового цвета.
При обнаружении на агаре видимого роста, типичного для микоплазм, колонии вырезают стерильным скальпелем вместе с кусочком агара и переносят в жидкую питательную среду без ингибиторов. Посевы инкубируют в течение трех суток и затем проводят не менее трех - пяти последовательных пересевов с тем же интервалом на аналогичных средах.
2.3.10.6. Культуры микоплазм имеют много общих признаков с <...>-формами различных видов бактерий, в связи с чем выделенные культуры необходимо дифференцировать от последних. В отличие от микоплазм L-формы бактерий обладают способностью при пересеве на сывороточные питательные среды реверсировать в исходную форму. Если через три - пять пассажей культура не реверсирует в типичную для них форму, ее относят к микоплазмам.
2.3.10.7. При необходимости дальнейшей дифференциации микоплазм (микоплазм, ахолеплазм и уреаплазм) проводят исследования в соответствии с "Методическими рекомендациями по выделению и идентификации микоплазм из молока коров", одобренные 10 апреля 1984 г. ВАСХНИЛ.
2.3.11. Выделение и идентификация нокардий
2.3.11.1. Исследование молока (секрета вымени) коров на наличие Nocardia asteroides - возбудителя мастита проводят в случае поражения вымени, сопровождающегося увеличением лимфатических узлов вымени и возникновением плотных безболезненных узлов под кожей или в паренхиме, а также в случае образования абсцессов и выделения из секрета пораженной четверти вымени хлопьев или гноя, окрашенного в желтый, серовато-желтый или красно-коричневый цвет. Для выделения нокардий используют посев молока на кровяной агар без добавления или с добавлением 7,5% хлорида натрия (рец. N 1). Посевы инкубируют при 37 +/- 1 °C. Осмотр чашек проводят через 48 ч и далее ежедневно в течение 5 сут после посева материала.
2.3.11.2. На кровяном агаре Nocardia asteroides растет в виде бугорков или возвышающихся плоских серовато-белых колоний, слегка вдавленных в среду, диаметром 0,5 - 1,5 мм.
Могут встречаться колонии, образующие пигмент за счет которого они окрашиваются от оранжевого до красновато-коричневого цвета. При росте на кровяном агаре пигментообразование у колоний выражено слабо. Более интенсивно оно проявляется при росте нокардий на глюкозо-дрожжевом агаре (рец. N 36). Консистенция колоний от влажной (рыхлой) до сухой (пескообразной). Вдоль краев колоний и на поверхности образуется тонкий воздушный мицелий в виде пушистого налета. Для микроскопии культур готовят мазок из части колоний, которую эмульгируют в капле спирт-глицериновой смеси на предметном стекле, накрывают ее покровным стеклом и просматривают под микроскопом. В препарате из культуры виден тонкий разветвленный мицелий, распадающийся на палочки и кокки, мицелий хорошо окрашивается по Граму или фуксином 1:5.
N. asteroides - грамположительные, в мазках из культуры - ветвящиеся, нитевидные клетки длиной до 30 мкм и диаметром 0,4 - 0,7 мкм.
2.3.11.3. Нокардии растут в МПБ в виде зерен, образуя на поверхности бульона серо-белую пленку, на дне - зернистый осадок, сам бульон остается прозрачным.
В желатине при посеве уколом рост отмечается только на поверхности, при этом желатин не разжижается.
N. asteroides ферментируют с образованием кислоты глюкозу, адонит, эскулин, мочевину, не вызывают свертывания молока, разжижения желатина. При наличии в среде 7,5% хлористого натра рост N. asteroides не ингибируется.
Нокардии так же, как возбудители туберкулеза, могут расти на среде Петраньяни, образуя оранжево-желтые колонии. На среде Эндо не растут.
2.3.11.4. При необходимости (несоответствие биохимических свойств N. asteroides) определяют патогенность нокардий путем перитониального заражения двух морских свинок или двух кроликов бульонной культурой в дозе 1 см3. Нокардии патогенны для кроликов и морских свинок при интраперитониальном заражении и непатогенны при подкожном заражении. Гибель животных наступает через 7 - 10 дней. Если зараженные кролики не гибнут через указанный срок, их убивают и при обнаружении грануломатозных поражений в легких, почках, селезенке культуру относят к слабовирулентному штамму. Заключение о мастите нокардиозной этиологии делают с учетом характерных клинических признаков и выделении нокардий вида N. asteroides или нокардий, патогенных для морских свинок или кроликов.
2.3.12. Выделение и идентификация грибов рода Candida
2.3.12.1. Для выделения из молока (секрета вымени) грибов рода Candida используют питательные среды в соответствии с ГОСТ 26888-85 (рец. NN 37, 38, 39), а также элективную дифференциальную диагностическую среду (рец. N 40). Посевы молока (секрета вымени) делают на две чашки Петри в количестве 0,1 - 0,3 см3. Высеянный материал равномерно растирают стерильным шпателем по всей поверхности среды круговыми движениями. Засеянные чашки помещают в термостат вверх дном при температуре 37 +/- 1 °C на 18 - 20 ч.
2.3.12.2. После инкубирования чашек Петри просматривают выросшие культуры и проводят их микологическое исследование. Окрашенные по Граму или другим методом препараты микроскопируют с целью изучения морфологии грибов и проверки чистоты культуры, затем пересевают из колонии в пробирку с той же самой средой для получения чистой культуры и выявления псевдомицелия. Чашки Петри с выросшими культурами оставляют затем при комнатной температуре на 20 - 24 ч. Засеянные пробирки выдерживают при 37 +/- 1 °C в течение 24 ч, после чего оставляют их на двое суток при комнатной температуре (18 - 22°). После этого выросшие колонии микроскопируют. Первичный учет результатов проводят через 20 ч инкубирования материалов, а окончательный - на 4-й день исследования.
2.3.12.3. Дрожжеподобные грибы рода Candida (вид C. tropicalis) имеют одноклеточное строение, размножаются почками (бластоспорами). Для Candida характерно образование псевдомицелия, отличающееся от истинного мицелия отсутствием перегородок, сумки с аскоспорами не развиваются. Данный признак является дифференцирующим для грибов рода Candida.
Колонии грибов рода Candida гладкие, морщинистые, плоские, беловато-серого, беловато-кремового или кремового цвета, сметанообразной консистенции, врастающие в питательный субстрат.
2.3.12.4. Для идентификации грибов рода Candida достаточно определения псевдомицелия. Псевдомицелий образует бластоспоры. Псевдомицелий на элективной дифференциальной - диагностической среде определяют путем микроскопии окрашенных препаратов.
Срок лабораторного исследования - 4 дня.
2.3.13. Определение чувствительности выделяемых микроорганизмов к антибиотикам.
2.3.13.1. Для определения чувствительности микроорганизмов к антибиотикам должны быть использованы питательные среды, не содержащие ингибиторов, применяемые для культивирования определенного вида микроорганизмов.
В их числе: МПА или агар Хоттингера (для стафилококков, бактерий группы кишечной палочки, псевдомонад), сывороточный МПА (для стрептококков, коринебактерий).
Среду разливают по 20 см3 в стерильные чашки Петри, расположенные на горизонтальной поверхности, и после застывания ее подсушивают в термостате.
2.3.13.2. Выделенные культуры выращивают на одной из указанных сред, смывают стерильным физиологическим раствором и готовят бактериальную взвесь в концентрации 1 млрд микробных тел в 1 см3, что соответствует 10 ед мутности оптического стандарта.
2.3.13.3. На поверхность среды наливают 1 см3 взвеси культуры, орошив ею всю поверхность. Наклонив чашку, излишки культуры отсасывают пастеровской пипеткой. Чашку с посевами подсушивают при комнатной температуре в течение 40 мин, после чего на поверхность засеянной среды накладывают диски с антибиотиками. Диски раскладывают стерильным пинцетом на расстоянии 2 см от края чашки и слегка прижимают к агару. Одна чашка с агаром может служить для испытания 5 - 6 видов антибиотиков.
2.3.13.4. Для лучшей диффузии антибиотика в агар чашки с засеянной культурой и разложенными дисками выдерживают в течение 2 ч при комнатной температуре, затем помещают в термостат при 37 °C вверх дном.
2.3.13.5. Результаты учитывают через 16 - 18 ч, для чего линейкой определяют диаметр зоны задержки роста микробов вокруг бумажных дисков, включая размер дисков.
Отсутствие зоны задержки роста микробов вокруг диска указывает на то, что испытуемая культура не чувствительна к данному виду антибиотика.
На основании полученных результатов составляют антибиотикограмму.
2.3.13.6. Для лечения коров рекомендуется тот антибиотик, к которому чувствительны выделенные культуры возбудителей мастита. При подборе нескольких видов антибиотиков учитывают их совместимость, а также совместимость с другими лечебными препаратами.
Кровяной агар цитратный
Для приготовления кровяного агара у здоровой коровы из яремной вены берут 250 см3 крови в стерильную колбу, в которую предварительно вносят 50 см3 стерильно приготовленного 5% раствора лимонно-кислого натрия. По мере взятия кровь в колбе смешивают с лимонно-кислым натрием путем встряхивания. Полученную цитратную кровь проверяют на стерильность путем посева в МПБ и только после этого используют для приготовления кровяного агара. Цитратная кровь при необходимости может сохраняться в условиях холодильника в течение 10 - 14 суток. 100 см3 стерильного мясо-пептонного агара расплавляют в колбе на водяной бане, затем охлаждают до 42 - 45 °C и стерильной пипеткой вносят в него 7 - 8 см3 цитратной крови, равномерно смешивая, после чего разливают в чашки Петри по 10 - 12 см3. Чашки с застывшим агаром помещают в термостат при температуре 37 +/- 1 °C на 2 - 4 ч для подсушивания и проверки на стерильность.
Для приготовления кровяного агара может быть использована также дефибринированная кровь барана.
Кровяной агар с хлористым натрием
К 100 см3 расплавленного и остуженного 6,5%-ного солевого агара добавляют 8 - 10 см3 дефибринированной крови барана (можно использовать цитратную кровь крупного рогатого скота). Тщательно перемешивают, разливают в чашки Петри. Чашки с застывшим агаром помещают в термостат и подсушивают 1 - 1,5 ч.
Молочно-солевой агар
К 100 см3 расплавленного и остуженного 6,5%-ного солевого агара добавляют 10 см3 стерильного молока. Тщательно размешивают, разливают в чашки Петри. Чашки с застывшим агаром помещают в термостат и подсушивают 1 - 1,5 ч.
Кровяной агар с новокаином
К 100 см3 расплавленного и остуженного 2% новокаинового агара добавляют 8 - 10 см3 дефибринированной крови барана (можно использовать цитратную кровь крупного рогатого скота). Тщательно перемешивают, разливают в чашки Петри. Чашки с застывшим агаром помещают в термостат и подсушивают 1 - 1,5 ч.
ДНК-новокаиновый агар
К 150 см3 расплавленного стерильного 2% МПА (pH 8,6) добавляют 150 мг ДНК, предварительно растворенной в 10 см3 (подщелоченной 2 каплями 10% раствора едкого натра) дистиллированной воды, и 3 г (2%) новокаина. После перемешивания среду прогревают в течение 30 мин в кипящей водяной бане.
К остывшей до 45 +/- 2 °C среде добавляют 7 - 8 см3 (5%) сыворотки крови крупного рогатого скота и 1,2 см3 10%-ного стерильного раствора хлористого кальция, перемешивают и разливают в чашки Петри. Среду в чашках подсушивают 50 - 60 мин в термостате при температуре 37 +/- 1 °C.
Среда Гисса с маннитом для определения
ферментных свойств стафилококков
На 1 дм3 дистиллированной воды берут: МПА - 15 г, пептон - 10 г, хлористый натрий - 75 г, маннит - 10 г, фенол-рот - 0,025 г, pH - 7,4. Для создания анаэробных условий на готовую среду, разлитую в пробирки, наслаивают 1 см3 стерильного вазелинового масла.
Среда для определения фосфатазной активности стафилококков
МПА - 100 см3
10%-ный раствор фенолфталеинофосфата натрия - 1 см3
100 см3 стерильного мясо-пептонного агара расплавляют в колбе, затем охлаждают до 42 - 45 °C и стерильной пипеткой вносят раствор фенолфталеинофосфата, равномерно смешивают и разливают в чашки Петри по 12 - 15 см3. Чашки с застывшим агаром помещают в термостат и подсушивают 1 - 1,5 ч.
РЕЦЕПТ 8
Агар для определения ДНК-азной активности стафилококков
К 150 см3 расплавленного 2% МПА (pH 8,6) добавляют 150 мг натриевой соли дезоксирибонуклеиновой кислоты (ДНК), растворенной в 10 см3 дистиллированной воды с 2 каплями 10% едкого натра. Среду прогревают на водяной бане 30 мин и затем охлаждают до 50 - 60°, добавляют 1,2 см3 10%-ного стерильного раствора хлористого кальция и 7 - 8 см3 (5%) сыворотки крови крупного рогатого скота. Среду разливают в чашки Петри по 12 - 15 см3. Чашки с застывшим агаром помещают в термостат и подсушивают 1 - 1,5 ч.
Среда для стафилококкового фага
Для приготовления 1 дм3 среды требуется агар-агара 12 г, гидролизата Хоттингера - 200 см3, свежей мясной воды - 400 см3, водопроводной воды - 400 см3, глюкозы - 4 г, хлористого кальция 0,2 г (последний добавляют непосредственно к готовой расплавленной среде перед разливом ее в чашки Петри - 2 см3 10% стерильного раствора).
Среда Карташовой для выделения стрептококков (жидкая)
К 500 см3 МПБ добавляют 2,5 г лактозы, 1 см3 спиртового раствора 1:100 бромкрезолпурпура (после растворения 1 г порошка в 50 см3 спирта добавляют 50 см3 дистиллированной воды). Колбу со средой ставят в холодную водяную баню, доводят до кипения и кипятят 5 - 7 мин. Охлаждают среду до 50 - 55 °C и добавляют 50 см3 стерильной сыворотки и неомицин из расчета 50 ЕД на 1 см3 среды. Среду разливают в стерильные пробирки по 5 см3.
Среда Карташовой для выделения стрептококков (плотная)
К 500 см3 расплавленного стерильного МПА добавляют 2,5 г лактозы, 1 см3 спиртового раствора 1:10 бромкрезолпурпура (после растворения 1 г порошка в 50 см3 спирта добавляют 50 см3 дистиллированной воды). Колбу со средой ставят в холодную водяную баню, доводят до кипения и кипятят 5 - 7 мин. Охлаждают среду до 50 - 55 °C и добавляют 50 см3 сыворотки и неомицин из расчета 50 ед на 1 см3 среды. Среду разливают в стерильные пробирки по 5 см3.
Среда Эдвардса для выделения стрептококков
1. Приготовить раствор А, для этого 6,66 г ацетата таллия растворить в 50 см3 воды.
2. Приготовить раствор Б, для этого 0,026 г кристаллвиолета растворить в 50 см3 воды.
3. Раствор А смешать с раствором Б.
К 500 см3 расплавленного и охлажденного до 45 +/- 2 °C МПА добавляют вначале 37,5 см3 дефибринированной крови, а затем 2,5 см3 смеси растворов А + Б.
Мясо-пептонный бульон с желчью
К 60 см3 стерильного МПБ pH 7,4 добавляют асептически 40 см3 стерильной бычьей желчи, перемешивают, разливают в пробирки и стерилизуют при 0,5 атм. 20 мин.
Молоко с метиленовым голубым
0,2 г метиленового голубого растворяют в 20 см3 горячей дистиллированной воды, раствор пропускают через бумажный фильтр и стерилизуют при 112 °C 20 мин. К стерильному обезжиренному молоку добавляют 1% приготовленного раствора.
Среда Гисса в полужидком агаре для определения
ферментативных свойств стафилококков
К полужидкой пептонной среде (1% пептона, 0,5% хлорида натрия; 0,15% агар-агара) с pH 7,4 после ее расплавления добавляют 0,5% маннита и 1% индикатора Андреде, перемешивают, разливают в пробирки по 8 - 10 см3. Стерилизуют при 112 °C 30 мин, после чего наслаивают стерильное вазелиновое масло высотой 0,5 - 0,6 см.
Среда Гисса для определения ферментативных свойств
стрептококков
К дистиллированной воде добавляют 1% пептона, 0,5% хлорида натрия, 1% индикатора Андреде. Колбу с компонентами нагревают до 80 °C, устанавливают pH 7,2. Затем среду кипятят 5 мин, добавляют 0,5 - 1% одного из углеводов, разливают по пробиркам с поплавками по 4 - 5 см3. Стерилизуют 3 дня текучим паром при 112 °C 15 мин. Перед посевом культур к готовой среде добавляют 1,5 - 2 см3 сыворотки (1 часть сыворотки на 2 - 3 части среды).
Питательная среда для выделения энтеробактерий (КОДА)
Пептон | - 15,0 г |
Натрия хлорид | - 5,0 г |
Натрия карбонат | - 1,0 г |
Лактоза | - 10,0 г |
Сульфанол | - 12,0 г |
Бромкрезоловый пурпурный | - 0,03 г |
Метиленовый синий | - 0,003 г |
Дистиллированная вода | - 1 дм3 |
Среда выпускается в виде сухого порошка Дагестанским НИИ по производству питательных сред Мин. здрав. Российской Федерации.
Среда Олькеницкого
К 100 см3 стерильного питательного агара добавляют 1 г лактозы, 0,2 г соли Мора (аммоний железо сульфат - (NH4)·SO4 FeSO4 6H2O), 0,03 г гипосульфита (тиосульфат натрия - Na2SO3 5H2O), 1 г сахарозы, 0,1 г глюкозы, 1 г мочевины и 0,4 см3 0,4% раствора фенолового красного. Предварительно растворяют соль Мора с гипосульфитом в одной пробирке с небольшим количеством воды, а в другой - мочевину с углеводами.
После растворения все смешивают с агаром и фильтруют через марлю. Стерилизуют текучим паром 3 дня подряд по 20 мин или при 0,5 атм в течение 15 мин. Горячую среду разливают по 5 - 6 см3, скашивают, оставляя столбик высотой 2 - 2,5 см.
Цитратный агар Симонса
<...>й для приготовления цитратного агара Симонса служит жидкая среда Козера следующего состава:
натрий-аммоний фосфорнокислый - 1,5 г
NaNH4H9O4·4H2O
калий фосфорнокислый однозамещенный - 1 г
KH2PO4
магний сернокислый - 0,2 г
MgSO4·7H2O
натрий лимоннокислый - 3 г
Na3C6H2O7·5H2O
Для приготовления агара Симонса к 1 дм3 среды Козера добавляют 20 г агар-агара, устанавливают pH 7,2, после чего вносят 10 см3 1,5%-ного спиртового раствора индикатора - бромтимолблау, приготовленного из расчета: бромтимолблау - 1 г; 0,1% раствор NaOH - 25 см3, дистиллированная вода - 475 см3.
Среду нагревают до полного расплавления агара, фильтруют через ватно-марлевый фильтр, затем разливают в пробирки по 5 см3 и стерилизуют при 121 °C в течение 15 мин. Готовая среда имеет зеленовато-оливковый цвет. Перед употреблением среду скашивают.
Бактерии, способные усваивать цитрат-аммонийные соли, дают рост на агаре Симонса с изменением его в синий цвет - положительная реакция.
Среда Кларка
Пептон - 5 г
Калий фосфорнокислый двузамещенный - 5 г
Вода дистиллированная - 1000 см3
Ингредиенты растворяют в воде, кипятят 2 - 8 мин, фильтруют через бумажный фильтр, устанавливают pH 6,9 - 7,0, разливают в пробирки по 5 см3. Стерилизуют при 112 +/- 1 °C 20 мин или 3 дня текучим паром по 20 мин.
Среда с мочевиной (Блэк-Кристенсена)
Пептон - 1 г
Натрий хлорид (NaCl) - 5 г
Калий фосфорнокислый однозамещенный (KH2PO4) - 2 г
Глюкоза - 1 г
Фенолрот (0,2%-ный водный раствор) - 6 см3
Дистиллированная вода - 900 см3
Смесь нагревают до кипения, устанавливают pH 7,0, фильтруют среду через бумажный фильтр, затем автоклавируют при 0,5 атм 15 мин. К стерильной среде добавляют 100 см3 20%-ного раствора мочевины, предварительно профильтрованного через фильтр Зейтца. Готовую среду с мочевиной разливают стерильной пипеткой в стерильные пробирки по 3 - 4 см3, которые ставят на 1 - 2 суток в термостат для контроля на стерильность. При расщеплении мочевины среда приобретает малиновый цвет.
Реактив Эрлиха
Пара-диметиламинобензальдегид - 1 г
Спирт этиловый 96° - 95 см3
Соляная кислота концентрированная - 20 см3
Альдегид растворяют в спирте, затем добавляют кислоту. Реактив хранят в темном флаконе с притертой пробкой.
Среда Гисса с углеводами для определения ферментативных
свойств энтеробактерий
К 100 см3 дистиллированной воды прибавляют 1 г пептона, 0,5 г хлорида натрия, растворяют при нагревании воды в течение нескольких минут, фильтруют через бумажный фильтр, устанавливают pH 7,0 - 7,4, прибавляют 0,5 г одного из необходимых углеводов (лактоза, сахароза, глюкоза и т.д.), а затем индикатор Андреде в количестве 1 см3 на 100 см3 среды.
Готовую среду разливают по 5 см3 в пробирки с поплавками, расположенными запаянными концами кверху. Среду стерилизуют текучим паром 3 дня подряд по 30 мин или при 0,5 атм (112 °C) в течение 15 мин. Среды Гисса с индикатором Андреде имеют соломенно-желтый цвет. В результате расщепления углеводов среда приобретает розово-красный цвет. Образование газа определяют по наличию пузырьков в поплавке.
Среда Гисса в полужидком агаре
При изготовлении полужидких сред Гисса добавляют также 1% углеводов и 0,4% агар-агара. При наличии газа наблюдаются пузырьки и разрывы в толще агара. См. рецепт 23.
Среда с сернокислым железом для обнаружения сероводорода
К 1 дм3 стерильного 2%-ного МПА добавляют сернокислое железо (FeSO4) - 0,2 г, гипосульфит натрия (Na2S2O5) - 0,3 г, лактозу - 1 г, 12 см3 0,2% водного раствора фенолрота. Среду разливают в стерильные пробирки по 5 - 6 см3 и стерилизуют текучим паром 20 мин. Посев производят уколом в столбик агара. При положительной реакции внутри столбика образуется почернение среды.
РЕЦЕПТ 26
Реактив Ковача для обнаружения индола
пара-диметиламинобензальдегид | - 5 г |
спирт амиловый | - 75 см3 |
хлористоводородная кислота (HCl) концентрированная | - 25 см3 |
Бульон на переваре Хоттингера
Для приготовления бульона к 100 см3 основного перевара Хоттингера добавляют 900 см3 дистиллированной воды, 0,5% хлорида натрия, 0,1% двузамещенного фосфата калия, устанавливают pH 7,4 - 7,6 и кипятят 15 - 20 мин.
Приготовленный таким образом бульон фильтруют через ватно-марлевый или бумажный фильтр, разливают во флаконы или пробирки и стерилизуют при температуре 120 °C в течение 20 - 30 мин.
Желатин для определения протеолитических ферментов
В мясную воду добавляют 1% пептона, 0,5% хлорида натрия, 15% желатина. Предварительно желатин заливают для набухания небольшим количеством мясной воды и ставят на водяную баню при температуре 40 - 50 °C. После ее набухания доливают оставшуюся часть мясной воды, вносят хлорид натрия и нагревают смесь до полного растворения компонентов, затем устанавливают pH 7,2 - 7,4 и прогревают 1 час текучим паром. Готовую среду фильтруют через ватно-марлевый фильтр. Разливают в пробирки и стерилизуют текучим паром 2 дня по 20 мин или при 0,5 атм в течение 15 мин. Протеолиз выражается разжижением плотного столбика желатина.
Агар с фенилаланином
Дрожжевой экстракт жидкий | - 100 см3 |
или экстракт сухой | - 3 г |
Натрий хлорид (NaCl) | - 5 г |
Однозамещенный фосфат натрия (NaH2PO4·2H2O) | - 1 г |
L-фенилаланин | - 1 г |
или Д-фенилаланин | - 2 г |
Агар-агар | - 12 г |
Вода дистиллированная | - 1 дм3 |
Дрожжевой экстракт вносят в холодную воду, нагревают смесь, затем последовательно добавляют остальные ингредиенты и кипятят до полного растворения агара (5 - 10 мин). Фильтруют через ватно-марлевый фильтр и разливают по 2 - 3 см3 в пробирки. pH среды должен быть 7,0 - 7,2. Стерилизуют при 112 °C 15 мин. Перед употреблением среду скашивают.
Среда с аминокислотой
Гидролизат казеина сухой | - 5 г |
Дрожжевой экстракт сухой | - 3 г |
Глюкоза | - 1 г |
Бромтимоловой синий (0,1%-ный раствор в 20% спирта) | - 45 см3 |
Дистиллированная вода | - 1 дм3 |
Все компоненты растворяют при нагревании, устанавливают pH среды 6,0, затем добавляют индикатор - бромкрезоловый синий и делят среду на 4 равные части. В одну часть среды аминокислоту не добавляют, эта порция служит контролем. В остальные порции вносят соответственно лизин и аргинин в количестве по 1%.
Аминокислоты указаны в L-форме. Если используется Д-форма аминокислоты, то ее добавляют в количестве 2%. После добавления аминокислот pH среды доводят до 6,0; среду разливают по 2 - 3 см3 в стерильные пробирки и стерилизуют при 112 °C 20 мин.
Среда с бромтимоловым синим зелено-оливкового цвета, при щелочной реакции приобретает синий цвет, при кислой - желтеет.
ЦПХ-агар для выделения культур синегнойной палочки
Пептон ферментативный | - 20,0 г |
Калий сернокислый | - 7,0 г |
Магний хлористый | - 1,5 г |
Магний сернокислый | - 1,5 г |
N-цетилпиридиний-хлористый одноводный | - 2,0 г |
Агар-агар | - 10,0 г |
Вода дистиллированная | - 1000,0 см3 |
Среду нагревают и кипятят 2 - 3 мин и разливают перед исследованием в чашки Петри.
Среда ГСМП для выделения культур синегнойной палочки
К 1 дм3 расплавленного МПА добавляют 10 г глюкозы, 3 г сульфанола. Среду охлаждают до 45 +/- 2 °C и вносят 0,3 см3 рабочего разведения мономицина, т.е. 0,003 г антибиотика и 2,5 см3 разведенного пенициллина (0,15 г или 250000 ед антибиотика). После внесения каждого компонента содержимое колбы осторожно перемешивают круговым движением (без образования пены).
Среду разливают в стерильные чашки Петри по 10 - 15 см3 и подсушивают в термостате при 37 °C.
Для приготовления рабочего разведения мономицина во флакон, содержащий 0,5 г антибиотика, добавляют 5 см3 стерильной дистиллированной воды. 1 см3 полученного разведения переносят в пробирку с 9 см3 стерильной дистиллированной воды. На 1 дм3 среды добавляют 0,3 см3 рабочего разведения мономицина, как указано в рецепте приготовления сред.
Для приготовления разведения пенициллина во флакон, содержащий 500000 ед антибиотика, добавляют 5 см3 стерильной дистиллированной воды. На 1 дм3 среды необходимо внести 2,5 см3 этого разведения.
Среда Кинг A для образования пиоцианина синегнойной палочки
Пептон | - 20 г |
Глицерин | - 10 г |
Калий сернокислый | - 10 г |
Магний хлористый | - 1,4 г |
Агар-агар | - 20 г |
Вода дистиллированная | - 1000 см3 |
Среду стерилизуют при 112 °C в течение 20 мин.
Питательная среда ИЭМ им. Н.Ф. Гамалеи в модификации ВНИИВС
для выделения микоплазм
1. 65% стерильного бульона из триптического перевара сердца крупного рогатого скота;
2. 20% стерильной сыворотки крови лошадей, инактивированной при 56 °C в течение 30 мин;
3. 10% стерильного дрожжевого экстракта (25%)
4. 5% стерильной молочной сыворотки, инактивированной при 56 °C в течение 30 мин;
5. 0,5% хлористого натрия;
6. 0,5% стерильного раствора глюкозы (40%-ного);
7. 0,002% фенолового красного
pH среды 8,0
При приготовлении плотной среды к бульону добавляют 1,5 - 2% агар-агара. Сыворотку крови лошади, молочную сыворотку и дрожжевой экстракт вносят в расплавленный агар.
С целью подавления роста посторонней микрофлоры в жидкие среды при первичном выделении микоплазм и ахолеплазм добавляют следующие ингибиторы: раствор ацетата таллия в конечной концентрации 1:2000 и раствор пенициллина из расчета 1000 ЕД/см3 питательной среды.
Питательная среда для выделения уреаплазм
Для приготовления жидкой питательной среды смешивают равные объемы пептона Мартена и мясной воды. Двунормальным раствором соляной кислоты pH доводят до 5,8 - 6,0, жидкую среду разливают в колбы по 200 - 400 см3 и стерилизуют 30 мин при температуре 120 °C. Перед употреблением на 100 см3 бульона добавляют 20 см3 неинактивированной сыворотки крови лошади, 10 см3 дрожжевого экстракта (pH 6,0), 6 см3 25%-ного водного раствора мочевины и 0,3 см3 0,5%-ного раствора фенолового красного.
При приготовлении плотной среды к бульону добавляют, 1,5 - 2% агар-агара. Ацетат таллия ингибирует рост уреаплазм, вследствие чего его не добавляют к питательной среде. Для подавления роста сопутствующей микрофлоры при выделении уреаплазм в питательную среду вносят только пенициллин (1000 ЕД).
Раствор мочевины стерилизуют через пластины СФ фильтра Зейтца.
Глюкозо-дрожжевой агар
Пептон | - 10 г |
Дрожжевой экстракт сухой | - 1,0 г |
Глюкоза | - 40,0 г |
Агар-агар | - 15,0 г |
Вода дистиллированная pH 6,0 - 6,2 | - 1000 см3 |
Стерилизуют среду в автоклаве при 112 °C 20 мин.
Среда Сабуро
Глюкоза (мальтоза) | - 40 г |
Пептон | - 10 г |
Агар-агара | - 18 г |
Вода дистиллированная | - 1000 см3 |
К 1000 см3 дистиллированной воды добавляют 18 г агар-агара, 40 г мальтозы или глюкозы и 10 г пептона.
Нагревают среду до полного растворения (при наличии осадка ее фильтруют). Устанавливают активную кислотность (6,6 +/- 0,1) ЕД pH с помощью молочной кислоты, разливают в мерные колбы и стерилизуют при 112 +/- 1 °C в течение 15 мин.
Солодовый агар
Солодовое сусло | - 1000 см3 |
Агар-агар | - 30 г |
Приготовление солодового сусла с массовой долей сухих веществ 7,5 +/- 0,5%.
Сусло фильтруют через фильтровальную бумагу, разливают в колбы и стерилизуют 30 мин при 112 °C. Затем сусло декантируют. Массовую долю сухих веществ определяют ареометром-сахарометром с диапазоном измерений 0 - 10%. Сусло разбавляют водой до массовой доли сухих веществ 7,5 +/- 0,5%, разливают в колбы и стерилизуют при 112 +/- 1 °C 20 мин.
Приготовление агара. К 1000 см3 сусла прибавляют 30 г агар-агара, нагревают среду до полного расплавления агара и фильтруют через вату. Охлаждают до 50 +/- 5 °C и устанавливают активную кислотность 6,6 +/- 0,1 ЕД pH с помощью молочной кислоты, фильтрат разливают в мерные колбы и стерилизуют при 112 +/- 1 °C в течение 20 мин.
Среда из сухого сывороточного агара БФ
Агар сухой сывороточный БФ (производство Северо-Кавказского филиала ВНИИМС) | - 60 г |
Вода дистиллированная | - 1000 см3 |
К 1000 см3 дистиллированной воды добавляют 60 г сухого сывороточного агара БФ, нагревают до полного растворения (при наличии осадка фильтруют). Устанавливают активную кислотность 4,0 +/- 0,5 ЕД pH с помощью молочной кислоты, разливают в мерные колбы и стерилизуют при 120 °C в течение 15 мин. См. дополнение стр.
Элективная дифференциально-диагностическая среда
для выделения и идентификации грибов рода Candida (ЭДДС)
Элективная дифференциально-диагностическая среда обусловлена введением карамели (солод, поджаренный при 150 - 170 °C в течение 2,5 ч), что дает обогащение минерального состава среды.
В качестве субстрата используют фильтрат сусла, имеющего углеводов 15 - 17° по ареометру (по Баллингу), и расплавленный в дистиллированной воде агар-агар.
18 - 20 г агар-агара растворяют в 500 см3 дистиллированной воды, затем добавляют 1 дм3 фильтрата сусла, имеющего карамели 6 - 8%. После установления pH 6,6 - 6,8 среду разливают в колбы и автоклавируют при 121 +/- 1 °C в течение 15 мин. Для проверки на стерильность среду ставят в термостат на 24 часа при 37 +/- 1 °C. По истечении этого срока ее нагревают до 100 °C и остывшую до 47 - 50 °C разливают в чашки Петри или в пробирки. Чашки со средой можно хранить в холодильнике в течение 15 - 30 сут., защитив от высыхания путем помещения в целлофановые мешки.
Селективная среда для выделения коринебактерий
Применяют шоколадный теллуритовый агар. Вначале готовят кровяной агар.
К 500 см3 расплавленного агара при температуре водяной бани 75 - 80 °C добавляют 25 см3 цитратной или дефибринированной крови лошади и смешивают в течение 3 - 5 мин, пока агар не приобретет темно-кофейный (шоколадный) цвет.
После охлаждения агара до 56 °C к нему добавляют 35 см3 стерильной сыворотки лошади и тщательно ее размешивают. Затем добавляют 5 см3 1%-ного водного раствора теллурита калия. Готовый агар разливают в чашки. Хранят среду в холодильнике в течение пяти суток.
Теллуритовая среда Клауберга
Первая смесь: предварительно готовят глицериново-кровяную смесь, смешивая 20 см3 бараньей или лошадиной крови с 10 см3 х.ч. глицерина. В день приготовления среды готовят две другие смеси.
Вторая смесь: расплавляют 50 см3 мясо-пептонного агара, охлаждают его до 50 °C, после чего к нему добавляют 2,5 см3 глицериново-кровяной смеси.
Третья смесь: смешивают 17 см3 бараньей крови с 33 см3 дистиллированной воды (смесь готовят стерильно), подогревают в водяной бане до 50 °C. Соединяют вторую и третью смеси, добавляют 4 см3 1% раствора теллурита калия, быстро все компоненты перемешивают и разливают среду в чашки Петри. Среда прозрачная, имеет красно-вишневый цвет.