СПРАВКА
Источник публикации
Документ опубликован не был
Примечание к документу
В соответствии с Приказом Минздрава России от 29.10.2015 N 771 данный документ введен в действие с 1 января 2016 года.
Текст документа приведен в соответствии с публикацией на сайте http://femb.ru/feml, и разделен в Информационном банке на отдельные фармакопейные статьи.
Взамен ФС 42-3110-95.
Название документа
Фармакопейная статья "Вакцина оспенная эмбриональная живая. ФС.3.3.1.0035.15"
("Государственная фармакопея Российской Федерации. XIII издание. Том III")
Фармакопейная статья "Вакцина оспенная эмбриональная живая. ФС.3.3.1.0035.15"
("Государственная фармакопея Российской Федерации. XIII издание. Том III")
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАКОПЕЙНАЯ СТАТЬЯ
Вакцина оспенная эмбриональная живая | ФС.3.3.1.0035.15 Взамен ФС 42-3110-95 |
Настоящая фармакопейная статья распространяется на вакцину оспенную эмбриональную живую, таблетки жевательные для орального применения. Вакцина представляет собой вирус вакцины, выращенный в хорионаллантоисной оболочке (ХАО) и плодике куриного эмбриона (КЭ), и высушенный со стабилизатором без консерванта. В таблетке содержится вируссодержащий материал и вспомогательные вещества, разрешенные к медицинскому применению.
Вакцина оспенная эмбриональная живая предназначена для профилактики натуральной оспы и заболеваний, вызываемых вирусами оспы животных, патогенными для человека.
Все этапы производства вакцины должны осуществляться с соблюдением установленных требований к правилам организации производства и контролю качества лекарственного препарата, гарантирующих его качество и безопасность для человека.
Производство вакцины оспенной эмбриональной живой должно проводиться в отдельных изолированных помещениях, в которых не допускается производство других лекарственных средств. Условия производства должны соответствовать требованиям Санитарных правил "Безопасность работы с микроорганизмами III-IV групп патогенности (опасности) и возбудителями паразитарных болезней".
Основные этапы производства:
- получение вируссодержащего материала путем введения посевного вируса на ХАО КЭ;
- инкубирование инфицированных эмбрионов, извлечение плодика и ХАО из эмбриона;
- гомогенизация материала;
- приготовление жидкой вакцины и добавление стабилизатора;
- лиофильная сушка материала;
- подготовка и расчет вспомогательных веществ для получения таблеток;
- прессование таблеток.
Характеристика материалов животного происхождения, используемых в производстве. В качестве продуцента для производства вакцины и посевного материала используют 12-суточные куриные эмбрионы пород "Леггорн", "Роменбраун", "Родонит", "Изобраун", "Русская белая", кросс 46, линия П4, П6. Яйца куриные инкубационные получают из птицехозяйств, свободных от вирусных и других заболеваний, патогенных для человека.
Требования к производственному штамму. Для производства вакцины оспенной эмбриональной живой используют штамм вируса осповакцины БИЭМГ (Б-51). Для приготовления вакцины используется посевной вирус первых 10 пассажей.
Штамм должен отвечать следующим требованиям:
- формировать на ХАО КЭ два вида (специфических образований) оспин: не менее 80% белых плотных оспин размером 1-5 мм ("белый" клон) и не более 20% сероватых расплывчатых поверхностных оспин размером 1-3 мм ("серый" клон);
- при культивировании на ХАО КЭ при температуре ( ) °С в течение (42-48) ч вирус вакцины должен накапливаться в концентрации 108 ООЕ/мл (ООЕ - оспообразующие единицы);
) °С в течение (42-48) ч вирус вакцины должен накапливаться в концентрации 108 ООЕ/мл (ООЕ - оспообразующие единицы);
- не вызывать некроз кожи кроликов при внутрикожном введении в дозе 104 ООЕ в 0,1 мл;
- не вызывать гибели кроликов при внутримозговом введении в дозе 106 ООЕ в 0,1 мл;
- быть безвредным (нетоксичным) для морских свинок и белых мышей в дозах соответственно 3 · 107 и 1,2 · 106 ООЕ/мл при подкожном введении.
Допустимое количество микроорганизмов в пересчете на 1 мл:
- общее число аэробных бактерий - не более 103;
- общее число грибов - не более 102;
- должны отсутствовать Enterobacteriaceae, Pseudomonas aeruginosa, Staphylococcus aureus.
Производственный штамм контролируется на каждом пассажном уровне.
Описание. Таблетки жевательные круглые двояковыпуклые с риской и цельными краями диаметром 8-13 мм светло-коричневого цвета с запахом ванили. Определение проводят органолептически. По внешнему виду таблетки должны соответствовать требованиям ОФС "Таблетки".
Подлинность. Вакцина должна вызывать на хорионаллантоисных оболочках 12-суточных КЭ характерные специфические образования (оспины) 2 видов: не менее 80% белых плотных оспин размером 1-5 мм ("белый" клон), не более 20% расплывчатых сероватых поверхностных оспин размером 1-3 мм ("серый" клон). Контроль проводят одновременно с определением специфической активности (раздел "Специфическая активность").
Средняя масса и отклонение от средней массы. От 0,2 до 1 г. Определение проводят в соответствии с ОФС "Таблетки".
Распадаемость. Должны распадаться в течение 1 ч. Определение проводят в соответствии с ОФС "Распадаемость таблеток и капсул".
Потеря в массе при высушивании. Не более 3,0%. На 2 параллельных анализа используют не менее 7 таблеток. Определение проводят по ОФС "Потеря в массе при высушивании".
- общее число аэробных бактерий - не более 103;
- общее число грибов - не более 102;
- должны отсутствовать Enterobacteriaceae, Pseudomonas aeruginosa, Staphylococcus aureus.
Определение проводят по ОФС "Микробиологическая чистота". Масса исследуемых таблеток должна быть не менее 3 г. Таблетки в асептических условиях помещают в фарфоровую ступку с пестиком, растирают и суспендируют в 0,004 М стерильном фосфатно-цитратном буферном (ФЦБ) растворе Мак-Ильвейна в соотношении 1:10 (1 г в 10 мл).
Примечания.
1. Приготовление ФЦБ раствора Мак-Илвейна 0,004 М (pH 7,2-7,4). Готовят растворы 1 и 2.
Раствор 1: Лимонная кислота - 2,1 г; Вода очищенная - 100 мл.
Раствор 2: В мерной колбе вместимостью 1000 мл в воде очищенной растворяют 28,4 г натрия гидрофосфата безводного или 35,6 г натрия гидрофосфата дигидрата или 71, 6 г натрия гидрофосфата додекагидрата, доводят объем раствора тем же растворителем до метки и перемешивают.
Смешивают 2 мл раствора 1 и 18 мл раствора 2 в мерной колбе вместимостью 1000 мл, доводят объем раствора водой очищенной до метки и перемешивают. Полученный раствор должен иметь pH 7,2-7,4. Если pH полученного раствора более 7,4, его доводят до нормы раствором 1. В случае, если pH полученного раствора меньше 7,2, приготовление раствора повторяют. Буферный раствор стерилизуют при температуре ( ) °С и давлении (
) °С и давлении ( ) МПа в течение 8-30 мин (в зависимости от объема) или фильтруют через мембраны с диаметром пор 0,22 мкм и хранят при температуре от 2 до 8 °С. Срок хранения от 10 до 30 сут. в зависимости от способа укупорки флаконов (способ укупорки флаконов должен быть указан в нормативной документации).
) МПа в течение 8-30 мин (в зависимости от объема) или фильтруют через мембраны с диаметром пор 0,22 мкм и хранят при температуре от 2 до 8 °С. Срок хранения от 10 до 30 сут. в зависимости от способа укупорки флаконов (способ укупорки флаконов должен быть указан в нормативной документации).
 ) МПа в течение 8-30 мин (в зависимости от объема) или фильтруют через мембраны с диаметром пор 0,22 мкм и хранят при температуре от 2 до 8 °С. Срок хранения от 10 до 30 сут. в зависимости от способа укупорки флаконов (способ укупорки флаконов должен быть указан в нормативной документации).
) МПа в течение 8-30 мин (в зависимости от объема) или фильтруют через мембраны с диаметром пор 0,22 мкм и хранят при температуре от 2 до 8 °С. Срок хранения от 10 до 30 сут. в зависимости от способа укупорки флаконов (способ укупорки флаконов должен быть указан в нормативной документации).Аномальная токсичность. Препарат должен быть нетоксичен для морских свинок массой 250-300 г и белых мышей массой 18-20 г при подкожном введении 1 и 1/25 прививочной дозы соответственно. Испытания проводят по ОФС "Аномальная токсичность".
Для определения токсичности используют не менее 4 таблеток. Таблетки растирают в стерильной ступке и суспендируют в 0,9% стерильном растворе натрия хлорида из расчета 5 мл на таблетку. После отстаивания в течение 45-60 мин вводят 5 мл надосадочной жидкости (по 2,5 мл в каждый бок) 2 морским свинкам и по 0,2 мл 5 беспородным белым мышам в холку. Наблюдение за животными проводят в течение 7 сут. В случае развития абсцесса или гибели хотя бы 1 животного производят повторный анализ на удвоенном количестве животных. Если при повторном анализе вновь регистрируются вышеперечисленные явления, серию препарата бракуют.
Специфическая активность. Одна прививочная доза препарата должна содержать не менее 1 · 106 и не более 3 · 107 ООЕ вируса вакцины.
Испытания проводят биологическим методом на ХАО 12-дневных КЭ от кур породы "Леггорн", "Роменбраун", "Родонит-2", "Изобраун" или "Хайсек", или пород кур, эмбрионы которых чувствительны к вирусу осповакцины. Объем выборки составляет не менее 7 прививочных доз (4 таблетки).
Куриные эмбрионы получают из хозяйств, свободных от вирусных и других возбудителей, патогенных для человека.
Подготовка КЭ. Проводят овоскопию КЭ в затемненном помещении. Каждый эмбрион просматривают в направленном пучке света. Свет должен падать сверху на тупой конец яйца. Яйцо с погибшим эмбрионом или с кровоизлиянием под оболочкой бракуют. В центре воздушного мешка на тупом конце яйца и на боковой поверхности яйца, на участке между сосудами и их ответвлениями карандашом делают отметку. В местах отметок с соблюдением правил асептики пропиливают бормашиной с абразивным диском отверстия (щели) длиной 3-4 мм и шириной 1,5 мм, не повреждая оболочки. Яйцо укладывают так, чтобы отверстие на боковой стороне было обращено вверх. Подскорлупную оболочку в центре воздушного мешка прорывают плоской полукруглой хирургической иглой. Затем на отверстие, расположенное на боковой поверхности, вносят 0,1 мл стерильного 0,004 М раствора ФЦБ Мак-Илвейна, подогретого до температуры ( ) °С, и той же иглой осторожно продавливают подскорлупную оболочку. После этого практически вся капля раствора проходит под подскорлупную оболочку и частично отслаивает ХАО.
) °С, и той же иглой осторожно продавливают подскорлупную оболочку. После этого практически вся капля раствора проходит под подскорлупную оболочку и частично отслаивает ХАО.
Из отверстия (в месте пропила) в центре воздушного мешка резиновой грушей осторожно отсасывают воздух до полного опускания ХАО. Яйца с опущенной ХАО помещают на лотки отверстием на боковой поверхности вверх и помещают в камеру с температурой ( ) °С. Через 2 ч проводят овоскопию и бракуют эмбрионы с кровоизлияниями и воздушными мешками под ХАО или без воздушных мешков.
) °С. Через 2 ч проводят овоскопию и бракуют эмбрионы с кровоизлияниями и воздушными мешками под ХАО или без воздушных мешков.
Приготовление десятикратных разведений. Таблетки взвешивают с точностью до 0,001 г, растирают в фарфоровой ступке и добавляют стерильный ФЦБ из расчета 10 мл на 1 г таблеток (соотношение 1:10 - "исходное разведение пробы"). В полученной взвеси дают отстояться грубым частицам в течение 45 мин. Из надосадочной жидкости пробы готовят 2 параллельных ряда последовательных десятикратных разведений. С этой целью отбирают по 0,5 мл испытуемого образца и вносят в 2 пробирки, содержащие 4,5 мл стерильного ФЦБ, получают разведение 10-1. Содержимое пробирок перемешивают с помощью пипеток не менее 30 раз. Из каждой пробирки с разведением 10-1 по 0,5 мл разведенного материала пипеткой переносят в последующую пробирку с 4,5 мл ФЦБ, не касаясь жидкости пипеткой, получают разведение 10-2, и т.д. до разведения 10-5, меняя пипетки после каждого разведения.
Примечание.
В используемый ФЦБ (раздел "Микробиологическая чистота") добавляют бензилпенициллин калия или натрия и стрептомицина сульфат из расчета 250 ед. активности каждого антибиотика в 1 мл ФЦБ.
Инфицирование КЭ. Для инфицирования КЭ используют разведения вакцины 10-3, 10-4 и 10-5, предварительно объединенные из 2 параллельных рядов. Каждое разведение материала вводят на ХАО 15 КЭ по ( ) мл в отверстие на боковой поверхности яйца. Круговым вращением яйца вирус равномерно распределяют по ХАО. Инокулированные эмбрионы инкубируют при температуре (
) мл в отверстие на боковой поверхности яйца. Круговым вращением яйца вирус равномерно распределяют по ХАО. Инокулированные эмбрионы инкубируют при температуре ( ) °С в течение 42-48 ч. По окончании инкубации КЗ вскрывают, изолируют ХАО, промывают ее в воде, раскладывают на темном фоне и подсчитывают количество оспин на ХАО для каждого разведения. Из испытания исключают КЭ с поврежденной ХАО и погибшие.
) °С в течение 42-48 ч. По окончании инкубации КЗ вскрывают, изолируют ХАО, промывают ее в воде, раскладывают на темном фоне и подсчитывают количество оспин на ХАО для каждого разведения. Из испытания исключают КЭ с поврежденной ХАО и погибшие.
 ) мл в отверстие на боковой поверхности яйца. Круговым вращением яйца вирус равномерно распределяют по ХАО. Инокулированные эмбрионы инкубируют при температуре (
) мл в отверстие на боковой поверхности яйца. Круговым вращением яйца вирус равномерно распределяют по ХАО. Инокулированные эмбрионы инкубируют при температуре (Учет результатов. Вычисляют среднее арифметическое количество оспин на ХАО КЭ, инфицированных разведением вакцины, вызвавшим образование не менее 10 оспин (допускается расчет по максимальному разведению, содержащему не менее 80% таких КЭ).
Расчет специфической активности (А) в ООЕ проводят по формуле:
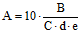 ,
,где: 10 - коэффициент исходного разведения пробы;
B - среднее арифметическое количество оспин на ХАО КЭ;
C - разведение исходной пробы;
d - объем инокулята, вводимого в КЭ;
e - количество таблеток (доз) в 1 г анализируемого образца.
Для определения чувствительности КЭ к вирусу вакцины параллельно с определением специфической активности на той же партии КЭ проводят определение специфической активности стандартного образца (СО) активности специфичности и некротической активности оспенной вакцины в соответствии с инструкцией по применению. На каждое разведение используют 15 КЭ.
Если полученная величина специфической активности СО отличается от указанной в паспорте, то вычисляют поправочный коэффициент (Kn) чувствительности данной партии КЭ к вирусу вакцины по формуле:
где: Ac - специфическая активность СО, указанная в паспорте, ООЕ/мл;
А1 - полученная специфическая активность СО, ООЕ/мл.
Результаты определения специфической активности испытуемой серии препарата умножают на поправочный коэффициент Kn.
Упаковка и маркировка. В соответствии с ОФС "Иммунобиологические лекарственные препараты".
Транспортирование и хранение. При температуре от 2 до 8 °С.