СПРАВКА
Источник публикации
Документ опубликован не был
Примечание к документу
В соответствии с Приказом Минздрава России от 11.04.2022 N 246 данный документ введен в действие с 01.04.2022.
Название документа
"ФС.3.1.0157.22. Фармакопейная статья. Кокарбоксилазы гидрохлорид + Никотинамид + Трифосаденина динатрия тригидрат + Цианокобаламин, лиофилизат для приготовления раствора для внутримышечного введения. Кокарбоксилаза + Никотинамид + Трифосаденин + Цианокобаламин, лиофилизат для приготовления раствора для внутримышечного введения"
(утв. и введена в действие Приказом Минздрава России от 11.04.2022 N 246)
("Государственная фармакопея Российской Федерации. XIV издание")
"ФС.3.1.0157.22. Фармакопейная статья. Кокарбоксилазы гидрохлорид + Никотинамид + Трифосаденина динатрия тригидрат + Цианокобаламин, лиофилизат для приготовления раствора для внутримышечного введения. Кокарбоксилаза + Никотинамид + Трифосаденин + Цианокобаламин, лиофилизат для приготовления раствора для внутримышечного введения"
(утв. и введена в действие Приказом Минздрава России от 11.04.2022 N 246)
("Государственная фармакопея Российской Федерации. XIV издание")
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАКОПЕЙНАЯ СТАТЬЯ
Кокарбоксилазы гидрохлорид + Никотинамид + Трифосаденина динатрия тригидрат + Цианокобаламин, лиофилизат для приготовления раствора для внутримышечного введения Метопролола тартрат, раствор для инъекций Кокарбоксилаза + Никотинамид + Трифосаденин + Цианокобаламин, лиофилизат для приготовления раствора для внутримышечного введения Cocarboxylasi hydrochloridum + Nicotinamium + Triphosadenini dinatrii trihydras + Cyanocobalaminum, lyophilisatum pro solutionibus pro injection intramusculari | ФС.3.1.0157.22 |
Вводится впервые |
Настоящая фармакопейная статья распространяется на лекарственный препарат кокарбоксилазы гидрохлорид + никотинамид + трифосаденина динатрия тригидрат + цианокобаламин, лиофилизат для приготовления раствора для внутримышечного введения. Препарат должен соответствовать требованиям ОФС "Лиофилизаты", ОФС "Лекарственные формы для парентерального применения" и нижеприведенным требованиям.
Содержит:
- не менее 90,0%, и не более 125,0% от заявленного количества кокарбоксилазы гидрохлорида C12H18N4O7P2S·HCl;
- не менее 90,0% и не более 125,0% от заявленного количества никотинамида C6H6N2O;
- не менее 90,0% и не более 110,0% от заявленного количества трифосаденина динатрия тригидрата C10H14N5Na2O13P3·3H2O;
- не менее 90,0% и не более 125,0% от заявленного количества цианокобаламина C63H88CoN14O14P.
Описание. Содержание раздела приводится в соответствии с ОФС "Порошки".
Подлинность. ВЭЖХ. Время удерживания основных пиков на хроматограммах испытуемых растворов должно соответствовать времени удерживания соответствующих пиков кокарбоксилазы гидрохлорида, никотинамида, трифосаденина динатрия тригидрата, цианокобаламина на хроматограммах растворов стандартных образцов или стандартных растворов (раздел "Количественное определение").
Время растворения. Не более 30 с. в соответствии с требованиями ОФС "Время растворения". К содержимому 1 флакона прибавляют 2 мл лидокаина гидрохлорида раствора 0,5%.
Вода. Не более 3,0% (ОФС "Определение воды", метод 1). Для определения используют точную навеску содержимого одного флакона.
Прозрачность. Раствор должен быть прозрачным (ОФС "Прозрачность и степень мутности жидкостей"). Содержимое флакона растворяют в 2 мл лидокаина гидрохлорида раствора 0,5%.
pH. В соответствии с требованиями ОФС "Ионометрия" (метод 3). Содержимое флакона растворяют в 2 мл воды.
Механические включения. Видимые. В соответствии с требованиями ОФС "Видимые механические включения в лекарственных формах для парентерального применения и глазных лекарственных формах".
Невидимые. В соответствии с требованиями ОФС "Невидимые механические включения в лекарственных формах для парентерального применения".
Однородность дозирования. Определение проводят в соответствии с ОФС "Однородность дозирования" (способ 1 или способ 2). При использовании способа 1 определение проводят методом ВЭЖХ в условиях испытания "Количественное определение".
Кокарбоксилазы гидрохлорид, Никотинамид, Трифосаденина динатрия тригидрат
Испытуемый раствор. Содержимое одного флакона растворяют в 2,0 мл лидокаина гидрохлорида растворе 0,5%, количественно переносят с помощью воды в мерную колбу вместимостью 100 мл, доводят объем раствора водой до метки, перемешивают и фильтруют через мембранный фильтр с размером пор 0,45 мкм.
Содержание кокарбоксилазы гидрохлорида C12H18N4O7P2S·HCl, никотинамида C6H6N2O, трифосаденина динатрия тригидрата C10H14N5Na2O13P3·3H2O в одном флаконе в процентах от заявленного количества (X) вычисляют по формуле:
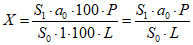 ,
,где S1 - площадь пика кокарбоксилазы гидрохлорида/никотинамида/трифосаденина динатрия тригидрата на хроматограмме испытуемого раствора;
S0 - площадь пика кокарбоксилазы гидрохлорида/никотинамида/трифосаденина динатрия тригидрата на хроматограмме стандартного раствора;
a0 - навеска стандартного образца кокарбоксилазы гидрохлорида/никотинамида/трифосаденина динатрия тригидрата, мг;
P - содержание основного вещества в стандартном образце кокарбоксилазы гидрохлорида/никотинамида/трифосаденина динатрия тригидрата, %;
L - заявленное содержание кокарбоксилазы гидрохлорида/никотинамида/трифосаденина динатрия тригидрата в одном флаконе, мг.
Цианокобаламин
Испытуемый раствор. Содержимое одного флакона растворяют в 2,0 мл лидокаина гидрохлорида растворе 0,5%. количественно переносят с помощью воды в мерную колбу вместимостью 50 мл, доводят объем раствора водой до метки, перемешивают и фильтруют через мембранный фильтр с размером пор 0,45 мкм.
Содержание цианокобаламина C63H88CoN14O14P в одном флаконе в процентах от заявленного количества (X) вычисляют по формуле:
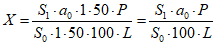 ,
,где S1 - площадь пика цианокобаламина на хроматограмме испытуемого раствора;
S0 - площадь пика цианокобаламина на хроматограмме раствора стандартного образца цианокобаламина;
a0 - навеска стандартного образца цианокобаламина, мг;
P - содержание основного вещества в стандартном образце цианокобаламина, %;
L - заявленное содержание цианокобаламина в одном флаконе, мг.
Бактериальные эндотоксины. Не более 2 ЕЭ/мг суммы действующих веществ. В соответствии с требованиями ОФС "Бактериальные эндотоксины".
Стерильность. Препарат должен быть стерильным. В соответствии с требованиями ОФС "Стерильность" (метод мембранной фильтрации). Смешивают содержимое флакона с 2 мл лидокаина гидрохлорида раствора 0,5%.
Кокарбоксилазы гидрохлорид, Никотинамид, Трифосаденина динатрия тригидрат
Определение проводят методом ВЭЖХ в соответствии с требованиями ОФС "Высокоэффективная жидкостная хроматография".
Подвижная фаза. 1,0 г натрия гептансульфоната растворяют в смеси, состоящей из 400 мл воды и 400 мл калия дигидрофосфата раствора 0,05 М с pH 3,5 +/- 0,05, прибавляют 200 мл метанола и 1,0 мл триэтиламина. Доводят pH раствора до 2,8 +/- 0,05 фосфорной кислотой.
Лидокаина гидрохлорида раствор 0,5%. 10 мг лидокаина гидрохлорида помещают в мерную колбу вместимостью 2 мл и доводят объем раствора водой до метки.
Испытуемый раствор. Содержимое нескольких флаконов растворяют в лидокаина гидрохлорида растворе 0,5% до получения концентрации кокарбоксилазы гидрохлорида 25 мг/мл, никотинамида 10 мг/мл, трифосаденина динатрия тригидрата 5 мг/мл. В мерную колбу вместимостью 100 мл помещают 2,0 мл полученного раствора, доводят объем раствора водой до метки, перемешивают и фильтруют через мембранный фильтр с размером пор 0,45 мкм.
Стандартный раствор. Около 10 мг (точная навеска) стандартного образца трифосаденина динатрия тригидрата, около 20 мг (точная навеска) стандартного образца никотинамида и около 50 мг (точная навеска) стандартного образца кокарбоксилазы гидрохлорида и помещают в мерную колбу вместимостью 100 мл, доводят объем раствора водой до метки, перемешивают и фильтруют через мембранный фильтр с размером пор 0,45 мкм.
Хроматографические условия
Колонка | 250 x 4,6 мм, силикагель октадецилсилильный, деактивированный по отношению к основаниям, эндкепированный, для хроматографии, 5 мкм; |
Температура колонки | 60 °C; |
Скорость потока | 1,5 мл/мин; |
Детектор | спектрофотометрический, 254 нм; |
Объем пробы | 2,5 мкл; |
Время хроматографирования | 10 мин |
Хроматографируют стандартный и испытуемый раствор.
Последовательность выхода пиков: трифосаденина динатрия тригидрат, кокарбоксилаза, никотинамид.
Пригодность хроматографической системы. На хроматограмме стандартного раствора:
- разрешение (RS) между пиками кокарбоксилазы и трифосаденина динатрия тригидрата должно быть не менее не менее 2;
- эффективность хроматографической колонки (N), рассчитанная по пику никотинамида должна быть не менее 1000 теоретических тарелок;
- фактор асимметрии (AS) пика никотинамида должен быть не более 2,0;
- относительное стандартное отклонение площади пиков всех активных компонентов должно быть не более 2,0% (6 введений);
Содержание кокарбоксилазы гидрохлорида C12H18N4O7P2S·HCl, никотинамида C6H6N2O, трифосаденина динатрия тригидрата C10H14N5Na2O13P3·3H2O в препарате в процентах от заявленного количества (X) вычисляют по формуле:
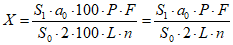 ,
,где S1 - площадь пика кокарбоксилазы гидрохлорида/никотинамида/трифосаденина динатрия тригидрата на хроматограмме испытуемого раствора;
S0 - площадь пика кокарбоксилазы гидрохлорида/никотинамида/трифосаденина динатрия тригидрата на хроматограмме стандартного раствора;
a0 - навеска стандартного образца кокарбоксилазы гидрохлорида/никотинамида/трифосаденина динатрия тригидрата, мг;
P - содержание основного вещества в стандартном образце кокарбоксилазы гидрохлорида/никотинамида/трифосаденина динатрия тригидрата, %;
L - заявленное содержание кокарбоксилазы гидрохлорида/никотинамида/трифосаденина динатрия тригидрата в одном флаконе, мг;
F - фактор дополнительного разведения испытуемого раствора;
n - количество флаконов, взятых на анализ.
Цианокобаламин
Определение проводят методом ВЭЖХ в соответствии с требованиями ОФС "Высокоэффективная жидкостная хроматография"
Фосфатный буферный раствор. 10 г натрия дигидрофосфата растворяют в 1000 мл воды, и доводят pH раствора фосфорной кислотой до 3,5 +/- 0,05.
Подвижная фаза. Метанол - Фосфатный буферный раствор 25:75.
Испытуемый раствор. Содержимое нескольких флаконов растворяют в лидокаина гидрохлорида растворе 0,5% до получения концентрации цианокобаламина 0,25 мг/мл. В мерную колбу вместимостью 50 мл помещают 2,0 мл полученного раствора, доводят объем раствора водой до метки, перемешивают и фильтруют через мембранный фильтр с размером пор 0,45 мкм.
Раствор стандартного образца цианокобаламина. Около 50 мг (точная навеска) стандартного образца цианокобаламина, помещают в мерную колбу вместимостью 100 мл, растворяют в подвижной фазе, доводят объем раствора подвижной фазой до метки и перемешивают. В мерную колбу вместимостью 50 мл помещают 1,0 мл полученного раствора, доводят объем раствора подвижной фазой до метки, перемешивают.
Хроматографические условия
Колонка | 150 x 4,6 мм, силикагель октадецилсилильный, деактивированный по отношению к основаниям, эндкепированный, для хроматографии, 5 мкм; |
Температура колонки | 35 °C; |
Скорость потока | 1,0 мл/мин; |
Детектор | спектрофотометрический, 361 нм; |
Объем пробы | 10 мкл; |
Время хроматографирования | 10 мин |
Хроматографируют раствор стандартного образца цианокобаламина и стандартный и испытуемый раствор.
Пригодность хроматографической системы. На хроматограмме раствора стандартного образца цианокобаламина:
- эффективность хроматографической колонки (N), рассчитанная по пику цианокобаламина должна быть не менее 1000 теоретических тарелок;
- фактор асимметрии (AS) пика цианокобаламина должен быть не более 2,0;
- относительное стандартное отклонение площади пиков цианокобаламина должно быть не более 2,0% (6 введений);
Содержание цианокобаламина C63H88CoN14O14P в препарате в процентах от заявленного количества (X) вычисляют по формуле:
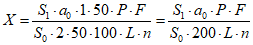 ,
,где S1 - площадь пика цианокобаламина на хроматограмме испытуемого раствора;
S0 - площадь пика цианокобаламина на хроматограмме раствора стандартного образца цианокобаламина;
a0 - навеска стандартного образца цианокобаламина, мг;
P - содержание основного вещества в стандартном образце цианокобаламина, %;
L - заявленное содержание цианокобаламина в одном флаконе, мг;
F - фактор дополнительного разведения испытуемого раствора;
n - количество флаконов, взятых на анализ.
Хранение. Содержание раздела приводится в соответствии с требованиями ОФС "Хранение лекарственных средств".