Скачать СП 3.3.2.561-96 Государственные испытания и регистрация новых медицинских иммунобиологических препаратов
Дата актуализации: 01.01.2021

 СП 3.3.2.561-96
СП 3.3.2.561-96
Государственные испытания и регистрация новых медицинских иммунобиологических препаратов
| Обозначение: |  СП 3.3.2.561-96 СП 3.3.2.561-96 |
| Обозначение англ: |  SP 3.3.2.561-96 SP 3.3.2.561-96 |
| Статус: | введен впервые |
| Название рус.: | Государственные испытания и регистрация новых медицинских иммунобиологических препаратов |
| Название англ.: | State trials and registration of new medical immunobiological preparations |
| Дата добавления в базу: | 01.01.2021 |
| Дата актуализации: | 01.01.2021 |
| Дата введения: | 31.10.1996 |
| Область применения: | Санитарные правила устанавливают единый порядок государственных испытаний и регистрации новых МИБП. Он обязателен для всех организаций и предприятий, разрабатывающих, производящих и использующих МИБП, вне зависимости от их ведомственной принадлежности и форм собственности. Этот же порядок распространяется на зарубежные МИБП, впервые регистрируемые в Российской Федерации |
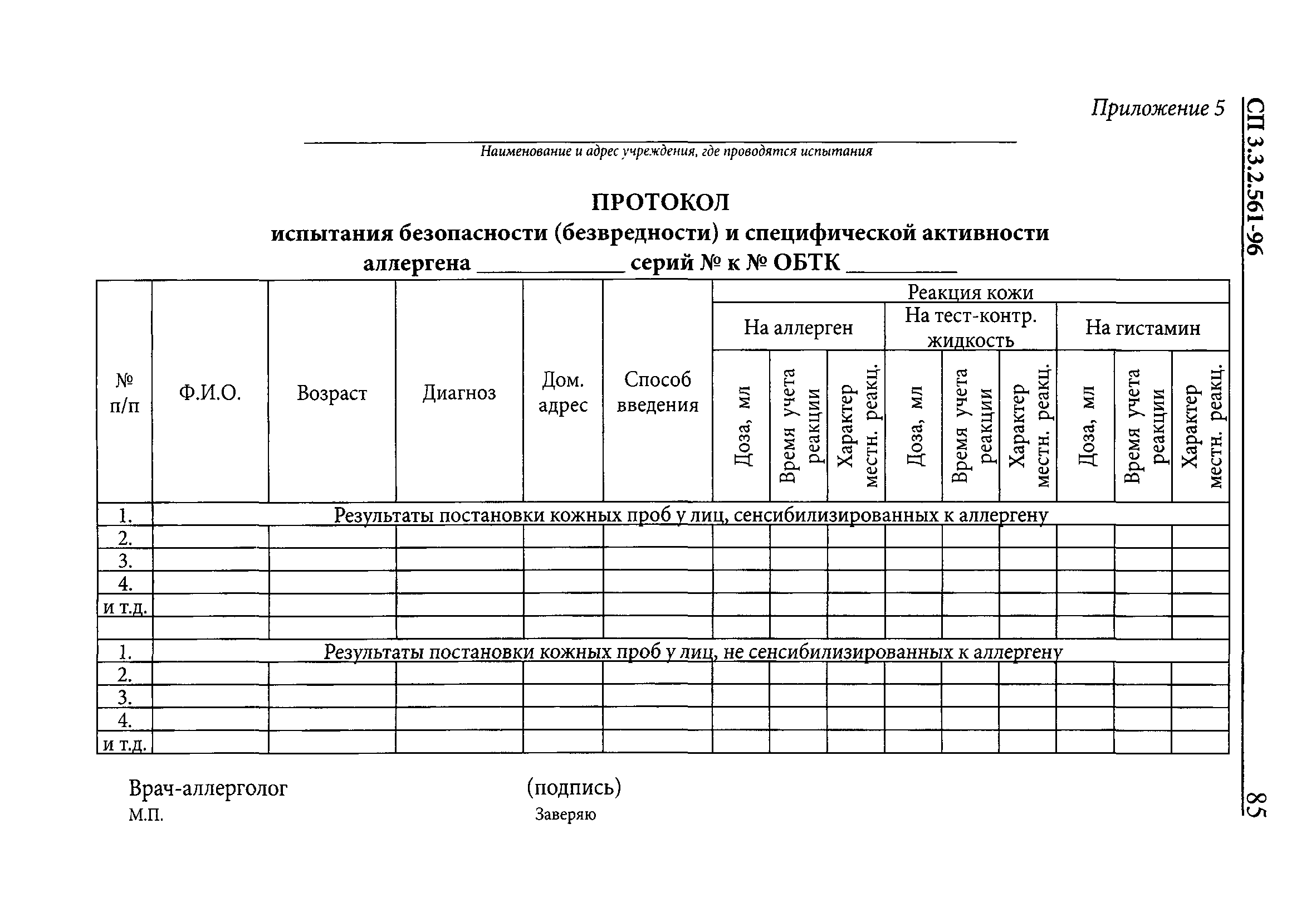
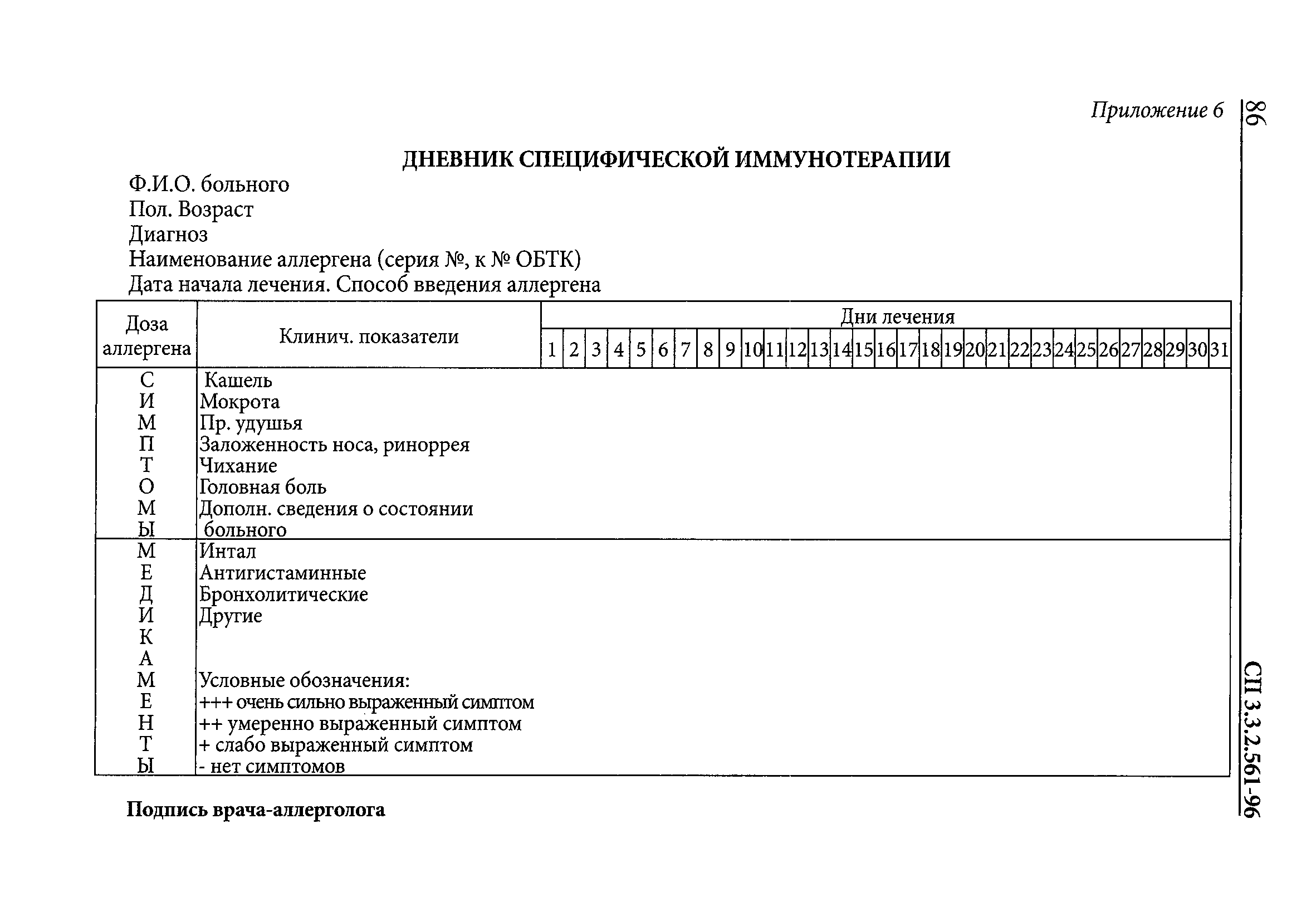
| Оглавление: | 1. Область применения 2. Нормативные ссылки 3. Сокращения, термины и определения 4. Порядок государственных испытаний и регистрации новых МИБП 4.1. Общие положения 4.2. Лабораторно-экспериментальное изучение МИБП 4.3. Испытание новых МИБП, вводимых человеку 5. Доклинические испытания МИБП. Основные положения 5.1. Определение специфической активности 5.2. Определение токсичности инактивированных бактериальных и вирусных вакцин и анатоксинов 5.3. Определение специфической безопасности живых вакцин. Общие принципы 5.4. Особенности испытания таблетированных пероральных препаратов 6. Ограниченные клинические испытания МИБП 6.1. Содержание разделов программы 6.2. Оформление результатов испытания 7. Государственные полевые испытания МИБП, предназначенных для профилактики инфекционных заболеваний 8. Особенности испытания аллергенов 8.1. Доклинические испытания аллергенов 8.2. Испытание аллергенов на ограниченной группе лиц 8.3. Государственные испытания аллергенов 9. Особенности испытания бактериофагов 10. Испытание диагностических препаратов 10.1. Государственные полевые испытания диагностических препаратов, применяемых ин витро 11. Особенности испытания диагностических питательных сред 12. Оценка иммунологической безопасности вакцин 12.1. Лабораторно-экспериментальное (доклиническое) изучение 12.2. Клиническое изучение 13. Фармакопейные статьи на медицинские иммунобиологические препараты 13.1. Общие положения 13.2. Построение наименований МИБП 13.3. Построение, содержание и изложение фармакопейной статьи 13.4. Порядок оформления фармакопейных статей и особенности изложения некоторых разделов 13.5. Порядок присвоения обозначений и регистрации ВФС и ФС 13.6. Порядок оформления изменений к фармакопейным статьям 13.7. Порядок пересмотра и переутверждения фармакопейных статей 14. Инструкция по применению медицинских иммунобиологических препаратов 14.1. Построение, содержание и изложение инструкций по применению МИБП, предназначенных для введения человеку 14.2. Построение, содержание и изложение инструкций по применению МИБП, предназначенных для лабораторной диагностики Приложение 1. Методы определения токсичности Приложение 2. Индивидуальная карта привитого Приложение 3. Построение и содержание программы государственных полевых испытаний Приложение 4. Методики испытания аллергенов и бакпрепаратов Приложение 5. Протокол испытания безопасности (безвредности) и специфической активности аллергена Приложение 6. Дневник специфической иммунотерапии Приложение 7. Схема заключения по испытанию безопасности (безвредности) и специфической активности аллергена Приложение 8. Схема заключения по испытанию лечебной эффективности аллергена Приложение 9. Методика оценки иммунобиологической безопасности вакцин Приложение 10. Временная фармакопейная статья Приложение 11. Фармакопейная статья Приложение 12. Оформление последнего листа ФС Приложение 13. ФС 42 Приложение 14. Содержание пояснительной записки к ВФС и ФС на препараты, вводимые людям Приложение 15. Содержание пояснительной записки к ВФС и ФС на диагностические препараты, применяемые "ин витро" |
| Разработан: | Российский государственный научно-исследовательский институт стандартизации и контроля медицинских биологических препаратов им. Л.А. Тарасевича |
| Утверждён: | 31.10.1996 Главный Государственный санитарный врач России (33) |
| Издан: | Моркнига (2020 г. ) |
| Нормативные ссылки: |
|










































































































 ГОСТ 15467-79 «Управление качеством продукции. Основные понятия. Термины и определения»
ГОСТ 15467-79 «Управление качеством продукции. Основные понятия. Термины и определения»