| Область применения: | Настоящий стандарт распространяется на биоматериалы, предназначенные для использования в медицинских изделиях (МИ), и устанавливает методы имплантации для исследования местного биологического действия биоматериалов. Настоящий стандарт распространяется на следующие биоматериалы: - нерезорбируемые материалы в твердой форме; - пористые материалы, материалы в форме жидкости, геля, пасты и порошка; - деградируемые материалы. Настоящий стандарт распространяется на биоматериалы для МИ, предназначенные для местного использования по клиническим показаниям, и устанавливает требования к проведению оценки безопасности. Исследуемые образцы имплантируют в заданное место тела животного. Методы имплантации, установленные в настоящем стандарте, не предназначены для оценки или определения механических или функциональных свойств исследуемого биоматериала. Местное действие биоматериала оценивают, сравнивая реакцию ткани, вызванную исследуемым образцом, с реакцией аналогичной ткани, вызванной контрольным образцом. В качестве контрольных образцов применяют материалы, входящие в состав МИ, биосовместимость и возможное клиническое применение которых ранее доказаны. При проведении исследований определяют характеристику динамики реакции тканей после имплантации МИ/биоматериала, включая конечный результат процессов интеграции материала в окружающую ткань или его рассасывания/деградации. Для деградируемых/резорбируемых биоматериалов следует определить характеристики их деградации и реакцию местных тканей на нее. Настоящий стандарт не устанавливает методы исследований общей токсичности, канцерогенности, тератогенности или мутагенности. При этом в процессе исследования биоматериалов методами имплантации в течение длительного периода времени для оценки местного биологического действия у них могут быть выявлены некоторые из вышеперечисленных свойств. Методы имплантации, установленные в настоящем стандарте, допускается применять для исследования общей токсичности. Комбинированные исследования для оценки местного действия после имплантации и общетоксического действия биоматериалов следует выполнять с учетом требований соответствующих стандартов |

 ГОСТ ISO 10993-6-2021
ГОСТ ISO 10993-6-2021
 ГОСТ ISO 10993-6-2021
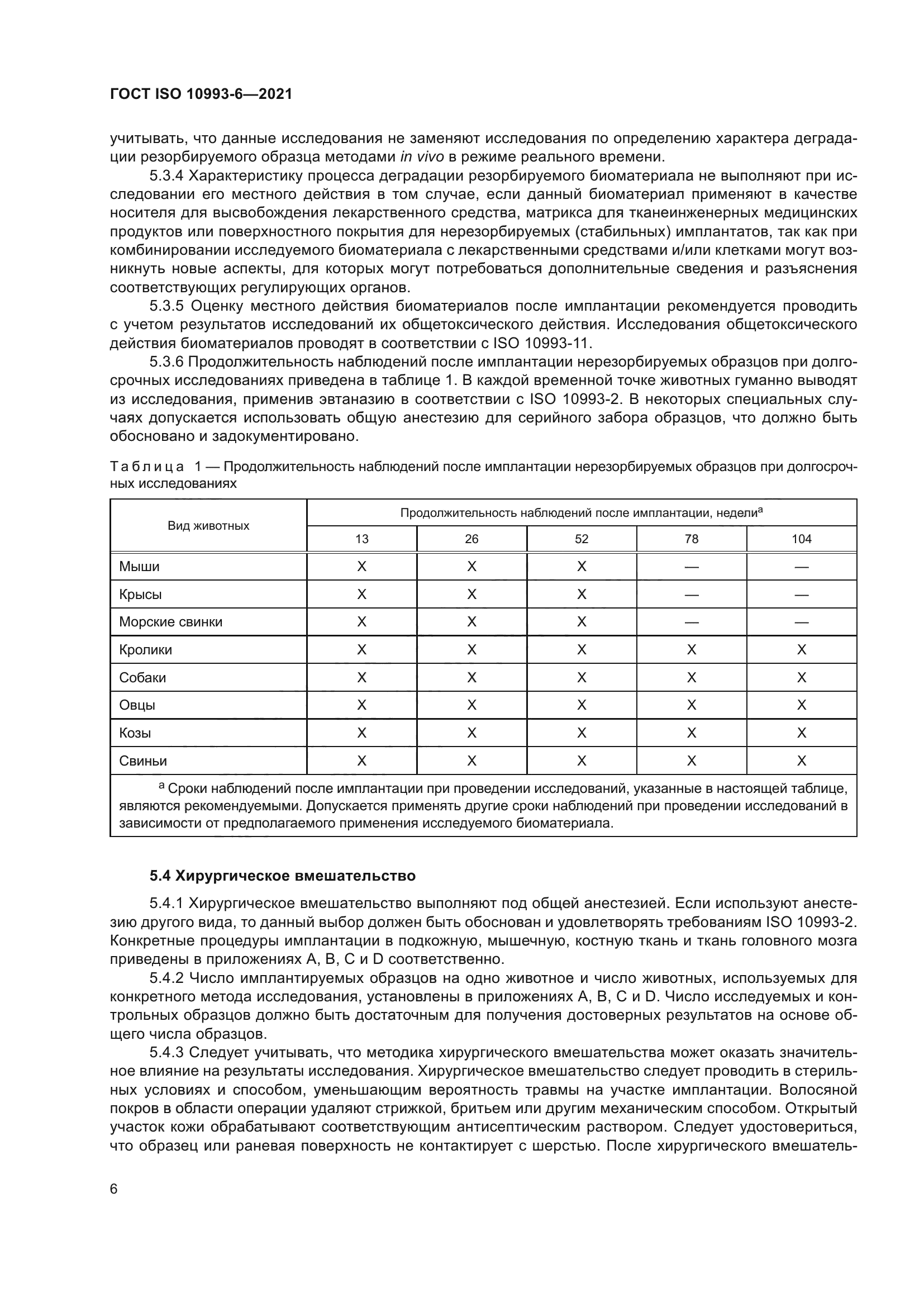
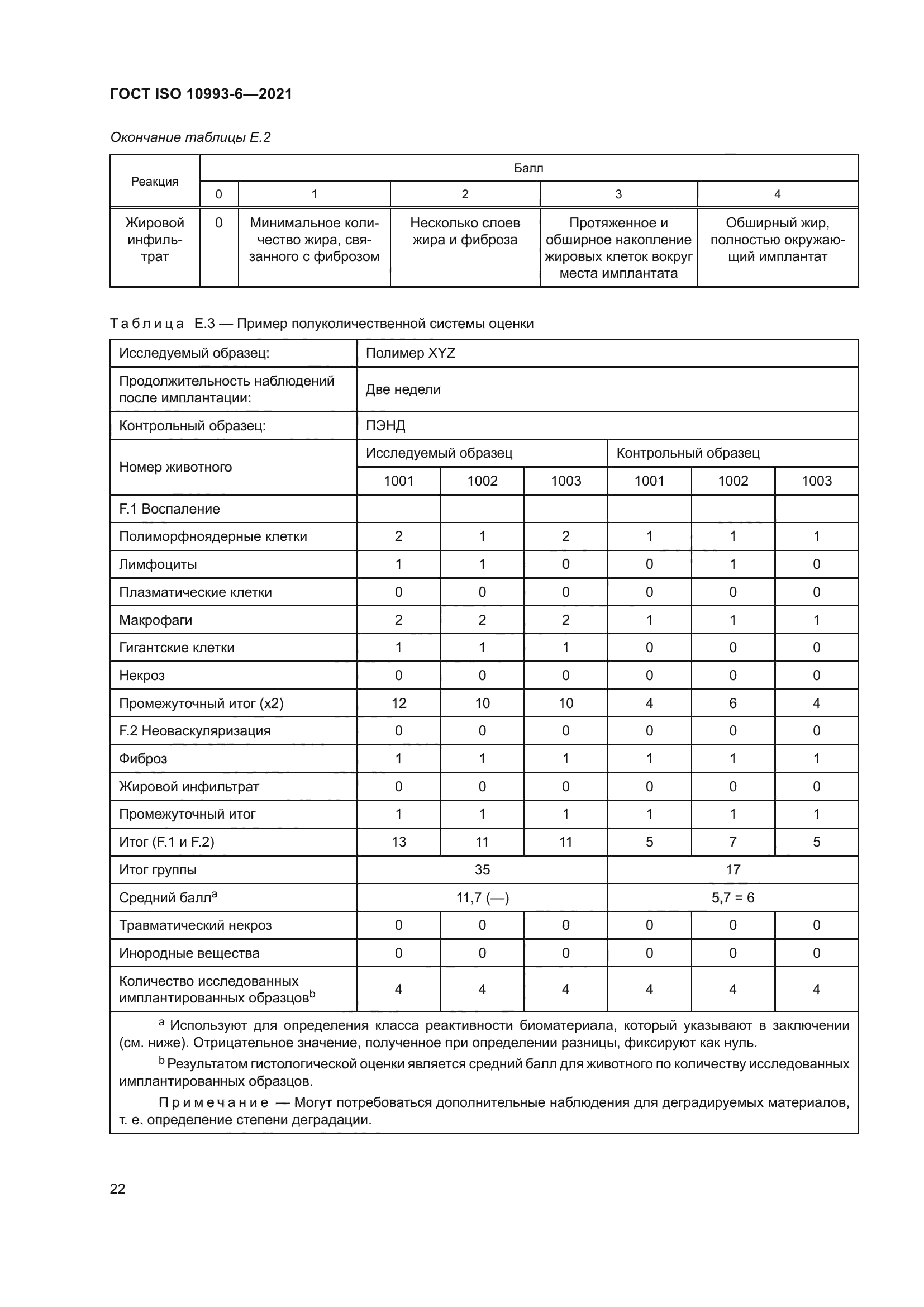
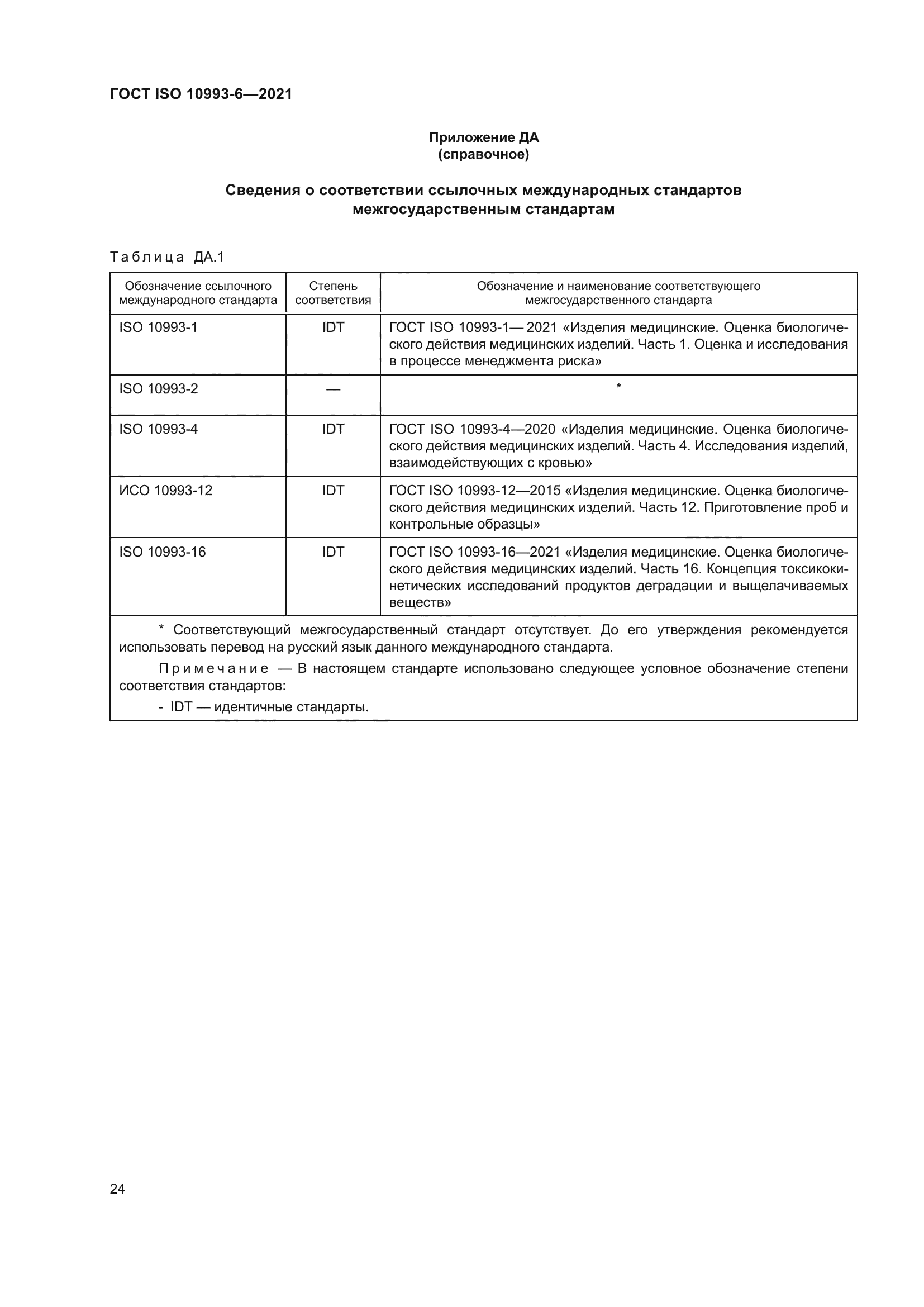
ГОСТ ISO 10993-6-2021