Государственное санитарно-эпидемиологическое нормирование Российской Федерации
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Санитарно-паразитологическое исследование воды хозяйственного и питьевого использования
Методические указания
МУК 4.2.964-00
Минздрав России
Москва · 2000
Санитарно-паразитологическое исследование воды хозяйственного и питьевого использования: Методические указания. - М.: Федеральный центр госсанэпиднадзора Минздрава России, 2000.
1. Подготовлены коллективом авторов: Г.И. Новосильцев (к.м.н.), Н.А. Романенко (д.м.н., академик РАЕН), В.А. Рябченко (к.б.н.), Г.С. Горяинова, Т.А. Семенова (к.б.н.), М.Е. Батаева (к.м.н.), Ю.А. Рахманин (д.м.н., академик РАМН), Р.Э. Михайлова (д.м.н.) - ИМПиТМ им. Е.И. Марциновского Минздрава России, НИИКВОВ АКХ им. К.Д. Памфилова, НИИЭЧиГОС им. А.Н. Сысина РАМН. Использованы материалы, разработанные Н.А. Русановой (к.м.н), Г.Л. Медришем (к.т.н.) - НИИКВОВ АКХ им. К.Д. Памфилова.
2. Утверждены и введены в действие Главным государственным санитарным врачом Российской Федерации 22 марта 2000 г.
3. С введением настоящих методических указаний утрачивают силу МУК 4.2.668-97 «Санитарно-паразитологическое исследование воды» и раздел «Контроль качества питьевой воды по паразитологическому показателю (содержание цист лямблий)», пункты 4, 5, 6 Информационно-методического письма «О дополнительных мерах по осуществлению контроля качества питьевой воды по микробиологическим и паразитологическим показателям» от 24 июля 1998 г. № 1100/1670-98-11.
СОДЕРЖАНИЕ
|
1. Назначение и область применения. 2 2.2. Чувствительность метода. 2 3. Оборудование и материалы.. 3 3.3. Приготовление рабочих растворов реактивов. 4 |
УТВЕРЖДАЮ
Главный государственный
санитарный врач Российской
Федерации - Первый заместитель
Министра здравоохранения
Российской Федерации
Г.Г. Онищенко
22 марта 2000 г.
Дата введения: 1 июня 2000 г.
Санитарно-паразитологическое исследование воды хозяйственного и питьевого использования
Методические указания
МУК 4.2.964-00
1. Назначение и область применения
1.1. Настоящие методические указания устанавливают метод лабораторного исследования качества воды хозяйственно-питьевого и культурно-бытового водопользования по паразитологическим показателям безопасности для здоровья человека, проводимого в порядке государственного санитарно-эпидемиологического надзора.
1.2. Методические указания предназначены для применения в лабораториях учреждений, осуществляющих государственный санитарно-эпидемиологический надзор, а также ведомственный лабораторный контроль качества окружающей среды на соответствие:
* СанПиН 2.1.4.559-96 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества»;
* СанПиН 2.1.2.568-96 «Гигиенические требования к устройству, эксплуатации и качеству воды плавательных бассейнов»;
* СанПиН 3.2.563-96 «Профилактика паразитарных болезней на территории Российской Федерации»;
* действующим санитарным правилам по охране поверхностных вод от загрязнения.
2. Методика санитарно-паразитологического исследования воды хозяйственного и питьевого использования
Методика предназначена для обнаружения в воде цист патогенных простейших кишечника (лямблий, амебы дизентерийной, балантидия) и яиц гельминтов, представляющих непосредственную угрозу для здоровья человека при их заглатывании, при осуществлении контроля качества воды по паразитологическим показателям в источниках хозяйственно-питьевого водоснабжения (поверхностных водоемах, ручьях, каптажах, колодцах, артезианских скважинах), в распределительной сети систем централизованного хозяйственно-питьевого водоснабжения, а также в водоемах рекреационного назначения*.
________________
* Настоящая методика не предназначена для индикации в воде ооцист криптоспоридий, т.к. для их определения требуются более сложная подготовка диагностического материала и использование дорогостоящих специальных тест-систем, не выпускаемых в настоящее время отечественными производителями.
2.1. Принцип методики
Цисты патогенных простейших кишечника и яйца гельминтов обнаруживаются при микроскопическом исследовании осадка, получаемого после центрифугирования не менее 4-кратно разведенного раствора флотанта с плотностью 1,26, в который искомые паразитарные агенты попадают из осадка, смываемого с мембранных фильтров после фильтрации через них исследуемой воды. Осаждение цист простейших и яиц гельминтов происходит за счет резкого снижения плотности флотанта, которая после разведения достигает 1,03 и менее, что ниже плотности паразитарных агентов. Плотность их приводится в разделе 7.
2.2. Чувствительность метода
Метод обладает чувствительностью с пределом обнаружения, равным единичным цистам лямблий на 1 л. Эффективность выделения цист лямблий данным методом зависит от исходной концентрации паразитарных патогенов в пробе, объема пробы, мутности, обилия фитопланктона и квалификации исполнителя.
3. Оборудование и материалы
3.1. Оборудование
3.1.1. Устройство для вакуумной фильтрации через мембранные фильтры: стационарное устройство, используемое для бактериологических и химических исследований в лабораториях водоочистных станций и центров госсанэпиднадзора: фильтровальный аппарат АФ или «Прибор вакуумного фильтрования» ПВФ-142/ЭМ. При отсутствии указанных стационарных установок может быть использован аппарат Гольдмана, состоящий из воронки Гольдмана, колбы для фильтрования под вакуумом номинальной вместимостью 2000-5000 мл (ГОСТ 6514-63), водоструйного насоса (ГОСТ 10696-75) или насоса Комовского, а в полевых условиях - ручного велосипедного насоса или других установок, прошедших гигиеническую оценку и имеющих гигиеническое заключение.
3.1.2. Мембранные фильтры с порами размером 3-5 мк и диаметром мембранного диска, соответствующим размерам фильтровальной ячейки фильтрующего устройства, - от 35 ± 2 мм и более. В качестве мембранных фильтров могут быть применены фильтрующие мембраны «Владипор» марки МФАС-СПА ТУ 6-55-221-15-18-98 (предназначены для использования в приборе ПВФ-142/ЭМ), «Миллипор», «Прагопор», «Сарториус» или другие с аналогичными свойствами, прошедшие гигиеническую оценку и имеющие гигиеническое заключение.
3.1.3. Лабораторная центрифуга типа ОПН-3, ОПН-8, ЦЛС-31М со сменным ротором или другие с аналогичными параметрами, обеспечивающие 1500-2500 об/мин (600-650 g), позволяющие центрифугировать пробы воды в центрифужных пробирках объемом 10-250 мл.
3.1.4. Холодильник электрический или газовый, поддерживающий температуру 4-6 °С.
3.1.5. Термостат электрический типа ТС-80 или аналогичный с автоматическим терморегулятором и термометром с ценой деления 0,2 °С.
3.1.6. Микроскоп биологический (типа МБИ, «Биолам» и др.), снабженный бинокулярной насадкой (АУ-12 и др.), препаратоводителем (типа СТ-12 и др.), имеющий объективы 10, 20, 40 и объектив 90-100х масляной иммерсии, а также желательно объектив 40-65х водной иммерсии, обеспечивающий увеличение от 100 до 1000 крат, имеющий объектив и укомплектованный окуляр-микрометром и объект-микрометром для калибровки первого, а также имеющий оптику фазового контраста, расширяющую возможности дифференциации цист от фитопланктона.
3.1.7. Осветитель ОИ-19 для микроскопа или другой аналогичный с мощностью лампы не менее 50 ватт.
3.1.8. Весы лабораторные для взвешивания в диапазоне 50 мг - 200 г равноплечные ручные (аптекарские) с разновесами, ВЛР-200 и др.
3.1.9. Денсиметры (ареометры) типа 1 (А1) с пределами измерения от 1,000 до 1,400 кг/м3 ГОСТ 1300-74.
3.1.10. Дозаторы пипеточные П1-0,1, П1-0,5, П1-1,0 мл ТУ 64-339-81 или аналогичные.
3.1.11. Пинцет анатомический.
3.1.12. Кисти мягкие из волоса белки, колонка или соболя для живописи №№ 12-18.
3.1.13. Стаканы стеклянные высокие с носиком (ВН) номинальной вместимостью 50-100 мл ГОСТ 10394-63.
3.1.14. Пробирки центрифужные градуированные (ПЦГ) емкостью 10 мл ГОСТ 1770-64.
3.1.15. Стекла предметные 25 ´ 75 мм.
3.1.16. Стекла покровные 18 ´ 18, 24 ´ 24 мм ГОСТ 6672-59.
3.1.17. Чашки биологические (Петри) ГОСТ 25336-82.
3.1.18. Часы песочные на 3-5 мин или часы сигнальные.
3.1.19. Штативы лабораторные для пробирок ТУ 64-1-707-80.
3.1.20. Емкости для отбора проб воды из нейтрального материала, пригодные для обеззараживания принятыми методами: канистры пластмассовые емкостью 5-10-20-25 л, стеклянные бутыли, фляги молочные металлические емкостью 30-35 л, эмалированные бидоны.
3.1.21. Цилиндры измерительные с носиком 1-100, 1-250, 1-500 ГОСТ 1770-74.
3.1.22. Колба 2-50-2, 2-100-2, 1-1000 ГОСТ 1770-74.
3.1.23. Капельница для многократной дозировки по Манну ГОСТ 9876-61.
3.1.24. Широкогорлые стеклянные или пластиковые флаконы емкостью 100-500 мл с притертыми или завинчивающимися крышками.
3.1.25. Спиртовка.
3.1.26. Иглы препаровальные.
3.1.27. Ножницы с прямыми браншами.
3.2. Реактивы
3.2.1. Формальдегид 40 %-ный (продажный).
3.2.2. Сульфат цинка семиводный (ZnSО4 7Н2О) х.ч.
3.2.3. Сахароза ч.д.а.
3.2.4. Сульфат магния (MgSО4) ч.д.а.
3.2.5. Тиосульфат натрия ГОСТ 244-76.
3.2.6. Вода дистиллированная ГОСТ 6709-72.
3.2.7. Натрий хлористый х.ч. ГОСТ 4233-77.
3.2.8. Йод кристаллический х.ч.
3.2.9. Калий йодистый (KI) х.ч.
3.2.10. Эозин сухой х.ч.
3.2.11. Метиленовый синий сухой х.ч.
3.2.12. Кислота хлористоводородная (НСl) 30 % х.ч.
3.2.13. Сульфат аммония [(NH4)2SО4] х.ч.
3.2.14. Сульфат железа [Fе2(SО4)3] х.ч.
3.2.15. Сульфат меди (CuSО4) x.ч.
3.2.16. Панкреатин сухой.
3.2.17. Сода двууглекислая (Na2CO3).
3.3. Приготовление рабочих растворов реактивов
3.3.1. Флотанты - любой из трех ниже названных:
* 33 %-ный водный раствор семиводного сульфата цинка: 331 г семиводного сульфата цинка растворяют в 1 дм3 кипящей дистиллированной воды;
* 30 %-ный водный раствор сахарозы: 300 г сахарозы ч.д.а. растворяют в 1 дм3 горячей (70-80 °С) дистиллированной воды;
* раствор, состоящий из смеси насыщенных растворов сульфата магния (250 г соли растворяют в 1 л воды при температуре 80 °С), тиосульфата натрия (300 г соли растворяют в 1 л кипящей воды) и дистиллированной воды, соотношение компонентов 3:3:1.
После приготовления флотанта и снижения его температуры до 18 °С контролируют его удельную плотность ареометром. Для выделения цист простейших и яиц гельминтов, представляющих непосредственную опасность заражения человека при заглатывании с водой, удельная плотность флотанта должна быть 1,25-1,26. Если величина этого показателя ниже, ее нужно откорректировать, добавляя более концентрированные растворы соответствующих веществ.
3.3.2. 3 %-ный раствор Люголя: 1,5 г йода кристаллического и 3 г калия йодистого растворяют в 100 мл дистиллированной воды (первым растворяют калий йодистый), выдерживают в темноте при 37 °С в течение 3 суток, после чего используют в работе.
3.3.3. 2 %-ный водный раствор формалина: 1 часть 40 %-ного формальдегида растворяют в 20 частях дистиллированной воды.
3.3.4. Жидкость Барбагалло: 3 %-ный формалин на физиологическом растворе (0,85 % хлорида натрия).
3.3.5. 1 %-ный водный раствор эозина.
3.3.6. Раствор, состоящий из 1 части метиленового синего и 50000 частей дистиллированной воды, готовят путем последовательных разведений.
3.3.7. Смесь (искусственный дуоденальный сок), состоящая из 0,5 г панкреатина, 0,9 г двууглекислой соды и 5 мл дистиллированной воды.
3.3.8. Раствор хлористоводородной кислоты 1 %-ный.
4. Отбор и хранение проб
Отбор проб питьевой воды и воды плавательных бассейнов по количеству и кратности проводят в соответствии с СанПиН 2.1.4.559-96 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества» и СанПиН 2.1.2.568-96 «Гигиенические требования к устройству, эксплуатации и качеству воды плавательных бассейнов».
Контроль воды подземных водоисточников по паразитологическим показателям может быть рекомендован при условии неоднократных неудовлетворительных микробиологических результатов исследования.
Количество проб и точек забора в распределительной сети утверждается по согласованию с санитарно-эпидемиологической службой при разработке рабочей программы с учетом численности водопотребителей.
Отбор проб воды производится в чистые емкости. Сосуды больших объемов - молочные фляги, металлические и пластмассовые ведра и т.п., которые тщательно промываются кипяченой водой и ополаскиваются отбираемой для анализа водой.
Пробы воды могут доставляться в лабораторию без обработки или, в целях облегчения их транспортирования, после предварительной обработки (концентрирования материала путем фильтрования на месте отбора проб, в лаборатории водопроводной станции и др.).
С этой же целью может быть использована методика первичной концентрации паразитарных патогенов с помощью таких коагулянтов, как сульфат аммония, сульфат железа, сульфат меди в дозе 0,1-0,3 г/л.
В пробу воды на месте отбора добавляют коагулянт, затем тщательно перемешивают и отстаивают 1-2 ч. После этого надосадочную жидкость удаляют, а осадок переносят в сосуд объемом 1 л и доставляют в лабораторию. Содержимое сосуда вновь отстаивают 1-2 ч, а осадок после удаления надосадочной жидкости переносят в центрифужные пробирки 10-50 мл (в зависимости от объема осадка) и центрифугируют в течение 5 мин при 1500 об/мин. Надосадочную жидкость сливают, а к осадку добавляют 3 мл 1 %-ного раствора хлористоводородной кислоты для растворения хлопьев коагулянта, перемешивают и центрифугируют в таком же режиме. Надосадочную жидкость удаляют, а осадок обрабатывают по нижеописанной методике.
Пробы, не прошедшие предварительную обработку, могут храниться при температуре 15-20 °С не более двух суток.
В случае если первичная обработка пробы воды (фильтрование) проводилась вне лаборатории, использованные фильтры помещают в широкогорлый флакон или стеклянную банку, добавляют 30-50 мл исходной воды; закрывают флакон или банку завинчивающейся или притертой крышкой, маркируют, указывают дату, место отбора, количество профильтрованной воды и транспортируют в лабораторию для дальнейшего исследования. При невозможности исследования в день отбора материал хранят при 4 °С не более суток; при отсутствии необходимости определения жизнеспособности цист кишечных простейших и яиц гельминтов материал хранят при 4 °С не более 3-4 суток после добавления в него формальдегида с таким расчетом, чтобы концентрация его в суспензии составила 2 %.
5. Ход исследования
Перед началом фильтрации мембранные фильтры должны быть подвергнуты 10-минутному кипячению в дистиллированной воде для удаления посторонних частиц из пор фильтров, препятствующих оптимальному проведению процесса фильтрации.
Питьевая вода исследуется в объеме не менее 50 л, вода водоисточников - в объеме не менее 25 л.
Исследуемый объем воды с помощью фильтровального устройства пропускают через мембранные фильтры (см. раздел «Оборудование и материалы»). По мере замедления процесса фильтрации из-за загрязнения фильтра его заменяют новым, а использованные фильтры с осадком помещают в широкогорлую емкость (стаканчики ВН) с помощью чистого пинцета (предварительно прокипяченного или обработанного спиртом) и заливают исследуемой водой в количестве 30-50 мл для сохранения их во влажном состоянии.
По окончании фильтрации всей пробы осуществляется смыв осадка с фильтров. Каждый фильтр чистым пинцетом опускается в стаканчик с дистиллированной водой; придерживая пинцетом фильтр, осторожно смывают осадок при помощи чистой мягкой кисточки, затем фильтр еще раз прополаскивают в другой порции дистиллированной воды. При использовании фильтров с диаметром диска более 35 мм рекомендуется разрезать их чистыми ножницами на несколько частей для удобства и более эффективной отмывки. Данную операцию удобнее проводить в чашках Петри.
По окончании отмывки всех фильтров кисточку также тщательно прополаскивают в небольшом объеме дистиллированной воды (5-10 мл). Процедура отмывки фильтров и кисточки требует особой тщательности во избежание возможных потерь цист простейших и яиц гельминтов.
Весь полученный смыв центрифугируют в пробирках емкостью 10 мл или более в течение 5 мин при 1500 об/мин (600 g). Надосадочную жидкость сливают. При отсутствии необходимости определения жизнеспособных цист и яиц гельминтов осадок помещают в 6-8 мл 2 %-ного водного раствора формалина и размешивают.
Если предполагается определение жизнеспособности паразитарных патогенов, к осадку добавляют воду для отмывания его. Суспензии вновь центрифугируют в прежнем режиме, после чего удаляют надосадочную жидкость, а к осадку добавляют 3 мл одного из флотантов и тщательно перемешивают чистой стеклянной палочкой. Центрифугируют 5 мин при 2000 об/мин, или 10 мин при 1500 об/мин, после чего надосадочную жидкость переносят пипеткой в центрифужную пробирку, разбавляют не менее чем в 4 раза дистиллированной водой. Центрифугируют в прежнем режиме, удаляют надосадочную жидкость, а из осадка готовят препараты на предметных стеклах.
В зависимости от задач исследования препарат не окрашивают или подвергают окраске. Если нужно провести только подсчет паразитарных агентов без определения их жизнеспособности, препарат не окрашивается или его окрашивают 1 каплей 3 %-ного раствора Люголя. Вероятную жизнеспособность цист лямблий можно определять, окрашивая препарат 1 каплей 1 %-ного водного эозина.
Готовые препараты накрывают покровным стеклом и микроскопируют, сканируя всю площадь покровного стекла, с использованием 100-600-кратного увеличения (объективы - 10х, 40х, окуляры - 10х, 15х) сухой оптической системы. Для определения более тонких внутренних структур цист простейших, имеющих значение для их идентификации, используют масляно-иммерсионный 90-100-кратный объектив или фазово-контрастное микроскопирование. Таким образом микроскопируется весь объем полученного осадка. При необходимости проводят визуальную оценку вероятной жизнеспособности цист лямблий и других простейших, а также яиц гельминтов.
Микроскопирование и идентификация паразитарных патогенов в пробах воды должны выполняться специалистом, умеющим отличать их от фитопланктона и яиц гидробионтов.
На обработку одной пробы требуется не менее 10 человеко-часов. Результат анализа может быть получен не ранее чем на следующий рабочий день после доставки пробы.
6. Оценка результатов исследования
При микроскопировании подсчитывают число паразитарных патогенов во всем объеме осадка, что соответствует их числу во всей исследованной пробе. Одновременно определяют систематическую принадлежность обнаруживаемых паразитических организмов; идентификация их проводится по следующим признакам.
Цисты лямблий - овальная форма, размеры 10-14 мк в длину и 6-10 мк в ширину; незрелые цисты содержат 2 ядра, зрелые - 4; ядра находятся у переднего полюса цисты. Оболочка цисты отчетливо выражена и большей частью отстает от протоплазмы, что является одним из характерных отличий цист лямблий от цист других простейших. Внутри цисты вдоль по средней линии проходят две опорные нити - аксостили; в косом или поперечном направлении лежат характерные парабазальные тела (2 - в незрелых и 4 - в зрелых цистах), нередко заметен сложно свернутый жгутиковый аппарат. Плотность 1,06-1,09.
Цисты амебы дизентерийной - округлая, редко овальная форма, размеры от 10 до 16 мк; молодые цисты содержат 1-2 ядра с центрально расположенной звездчатой кариосомой, зрелые цисты содержат 4 ядра, в зрелых четырехъядерных и незрелых двухъядерных цистах ядра расположены в различных плоскостях; оболочка цист двухконтурная в виде светлого прозрачного ободка. Одноядерные цисты почти всегда содержат в большом количестве гликоген, который в виде крупной вакуоли с нерезкими очертаниями занимает обычно больше половины цисты и раствором Люголя окрашивается в темно-коричневый цвет. Плотность 1,08-1,1.
Следует иметь в виду, что в природной воде могут встречаться цисты Entamoeba dispar, идентичные цистам дизентерийной амебы, но не обладающие патогенными свойствами для человека. В этом случае следует в протоколе исследования отмечать находки без указания видовой принадлежности таких цист. Для идентификации их необходимы дополнительные специальные исследования. Однако и в данной ситуации должна быть настороженность в отношении эпидемического неблагополучия.
Цисты балантидия кишечного - правильная круглая форма, плотная двухконтурная оболочка, средний размер около 50 мк. Внутри цист имеется крупное бобовидное ядро. Протоплазма однородна, гликоген в ней распылен равномерно. Под оболочкой в некоторых цистах заметно углубление, представляющее собой редуцированный цитостом - органеллу, соответствующую началу пищеварительной трубки многоклеточных. Ресничный покров отсутствует. Плотность 1,1.
Яйца аскариды человеческой (свиной) - оплодотворенные яйца овальной или шаровидной формы. Наружная оболочка крупнобугристая, толстая, коричневого цвета (иногда встречаются яйца без наружной бугристой оболочки). Размеры яиц 50-70 ´ 40-50 мк. Яйцеклетка мелкозернистая и шаровидная, расположена в центре яйца. Плотность 1,10-1,14.
Зрелое яйцо (способное заразить при заглатывании) содержит внутри подвижную личинку, свернувшуюся кольцевидно или перекрестно.
Яйца токсокары (аскариды собачьей) - почти круглые, 65-75 мк в диаметре, с нежноячеистой наружной толстой оболочкой темно-коричневого цвета, внутри яйца видна округлая зародышевая клетка. Зрелые инвазионные яйца содержат внутри подвижную свернувшуюся кольцом или перекрестно личинку. Плотность 1,22.
Яйца власоглава - симметричные, имеют лимонообразную или бочонковидную форму. Оболочка темно-коричневая, толстая. На обоих полюсах имеются светлоокрашенные пробковидные образования. Размеры яиц 50-54 ´ 23-26 мк. В зрелых инвазионных яйцах видна подвижная личинка. Плотность 1,16-1,22.
Яйца острицы - асимметричные. Одна сторона заметно уплощена, другая выпукла. Размеры яиц 50-60 ´ 30-32 мк. Оболочка тонкая, гладкая и бесцветная. Яйца могут быть на различных стадиях созревания, до головастикоподобной личинки включительно. Плотность 1,14.
Яйца цепня карликового - оболочка яйца бесцветная, тонкая, гладкая. Форма овальная. Размер яиц 40 ´ 50 мк, эмбриофора (зародыш) почти шаровидная (29 ´ 30 мк), с длинными нитевидными придатками на полюсах. Плотность 1,12.
Онкосферы тениид (цепня свиного и эхинококков) - овальная форма, размеры 31-40 ´ 2-30 мк; имеют тонкую наружную оболочку и толстую радиально-исчерченную внутреннюю оболочку темно-коричневого цвета. Внутри онкосферы находится зародыш-эмбриофора с шестью зародышевыми крючьями. Плотность 1,24.
Отрицательный результат анализа не гарантирует отсутствия паразитарных патогенов в пробе, поэтому результат исследования должен представляться в протоколе термином «не обнаружены». Обнаружение даже одного экземпляра паразитарных патогенов в 1 пробе питьевой воды указывает на эпидемиологическое неблагополучие в системе питьевого водоснабжения.
7. Визуальная оценка вероятной жизнеспособности цист патогенных простейших кишечника и яиц гельминтов
Оценка вероятной жизнеспособности цист патогенных простейших и яиц гельминтов визуально проводится по следующим критериям, подтверждающим жизнеспособность:
* целостность наружной оболочки (отсутствие ее разрывов, вдавлений, выбухания, сморщивания);
* четкая внутренняя структура цисты или яйца: у цист - четко видны ядра, отсутствует зернистость. У цист лямблий, кроме того, видны аксостили, жгутиковый аппарат, медиальное тело. Для яиц гельминтов (аскарид, токсокар, власоглавов, остриц) характерно наличие дробящейся зародышевой клетки или подвижной личинки. У живых онкосфер тениид и карликового цепня зародышевые крючья расположены попарно, а у мертвых - беспорядочно;
* при окраске препарата 1 %-ным водным раствором эозина жизнеспособные цисты лямблий не воспринимают окраску в течение первых 5 мин, мертвые окрашиваются сразу же в розовый цвет. Поэтому указанную окраску следует использовать до микроскопии только в том случае, когда на изучение препарата потребуется не более 5 мин. Часто просмотр мазка длится 15-30 мин, тогда 1 %-ный водный эозин можно вводить аккуратно, не сдвигая препарат, под покровное стекло пипеткой в точке, где при предварительном просмотре уже обнаружены цисты лямблий;
* жизнеспособность онкосфер тениид и яиц аскарид, содержащих личинку, определяют путем окрашивания препарата смесью, содержащей метиленовый синий (см. п. 4.3.6). Живые онкосферы тениид, а также личинки, находящиеся внутри яиц аскарид, не окрашиваются в течение первых 15 мин. Мертвые окрашиваются сразу в синий цвет;
* жизнеспособность онкосфер тениид можно также определить по движению зародышей при воздействии на них пищеварительными ферментами. Для этого исследуемый осадок, содержащий онкосферы, помещают на часовое стекло в искусственный дуоденальный сок (см. п. 4.3.7). Стекло ставят в термостат при 36-38 °С на 4 ч. Живые зародыши освобождаются от оболочек, а мертвые - нет;
* оболочки жизнеспособных онкосфер растворяются также в подкисленном пепсине (рН 5-6) и в щелочном растворе трипсина (рН 8-8,5) через 6-8 ч при температуре 38 °С.
* Схема выполнения методики санитарно-паразитологического исследования воды и изображения определяемых с ее помощью цист кишечных простейших и яиц гельминтов представлены в приложениях 1, 2, 3.
Приложение 1

Схема методики санитарно-паразитологического исследования воды (последовательность операций)
Приложение 2

Цисты лямблий

Цисты амебы дизентерийной

Циста балантидия кишечного

Яйца аскариды человеческой (свиной),
слева - оплодотворенное яйцо,
справа - инвазионное

Яйца власоглава
слева - свежевыделенное,
справа - инвазионное

Яйца аскариды собачьей (токсокары)
вверху - яйцо на начальной стадии развития,
внизу - инвазионное
Цисты патогенных кишечных простейших и яйца гельминтов, определяемые методикой санитарно-паразитологического исследования воды
Приложение 3

Яйцо острицы

Онкосфера тенинд
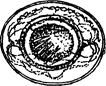
Яйцо цепня карликового
Яйца гельминтов, определяемые методикой санитарно-паразитологического исследования воды