МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ СССР
|
«УТВЕРЖДАЮ» Заместитель Главного государственного санитарного врача СССР А.И. ЗАИЧЕНКО 17 октября 1980 г. № 2260-80 |
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ГИГИЕНИЧЕСКОМУ КОНТРОЛЮ ЗАГРЯЗНЕНИЯ
МОРСКОЙ СРЕДЫ
Москва - 1981 год
1. ВВЕДЕНИЕ
«Правила охраны поверхностных вод от загрязнения сточными водами» № 1166-74 и «Правила санитарной охраны прибрежных вод морей» № 1210-74 предусматривают предупреждение и устранение загрязнения рек бассейнов и прибрежных районов морей с целью создания благоприятных гигиенических условий хозяйственно-питьевого (в том числе, после опреснения), оздоровительно-лечебного и культурно-бытового использования населением пресных и морских вод. Действующие «Правила санитарной охраны прибрежных вод морей» и «Инструктивно-методические указания по устройству, эксплуатации и санитарному контролю плавательных бассейнов с морской водой» № 1437-76 включают принципиально новое определение границ прибрежных охраняемых районов морей с зонированием в зависимости от характера и интенсивности организованного водопользования, дифференцированные требования к составу и свойствам морской воды района водопользования и зоны его санитарной охраны, основные требования и нормативы к использованию морских вод в оздоровительно-лечебных целях.
Разработанные методические указания предназначены для органов и учреждений санитарно-эпидемиологической службы, научно-исследовательских институтов и кафедр гигиенического профиля, а также других учреждений, занятых вопросами охраны морской среды, и должны способствовать дальнейшему совершенствованию их деятельности по разработке и контролю за выполнением мер, направленных на предотвращение загрязнения морей.
Методические указания разработаны Институтом общей и коммунальной гигиены им. А.Н. Сысина АМН СССР (В.Г. Субботин, Е.П. Сергеев, Ю.А. Рахманин, Т.З. Артемова, Р.М. Абиева, В.И. Немыря, А.Е. Недачин, Ю.Н. Никитина, А.И. Мельникова) и Министерством здравоохранения СССР (З.В. Левашова).
При подготовке указаний приняты предложения Всесоюзного НИИ гигиены и токсикологии пестицидов, полимерных и пластических масс Минздрава СССР, Московского НИИ гигиены им. Ф.Ф. Эрисмана и Ростовского-на-Дону НИИ эпидемиологии, микробиологии и гигиены Минздрава РСФСР, Киевского НИИ общей и коммунальной гигиены им. А.Н. Марзеева Минздрава Украинской ССР, Таллинского НИИ эпидемиологии, микробиологии и гигиены, Института экспериментальной и клинической медицины, Республиканской, Пярнуской и Харьюской СЭС Минздрава Эстонской ССР, СЭС Красноводской области Минздрава Туркменской ССР, НИИ эпидемиологии, микробиологии и гигиены Минздрава Литовской ССР, НИИ вирусологии, микробиологии и гигиены им. Г.М. Мусабекова Минздрава Азербайджанской ССР, Государственного океанографического института Госкомитета СССР по гидрометеорологии и контролю окружающей природной среды, Военно-медицинской академии им. С.М. Кирова МО СССР.
2. ОСНОВНЫЕ ПОЛОЖЕНИЯ
2.1. Указания распространяются на районы морей, используемые в настоящее время и предусматриваемые на перспективу для купания, водного спорта и культурного отдыха с устройством пляжей и водных станций в границах населенных мест, пригородов, курортов (санаториев, домов отдыха, пансионатов) пионерских лагерей, туристских баз, кемпингов, палаточных городков и других баз длительного и кратковременного отдыха населения, а также на водозаборы плавательных бассейнов, водолечебниц, ванн и других бальнеологических сооружений и опреснительных установок с использованием морских вод в оздоровительно-лечебных и хозяйственно-питьевых целях.
2.2. Государственный санитарный контроль за качеством прибрежных вод моря осуществляется органами и учреждениями санитарно-эпидемиологической службы в границах прибрежного охраняемого района моря и района водопользования по показателям, предусмотренным действующими правилами и инструктивно-методическими указаниями, с использованием рекомендаций настоящих указаний.
2.3. При осуществлении контроля промышленного и бытового загрязнения прибрежных вод из микробиологических показателей определяющее санитарно-показательное значение имеют лактозоположительные бактерии группы кишечных палочек. Наиболее адекватными показателями вирусного загрязнения являются фаги кишечных палочек.
2.4. В целях обеспечения благоприятных гигиенических условий морского водопользования, исключающих возможность ухудшения органолептических свойств воды и появления постороннего запаха и привкуса пищевых продуктов моря научно-исследовательским институтам и кафедрам гигиенического профиля рекомендуется корректировка ПДК вредных веществ, принятых по органолептическому признаку вредности в «Правилах охраны поверхностных вод от загрязнения сточными водами» № 1166-74.
Примечания:
1. Перечень вредных веществ, для которых устанавливается практический порог необычного для морских вод запаха, определяется в зависимости от конкретной санитарной обстановки в районе водопользования и по бассейну моря в целом.
2. Утверждение ПДК вредных веществ в морской воде производится в установленном порядке.
2.5. При оценке потенциальной опасности для здоровья населения вредных веществ, ПДК которых установлена для пресных водоемов по токсикологическому признаку вредности, порядок приоритетности выбора химических веществ, подлежащих контролю в морской воде, определяется (с учетом данных литературы) в следующей последовательности:
- Вещества, обладающие кожно-резорбтивным и раздражающим действием, и стабильные высококумулятивные вещества, способные накапливаться в пищевых продуктах морского происхождения (в особенности, вещества, хорошо растворимые в жирах и плохо растворимые в воде), допустимые концентрации которых в продуктах питания наиболее низки или их содержание в продуктах питания не допускается.
- Вещества, вызывающие отдаленные биологические эффекты (мутагенный, тератогенный, канцерогенный, эмбриотоксический, гопадотоксический, аллергенный, героэффект), или другие выраженные неблагоприятные последствия.
- Тяжелые металлы и их органические соединения, а также наиболее распространенные химические загрязнители - нефть и нефтепродукты, фенолы, ПАВ, пестициды, биогенные вещества и др.
Примечания:
1. Последовательность выбора подлежащих контролю отдельных вредных веществ устанавливается по степени их опасности для биологических ресурсов и здоровья населения, а также с учетом наличия методов индикации и количественного определения веществ в морской воде и пищевых продуктах моря.
2. При выборе подлежащих контролю вредных веществ в морской среде необходимо дополнительно учитывать способность веществ к трансформации и деструкции в водной среде, степень накопления в пищевых цепях (гидробионтах), степень контакта населения с этими веществами при купании и употреблении в пищу продуктов моря (по данным литературы).
3. ОБЩАЯ СХЕМА И ОРГАНИЗАЦИЯ КОНТРОЛЯ
3.1. Гигиеническая характеристика прибрежного охраняемого района моря должна включать основные данные о санитарно-технических условиях (состоянии водоснабжения, канализования и др.) в приморских городах, курортах и других населенных местах; сведения о качестве морской воды, существующих и потенциальных источниках загрязнения морской среды; данные о связи заболеваемости местного населения и отдыхающих с основными видами морского водопользования.
3.2. Организация наблюдений осуществляется в зависимости от санитарной ситуации и условий морского водопользования. Обоснованию выбора районов наблюдений, в соответствии с действующими правилами, должно предшествовать санитарно-топографическое обследование побережья в границах прибрежного охраняемого района моря.
3.3. Месторасположение точек контроля определяется функциональным зонированием района водопользования. При этом наблюдения в отдельных точках должны характеризовать санитарное состояние определенной функциональной зоны - пляжей, зон культурно-бытового водопользования; зоны водозаборов для оздоровительно-лечебного и хозяйственно-питьевого (после опреснения) использования морских вод; участков, используемых в оздоровительных и спортивных целях, для отдыха на воде, любительского лова рыбы и др.
3.4. Точки отбора проб морской воды выбирают:
- в зависимости от ширины и протяженности зоны культурно-бытового водопользования (не менее двух точек в местах массового купания);
- в местах расположения морских водозаборных сооружений;
- на участках оздоровительно-спортивного использования (минимум 1 точка);
- на границе района водопользования по направлению к источнику загрязнения (1 точка).
3.5. Для определения границ зон, подверженных влиянию источников загрязнений, в том числе подлежащих ликвидации выпусков сточных вод, в отдельных случаях рекомендуется динамичный отбор контрольных проб морской воды у погруженных поплавков, движение которых соответствует скорости и направлению перемещения поверхностного слоя загрязнений морской воды (2 деревянных крестообразных поплавка с отрегулированным грузом и сигнальным флажком; 4 связки из двух заполненных водой бутылок, почти полностью погруженных в воду; погруженный буек с сигнальным флажком).
Примечания:
1. Отбор проб морской воды производится тотчас, на середине расстояния между поплавками, опущенными в месте поступления «пятна» загрязнения от организованных сбросов сточных вод, а также через 15, 30, 60 минут и в дальнейшем через каждый час в течение 6 - 7 часов.
В зависимости от местных условий, источника и интенсивности загрязнения, при установлении влияния загрязнения на зоны оздоровительно-лечебного, культурно-бытового и хозяйственно-питьевого (после опреснения) водопользования интервалы между выемкой проб и общая продолжительность наблюдений могут быть увеличены или сокращены.
2. Расстояние S (в метрах), пройденное дрейфующими поплавками, может определяться расчетным путем по формуле:
![]()
где К - ветровой коэффициент,
V - скорость ветра в м/сек,
t - время дрейфа поплавков в секундах.
Величина ветрового коэффициента определяется по гидрометеорологическим справочникам и может быть уточнена на гидрометеорологической станции. При невозможности определения ветрового коэффициента может быть использована формула Н.Н. Струйского с коэффициентом В.В. Шулейкина, предложенная В.Я. Яковенко (1959):
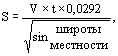
где ![]() = 0,84
- для южных широт и 1,0 - для северных широт.
= 0,84
- для южных широт и 1,0 - для северных широт.
Во время дрейфа скорость ветра измеряется ручным чашечным анемометром в начале работы и далее через каждый час.
3. Расстояние от точек отбора проб до береговой полосы определяется также ориентировочно, визуально или по скорости и времени его прохождения используемыми плавсредствами (катером, глиссером, моторной лодкой и т.д.).
3.6. Пробы воды отбирают с поверхности 2 - 3 раза в месяц в течение всего периода морского водопользования: в ранние утренние часы до начала массового купания (контроль), в период купания и по показаниям. Для оценки степени и характера загрязнения, не связанного с морским водопользованием населения, производится разовый отбор проб воды до начала купального сезона.
3.7. При возможности вторичного загрязнения прибрежных вод параллельно производится отбор проб донных отложений. Для мелководных районов водопользования, где снижение прозрачности морской воды обусловлено местными гидрофизическими, топографо-гидрологическими и другими природно-климатическими факторами, отбор и исследование проб донных отложений является обязательным.
3.8. Факторами, определяющими выбор контрольного участка для отбора проб воды в прибрежном охраняемом районе, являются санитарная обстановка, условия водопользования природные особенности отдельных морей.
Примечание:
Для прибрежных районов морей со специфическими топографо-гидрологическими и другими природными особенностями, способствующими ухудшению санитарных условий вследствие концентрации загрязнений в прибрежной полосе, контрольная точка для отбора проб воды может быть за границами этих районов.
3.9. Оценка качества морской воды района водопользования и поясов зоны его санитарной охраны дается по показателям состава и свойств воды, предусмотренным «Правилами санитарной охраны прибрежных вод морей» № 1210-74: «плавающие примеси», «запах», «прозрачность», «окраска», «БПК5», «возбудители инфекционных заболеваний», «число лактозоположительных бактерий группы кишечных палочек в 1 л воды (коли-индекс)», «вредные вещества».
3.10. Оценка степени и характера превышающего установленные нормативы органического загрязнения морских вод производится с учетом общей санитарной обстановки и дополнительных прямых и косвенных показателей загрязнения воды (БПК полное и др.). При загрязнении прибрежных вод сточными водами целлюлозно-бумажной промышленности, содержащими биохимические трудноокисляемые вещества, оценка степени и характера загрязнения морской воды производится с использованием бихроматной (ХПК) и перманганатной окисляемости и величины соотношения БПК5 и окисляемости.
3.11. Определение биоаккумулируемых в морской среде вредных химических веществ (хлорированные дифенилы, тяжелые металлы, радионуклеиды и др.) осуществляется в донных отложениях, придонных организмах и пищевых продуктах морского происхождения при превышении нормативных показателей химического загрязнения морской воды.
3.12. Отбор проб на содержание биоаккумулируемых веществ производится из верхнего 5 см слоя грунта на доступных глубинах в границах функциональных зон района водопользования, не реже 1 раза в сезон (в 2 - 3 месяца).
3.13. Определяющими особенностями контроля загрязнения морской среды пестицидами являются условия их неравномерной миграции в водные объекты в течение года, усиливаемые влиянием поверхностного и коллекторно-дренажного стока, сорбцией пестицидов в др.
В соответствии с рекомендуемой схемой (п.п. 3.2 - 3.9) контроль за содержанием пестицидов производится в периоды наиболее интенсивного использования морского побережья (не реже 1 раза в месяц) в границах функциональных зон района водопользования и в устьях рек. Дополнительным контролем при этом служат аналогичные пробы, отобранные до начала применения пестицидов в текущем году (в апреле - для южных широт и не позднее середины мая - для северных).
Примечания:
1. При исследовании проб морской воды на остаточные количества пестицидов в каждом конкретном случае дополнительно учитывается номенклатура и количество применяемых пестицидов в бассейне моря и на водосборной площади рек, впадающих в море.
2. В целях регламентации и контроля применения пестицидов при прямом внесении в водоемы (водных гербицидов, ларвицидов, ихтиоцидов и др.) применение пестицидов в этих целях в каждом конкретном случае подлежит обязательному согласованию с органами санитарно-эпидемиологической службы, органами по регулированию использования и охране вод и охраны рыбных запасов.
Ответственность за соблюдение правил применения пестицидов и контроль за их содержанием в водоемах несут организации, осуществляющие применение этих веществ.
3.14. Контроль качества морской воды акватории портов и бухт осуществляется в четырех точках, две из которых расположены на границе акватории, в местах возможной наибольшей концентрации загрязнения от судов (как правило, в центральной части) и в 500 м от выхода из порта, бухты.
3.15. Отбор проб морской воды в эстуарийных участках моря производится в 500 м от устья реки вверх по течению, в устьевом участке и далее по рекомендуемым створам наблюдений (п.п. 3.2 - 3.9).
3.16. Организация и проведение гигиенического контроля за качеством морских вод в местах водозаборов морской воды для опреснения производится в соответствии с методическими указаниями по применению и эксплуатации различных типов опреснительных установок, утвержденными Минздравом СССР, и требованиями действующих ГОСТов.
3.17. Оценка качества исходной морской воды, используемой (после опреснения) в хозяйственно-питьевых целях, дается по показателям состава и свойств воды, регламентируемых ГОСТом № 17.1.3.03-77 «Охрана природы. Гидросфера. Правила выбора и оценки качества источников централизованного хозяйственно-питьевого водоснабжения» и «Правилами санитарной охраны прибрежных вод морей» № 1210-74.
3.18. В местах расположения водозаборов опреснительных установок при коли-индексе морской воды, превышающем по числу лактозоположительных бактерий группы кишечных палочек - 1000, а также при показателях химического загрязнения воды, превышающих их предельно допустимые концентрации в воде, необходимо определение прямых показателей безопасности воды в эпидемическом отношении - патогенных энтеробактерий.
3.19. В местах расположения водозаборов для оздоровительно-лечебного использования морских вод и опреснительных установок хозяйственно-питьевого водоснабжения отбор проб воды производится из горизонта, соответствующего заглублению оголовков водозаборов, не реже 1 раза в месяц.
3.20. Организация контроля качества, условия, частота и объем анализа морских вод, используемых в оздоровительно-лечебных целях, определяются действующими «Инструктивно-методическими указаниями по устройству, эксплуатации и санитарному контролю плавательных бассейнов с морской водой» № 1437-76.
3.21. Физико-химические исследования производят методами, принятыми для анализа морских и высокоминерализованных вод в соответствии с методическими разработками, утвержденными или согласованными Госкомитетом СССР по гидрометеорологии и контролю окружающей природной среды.
3.22. Организация и проведение контроля за загрязнением прибрежных охраняемых районов морей от судов и за соблюдением мер, определяемых «Международной конвенцией по предотвращению загрязнения с судов 1973 года», Конвенцией по защите морской среды района Балтийского моря 1974 года», положениями «Перечня веществ, вредных для здоровья людей или для живых ресурсов моря, сброс которых запрещается, и норм предельно допустимой концентрации этих веществ в сбрасываемых смесях» и дополнением к указанному перечню, утвержденными соответственно 5 - 10 ноября 1974 года и 13 - 17 января 1979 года Министерством мелиорации и водного хозяйства СССР, Министерством здравоохранения СССР и Министерством рыбного хозяйства СССР, осуществляются в части, касающейся охраны от загрязнения районов водопользования.
Приложение
4. МЕТОДИЧЕСКИЕ ПРИЕМЫ
4.1. Оценка влияния вредных веществ промышленных сточных вод на микроорганизмы
Оценка возможного неблагоприятного влияния вредных химических веществ промышленных или промышленно-бытовых сточных вод на процессы микробного самоочищения в морской среде (на рост и развитие нормируемых санитарно-показательных и патогенных микроорганизмов) проводится в лабораторных условиях.
В этих целях моделируются наиболее характерные условия, которые создаются в прибрежных морских водах в районе водопользования при сбросе сточных вод, а именно: кратность начального разбавления сточных вод, температурный режим, состав и количество кишечной микрофлоры и т.п.
Отбирают среднесуточную пробу сточных вод и морскую воду в контрольной точке вне влияния загрязнений. Пробы морской воды и сточные воды фильтруют через ватно-марлевый фильтр.
Исследования рекомендуется проводить в модельных водоемах в следующих вариантах:
1. Сточная вода, разбавленная морской водой примерно в такое количество раз, как начальное разбавление в месте ее выпуска в море.
2. Разбавление сточной воды в меньшее число раз (3 - 5 раз) для оценки влияния содержащегося в стоке комплекса вредных веществ в заведомо неблагоприятных условиях (при локализации сточных вод, например, у места выпуска, в заливах, ограниченных участках и т.п.).
3. Разбавление сточной воды во столько раз, чтобы ведущие группы вредных веществ содержались в воде модельного водоема примерно на уровне ПДК.
Примечание:
В случаях совпадения или близкого значения степени разбавления в каких-либо из 3-х вариантов число опытных водоемов может быть уменьшено.
Контрольный водоем - морская вода, которая была взята для разбавления, с добавлением имитированного фекального стока с таким расчетом, чтобы содержание легкоусвояемых органических веществ в воде было примерно на уровне 1-го варианта. Имитированный сток готовят из фекалий, смешивая их с водопроводной водой и профильтровывая затем через ватно-марлевый фильтр.
В модельные водоемы вносят суточные культуры микроорганизмов, выращенных на питательном агаре в следующих количествах:
Escherichia coli - 1 · 104 кл/мл,
Streptococcus faecalis - 1 · 103 кл/мл,
Фаг кишечных палочек - ДНК фаг T1 E. coli В - 1 · 10 кл/мл,
Salmonella typhimurium - 10 - 50 кл/мл,
вирус полиомиелита 1 типа LSc 2 ав - 10 - 50 кл/мл.
Санитарно-показательные микроорганизмы вносят по 3 - 4 штамма каждого вида, свежевыделенных от 3 - 4 здоровых людей. Фаг кишечных палочек вносят в отдельный сосуд.
Объем воды в модельных водоемах: не менее 1 л - для бактериологических исследований и не менее 2 л - для вирусологических. Модельные водоемы выдерживают при комнатной температуре 20 - 23 °С, предохраняя от прямых солнечных лучей.
В воде определяют динамику жизнедеятельности внесенных микроорганизмов и сапрофитных микроорганизмов, вырастающих на питательном агаре при температуре 20 - 22 °С в течение 48 часов. Высевы производит сразу же после внесения тест-микроорганизмов (исходная концентрация), а также на 1, 2, 3, 6, 9 и 14 сутки. Для определения содержания бактерий свыше 20 кл/мл используют прямые посевы на поверхность подсушенных питательных сред. Исследования рекомендуется проводить одномоментно на все виды микроорганизмов с использованием одного и того же стока.
Повторность опыта - не менее 3-х раз.
Оценку результатов производят путем сравнения логарифмических кривых отмирания микроорганизмов в опытных и контрольных водоемах.
Наиболее неблагоприятное влияние комплекса вредных веществ, содержащихся в стоках, выражается в угнетении жизнедеятельности санитарно-показательных микроорганизмов при одновременной стимуляции развития патогенных.
Идентичная динамика отмирания микроорганизмов в контрольных и опытных водоемах свидетельствует об отсутствии влияния комплекса вредных веществ в исследуемом стоке на показатели эпидемической безопасности и сохранении санитарно-показательного значения индикаторных микроорганизмов.
При существенном преобладании в стоках одного или нескольких вредных веществ исследование может быть проведено с каждым из этих ингредиентов.
Вещества в концентрациях, соответствующих их ПДК, а также содержанию в сточных водах и в местах сбросов в прибрежной полосе, вносят в модельные водоемы с незагрязненной морской водой, отобранной в контрольной точке, добавляют имитированный фекальный сток и культуры тест-микроорганизмов. Остальные условия идентичны вышеизложенным.
4.2. Методы санитарно-микробиологического анализа морских вод
4.2.1. Правила отбора, хранения и транспортировки проб морской воды
Пробы воды для микробиологического анализа отбирают батометрами в стерильные флаконы с соблюдением правил стерильности. При оценке качества воды, используемой для купания, необходимо отбирать самый поверхностный слой воды, не заглубляя горлышко флакона.
При невозможности проведения анализа на месте, отобранные пробы транспортируют в лабораторию в сумках-холодильниках или термоконтейнерах, где поддерживается температура +1° - 5 °С с помощью водонепроницаемых мешков, летом наполненных льдом, а зимой - теплой водой.
Во время перевозки проб воды следует избегать резких толчков, опрокидывания и замачивания пробок. Исследование воды должно быть произведено не позднее 2 - 4-х часов с момента ее отбора.
Любые отклонения от правил должны быть зафиксированы в протоколе анализа, поскольку от этого зависит точность и трактовка результатов исследования воды.
4.2.2. Определение лактозоположительных кишечных палочек
Лактозоположительные кишечные палочки являются основным нормируемым показателем степени фекального загрязнения морской воды. Установленный норматив - не более 1000 в 1 л - гарантирует эпидемическую безопасность при водопользовании в охраняемых районах морей.
К лактозоположительным кишечным палочкам относят грамотрицательные, не образующие спор палочки, ферментирующие лактозу с образованием кислоты и газа при температуре 37 °С в течение 24 часов и не обладающие оксидазной активностью.
При определении числа лактозоположительных кишечных палочек в морской воде рекомендуется метод мембранных фильтров. При отсутствии мембранных фильтров допустимо использовать титрационный метод.
Метод мембранных фильтров
Сущность метода заключается в концентрировании бактерий из определенного объема анализируемой воды на мембранный фильтр, выращивании их при температуре 37° ± 0,5 °С на среде Эндо, дифференцировании выросших колоний и подсчете количества лактозоположительных кишечных палочек в 1 л воды.
При выборе объема воды для посева исходят из предполагаемой степени загрязнения исследуемой воды: при исследовании чистых вод фильтруют 50, 40 и 10 мл; при исследовании загрязненных вод фильтруют 10, 1 и 0,1 мл или 1, 0,1 и 0,01 мл из расчета, чтобы на одном - двух фильтрах выросло не более 30 изолированных колоний кишечных палочек. Выбирая объем воды, ориентируются на результаты предыдущих анализов воды в этих пунктах. При анализе воды неизвестной степени бактериального загрязнения засевают 4 десятикратных объема воды.
Выбранные объемы воды профильтровывают под вакуумом через мембранные фильтры с использованием фильтровального аппарата, простерилизованного фламбированием.
Фильтры с осевшими на них бактериями переносят на среду Эндо и инкубируют посевы в термостате 18 - 20 часов при температуре 37° ± 0,5 °С.
Для учета результатов выбирают только такие фильтры каждой пробы воды, на которых получен рост изолированных колоний в оптимальном количестве (например, 5 - 20 темно-красных колоний).
Мембранный фильтр с выросшими на нем колониями бактерий переносят пинцетом, не переворачивая, на кружок фильтровальной бумаги несколько большего диаметра, чем фильтр, обильно смоченной реактивом для определения оксидазной активности. Через 2 - 4 мин. учитывают результат. Все колонии, которые приобрели сине-фиолетовую окраску или синий ободок, не относятся к семейству и их не учитывают. Среди колоний, не изменивших первоначального цвета, подсчитывают количество темно-красных с металлическим блеском и без него, а также слизистых крупных выпуклых лактозоположительных колоний, дающих отпечаток на обратной стороне фильтра.
В сомнительных случаях, когда необходимо подтвердить принадлежность колоний к лактозоположительным кишечным палочкам, а также при отсутствии реактива для определения оксидазной активности, подсчитывают отдельно каждый тип колоний, которые по морфологии и окраске можно предположительно отнести к ферментирующим лактозу кишечным палочкам (темно-красные с металлическим блеском и без него, красные, розовые с красным центром, розовые выпуклые слизистые и других оттенков с отпечатками на обратной стороне мембранного фильтра).
По 2 - 3 колонии каждого типа пересевают на полужидкую среду с лактозой. Посевы инкубируют в течение 5 - 6 часов при температуре 37° ± 0,5 °С. Через 5 часов учитывают результат. При наличии кислоты и газа дают положительный ответ, при отсутствии изменения среды - отрицательный. При наличии только кислоты посевы оставляют в термостате и окончательный учет производят через 24 часа.
Результат анализа выражают в виде индекса - количества лактозоположительных кишечных палочек в 1 л воды. Индекс определяют по формуле:
![]()
где n - число лактозоположительных кишечных палочек на фильтре,
V - объем воды, профильтрованной через этот фильтр, в мл.
Приготовление среды Эндо
Готовят из сухого препарата Дагестанского НИИПС по прописи на этикетке. В приготовленную и слегка остуженную среду вносят 0,1 мл 10 % спиртового раствора основного фуксина. Готовую среду разливают в чашки Петри слоем 0,5 см. Если на поверхности среды заметны следы влаги, чашки перед посевом необходимо подсушить. Хранение чашек со средой допускается не более двух - трех суток в темноте или холодильнике.
Приготовление полужидкой среды с лактозой
Готовят из сухого препарата с индикатором ВР и лактозой Дагестанского НИИПС по прописи на этикетке.
Приготовление реактива для определения оксидазной активности бактерий.
А - 1% спиртовой раствор a-нафтола.
В - 1 % водный раствор диметил-n-фенилендиамина дигидрохлорида или другого фенилендиаминового соединения.
Растворы могут храниться в темных склянках, флаконах с притёртыми пробками в течение 2 - 3 недель. Перед определением 3 мл раствора А смешивают с 7 мл раствора В.
Титрационный метод
Объемы воды для посева в лактозо-пептонную среду накопления выбирают с таким расчетом, чтобы в больших объёмах, получить положительные результаты, а в наименьших объемах - один или несколько отрицательных результатов. (Например, схема посева воды: у пляжей - 2 по 10 мл, 2 по 1 мл, 2 по 0,1 мл, 2 по 0,01 мл; в контрольной точке - 2 по 100 мл, 2 по 10 мл, 2 по 1 мл; недалеко от источников загрязнений - 2 по 1 мл, 2 по 0,1 мл, 2 по 0,01 мл, 2 по 0,001 мл).
Выбранные объемы воды засевают: 100 мл и 10 мл соответственно в 30 мл и 3 мл концентрированной среды, 1 мл пробы воды и 1 мл из разбавлений - в 10 мл среды нормальной концентрации. Посевы инкубируют 24 часа при температуре 37 °C.
Учет результатов. Полное отсутствие изменения среды или помутнение без образования газа позволяет дать отрицательный ответ. Из посевов в среду накопления, где отмечено помутнение и газообразование, производят высев на поверхность подтверждающей плотной среды Эндо, разделенной на 3 - 4 сектора с таким расчетом, чтобы получить изолированные колонии. Посевы инкубируют при 37 ± 0,5 °С 16 - 18 часов. При наличии в среде накопления помутнения и газообразования, а при высеве на подтверждающую среду характерных для кишечных палочек колоний (темно-красных с металлическим блеском и без него; слизистых крупных, изменяющих цвет среды) дают положительный ответ.
В тех случаях, когда имеет место сомнительная реакция в средах накопления (небольшое газообразование) или колонии на среде Эндо выросли не характерного для кишечных палочек вида, подтверждают принадлежность выросших колоний к лактозоположительным кишечным палочкам. По две колонии каждого типа с этого сектора засевают в полужидкую среду с лактозой уколом до дна пробирки и инкубируют при температуре 37 °С. Через 5 часов инкубации посевов производят учет. При образовании кислоты и газа хотя бы в одной пробирке результат анализа считают положительным. При отсутствии изменений среды дают отрицательный ответ. При наличии только кислоты окончательный результат учитывают через 24 часа.
Для подтверждения способности бактерий ферментировать лактозу можно использовать и лактозо-пептонную среду накопления, с поплавками. Учет результатов в этом случае следует производить через 24 часа.
Ускоренный подтверждающий метод
В сомнительных случаях на колонии, выросшие на секторе среды Эндо, накапывают реактив для определения оксидазной активности. При наличии в среде накопления помутнения и газообразования, а на секторе среды Эндо колоний одного из следующих видов: темно-красных с металлическим блеском и без него, слизистых розовых крупных, с темно-красным центром, не обладающих оксидазной активностью, - дают положительный ответ.
Если все колонии на секторе под воздействием реактива окрасились в сине-фиолетовый цвет, или остались без изменения только розовые плоские лактозоотрицательные колонии, дают отрицательный ответ.
Вычисление коли-индекса
После определения положительных и отрицательных результатов вычисляют число лактозоположительных кишечных палочек в 1 л воды - по таблице.
Для расчета выбирают 3 таких последовательных десятикратных разведения или объема воды, засеянной в среду накопления, в которых получены положительные и отрицательные результаты.
Таблица расчета числа бактерий в 1 л воды
|
Число положительных порций из |
Число бактерий в 1 л (индекс) |
||
|
2 порций по 10 мл |
2 порций по 1,0 мл |
2 порций по 0,1 мл |
|
|
1 |
2 |
3 |
4 |
|
0 |
0 |
0 |
менее 50 |
|
0 |
0 |
1 |
50 |
|
0 |
0 |
2 |
90 |
|
0 |
1 |
0 |
50 |
|
0 |
1 |
1 |
90 |
|
0 |
1 |
2 |
140 |
|
0 |
2 |
0 |
90 |
|
0 |
2 |
1 |
140 |
|
0 |
2 |
2 |
190 |
|
1 |
0 |
0 |
60 |
|
1 |
0 |
1 |
120 |
|
1 |
0 |
2 |
190 |
|
1 |
1 |
0 |
130 |
|
1 |
1 |
1 |
200 |
|
1 |
1 |
2 |
280 |
|
1 |
2 |
0 |
210 |
|
1 |
2 |
1 |
290 |
|
1 |
2 |
2 |
370 |
|
2 |
0 |
0 |
230 |
|
2 |
0 |
1 |
500 |
|
2 |
0 |
2 |
950 |
|
2 |
1 |
0 |
620 |
|
2 |
1 |
1 |
1300 |
|
2 |
1 |
2 |
2100 |
|
2 |
2 |
0 |
2400 |
|
2 |
2 |
1 |
7000 |
|
2 |
2 |
2 |
более 24000 |
Приготовление лактозо-пептонной среды
10 г пептона, 5 г хлористого натрия, 5 г лактозы растворяют при нагревании в 1000 мл дистиллированной воды, после растворения устанавливают рН 7,4 - 7,6, разливают по 10 мл в пробирки с поплавками или комочками ваты, стерилизуют в автоклаве при 112 °С (0,5 кгс/см2) 12 мин.
Концентрированную лактозо-пептонную среду готовят так же, как и среду нормальной концентрации, но с добавлением на 1000 мл дистиллированной воды 39 г пептона, 19,3 г лактозы, 19,3 г хлористого натрия. Разливают по 3 мл в пробирки или по 30 мл во флаконы с поплавками.
Методы определения дополнительных показателей
При изменении санитарной и эпидемической обстановки, при коли-индексе, превышающем 1000, в случае несоответствия результатов анализа по коли-индексу санитарной ситуации и в условиях интенсивного промышленно-бытового загрязнения, когда концентрации вредных веществ в воде в десятки раз превышают ПДК, целесообразно определять комплекс дополнительных микробиологических показателей. Это повышает надежность микробиологического контроля качества морских вод, их эпидемическую безопасность, помогает вскрыть причину и характер микробного заражения.
4.2.3. Определение термотолерантных кишечных палочек (преимущественно Е. coli)
Наличие E. coli в морской воде в количестве, превышающем 500 в 1 л, свидетельствует о свежем фекальном загрязнении, опасном в эпидемическом отношении. При этом важно еще и соотношение числа Е. coli с числом лактозоположительных кишечных палочек. Чем ближе эти величины, тем выше степень опасности при одновременном повышении загрязнения по индексу Е. coli свыше 500.
При необходимости определения числа термотолерантных кишечных палочек (преимущественно Е. coli) пересевают темно-красные лактозоположительные колонии в лактозный бульон с борной кислотой или бриллиантовым зеленым, предварительно нагретый в термостате или в водяной бане. Сразу же после посева пробирки ставят в термостат и инкубируют 24 часа при температуре 43 ± 0,2 °С или 44,5 ± 0,2 °С (в соответствии с выбранной средой). Помутнение и газообразование в пробирках свидетельствуют о свежем фекальном загрязнении морской воды.
Методы определения и приготовление лактозного бульона с борной кислотой и бриллиантовым зеленым описаны в ГОСТе 18963-73 «Вода питьевая. Методы санитарно-бактериологического анализа».
4.2.4. Определение числа энтерококков
Энтерококки рекомендуется определять для подтверждения фекального загрязнения в случаях, когда коли-индекс не согласуется с санитарной характеристикой и другими показателями качества воды или отсутствуют Е. coli при большом индексе всей группы кишечных палочек.
При индексе энтерококков свыше 500 предполагается поступление свежего фекального загрязнения и опасность в эпидемическом отношении.
Метод мембранных фильтров
Объем исследуемой воды для посева выбирают с таким расчетом, чтобы не менее, чем на двух фильтрах выросли йодированные колонии в количестве не более 50. При выборе объёма воды для посева ориентируются на результаты предыдущих исследований (например, могут быть профильтрованы следующие объемы при анализе воды: у пляжей - 1, 5, 15 мл; в контрольной точке - 10, 40 мл; в зоне влияния сточных вод и других источников загрязнения - 0,01, 0,1, 1, 10 мл и т.п.).
При исследовании воды неизвестной степени бактериального загрязнения количество засеваемых последовательных десятикратных объемов следует увеличивать до 4-х.
Фильтры с посевами помещают на модифицированную среду Сланеца-Бертли или Турчинского и инкубируют при 37° ± 0,5 °С в течение 24 часов.
Для учета выбирают фильтры, на которых выросли изолированные колонии в количестве не более 50. На модифицированной среде Сланеца подсчитывают колонии, характерные для энтерококков выпуклые, с ровными краями, различной окраски: темно-вишневые, малиновые, розовые, светло-розовые, равномерно окрашенные или с темно-красным, нечетко оформленным центром. Как правило, все колонии, которые растут на этой среде, можно отнести к фекальным, стрептококкам, имеющим индикаторное значение. Очень мелкие, плоские, на пределе видимости невооруженным глазом колонии не учитывают. При необходимости подтвердить наличие энтерококков по 2 - 3 колонии каждого типа микроскопируют после окраски по Граму. При обнаружении в мазках грамположительных, полиморфных, со слегка заостренными концами клеток, соединенных попарно, дают положительный ответ.
При работе на среде Турчинского выбирают фильтры, на которых выросло не более 20 - 30 колоний. Подсчитывают колонии белые, кремовые, розовые и малиновые, плоские, крупные. Если выросли колонии другого вида - выпуклые, белые, мелкие, ярко окрашенные, то их принадлежность к энтерококкам можно подтвердить по отсутствию каталазной активности и по характерной морфологии клеток при микроскопировании мазков, окрашенных по Граму.
Каталазный тест выполняют путем нанесения петлей капли 3 % перекиси водорода на положительные колонии или, что более точно, нанося культуру на предметное стекло и после подсыхания - каплю перекиси водорода. При образовании пузырьков газа - наличии активной каталазы - колонии не учитывают.
Подсчитанное число колоний энтерококков суммируют, делят на объем воды, профильтрованный через фильтры, на которых велся учет, и умножают на 1000.
Приготовление среды Сланеца (модификации).
Сухого питательного агара Дагестанского НИИПС - 35 г
Калия фосфорнокислого однозамещенного - 4 г
Дистиллированной воды - до 1000 мл
Расплавить при нагревании, установить рН 7 - 7,1, разлить в сосуды, стерилизовать при 120 ± 2 °С (1,1 кгс/см2) 20 мин.
Перед употреблением в расплавленный и слегка остуженный агар добавить из расчета на 100 мл среды: глюкозы - 0,4 г, азида натрия - 0,04 г, ТТХ (1 % водного раствора) - 1 мл, натрия лимоннокислого - 2 г. Тщательно смешать, разлить в чашки толстым слоем по 20 - 25 мл.
Приготовление среды Турчинского.
Сухого питательного агара Дагестанского НИИПС - 35 - 40 г
Калия фосфорнокислого двузамещенного - 5 г
Калия фосфорнокислого однозамещенного - 5 г
Натрий-аммоний фосфорнокислого - 5 г
Дистиллированной воды - 600 мл
Желчи крупного рогатого скота - 400 мл
Перед употреблением в расплавленный и слегка охлажденный агар добавить из расчета на 100 мл среды: глюкозы - 0,5 г, ТТХ (1 % водный раствор) - 1 мл, 1 % водного раствора метиленового синего (хранить не более 14 дней) - 0,6 мл, полимиксина - 30000 ед., фурацилина (0,1 % спиртового раствора) - 1,2 мл. Тщательно смешать, разлить в чашки толстым слоем по 20 - 25 мл. Хранить не более 3-х суток.
Титрационный метод
При выборе схемы посева руководствуются указаниями, приведенными для титрационного метода определения кишечных палочек. Однако следует учесть, что энтерококки в морской воде содержатся в меньшем числе, чем кишечные палочки.
Метод с использованием щелочно-полимиксиновой среды по Калине
Посев производят в щелочно-полимиксиновую среду: объем 100 и 10 мл - в равные объемы среды двойной концентрации, остальные - в 5 мл среды обычной концентрации.
Посевы инкубируют 24 часа при 37° ± 0,5 °С.
Предварительный учет производят, высевая на 4 - 6 секторов плотной молочно-ингибиторной среды из порций среды, где отмечены признаки роста (помутнение и изменение цвета среды). Порции среды, в которых признаки роста отсутствуют, оставляют при 37° ± 0,5 °С еще на 24 часа, после чего из сосудов, в которых дополнительно появилось помутнение и изменение цвета среды, делают высев на сектора молочно-ингибиторной среды.
Через 24 - 48 часов инкубации посевов на молочно-ингибиторной среде при 37° ± 0,5 °С в качестве положительных результатов отмечают наличие аспидно-черных, выпуклых крупных с металлическим блеском колоний и сероватых, мелких колоний.
При необходимости убедиться в наличии энтерококков делают микроскопию после окраски мазков по Граму.
Число энтерококков в 1 л исследуемой воды определяют по таблице на стр. 17.
Приготовление щелочно-полимиксиновой среды
|
Обычная концентрация |
Удвоенная концентрация |
||
|
1. |
Мясо-пептонный бульон |
40 мл |
70 мл |
|
Натрий хлористый |
0,5 г |
1 г |
|
|
Глюкоза |
1 г |
2 г |
|
|
Дрожжевой экстракт |
2 мл |
4 мл |
|
|
2. |
Вода дистиллированная |
25 мл |
12,5 мл |
|
Натрий углекислый |
0,53 г |
1,1 г |
|
|
3. |
Вода дистиллированная |
25 мл |
12,5 мл |
|
Натрий двууглекислый |
0,25 г |
0,5 г |
Раздельная стерилизация растворов 1, 2 и 3 при 0,5 атм в течение 12 мин. После стерилизации растворы смешать, проверить рН (10), прибавить 20000 ед. полимиксина, 0,5 мл 1,6 % спиртового раствора бромтимолового синего, разлить в пробирки по 5 мл. В среду удвоенной концентрации прибавляют 40000 ед. полимиксина и 1 мл бромтимолового синего. Разлить в колбы или флаконы по 10, 50 или 100 мл соответственно количеству исследуемой воды.
Приготовление молочно-ингибиторной среды
Питательного агара - 85 мл
Стерильного снятого молока - 15 мл
0,01% водного раствора кристаллического фиолетового - 1,25 мл
2 % водного раствора теллурита калия - 1 мл.
Хорошо смешать и разлить в чашки.
Титрационный метод одновременного определения лактозоположительных кишечных палочек и энтерококков
Для определения количества энтерококков можно воспользоваться посевами в лактозо-пептонную среду накопления, которые были сделаны для определения бактерий группы кишечных палочек.
Через 48 часов инкубации посевов при температуре 37° ± 0,5 °С из среды накопления, где имеет место помутнение, независимо от наличия или отсутствия газообразования делают высев (по 6 секторов) на одну из подтверждающих элективных сред (Сланеца-Бертли, Турчинского). При этом необходимо соблюдать следующие условия: верхнюю часть среды слить, оставшуюся часть размешать и произвести посев бактериологической петлей диаметром 2 - 3 мм, внося материал 3 раза. При последующем посеве штрихом предусмотреть, чтобы к концу штриха выросли изолированные колонии.
При наличии на подтверждающей среде характерного для энтерококков роста дают положительный ответ. При необходимости убедиться в наличии на секторах подтверждающей среды энтерококков выполняют микроскопию с окраской по Граму, а при работе со средой Турчинского - еще и каталазную пробу.
4.2.5. Определение числа стафилококков
Стафилококки служат показателем загрязнения воды при купании микрофлорой верхних дыхательных путей и кожных покровов человека. Поэтому при оценке качества прибрежных морских вод, используемых для купания, этот показатель имеет самостоятельное значение наряду с индикаторами фекального загрязнения воды.
Вода с содержанием стафилококков свыше 100 в 1 л может представлять опасность в эпидемическом отношении. Индикаторное значение имеет, в основном, Stph. aureus.
Сущность метода заключается в концентрировании бактерий из определенного объема анализируемой воды на мембранные фильтры, выращивании их при 37° ± 0,5 °С на молочно-желточно-солевом агаре (МЖСА) с полимиксином, подсчете лецитовителлазоактивных стафилококков.
Через мембранные фильтры профильтровывают 50 мл воды с таким расчетом, чтобы выросли изолированные колонии (например, 5 мл, 20 мл, 25 мл). Фильтры помещают на среду МЖСА с полимиксином, не содержащую на поверхности следов влаги, выращивают при температуре 37° ± 0,5 °С в течение 24 часов. На эту среду при большом загрязнении стафилококками можно делать прямые посевы 1 мл и меньших объемов. Чашки с посевами можно оставить при комнатной температуре еще на 18 - 20 часов для лучшего проявления пигментообразования.
Подсчитывают количество выпуклых блестящих колоний, которые образовали характерный пигмент (золотистый, палевый лимонно-желтый, оранжевый, реже белый) и радужную зону вокруг.
При необходимости подтвердить наличие стафилококков, обладающих лецитовителлазной активностью, подозрительные колонии пересевают «пятнами» на чашки, разделенные на квадраты, со средой того же состава, отмечают пигментообразование, радужную зону разложения желтка и зону помутнения среды, а также характерную для стафилококков форму клеток при микроскопировании.
При отсутствии мембранных фильтров можно определить стафилококки титрационным методом, используя в качестве среды накопления солевой бульон. Схема посева должна соответствовать таблице на стр. 17, по которой определяют индекс бактерий. Высев из сред накопления делают на МЖСА с полимиксином, отмечая наличие лецитовителлазоактивных стафилококков.
Приготовление молочно-желточно-солевого агара (МЖСА)
Сухого питательного агара Дагестанского НИИПС - 45 г
Натрия хлористого - 90 г
Дистиллированной воды - до 1000 мл
Расплавляют при нагревании, разливают в сосуды и стерилизуют при 120° ± 2 °С (1,1 кгс/см2) 20 мин.
Перед употреблением в расплавленный и охлажденный до 50 - 55 °С солевой агар добавляют: стерильное обезжиренное молоко - 60 мл, один яичный желток, тщательно смешанный с помощью стеклянных бус с 50 мл физиологического раствора, полимиксин М (раствор хранить не более 14 дней) - 300000 ед. Тщательно смешивают и разливают в чашки Петри толстым слоем по 20 - 25 мл для выращивания бактерий на мембранных фильтрах и тонким слоем по 15 мл для подтверждающего этапа.
4.2.6. Выделение патогенных энтеробактерий
Вследствие незначительной концентрации патогенных энтеробактерий в морской воде непосредственный посев воды на плотные питательные среды не дает зачастую возможности выделить эти микроорганизмы из воды. Более надежные результаты можно получить после предварительного концентрирования этих бактерий из воды или накопления в средах обогащения.
Рецептура среды обогащения с охмеленным суслом и способ ее применения
Наиболее результативной для выделения патогенных энтеробактерий из морской воды является среда накопления с охмеленным суслом. Основной питательный субстрат среды - охмеленное сусло - является полуфабрикатом производства пива и может быть приобретен на пивоваренном заводе. Охмеленное сусло отбирают в стерильную посуду; его можно сохранять в холодильнике (+4 °С) в течение 3 - 4 недель.
Приготовление среды производят ex temporae: к 100 мл охмеленного сусла в плоскодонной колбе добавляют 5 г пептона, подогревают на небольшом огне при перемешивании, доводят до кипения и кипятят в течение 10 минут.
В остуженную среду доливают 400 мл исследуемой морской воды, устанавливают рН 7,3 - 7,5 (для подщелачивания может быть добавлено несколько капель 20 % раствора NaOH). Затем добавляют 7 - 9 мл 0,1 % раствор (водный) бриллиантового зеленого: при небольшом микробном загрязнении исследуемой воды - 7 мл, при большом - 9 мл. После тщательного перемешивания посев ставят в термостат для подращивания в течение 20 - 24 часов при температуре 37 °С.
Через сутки инкубации в термостате производят высев на плотные питательные среды: для подращивания сальмонелл, используют висмут сульфитный агар, для подращивания шигелл - агар с эозин-метиленовым синим (ЭМС-агар) или среду Плоскирева.
На висмут-сульфитной среде сальмонеллы образуют черные и зеленые колонии с темным центром, иногда и без центра, под колонией на питательной среде образуется почернение. Шигеллы на ЭМС-агаре и среде Плоскирева образуют мелкие прозрачные круглые нежные колонии.
C каждой чашки снимают для дальнейшего изучения по 4 - 5 колоний, «подозрительных» на сальмонеллы и шигеллы, и засевают на дифференциальные среды Ресселя, Олькиницкого и т.п.).
Дальнейшие исследования проводятся по общепринятой методике. Через сутки инкубации при 37 °С с дифференциальных сред отбирают культуры, имеющие типичные ферментативные реакции в отношении используемых в средах углеводов, а также те культуры, которые имеют некоторые отклонения от типичных свойств, но характеризуются нежным ростом на поверхности скошенного агара. Затем культуру проверяют на фаголизабельность при помощи О-сальмонеллезного и дизентерийного фагов. При наличии фаголизабельности у выделенных культур проводят серологическое определение культур, устанавливают их родовую и типовую принадлежность.
Для определения сальмонелл в сточной воде помимо охмеленного сусла можно использовать магниевую среду накопления (по Калине).
Готовят 3 раствора:
1. Пептона отечественного производства - 4,2 г
Хлористого натрия - 7 г
Калия фосфорнокислого однозамещенного - 1,5 г
Дрожжевого экстракта - 20 мл
Воды дистиллированной - 890 мл
2. Хлористого магния кристаллического - 36 г
Воды дистиллированной - 90 мл
3. 0,1 % водного раствора бриллиантового зеленого - 5 мл
Растворы смешивают, стерилизуют при 0,5 атм 30 мин. При посевах исследуемого материала в количестве более 100 мл концентрацию всех ингредиентов, кроме дистиллированной воды, удваивают. 100 мл сточной воды засевают в равное количество среды накопления удвоенной концентрации, 10 мл сточной воды - в 100 мл среды обычной концентрации, 1 мл сточной воды - в 10 мл среды обычной концентрации.
Навески химических реактивов и растворы ингредиентов можно вносить непосредственно в исследуемую воду и растворять их при встряхивании. На 100 мл сточной воды необходимо добавить 3,9 г хлористого магния кристаллического, 0,8 г хлористого натрия, 0,16 г калия фосфорнокислого однозамещенного безводного, 5 мл 10 % раствора пептона, 2,2 мл дрожжевого экстракта и 0,5 мл 0,1 % раствора бриллиантового зеленого.
После 24-часовой инкубации в термостате при 37 °С делают посев на 2 - 3 чашки с висмут-сульфитным агаром. Чашки с посевом инкубируют при 37 °С 18 - 20 часов.
Подозрительные колонии на сальмонеллы необходимо исследовать общепринятыми методами.
4.2.7. Выделение вирусов с помощью тампонного метода Моора
Стерильные тампоны погружают на глубину 3 - 5 м в воду в точках отбора проб. Сбор тампонов и последующую транспортировку производят в стерильных банках емкостью 0,5 л и до последующей обработки хранят в замороженном состоянии при температуре минус 15 - 20 °С.
Затем пробы (тампоны) размораживают. В сосуд, где находится тампон, вносят от 10 до 20 мл 0,5 М фосфатного буфера. Тампон тщательно разминают в течение 5 минут и отжимают. Выход каждой пробы составляет 60 - 100 мл. рН жидкости устанавливается 8 - 8,2 путем добавления 1 М NaOH. Затем жидкая фаза отсасывается в центрифужные пробирки и центрифугируется при 2500 об/мин. в течение 20 минут. Надосадочная жидкость отсасывается в стерильные пробирки с резиновыми пробками и замораживается на 1 - 2 суток, после чего пробы снова оттаивают и центрифугируют в том же режиме и добавляют равное количество эфира. Флаконы встряхивают для получения гомогенной эмульсии и, закрытые ватно-марлевыми пробками, помещают в холодильник с температурой 4 - 6 °С. Через 2 - 3 дня (после испарения эфира) флаконы закрывают резиновыми пробками и хранят в замороженном состоянии до вирусологического исследования на культуре ткани.
4.2.8. Выделение вирусов на ионнообменной колонке
Для концентрирования вирусов используют сильноосновной анионит отечественного производства АВ-17, выпускаемый в гидроксильной и Cl-формах. Для адсорбции вирусов могут быть использованы обе формы.
Перед употреблением сухую ионнообменную смолу для набухания замачивают в бидистиллированной воде не менее чем на 24 часа. После этого смолу переводят в Cl-форму путем обработки ее в течение 3 - 4 дней соляной кислотой из расчета не менее 1 л раствора кислоты на 100 мл набухшей смолы (1N раствора - для гидроксильной и 0,5N раствора для Cl-формы). Затем смолу промывают стерильной бидистиллированной водой до тех пор, пока рН воды не станет центральной или равной рН исходной воды. Обработанную воду вместе с бидистиллированной водой заливают в бюретку на 25 - 50 мл, на дно которой помещают кусочек стеклянной ваты. Высота столбика смолы - 8 - 10 см. До использования смолу необходимо держать под водой.
При исследовании в бутыль с тубусом или сифоном наливают исследуемую воду в объеме 1 - 3 л, рН воды доводят до 5,5. Бутыль ставят выше колонки и вода самотеком стекает по сифону и присоединенной к нему резиновой трубке (тщательно прокипяченной в дистиллированной воде) в колонку с анионитом. Зажимом, надетым на трубку, регулируют подачу воды в колонку с таким расчетом, чтобы столбик смолы был постоянно под водой, но вода не перетекала через край бюретки. Загрязненную мутную морскую воду, а также сточную воду целесообразно предварительно профильтровать через несколько слоев марли или стекловату.
Элюацию вирусов со смолы производят 0,5 М раствором фосфатного буфера (Na2HPO4), имеющим рН 8,2. Для этого после пропускания через колонку всего исследуемого объема воды бюретку продувают грушей для удаления остатков воды, заливают 10 мл указанного буфера, закрывают резиновой пробкой и тщательно взбалтывают. Буфер оставляют в колонке со смолой на 1 - 2 часа при комнатной температуре, на 16 - 18 часов при 4 - 6 °С, после чего производят одномоментный отбор всего элюата.
Последующая обработка проб производится так же, как и при использовании метода Моора. Вирусологическое исследование обработанных проб производится по методикам, принятым в вирусологической практике. Для более полного выделения энтеровирусов из проб природных вод анализ производят параллельно на двух видах культуры ткани: первичной и перевиваемой.
В качестве первично-трипсинизированной культуры ткани используются клетки почек обезьян макака-резус, чувствительные к группе вирусов полиомиелита, Коксаки В, некоторым типам вирусов Коксаки А и ECHO вирусам, а также к группе аденовирусов.
В качестве перевиваемой культуры используют клетки Hela (опухолевые клетки человеческого происхождения), чувствительные к некоторым типам вирусов Коксаки A, ECHO вирусам, аденовирусам.
Заражение производят на выращенном монослое. Для этого после удаления питательной среды на монослой клеток наносят 0,5 - 1 мл исследуемой воды и флаконы (объемом 50 - 60 мл) помещают в термостат при температуре 37 °С. После 30-минутного контакта вирусосодержащего материала с клетками пробу сливают и во флаконы доливают 10 мл поддерживающей среды.
Зараженные культуры клеток инкубируют в термостате от 7 до 9 дней для выделения энтеровирусов и 17 - 20 дней - для выделения аденовирусов.
При отсутствии цитопатического действия на культуру ткани проводят два слепых пассажа по общепринятой методике - при заражении не менее 2 флаконов.
4.2.9. Выделение и титрование бактериофагов
Для выделения и титрования бактериофагов применяется метод агаровых слоев по Грация: 1,5 % мясопептонный агар разливают на чашки Петри в количестве 25 - 30 мл. Чашки высушивают под бактерицидными лампами. В пробирки разливают 0,7 % мясопептонный агар в количестве 2,5 мл и остужают до 47 °С. Затем 1 мл исследуемой пробы в соответствующем разведении и 0,1 мл взвеси суточной культуры Е. coli помещают в пробирку с 0,7 % агаром, быстро перемешивают и выливают на поверхность 1,5 % агара. После застывания 0,7 % агара чашки Петри (в перевернутом виде) помещают в термостат при 37 °С для инкубирования. Подсчет колоний фага производят на следующий день.
4.3. Оценка влияния химических веществ на органолептические свойства морских вод
Оценка влияния химических веществ на органолептические свойства морских вод имеет целью определение необходимости корректировки ПДК вредных веществ, установленных для пресных водоемов по органолептическому признаку вредности и производится на основе установления, по методике «закрытого опыта», дифференцированного для прибрежных вод различных морей, практического (интенсивностью не более двух баллов) порога восприятия необычного (постороннего) для этих вод запаха.
Примечание:
Корректировке подлежат также ПДК тех вредных веществ, при нормировании которых в воде определяющим является провоцирование посторонних запахов.
Последовательность проведения опытов по определению практического порога восприятия запаха наиболее распространенных химических загрязнителей в прибрежном охраняемом районе моря следующая:
а) Для ориентировочного представления о пороговых величинах предварительно проводится опыт оценки интенсивности необычного для морской воды запаха путем анализа (по пятибальной шкале) последовательных двукратных разведении наиболее высокой концентрации исследуемого вещества в морской воде в районе водопользования.
б) Затем в интервале пороговых концентраций изучаемого вещества, соответствующих оценке 1 - 2 балла, выбираются 4 - 5 концентраций, отличающихся в 3, а затем в 1,5 раза, и каждая из этих концентраций (опытная проба) группируется с 4 контрольными пробами.
Одораторам предлагается найти опытную пробу в каждом комплексе проб. Предварительно одораторы должны быть ознакомлены с характером запаха вещества. При этом интенсивность органолептических свойств (запаха) демонстрационной пробы не должна быть более 2 - 3 баллов. Необходимо также проверить, не обладает ли исследуемое вещество феноменом последействия, маскировки или привыкания.
Последовательность поиска опытной пробы проводится от большей концентрации вещества к меньшей. В таблице регистрируются результаты опроса (знаками плюс и минус или как-либо иначе).
Общее число наблюдений по каждой концентрации должно быть не менее 30 - 50, результаты первого опыта не учитываются. Далее подсчитывается процент одораторов, правильно указавших опытную пробу из всего числа лиц, принимавших участие в опыте.
Если процент правильных ответов на испытанные концентрации вещества выражается величинами как больше, так и меньше 50 %, то опыт закончен. В противном случае необходимо продолжить работу.
Примечание:
При получении для испытанной концентрации примерно 20 % правильных ответов нецелесообразно изучать более низкие концентрации вещества.
в) Анализ полученных данных проводится методом пробит-анализа.
Процент правильных ответов (или их пробиты) от каждой испытанной концентрации наносится на график в двойном логарифмическом масштабе и результаты обрабатываются любым приемлемым методом пробит-анализа с вычислением величины среднеэффективной концентрации (ЕС50) и ее ошибки.
Среднеэффективная концентрация (ЕС50) - это порог ощущения, соответствующий одному баллу по пятибальной шкале оценки интенсивности органолептических свойств воды. Данная величина полностью отвечает всем требованиям, предъявленным психофизиологией для точной характеристики пороговых стимулов и сенсорных раздражителей.
Для получения особо точных результатов и исключения ошибки, связанной с вероятностью случайных правильных ответов, можно из процента правильных ответов вычислить соответственно процент ошибочных ответов, приходящихся в среднем на одну контрольную пробу.
Безупречную точность обеспечивает стандартизация данных по формуле Шнейдер-Орелли:
![]()
где Хст. - стандартизированный процент правильных ответов,
Хпр. - экспериментально полученный процент правильных ответов,
Хош. - процент ошибочных ответов, приходящихся в данной группировке проб на одну контрольную пробу.
Для определения практического порога, соответствующего двум баллам, величина ЕС50 умножается на показатель разностного порога ощущения запаха, точное значение которого находится в специальном опыте.
В известной мере оправданным может быть получение практического порога вещества по влиянию на запах воды в результате простого умножения величины ЕС50 на коэффициент 1,5.
СОДЕРЖАНИЕ