Методические указания
по санитарно-микробиологическому исследованию почвы
(утв.
заместителем Главного государственного санитарного врача СССР
4 августа 1976 г. № 1446-76)
Санитарная охрана почвы, как одного из важнейших объектов окружающей среды, в настоящее время имеет актуальное значение. В первую очередь это связано с тем, что несмотря на профилактические мероприятия, проводимые в нашей стране и за рубежом, заболеваемость кишечными инфекциями бактериальной и вирусной природы остается на высоком уровне, что в значительной степени обусловлено циркуляцией в окружающей среде патогенных энтеробактерий и кишечных вирусов.
Однако, чтобы своевременно ограничить циркуляцию в окружающей среде патогенных микроорганизмов за счет проведения профилактических мероприятий, необходимо иметь высокочувствительные и доступные широкой практике методы их обнаружения в объектах внешней среды, в том числе и в почве.
Широкое использование ядохимикатов в сельском хозяйстве обусловливает значительное загрязнение ими почвы. При этом в силу физико-химических особенностей почвы, процессов сорбции в ней создаются условия для накопления пестицидов и тесного контакта их остаточных количеств с микрофлорой. В литературе накоплен значительный материал о различном неблагоприятном воздействии химических токсических веществ на микроорганизмы. В этих условиях перед санитарно-эпидемиологической службой появляется ряд новых задач, увеличивающих объем исследований почвы по санитарно-микробиологическим показателям. Так, изучение влияния химических веществ на процессы самоочищения почвы, почвенный микробиоценоз, на выживаемость кишечных микробов в почве является одним из этапов гигиенического нормирования вредных химических веществ в почве.
В изданных за последние годы руководствах и сборниках по санитарной микробиологии и гигиене почвы (1 - 2, 4 - 7) практически повторяется инструкция по санитарно-бактериологическому исследованию почвы населенных мест (1958). В настоящее время получены новые данные по усовершенствованию методов обнаружения в почве патогенных и санитарно-показательных микроорганизмов, которые можно рекомендовать для практической санитарной службы.
Настоящие методические указания предназначены для использования санитарно-бактериологическими лабораториями санитарно-эпидемиологических станций, осуществляющих контроль за санитарным состоянием почвы, микробиологами научно-исследовательских учреждений и производственных лабораторий, изучающих влияние химических веществ на микрофлору почвы в плане их нормирования.
I. Схема и санитарно-микробиологические показатели исследования почвы
В настоящих методических указаниях приведен полный набор микробиологических показателей и методов их определения, использование которых позволяет дать комплексную санитарно-микробиологическую оценку почвенного покрова. Одни показатели (бактерии группы кишечных палочек, термофильные, нитрифицирующие, общее количество бактерий и Cl. perfringens) указывают на степень фекального загрязнения. Изучение состояния почвенного биоценоза по этим показателям и дополнительно по ряду групп и видов почвенной микрофлоры позволяет более глубоко определять изменения в почве, происходящие в результате бактериального, органического и химического загрязнений.
В соответствии с целями исследований в каждом конкретном случае можно использовать определенную группу показателей. В таблице 1 приведены 4 группы показателей. При проведении текущего санитарного надзора за состоянием почвы целесообразно ограничить исследования проведением краткого санитарно-микробиологического анализа, указывающего на наличие и степень фекального загрязнения почвы. По показателям, включенным в эту группу, можно определять и самоочищение почвы от энтеробактерий и органических веществ.
Схема санитарно-микробиологического исследования почвы
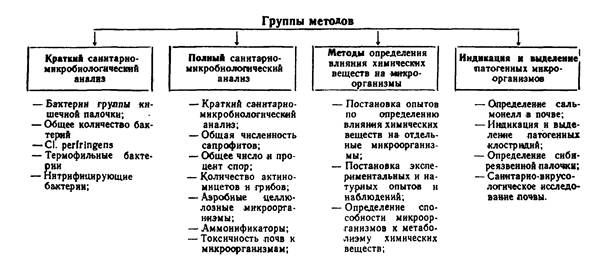
Исследование почвы по полному санитарно-микробиологическому анализу показано при осуществлении предупредительного санитарного надзора при выборе территорий для размещения населенных пунктов, отдельных объектов, ЗПО и др., а также при проведении научных исследований. Проведение анализа почвы по полной схеме позволяет получать наиболее полные данные о степени фекального и органического загрязнения и течения процессов самоочищения.
Определение влияния химических веществ на почвенный биоценоз предусматривает дополнительные исследования, позволяющие дать более быструю характеристику антибактериального действия химических соединений, а также их действия на активность почвенной микрофлоры.
В необходимых случаях, а также по эпидемическим показаниям можно проводить индикацию и выделение из почвы патогенных микроорганизмов, в распространении которых почва играет важную роль.
II. Оценка санитарного состояния почвы по микробиологическим показателям
Имеющиеся в литературе данные (1, 2, 3) и исследования, проведенные Молдавским НИИ гигиены и эпидемиологии, позволили разработать схему оценки санитарного состояния почвы по 4-м микробиологическим показателям (табл. 2).
Наличие кишечной палочки в титрах 0,9 и ниже свидетельствует о несомненном фекальном загрязнении почвы, притом свежем. Одновременно могут быть зарегистрированы низкие титры Cl. perfringens и нитрификаторов. Однако следует иметь в виду, что в первое время после имевшего место органического загрязнения нитрификаторов может быть мало - необходимо время, чтобы они успели размножиться.
В процессе самоочищения на разных этапах возникают различные количественные соотношения этих показателей. Наиболее быстро отмирает кишечная палочка, поэтому при сравнительно высоких ее титрах титры Cl. perfringens и нитрифицирующих бактерий низкие. Это показывает, что в почве интенсивно протекают процессы самоочищения как от патогенных микроорганизмов, так и от органического загрязнения.
Высокий титр (1,0 и выше) кишечной палочки при низких титрах остальных 3-х показателей характеризует почву как свободную от возбудителей кишечных инфекций, но в которой еще не закончились процессы распада и минерализации органических веществ.
Высокие титры всех показателей свидетельствуют о законченных процессах самоочищения и характеризуют почву как чистую, свободную от патогенных энтеробактерий и органических загрязнений.
Эти моменты имеют важное значение при определении не только фактического санитарного состояния почвы определенных территорий, но и для выяснения стадий течения процесса самоочищения, установления сроков полива, удобрения почвы навозом и т.д.
Схема оценки санитарного состояния почвы по микробиологическим показателям
|
Категория почв |
Титры |
Количество термофильных бактерий в грамме почвы |
||
|
Кишечной палочки |
Нитрифицирующих бактерий |
Cl. perfringens |
||
|
Чистая |
1,0 и выше |
0,1 и выше |
0,01 и выше |
100 - 1000 |
|
Загрязненная |
0,9 - 0,01 |
0,09 - 0,001 |
0,009 - 0,0001 |
1001 - 100000 |
|
Сильно загрязненная |
0,009 и ниже |
0,0009 и ниже |
0,00009 и ниже |
100001 - 4000000 |
О загрязнении почвы навозом и компостами свидетельствует повышенное содержание в ней термофилов (более 1000 клеток в 1 г почвы).
Дополнительным показателем является общее количество бактерий в грамме почвы. Единого норматива этого показателя нет, так как количество бактерий в почвах разных типов и климатических районов сильно варьирует. Для подзолистых почв наличие 10 млн бактерий в грамме почвы и более указывает на фекальное загрязнение. Для других типов почв необходимо устанавливать конкретные нормативы этого показателя.
Приведенная выше схема позволяет оценивать санитарное состояние почвы в 2-х аспектах: загрязнения патогенными энтеробактериями и органическими веществами. Причем исследования, проведенные в ИОКГ им. А.Н. Сысина, Молдавском НИИ гигиены и эпидемиологии и в Киевском НИИ ОКГ им. А.Н. Марзеева, показали, что основной косвенный показатель - численность кишечных палочек - является надежным индикатором фекального загрязнения почвы и при загрязнении ее химическими веществами. Вышеизложенное позволяет рекомендовать эту схему для оценки санитарного состояния почвы независимо от того, загрязнена она химическими веществами или нет.
Косвенные микробиологические показатели не указывают на наличие или отсутствие в почве других возбудителей инфекционных заболеваний (столбняка, сибирской язвы, ботулизма), кишечника и других вирусов, патогенных для человека.
Для выделения или индикации этих патогенных микроорганизмов необходимо проводить специальные исследования с использованием лабораторных животных в крупных бактериологических лабораториях или научных учреждениях. Описание этих методик приводится ниже в соответствующих разделах Методических указаний.
В санитарно-бактериологических лабораториях районных санэпидстанций можно проводить исследование почв на присутствие тифопаратифозных и сальмонеллезных возбудителей. Необходимость в проведении таких анализов возникает при расследовании вспышек, при установлении источника заражения, а также при проведении противоэпидемических мероприятий.
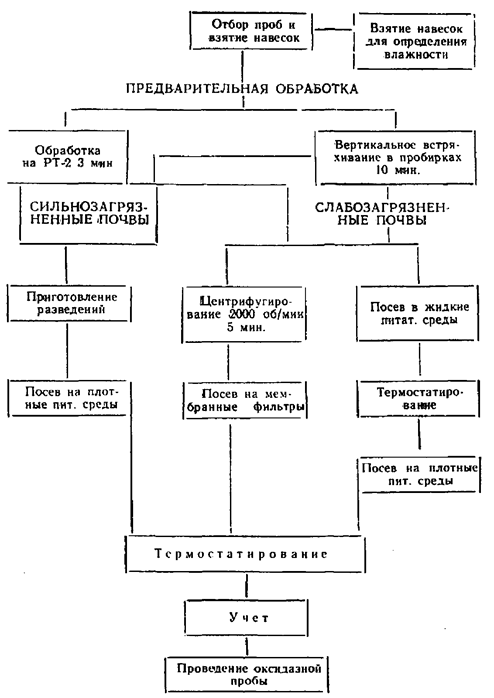
III. Отбор проб и предварительная обработка почвенных образцов для анализа
Санитарное обследование, выбор точек отбора проб
Увеличение количества источников загрязнения почвы привело к необходимости увеличения объема работы по санитарной охране почвы. В настоящее время санитарному надзору подлежат не только территории населенных мест, но и за их пределами.
Основными объектами, территории которых подлежат контролю органов санитарного надзора с применением санитарно-микробиологических методов исследования и требующими проведения ряда мероприятий по предотвращению загрязнения почвы, являются: детские и лечебно-профилактические учреждения; сельские и неканализованные районы городских населенных пунктов; территории первого пояса зоны санитарной охраны источников хозяйственно-питьевого водоснабжения; зоны свалок, отвальных площадок; сельскохозяйственные поля, орошаемые водой из открытых водоемов, стоками животноводческих ферм и комплексов и удобряемые навозом; земледельческие поля орошения городскими и промышленными сточными водами, а также при внесении их осадков в качестве удобрения.
Обязательным предварительным этапом при санитарно-бактериологическом исследовании почвы является санитарное обследование. Суть его заключается в том, что санитарный врач на основании предварительно составленной карты санитарного обследования визуально и в результате опроса описывает изучаемую территорию, выбирает на ней точки взятия проб, участвует в отборе проб. В Приложении 1 дан примерный образец карты санитарного обследования земельного участка.
На основании результатов санитарного обследования территории и ее описания составляется схематический план земельного участка с нанесением источников загрязнения. Это позволяет правильно обосновать выбор точек отбора проб почвы.
На изучаемой территории при наличии одного источника загрязнения выделяют два участка, 25 м2 каждый; один вблизи источника загрязнения (опытный), другой - вдали (контрольный). Контрольный выбирают с таким расчетом, чтобы он был заведомо незагрязненный и имел одинаковый почвенный состав с опытным.
Если на изучаемой территории имеется несколько источников загрязнения, то необходимо выделить несколько опытных участков около каждого, загрязняющего внешнюю среду, объекта. Если на территории нет видимых источников загрязнения, то необходимо выделить участки согласно элементам рельефа.
При санитарно-бактериологическом обследовании почвы значительных территорий определение количества точек для забора проб почвы производится согласно следующим рекомендациям. На каждые 100 га изучаемой территории при спокойном рельефе местности намечают к отбору проб почвы 6 - 7 участков площадью 25 м2. При выраженном рельефе количество отводимых участков увеличивается до 8 - 10.
Отбор образцов почвы
Пробы почвы отбираются на каждом из участков в его пяти точках по диагонали или по "конверту" (четыре точки по углам и одна в центре).
В том случае, если исследователя интересуют последствия непосредственного внесения химического вещества в почву, пробы отбираются поверхностно (0 - 1 см) стерильным инструментом (нож, шпатель) в количестве 0,3 - 0,5 кг в одной точке.
Если изучается воздействие химического вещества на микрофлору почвенного горизонта, то для отбора проб почвы пользуются следующей методикой. Каждая точка, в которой проводится отбор проб почвы, представляет собой центр выбранного для исследования 1 м2 территории. Здесь выкапывается прикопка (шурф) размером в плане 0,3 м×0,3 м и глубиной 0,2 м. Поверхность одной из стенок шурфа очищают стерильным ножом. Затем из этой стенки вырезают почвенный образец, размер которого обусловлен заданной навеской. Так, если необходимо отобрать 200 г почвы, размер образца 20 см×3 см×3 см, 500 г - 20 см×5 см×3 см.
При изучении воздействия пестицидов и др. химических веществ на микрофлору и процессы самоочищения в более глубоких слоях почвы, для отбора проб почвы пользуются шурфом глубиной до 1 м. Пробы отбираются из стенки шурфа стерильным инструментом через каждые 10 см.
В тех случаях, когда исследователя интересует влияние химических веществ на микрофлору почвы и процессы самоочищения в более глубоких слоях почвы, не имеет большого смысла отбирать пробы почвы, а следует производить изучение грунтовых вод, отбираемых с помощью прибора Гончарука.
Отобранные образцы помещают в стерильную посуду и доставляют в лабораторию. При невозможности приступить к исследованию почвы немедленно, допускается хранение образца при температуре 4 - 5°, но не более 24 часов.
Подготовка и обработка почвы для анализа
Для приготовления среднего образца объемом 0,5 кг почву всех образцов одного участка высыпают на стерильный плотный лист бумаги, тщательно перемешивают стерильным шпателем, отбрасывают камни и прочие твердые предметы. Если проба почвы однородна, допускается тщательное перемешивание почвы в банке. Затем почву распределяют на листе ровным тонким слоем в форме квадрата.
Диагоналями почву делят на 4 треугольника. Почву из двух противоположных треугольников отбрасывают, а оставшуюся вновь перемешивают, опять распределяют тонким слоем и делят диагоналями и так до тех пор, пока не останется примерно 0,5 кг почвы.
Перед посевом почву диспергируют. С этой целью почву с соблюдением условий стерильности просевают через сито диаметром 3 мм. При просеивании сито покрывают сверху стерильной бумагой. Почву дисперсную можно не подвергать просеиванию. Почву торфяную, содержащую большое количество органических веществ, предварительно растирают в ступке. Неперегнившую растительную массу отбрасывают.
Образец почвы тщательно перемешивают и из него отбирают навески, величины которых выбираются исходя из предполагаемой степени загрязнения почвы и планируемых определений. Для учета почвенных микроорганизмов и энтеровирусов достаточно навески от 1 до 10 г, для санитарно-показательных микроорганизмов от 1 до 30 г, для патогенных энтеробактерий (50 - 55,5 г). Первое разведение навески почвы (1:10) делают в стерильной посуде, добавляя стерильную водопроводную воду в соотношении 1:10 к весу почвы (например: 1 г почвы разводят в 10 мл стерильной водопроводной воды, 10 г почвы - в 100 мл воды и т.д.). После приготовления навески применяют соответствующую предварительную обработку почвы в зависимости от типа и вида учитываемого микроорганизма. Основная цель, которую преследуют проводя предварительную обработку почвы, заключается в том, чтобы извлечь клетки микроорганизмов из почвенных агрегатов, что достигается разрушением последних и десорбцией микроорганизмов с поверхности почвенных частиц.
Основными приемами предварительной обработки почвы являются: 1) 10-минутное вертикальное встряхивание почвенной суспензии первого разведения в пробирках с резиновыми пробками - при навеске почвы 1 г; 2) 3-минутная обработка почвенной суспензии первого разведения на мешалке механического диспергатора (размельчитель тканей, марки РТ-2) - при навеске почвы более 1 г.
Почвенную суспензию, содержащую в 1 мл 0,1 г почвы, через 30 секунд после предварительной обработки (за это время оседают грубые минеральные частицы) используют для приготовления последовательно убывающих концентраций почвы. Для этого из первого разведения, находящегося во флаконе, с содержанием почвы 0,1 г/мл отбирают стерильной пипеткой 1 мл и переносят в пробирку с 9 мл стерильной водопроводной воды. При этом получают второе разведение, содержащее 0,01 г/мл почвы. Повторяя эту операцию, доводят разведение почвы до 0,0001 - 0,00001 г/мл. Для приготовления каждого разведения используют отдельные пипетки.
Приготовленные децимальные разведения используются для посева почвы на различные питательные среды, а также для учета численности микроорганизмов методом прямой микроскопии.
Для определения отдельных показателей применяются и другие способы обработки, описание которых приводится ниже в соответствующих разделах.
Для получения сравнимых и более полных результатов желательно производить пересчет количества обнаруживаемых микроорганизмов на 1 г абсолютно сухой почвы. Для этого необходимо производить определение влажности анализируемого образца почвы. С этой целью навеску почвы (10 - 20 г) помещают в заранее взвешенный стеклянный или металлический бюкс и высушивают в сушильном шкафу при 105 °C. Первое контрольное взвешивание высушенной почвы делают через 3 часа, затем высушивают почву до постоянного веса (контрольное взвешивание каждые 2 часа). Расчет производится по следующей формуле:
![]()
N - количество клеток бактерий в 1 г абсолютно сухой почвы;
Nc - количество клеток бактерий в 1 г сырой почвы;
а - степень десятикратного разведения;
n - число колоний, выросших на чашке (берется среднее арифметическое из всех чашек);
С - влажность исследуемой почвы (%).
IV. Санитарно-бактериологическое исследование почвы
IV.1. Определение микробиологических показателей, характеризующих фекальное загрязнение почвы
Определение количества бактерий группы кишечных палочек
К бактериям группы кишечных палочек (БГКП) относятся грамотрицательные, не образующие спор короткие палочки, сбраживающие лактозу и глюкозу с образованием кислоты и газа при 37 ± 0,5 °С в течение 24 - 48 часов, не обладающие оксидазной активностью.
В настоящее время имеется возможность дифференцированно подходить к выбору методики определения БГКП в почве (рис.). При анализах почв, для которых предполагается невысокая степень фекального загрязнения, рекомендуется проводить определение БГКП титрационным методом. При этом возможно использование любой из двух равнозначных по эффективности сред - Кесслера-Свенертона или лактозного бульона с трифенилтетразолием хлорида (ТТХ). В качестве ускоренного метода для анализа слабозагрязненных почв рекомендуется использовать метод мембранных фильтров. При анализах проб с предполагаемой высокой степенью фекального загрязнения можно проводить прямой поверхностный посев разведений почвенной суспензии на среду Эндо.
Дальнейшая идентификация БГКП проводится по стандартной
методике
------- - предлагаемые усовершенствования
Рис. Определение бактерий группы кишечной палочки в почве
Для исследования используются предварительно подготовленные почвенные суспензии и разведения по описанной выше методике.
Определение кишечных палочек в почве титрационным методом. Из первого разведения почвенной суспензии (1:10), прошедшей предварительную обработку, стерильной пипеткой берут 10 мл и засевают во флаконы с 50 мл жидких сред, что соответствует засеву 1 г почвы. Посев меньших количеств (0,1 г, 0,01 г и т.д.) делают по 1 мл из соответствующих разведений почвенной суспензии в пробирки с 9 мл тех же сред.
Перед посевом в каждую пробирку с лактозным бульоном прибавляют по 0,3 мл 2 % водного раствора ТТХ, а в каждый флакон - по 1,5 мл. Методика с использованием ТТХ основана на способности кишечной палочки восстанавливать бесцветное соединение ТТХ в трифенилформазан, выпадающий в виде осадка и придающий среде коричневато-красный цвет. Кишечная палочка устойчива к действию формазана, в то время как развитие другой микрофлоры тормозится.
Посевы на среде Кесслера-Свенертона выращивают 48 часов при 43° или 37°. Отсутствие через 48 часов газообразования и помутнения в бродильных сосудах дает окончательный отрицательный ответ на наличие бактерий группы кишечных палочек. Отрицательный ответ на лактозном бульоне с ТТХ дается через 24 часа в том случае, если в пробирках и флаконах цвет среды не изменился.
При наличии в сосудах со средой Кесслера-Свенертона газообразования и помутнения или только помутнения производят высев на среду Эндо или на розоловый агар. Для посева на среду Эндо отбираются те сосуды с лактозным бульоном, цвет которых изменился в кирпично-красный. Чашки с посевами помещают в термостат на 24 часа при температуре 37°. Ход анализа в дальнейшем одинаков, независимо от того, какая среда использовалась первоначально.
Отсутствие роста на чашках дает окончательный отрицательный ответ. Типичными для кишечных палочек колониями являются красные, розовые с металлическим блеском, не разлагающие лактозу, и бесцветные на среде Эндо и желтые и оранжевые - на розоловой среде.
Заключительный этап исследования заключается в идентификации выросших на агаризованных средах характерных колоний, которая производится аналогично анализу кишечных палочек в воде. Из типичных колоний приготовляют мазки и окрашивают их по Граму.
У грамотрицательных палочек проверяют оксидазную активность. Постановка оксидазного теста при этом осуществляется следующим образом: петлей или стеклянной палочкой снимают колонии грамотрицательных палочек со среды Эндо и наносят штрихом на фильтровальную бумагу, смоченную специальным реактивом, (пропись приготовления которого дана ниже, в разделе "питательные среды"). В месте нанесения бактериальной массы цвет бумаги не изменяется, если оксидазный тест отрицательный, и синеет в течение 1 мин, если бактерии имеют активную оксидазу. Исследование изолированных колоний является обязательным, иначе можно необоснованно отбросить кишечную палочку при ложном посинении за счет примеси оксидазоположительных бактерий. Если оксидазный тест со среды Эндо проявляется недостаточно четко из-за того, что мешают ингибиторы, то для получения правильного результата такие колонии можно пересеять на скошенный питательный агар и после подращивания повторить оксидазный тест.
При наличии на поверхности агаризованной среды Эндо розовых или красных колоний грамотрицательных палочек с отрицательной оксидазной активностью их подсчитывают и причисляют к бактериям группы кишечных палочек после подтверждения ферментации глюкозы. Для этого засевают 2 - 3 колонии каждого типа в полужидкую среду с глюкозой. Учет производят через 4 - 5 и 18 часов инкубации при 37 °C. Если за это время в среде происходит образование кислоты и газа, то это подтверждает наличие кишечных палочек в исследуемом разведении почвы. Признаком газообразования является всплывание на поверхность среды ватного тампончика или появление пузырька газа в стеклянном поплавке; об образовании кислоты свидетельствует пожелтение среды. При наличии только кислоты пробирки оставляют в термостате для окончательного ответа через 24 часа. При отсутствии газообразования через этот срок получают окончательный отрицательный ответ, при наличии газообразования - положительный результат. Результаты анализа выражают колититром.
Определение кишечных палочек в почве методом мембранных фильтров. В качестве ускоренного метода для обнаружения БГКП целесообразно использовать метод мембранных фильтров. При этом через стерильные мембранные фильтры № 3 пропускают 5 - 10 мл почвенной суспензии первого разведения (1:10). Для того, чтобы облегчить фильтрование почвенной суспензии через мембранный фильтр, желательно до фильтрования провести после предварительной обработки центрифугирование почвенной суспензии при 2000 об/мин в течение 5 минут. При этом происходит осаждение крупных почвенных частиц и фильтрование почвенной суспензии происходит значительно эффективнее.
Мембранные фильтры № 3 перед употреблением стерилизуют путем кипячения в дистиллированной воде на медленном огне (во избежание скручивания фильтров). Кипячение проводят 2 раза по 20 минут, сливая каждый раз воду. После последнего кипячения воду не сливают, фильтры оставляют в воде до употребления.
По окончании фильтрования верхнюю часть прибора снимают. Мембранные фильтры с адсорбированными на них клетками бактерий осторожно захватывают обожженным пинцетом за край и накладывают на поверхность среды Эндо, налитой в чашки Петри и заранее остуженной, избегая образования пузырьков воздуха между мембранным фильтром и средой. В чашку можно поместить 4 фильтра. На чашке под каждым фильтром делают надпись с указанием номера пробы и объема профильтрованной суспензии (удобно это делать в виде дроби, например 1/5 - т.е. проба номер 1, профильтровано 5 мл и т.д.). Чашки с помещенными на них фильтрами ставят в термостат при температуре 37° на 24 часа. После инкубации отбирают 2 - 3 типичные колонии для окраски по Граму и дальнейшей идентификации, которая проводится аналогично тому, как это рекомендуется при работе титрационным методом, подробное описание которого приводилось выше.
Прямой поверхностный посев на агаризованные питательные среды для учета кишечных палочек в почве
При анализе загрязненных и сильнозагрязненных почв, отобранных в местах интенсивного фекального загрязнения, рекомендуется проводить прямой поверхностный посев почвенной суспензии в количестве 0,1 или 0,05 мл на поверхность среды Эндо обычным способом. Среда Эндо заранее разливается в чашке Петри и подсушивается в сушильном шкафу при температуре 50 - 60 °C до образования так называемой "муаровой" пленки. Возможно подсушивание чашек Петри со средой Эндо путем постепенного высушивания их при комнатной температуре. В этом случае чашки со средой Эндо оставляют на сутки на рабочем столе в положении - "крышкой вниз", прикрыв их от света. Посев при анализах сравнительно чистых почв производится из разведений от 1:10 до 1:1000. При работе с загрязненными почвами обычно используют разведения до 1:1000000. Посевы выращивают в термостате при 37° в течение 24 час. Следующий этап исследований заключается в идентификации выросших микроорганизмов, который проводится аналогично определению кишечных палочек титрационным методом.
Результаты анализа последними двумя методами можно выразить в колититре или колииндексе. В любом случае расчет ведется с учетом влажности анализируемой почвы. Чтобы подсчитать число клеток кишечной палочки в 1 г сырой почвы, необходимо среднее число колоний на чашке умножить на степень разведения, затем проводят перерасчет на 1 г абсолютно сухой почвы, согласно ранее приведенной формуле.
Определение в почве общего количества бактерий
Для характеристики в почве общего микробного загрязнения фекального происхождения используют определение численности микроорганизмов, преимущественно бактерий, растущих на мясопептонном агаре при 37 °C. При этом производят посев почвенных разведений в 1,5 % мясопептонный агар (возможно использование питательного агара дагестанского производства). Из каждой пробы почвы должно быть использовано для посева не менее двух различных разведений в зависимости от степени предполагаемого загрязнения исследуемой почвы. Перед посевом каждое разведение тщательно перемешивают стерильной пипеткой, после чего берут 1 мл суспензии и переносят на дно стерильной чашки. Из каждого разведения посев производят минимум на 2 параллельные чашки. После в каждую чашку вливают предварительно расплавленный и остуженный до 45° питательный агар в количестве 15 - 20 мл. Чашки Петри с расплавленным агаром хорошо перемешивают с имеющейся там почвенной суспензией, осторожно наклоняя чашки во все стороны. Затем чашки помещают на строго горизонтальную поверхность до затвердевания среды. На чашке должна быть сделана надпись с указанием номера или названия пробы и разведения.
После застывания агара чашки с посевом помещают в термостат в перевернутом виде (крышкой вниз) при температуре 37° на 24 часа.
После инкубации подсчитывают выросшие колонии и проводят пересчет на 1 г абсолютно сухой почвы.
Определение Cl. perfringens в почве
Рекомендуется два способа учета Cl. perfringens в почве.
Посев почвенных разведений в среде Вильсон-Блер. Из всех приготовленных почвенных разведений (до 1:1000000) по 1 мл переносится в два параллельных ряда пробирок. Один ряд пробирок прогревают при температуре 80 °C в течение 15 минут или при 90° - 10 минут. Затем во все пробирки наливают по 9 - 10 мл среды Вильсон-Блер, приготовленной ex tempore. Инкубация посевов производится при 37 °C или 43° в течение 24 часов. Учет можно производить и несколько раньше, так как санитарно-показательные клостридии, преимущественно Cl. perfringens, через несколько часов образуют колонии черного цвета. Наличие в мазках, приготовленных из этих колоний, характерных грамположительных палочек указывает на наличие Cl. perfringens.
В последние годы была показана также возможность использования вместо среды Вильсон-Блера сульфит-полимиксин-неомициновую среду, предложенную Г.И. Сидоренко и Ю.П. Пивоваровым для учета Cl. perfringens в объектах внешней среды.
Общепринятой методике индикации Cl. perfringens на среде Вильсон-Блер присущ существенный недостаток - питательная среда в определенной степени ингибирует рост Cl. perfringens. Для устранения этого явления разработана и предложена модификация учета содержания Cl. perfringens в почве.
Использование сред накопления для определения Cl. perfringens в почве. Модификация методики определения Cl. perfringens в почве, разработанной в Молдавском НИИ гигиены и эпидемиологии, заключается в следующем. По 1 мл прогретых и нативных почвенных разведений высевают в пробирки с жидкими и полужидкими питательными средами, предварительно регенерированных кипячением (Клодницкого, Китт-Тарроцци, бульона Мартена с ватой и др.). После инкубации (18 - 20 часов) при 37° производится высев в количестве 0,5 - 1 мл из помутневших пробирок в среду Вильсон-Блер или сульфит-полимиксин-неомициновую среду. Посев, инкубация и учет при этом производятся аналогично первому способу.
Определение термофильных бактерий
При выявлении степени фекального загрязнения почвы целесообразно провести определение в ней количества термофильных микроорганизмов. Как известно, последние несвойственны незагрязненным почвам. В почву термофилы попадают вместе с органическими удобрениями (навоз, компосты, термы). Сточные жидкости, фекалии и свежий навоз богаты кишечной палочкой, но бедны термофилами. Поэтому если почва содержит много кишечных палочек и много термофилов, то очевидно она была удобрена навозом и компостами. Почвы, показывающие высокое содержание кишечных палочек и бедные термофилами, можно рассматривать фекально загрязненными.
Учет термофильных сапрофитных микроорганизмов производят на мясопептонном агаре, который следует разливать более толстым слоем, чем обычно. Посев производят из разведений 1:10 - 1:1000000 на 2 - 3 параллельные чашки Петри. Термофильные бактерии выращивают при 60 ± 2 °C. Учет производят через 24 часа инкубации аналогично, как и при определении общего количества бактерий в грамме почвы.
Определение в почве нитрифицирующих бактерий
Нитрифицирующие бактерии завершают цикл превращения в почве азотсодержащих соединений, окисляя аммиак до нитритов и нитратов. Поэтому численность этих микроорганизмов довольно четко указывает на степень органического загрязнения, скорость и окончание распада органики в почве.
Определение нитрификаторов можно производить посевом разведений почвенной суспензии на плотных или жидких средах. Чаще всего применяется для этих целей минеральная среда Виноградского. Для этого производят посев почвенных разведений, приготовленных обычным способом, во флаконы со средой, разлитой тонким слоем. В опыт рекомендуется включать два незараженных флакона со средой, служащих контролем на чистоту среды. Посевы инкубируют при 28 °C в течение 14 - 15 суток.
При развитии нитрифицирующих бактерий в среде постепенно появляются азотистая и азотная кислоты. Образование окисных соединений азота рекомендуется проверять на 5 - 7 день после засева и вторично на 14 - 15 день. Титр нитрифицирующих бактерий чаще всего устанавливают с помощью качественной пробы с дифениламином; в присутствии азотистой и азотной кислот этот реактив дает синее окрашивание. Для этого пастеровской пипеткой несколько капель среды из каждого флакона, не взмучивая осадок, переносятся на стеклянную или фарфоровую пластинку. Затем добавляют несколько капель раствора дифениламина в концентрированной серной кислоте. Появление синего окрашивания указывает на присутствие в среде нитратов, как результат размножения нитрифицирующих бактерий. Среда контрольных флаконов не должна давать изменение окраски.
IV.2. Методы определения микроорганизмов, характеризующих загрязнение и самоочищение почвы от органических и химических загрязнений
Общее количество бактерий и нитрификаторов дает определенное представление о течении процессов загрязнения и самоочищения почвы от органических и химических загрязнений, но далеко не полное. В связи с этим, для более глубокого изучения этих процессов дополнительно применяется комплекс методов определения отдельных групп и видов почвенной микрофлоры: общая численность сапрофитных микробов, число споровых бактерий, аммонификаторов, целлюлозоразлагающих микроорганизмов и др.
Определение общей численности почвенных сапрофитных микроорганизмов
Напряженность микробиологических процессов почвы коррелятивно связана с размножением и активностью всей совокупности почвенных сапрофитных микроорганизмов. Существует несколько методов определения численности почвенных сапрофитов: посев почвы на питательные среды, прямая и электронная микроскопия. Практически применяются первые два метода.
Определение общей численности почвенных микроорганизмов на питательных средах. Для более полного учета общей численности сапрофитных микроорганизмов этим методом рекомендуется проводить диспергирование и десорбцию клеток с поверхности почвенных частиц следующим способом. Навеску почвы, используемую для приготовления первого разведения, доводят путем добавления небольшого количества стерильной водопроводной воды до пастообразного состояния. После чего почва в пастообразном состоянии растирается в течение 5 мин. Затем готовят первое разведение (1:10) почвы на стерильной водопроводной воде и почвенная суспензия охлаждается при -5 - 7° в течение 20 - 30 мин. По истечении срока охлаждения производят раститровку почвенной суспензии обычным способом.
Посев производится на поверхности почвенного агара, разлитого в чашки Петри. Термостатирование засеянных чашек ведется при 28 - 30 °C в течение 72 часов. Учет анализа и расчет общей численности почвенных микроорганизмов производится, как и при определении общего количества бактерий.
Определение общей численности почвенных микроорганизмов методом прямой микроскопии. При определении численности почвенной микрофлоры наиболее достоверные результаты можно получить при использовании методов непосредственного учета микроорганизмов в почве - прямой микроскопии. Желательно при этом пользоваться методом капилляроскопии по Перфильеву и Габе с последующей люминесцентной микроскопией. Обработка почвенной суспензии при этом проводится 1 % раствором акридинового оранжевого. Этот метод дает возможность определить в 10 раз большее количество живых микробных клеток в 1 г почвы за счет учета клеток, сорбированных на почвенных частицах.
Для этого к 1 мл почвенного разведения 1:10 добавляется 1 - 2 капли красителя. Через 5 секунд в почвенную суспензию помещают отрезок счетного капилляра (2 - 2,5 см). После заполнения капилляра его помещают на предметное стекло и фиксируют двумя каплями расплавленного парафина, нанося их на концы отрезка капилляра. Эти парафиновые капли одновременно защищают содержимое каналов. После этого приступают к подсчету общей численности почвенных микроорганизмов с помощью люминесцентного микроскопа при увеличении до 90×10.
Численность микроорганизмов в 1 г почвы определяется по формуле:
![]()
где Q - количество микроорганизмов в г изучаемого образца почвы;
m - средняя численность микроорганизмов в одном ходе капилляра;
1012 - объем 1 см3 в кубических мк;
И - объем одного хода капилляра в кубических мк;
С - кратность разведения суспензии, которое обычно равно 10.
Определение общего числа и процента почвенных бацилл
Этот показатель является индикатором глубины минерализации органического субстрата. В чистых почвах, с окончившимся процессом самоочищения, число бацилл относительно общей микробной обсемененности, достигает 20 - 50 %, в загрязненных сохраняется в пределах до 20 %. Однако содержание бацилл и их процент колеблется в зависимости от почвенно-климатических условий, поэтому в конкретных условиях необходимо устанавливать величины этих микробиологических показателей.
Для учета бациллярных форм микроорганизмов используются те почвенные разведения, что и для определения общей численности, предварительно прогретые при 80 °C в течение 15 минут. Посев может производиться на поверхность среды, состоящей из 50 % сусла и 50 % мясопептонного агара (pH 7,0 - 7,2), на поверхность агара Сабуро или почвенного агара. Термостатирование и учет производятся аналогично, как и при учете общей численности микроорганизмов.
Определение количества грибов и актиномицетов в почве
Данные по изучению загрязнения почвы указывает на большую чувствительность к действию отдельных химических веществ почвенных актиномицетов и грибов по сравнению с почвенными споровыми и неспоровыми бактериями. Несомненно, что такая разбалансировка равновесия в почвенном микробиоценозе, должна рассматриваться как отрицательное явление. Актиномицетам и грибам принадлежит большая роль в превращении широкого круга органических и минеральных веществ и благодаря чрезвычайно выраженным антагонистическим и токсическим свойствам они оказывают большое влияние на формирование микробных почвенных ценозов, являются продуцентами многих физиологических активных веществ - аминокислот, ферментов, витаминов.
Для учета почвенных актиномицетов и грибов используются те же разведения почвенной суспензии, что и при учете общей численности микроорганизмов, те же методы посева и учета. Как правило, для учета почвенных грибов используют разведения почвенной суспензии 1:10 - 1:100, а при учете актиномицетов - 1:100 - 1:10000. Посев производят поверхностным способом, нанося на агаризованные среды 0,1 - 0,05 мл суспензий. Для учета актиномицетов используется чаще всего крахмалоаммиачный агар или агар Ваксмана, при учете грибов - сусло-агар или минеральная среда Чапека. При учете грибов используют добавление в среду веществ, ингибирующих рост бактерий - концентрированную молочную кислоту в количестве 4 мл/л среды. Прибавление такого количества кислоты доводит pH среды до 4,0 - 4,5. Кислота добавляется непосредственно перед посевом в расплавленную среду. Поскольку прибавляют концентрированные кислоты, то их предварительно не стерилизуют.
Определение аэробных целлюлозоразлагающих микроорганизмов
Эта группа микроорганизмов осуществляет самоочищение почвы от остатков растительного происхождения. Чаще всего для учета этих микроорганизмов используют посев разведений почвенной суспензии в жидкую среду Гетчинсона. Среда разливается в колбочки или пробирки, куда в качестве источника углерода помещают фильтровальную бумагу; в колбочки опускают складчатый фильтр, в пробирки - полоски бумаги. Учет производится через 15 - 20 суток (инкубация при 28°) по разложению полосок фильтровальной бумаги и образованию колоний микроорганизмов на них.
Определение аммонификаторов в почве
Аммонифицирующие микроорганизмы принимают участие в расщеплении белковых соединений до аммиака. Их учитывают на мясопептонном агаре, а при необходимости на жидких пептонных средах (мясопептонный бульон, пептонная вода) с индикаторными бумажками, открывающими аммиак. Для определения выделяющегося аммиака над средой в пробирке подвешивают красную лакмусовую бумажку (при выделении аммиака она синеет) или полоски фильтровальной бумаги, пропитанные реактивом Круппа (от аммиака краснеют). При выращивании почвенных суспензий на мясопептонном агаре результаты выражают в количестве бактерий на 1 г почвы. При определении этого показателя в жидких средах определяют титр аммонифицирующих микроорганизмов по последней пробирке, в которой еще обнаруживается аммиак (на 10-е сутки) после термостатирования при температуре 25 - 30 °C.
Определение токсичности почв к микроорганизмам
Метод определения степени токсичности почв к микроорганизмам используется в качестве быстрого и достаточно чувствительного теста для получения ориентировочных данных о самоочищающей способности почвы от патогенных и санитарно-показательных микроорганизмов. Кроме того, этот тест оказался также чувствительным при определении влияния химических веществ на почвенный микробиоценоз. Низкая степень токсичности или ее снижение по отношению к патогенным микроорганизмам свидетельствует о наличии или возникновении более благоприятных условий для выживания возбудителей в таких почвах. К почвенным сапрофитам наоборот: высокая или повышенная токсичность - явление неблагоприятное. Степень токсичности почв отдельных территорий оценивается по классам:
|
1 - отсутствие |
- |
0 - 20 % |
токсичных |
образцов |
|
2 - слабовыраженная |
- |
21 - 40 % |
" |
" |
|
3 - средняя |
- |
41 - 60 % |
" |
" |
|
4 - сильновыраженная |
- |
61 - 80 % |
" |
" |
|
5 - абсолютная |
- |
81 - 100 % |
" |
" |
Для определения токсичности почв можно использовать два метода - качественный и качественно-количественный.
Качественный метод определения токсичности почв. В стерильную чашку Петри вносится 10 г перемешанной и просеянной почвы и ровным слоем распределяется на половину дна чашки. На дне и крышке чашки записывается номер пробы по журналу и тест-микроорганизм. Затем чашки переносятся в бокс и устанавливаются на ровной поверхности. Чашки с почвой заливают 1,5 % непитательным агаром в количестве около 10 мл с таким расчетом, чтобы он покрыл слой почвы. После его застывания в чашки вносится питательный агар также в количестве 10 мл адекватный тест-микроорганизмам. С одного почвенного образца готовятся 2 параллельные чашки к каждому микроорганизму. Чашки высушивают под бактерицидными лампами в течение 30 минут. Затем производится посев индикаторных штаммов микроорганизмов.
Посевы производятся петлей, причем движения петли всегда начинают с той части чашки, на которой помещена почва. В качестве контроля производят посевы тех же культур на аналогичные среды, но без почвы.
Посевы инкубируют в зависимости от вида индикаторного микроорганизма. Учет результатов начинается с просмотра контрольного посева. В случае равномерного роста тест-микроба на всей поверхности агаровой пластинки просматривают остальные чашки с посевами. Колонии идентифицируются по "форме роста". Кроме того, из каждой серии посевов с нескольких чашек снимают колонии и производят их идентификацию.
Распределение выросших колоний на всей поверхности среды свидетельствует о том, что исследуемая почва нетоксична (Н/Т), а в случае роста колоний только на участке агаровой пластинки, под которой нет почвы, показывает, что исследованный почвенный образец токсичен (Т). При исследовании некоторых почвенных проб отмечается частичное ингибирование роста тест-микроба. В этих случаях регистрируется маловыраженная токсичность (М/Т).
Качественно-количественный метод определения токсичности почв. В стерильную чашку Петри также вносится 10 г почвы, но распределяется равномерно по всей поверхности, затем, как и при качественном методе, вносится непитательный и питательный агар. В качестве дополнительного барьера между почвой и индикаторным штаммом на поверхности питательной среды укладывают мембранный фильтр.
На матовую поверхность мембранных фильтров № 3 - 4 простым карандашом наносятся 16 точек, после чего фильтр стерилизуется кипячением обычным способом. Затем на поверхность питательной среды помещаются мембранные фильтры (матовая поверхность - вверх) в количестве от 1 до 4-х на одну чашку.
На поверхность фильтра в местах, отмеченных точками, производится посев бактериальной петлей (иглой) культуры индикаторного штамма, суспензированного в физиологическом растворе, содержащем около 100 млн бактериальных клеток в 1 мл по оптическому стандарту мутности. Эта манипуляция упрощается при использовании специального штампа в виде металлического диска диаметром около 30 мм. В диск вмонтированы 16 стальных игл строго одинаковой длины и толщины. Культуры микроорганизмов наливаются в чашки Петри и погружают в них кончики игл стерильного штампа, а затем одновременно производится посев в 16 точках мембранного фильтра. Посевы инкубируются в термостате или анаэростате при оптимальной температуре и продолжительности в зависимости от физиологических особенностей каждого вида.
Учет результатов производится путем подсчета выросших колоний от количества точек посева. Процент пророста (Р) высчитывается как количество образовавшихся колоний к количеству посевов. Токсичность определяется по формуле: Т = 100 - Р. Этим методом, как и качественным, устанавливается абсолютная токсичность, когда на фильтрах не вырастает ни одной колонии; отсутствие токсичности - на местах всех посевов вырастают колонии и различная степень токсичности - когда прорастает только часть засеянных точек.
IV.3. Методы определения влияния химических веществ на микроорганизмы
Для установления влияния химических соединений применяются разнообразные методические приемы, которые позволяют изучить течение процессов самоочищения от органических, бактериальных и самих химических веществ в почве. Применяемые методы можно разделить на 4 группы: 1) определение действия соединений на культуры микроорганизмов; 2) изучение влияния химических веществ на отдельные сапрофитные и патогенные микроорганизмы в почве в экспериментальных условиях; 3) то же самое в натурных опытах; 4) определение способности микроорганизмов к метаболизму химических веществ.
Определение действия химических соединений на отдельные виды микроорганизмов
Для установления характера действия соединений на отдельные виды микроорганизмов, поиска тест-микроорганизмов, наиболее чувствительных к отдельным веществам проводят культивирование микробов на средах с изучаемым препаратом.
Посев на плотные питательные среды - наиболее простой экспрессный метод изучения действия соединения. Он позволяет получить качественную и количественную характеристику действия препаратов. Для проведения исследований в расплавленный и охлажденный до 45° питательный агар вносят по расчету изучаемый препарат в необходимой концентрации. Агар разливают в чашки и после его застывания и подсушивания делят штрихом посев испытуемых типов микробов на отдельные секторы. Одновременно те же культуры высевают на секторе питательной среды без изучаемого соединения. Посевы выращивают при оптимальной для данных микробов температуре и через 24 - 48 час. учитывают рост. Сравнение интенсивности роста культур в опыте и контроле позволяет дать предварительную характеристику антимикробного действия: препарат не действует, ингибирует, стимулирует или прекращает рост испытываемых тест-микробов.
Для установления степени воздействия препаратов на микроорганизмы необходимы количественные исследования. Для этого в ряд чашек вносят по 1 мл суточной суспензии тест-микроорганизмов (100 - 200 клеток в 1 мл) и заливают их питательной средой с различными концентрациями испытуемого соединения. Через 24 - 48 часов подсчитывают количество выросших колоний и сравнивают данные опыта и контрольных исследований. Эти данные позволят дать количественную характеристику действия химических веществ. Оценка будет особенно убедительна при использовании методов статистической обработки. Для возможного применения статистических методов необходима трехкратная повторность посевов для каждой концентрации веществ.
Исследование в жидких средах позволяет проследить за динамикой влияния соединений на микроорганизмы во времени и дать количественную характеристику его действия. При использовании в качестве питательной среды почвенного экстракта возможно получение результатов, наиболее близких к естественным условиям пребывания тест-микробов в почве. При постановке опытов питательные среды разливают в стерильные колбочки и вносят в них необходимые количества веществ (кроме контролей). Заражение всех сред производят равным объемом культуры, создавая в среде концентрацию микроорганизмов, обычную для естественных условий.
Посевы инкубируют при комнатной температуре. На 1, 3, 5, 7 и 10 сутки определяют число бактерий в опытах и контрольных средах высевом из них на элективную для тест-микробов среду, турбидиметрически или с помощью капилляров Перфильева. По окончании опыта строят график кривой развития популяции бактерий для каждой испытуемой концентрации пестицида. Сравнением кривых опыта и контроля определяют характер действия: бактериостатический, бактерицидный, стимулирующий или недействующий.
Постановка экспериментальных и натурных опытов и наблюдений
Для получения данных, наиболее близких к естественным условиям, рекомендуется изучение действия химических соединений на микроорганизмы проводить на почвенных образцах.
Для этого испытуемую почву в количестве 2,0 - 2,5 кг помещают в стерильные сосуды из нейтрального материала (лучше всего в стеклянные и фарфоровые). Готовят суспензию микроорганизма тест-претендента из 24-часовой культуры на физиологическом растворе. Почву обсеменяют суспензией тест-микроорганизмов из расчета близкого к их содержанию в естественных условиях. Микроорганизмы равномерно распределяют в почве перемешиванием. После внесения в почву культуры, в нее же вносят исследуемое вещество в заданном количестве, увлажняют почву и равномерно перемешивают. Сосуды выдерживают в условиях естественного освещения и температуры. Для поддержания постоянной влажности (60 % от полной влагоемкости) сосуды с почвенными образцами можно помещать в герметически закрытые эксикаторы, на дно которых налита вода.
Пробы почвы для исследования чаще всего отбирают через 1, 3, 5 и 10 и более суток (в первый месяц). Обычно исследования проводят до 120 суток, начиная со второго месяца, анализ производится раз в месяц. Исследования проб проводят обычным посевом 10 % почвенной суспензии с использованием элективных для исследуемого тест-микроорганизма сред или прямым счетом в капиллярах.
Для суждения о действии изучаемого вещества опыты сопровождаются контролем, отличающимся отсутствием испытуемого вещества. Количественная характеристика популяции тест-микробов в почве в динамике по суткам представляет основание для определения характера действия соединения: бактерицидное или бактериостатическое действие либо отсутствие действия.
Определение способности микроорганизмов к метаболизму химических веществ
Участие почвенной микрофлоры в биологической деструкции химических соединений проводится экспериментально в лабораторных условиях. Наиболее простым способом установления участия микроорганизмов в биодеградации является сравнение (в аэробных или анаэробных условиях) динамики изменения количества соединений в естественной почве и почве, не содержащей живых микроорганизмов. Для этого почву в количестве 0,3 - 0,5 кг помещают в ряд сосудов и создают анаэробные или аэробные условия. В части сосудов почву вносят стерилизованную. В нативную и стерильную почву вносят заданное количество изучаемого вещества, равномерно перемешивают его с почвой, увлажняют его стерильной водопроводной водой. Влажность почвы на уровне 60 % поддерживают постоянной весь период опыта. Сосуды прикрывают стеклом и оставляют при естественной температуре и освещении.
Периодически определяют количество внесенного соединения в нативной и обеспложенной почве. Одинаковая динамика изменения его содержания в нативной и стерильной почве свидетельствует об отсутствии роли микроорганизмов в процессах его метаболизма. Опережение процесса разрушения в естественной почве, по сравнению со стерильной, указывает на положительную роль почвенной микрофлоры в детоксикации тех или иных соединений.
Возможно изучение роли определенных видов микроорганизмов в разложении пестицидов и других веществ. Для этого используют чистые культуры тест-микробов. Последние выращиваются в обычных питательных средах, либо в средах, близких по составу к почве (почвенный экстракт). В среду вносят изучаемое соединение в заданной концентрации и тест-микроб в количестве 1 млн клеток/мл. Для заражения лучше использовать суточную суспензию тестмикроба в физиологическом растворе. Контрольные серии с тем же количеством химического вещества не заражают микроорганизмами. На 10, 20, 30-е сутки определяют количество внесенного вещества в опыте и контроле. Уменьшение его в присутствии микроорганизмов подтверждает их роль в биологическом превращении.
Кроме того, для этих целей могут быть использованы специальные питательные среды, не содержащие углерод или азот. Рост микроорганизмов на таких средах с внесением в них соединений, содержащих углерод или азот, указывает на их включение в метаболизм микробов.
Для суждения о включении химических соединений в метаболизм бактерий можно использовать радиоавтографический метод. Для этого исследования проводят с веществами, меченными радиоактивным углеродом. Обнаружение радиоактивного углерода в микробных клетках указывает на биологическую природу снижения содержания соединения в питательной среде.
При оценке результатов исследований по изучению воздействия химических соединений на почвенный микробиоценоз следует исходить из положения, что увеличение или уменьшение общей численности, отдельных видов и групп микрофлоры или ее биологической активности на 15 - 20 % по сравнению с контролем следует расценивать как наличие влияния изучаемого химического вещества. В том случае, если эти изменения сохраняются в течение 5 - 7 дней, можно говорить о неблагоприятном воздействии изучаемого вещества на состояние почвенного микробиоценоза. Это положение необходимо использовать при выборе критической дозы химического соединения, оказывающей воздействие на почвенный микробиоценоз, как один из показателей вредности при установлении ПДК химических токсических веществ в почве.
IV.4. Определение патогенных бактерий и вирусов в почве
Определение сальмонелл в почве
С целью определения сальмонелл в почве могут быть использованы два равнозначных по эффективности метода.
1. Усовершенствованный метод коагуляции с центрифугированием по Фиккеру (увеличение скорости центрифугирования с 3000 об/мин до 5000 об/мин повысило чувствительность метода в 5,8 раза).
2. Метод обнаружения сальмонелл в почве с использованием магниевой среды накопления, исключающей необходимость дополнительной обработки почвенной суспензии (коагуляцию с центрифугированием).
Выделение сальмонелл из почвы методом коагуляции с центрифугированием. Для концентрирования сальмонелл применяется 10 % раствор сернокислого железа (Fe2(SO4)3). В исследуемый объем почвенной суспензии (500 мл) добавляют 2 мл 10 % раствора углекислого натрия (Na2CO3) для подщелачивания, что способствует процессу коагуляции, и 1,7 мл 10 % раствора Fe2(SO4)3. Суспензию тщательно перемешивают с коагулянтами и помещают на 1 час в холодильник при температуре +4° до полного образования хлопьев.
Через час осадок вместе с надосадочной жидкостью разливают в стерильные центрифужные стаканы по 100 мл и центрифугируют 5 минут со скоростью 5000 об/мин. Если позволяет техническая возможность лаборатории лучше проводить центрифугирование 500 мл почвенной суспензии без ее предварительного дробления. Жидкость над осадком, образовавшимся после центрифугирования, выливают и добавляют по 1,0 мл 25 % раствора виннокислого калия, тщательно перемешивают и содержимое всех центрифужных стаканов сливают в одну колбу для дальнейшего исследования.
По 0,1 - 0,5 мл образовавшейся взвеси пипеткой засевают на 3 - 5 чашек с висмут-сульфитным агаром и шпателем растирают по поверхности агара. К оставшейся взвеси добавляют 50 мл желчного бульона с концентрацией желчи 10 - 20 %. Посевы инкубируются при температуре 37 °C.
Из сред накопления делают высев петлей на 3 - 5 чашек висмут-сульфитного агара через 5 часов инкубации, второй - через 20 часов. При этом основным является посев через 5 часов, а через 20 часов - дополнительным (в случае отсутствия срочности результатов исследования можно ограничиться лишь высевом через 20 часов инкубации желчного бульона).
Дальнейшая идентификация сальмонелл проводится по общепринятой методике.
Применение магниевой среды "М" для обнаружения сальмонелл в почве. Этот метод более простой, не требует каких-либо дефицитных реактивов и специального оборудования. Применение магниевой среды "М" сокращает время обработки каждой пробы почвы на 1,5 часа. Однако, следует учитывать, что среда "М" угнетает рост сальмонелл тифа.
В данном случае среда "М" используется в экспедиционной модификации Г.Г. Калины.
В почвенную суспензию вносят растворы и навески ингредиентов среды "М" с расчетом на исследуемый объем суспензии.
Посевы инкубируются в термостате при температуре 37°. Через 18 - 20 часов производят высев петлей на 3 - 5 чашек висмут-сульфитного агара. Дальнейшая идентификация проводится по общепринятой методике.
При исследовании сильнозагрязненных почв возможна замена желчного бульона и среды "М" широко распространенным в настоящее время селенитовым бульоном в классической прописи в первом случае и двойной концентрации - во втором (соотношение почвенной суспензии и среды 1:1). Однако необходимо отметить, что чувствительность метода коагуляции с центрифугированием при этом снижается на один, а без обработки коагулянтами - на два порядка, к тому же при использовании селенитового бульона высев через 5 часов инкубации малорезультативен.
Индикация и выделение патогенных клостридий из почвы
Индикация и выделение столбнячной и ботулинической палочек из почвы производится аналогично как и из других объектов внешней среды и при исследовании материалов от больных и трупов. Особенностью являются методические приемы предварительной обработки почвы до проведения анализа.
Исследования почвы на наличие патогенных клостридий могут производиться в обычных условиях санитарно-бактериологических лабораторий, имеющих виварий и экспериментальных животных (белые мыши, морские свинки).
Идентификация и выделение столбнячной палочки. Основным методом обнаружения Cl. tetani в почве является биологическая проба на лабораторных животных. Существует несколько способов подготовки образцов почвы к исследованию.
Исследование нативных почв. Предварительно образцы почв хорошо перемешивают в стерильных (обожженных спиртом) лотках, отбирают 3 - 5 г, которые переносят в стерильные фарфоровые ступки и тщательно растирают после чего добавляют 6 - 8 мл физиологического раствора, перемешивают и оставляют на 1 - 2 часа при комнатной температуре. Из полученной взвеси по 1 мл внутримышечно вводят двум белым мышам в правую заднюю лапку (в бедро); морским свинкам можно ввести 3 - 5 мл взвеси. При наличии столбнячной палочки в почве через 2 - 3 дня у мышей развивается типичная картина столбняка. Для окончательного решения вопроса о наличии столбнячной палочки в исследуемом образце ставят реакцию нейтрализации с противостолбнячной сывороткой (Руководство по санитарной охране почвы, М., 1972).
Методы пастеризации.
а) Исследуемый образец почвы, взвешенный в изотоническом растворе в соотношении 1:2 - 1:10, прогревают во флаконах на водяной бане при температуре 90° в течение 10 минут. Затем взвесь помещают в аппарат для встряхивания и взбалтывают 10 - 15 минут, после чего отстаивают в течение 1 - 2 минут и по 1 - 1,5 мл надосадочной жидкости внутримышечно вводят в заднюю правую лапку 2-м белым мышам. Учет производится как и при введении животным взвеси из нативной почвы.
б) Исследуемый образец в чашках Петри высушивают в печи Пастера при температуре 37° в течение 50 минут, затем растирают в стерильной ступке до порошкообразного состояния и просеивают через 3-мм стерильное сито. После образец прогревают при температуре 80° в течение 30 минут. Два грамма прогретой почвы помещают в стерильные пробирки, добавляют 6 мл стерильного изотонического раствора и снова прогревают при температуре 60° в течение 1 часа. Этот материал в количестве 1 - 1,5 мл вводят белым мышам аналогично как было указано выше. Контрольным животным за 48 часов до опыта необходимо ввести от 0,1 до 3 АЕ противостолбнячной сыворотки.
Гибель первой группы животных с характерными симптомами (функции конечностей нарушаются, хвост вытягивается, возникает искривление позвоночника) наряду с выживанием контрольных мышей указывает на наличие Cl. tetani в исследуемых образцах.
Подобные методические приемы обработки образцов почвы могут привести, однако, к уничтожению вегетативных, а частично и споровых форм столбнячной палочки. Поэтому более целесообразным является метод с подращиванием на питательных средах.
Метод с подращиванием. Нативную и прогретую при 80° в течение 15 - 20 минут почву засевают в питательные среды для культивирования анаэробных микроорганизмов (Китт-Тароцци, бульон Мартена с комочками ваты и др.). Биологическую пробу на белых мышах ставят путем введения им культуральной жидкости на 3 - 4 сутки инкубации. При этом методе опытным животным предварительно вводят противогангренозные сыворотки, а контрольным - противогангренозные и противостолбнячные сыворотки. Учет результатов аналогичен, как и при введении животным почвенных суспензий.
При всех методах предварительной обработки почвы наблюдение за опытными и контрольными животными необходимо вести в течение 10 дней.
Посев в питательные среды позволяет выделить и культуры столбнячной палочки. Выделение Cl. tetani производится по обычной методике.
Индикация и выделение ботулинической палочки. Для индикации и выделения возбудителя ботулизма производят посев почвы в среды накопления, преимущественно Китт-Тароцци.
Две навески почвы по 20 - 30 г растирают в стерильной ступке с физиологическим раствором или 1 % пептонной водой и засевают во флаконы с 80 - 100 мл питательной среды. Один флакон прогревают на водяной бане при 80° в течение 30 минут. Оба флакона инкубируются при температуре 37° в течение 2-х недель.
Для индикации Cl. botulinum на 5-е сутки роста по 0,5 мл культуральной жидкости, разведенной 1:2 - 1:3 физиологическим раствором, вводят 2-м белым мышам внутрибрюшинно. В случае гибели белых мышей на 1 - 2-е сутки после заражения ставят реакцию нейтрализации с поливалентной сывороткой с содержанием в 1 мл 10 АЕ каждого типа ботулинической палочки. Для этого 1 мл поливалентной сыворотки смешивают с 1 мл культуральной жидкости, выдерживают 45 минут при комнатной температуре, затем ставят биологическую пробу. Двум мышам внутрибрюшинно вводят по 0,5 мл нейтрализационной культуральной жидкости, а 2-м - культуральную жидкость без сыворотки. Реакция нейтрализации считается положительной, если животные, которым вводили культуральную жидкость без противоботулинической сыворотки, погибли на 1 - 4-е сутки после заражения с клинической картиной заболевания, типичной для ботулизма, а животные, которым вводили смесь культуральной жидкости с противоботулинической сывороткой, остались здоровыми в течение 4 дней или заболевали с нетипичной для ботулизма клинической картиной.
Для определения типа Cl. botulinum в дальнейшем ставят реакцию нейтрализации с моновалентными противоботулиническими сыворотками типа А, В, С, Д, Е с активностью 10 АЕ в 1 мл. При наличии в пробах почв нескольких типов Cl. botulinum ставят реакцию нейтрализации с би- или тривалентными сыворотками.
Выделение культур Cl. botulinum производят из сред обогащения, положительных на ботулинический токсин, на 8 - 14-е сутки. Производят высев на чашках с сахарным кровяным агаром с последующим обычным ходом анализа при выделении культур Cl. botulinum из других объектов.
Обнаружение сибиреязвенной палочки в почве
Исследования по выделению Bac. anthracis из почвы производится в лабораториях, имеющих условия и разрешение на работу с возбудителями особо опасных инфекций.
Предварительная подготовка проб почвы. Навеску почвы в 5 - 30 г взбалтывают в течение 10 минут с 50 - 100 мл стерильной воды, а затем отстаивают. Для уничтожения вегетативных форм микроорганизмов к почвенной взвеси добавляют в избытке кристаллов мочевины и подогревают на водяной бане при температуре 37° в течение 5 - 10 минут. Надосадочную жидкость сливают, доводят по объему до 1-го литра стерильным физиологическим раствором; 0,5 л равными порциями фильтруют через 4 мембранных фильтра без прогревания, а вторые 0,5 л в колбах предварительно прогревают при температуре 65 - 70° в течение 30 минут или при температуре 80° в течение 10 минут и также фильтруют через 4 мембранных фильтра.
Для проведения люминесцентно-серологического анализа 2 фильтра засевают на чашки с 0,7 % МПА путем накладывания мембранного фильтра на питательную среду вверх поверхностью, через которую фильтровали почвенную взвесь, а с остальных фильтров делают смыв в стерильных чашках Петри, для чего на поверхность наносят 1 мл физиологического раствора. Смыв используют для посева на среду ГКИ, введения белым мышам (тест капсулообразования in vivo) и исследования люминесцентно-серологическим методом.
Аналогично исследуются и фильтры, через которые профильтровывали прогретую надосадочную жидкость.
Предварительный положительный ответ (сигнальный) дается на основании специфического свечения материала в люминесцентно-серологическом анализе, капсулообразования in vivo и in vitro.
Люминесцентно-серологический анализ. Из исследуемых суспензий, полученных с мембранных фильтров, делают мазки на предметных стеклах, фиксируют путем погружения на 10 - 15 минут в метанол и окрашивают продажной люминесцирующей адсорбированной сибиреязвенной сывороткой в рабочем разведении, указанном в наставлении и на этикетке ампулы. Для этого на препарат наносят каплю сыворотки и помещают на 20 мин во влажную камеру, затем промывают забуференным физиологическим раствором (pH 7,2 - 7,4) в течение 10 минут и докрашивают люминесцирующей сывороткой против глобулинов кролика в рабочем разведении, смешанной с бычьим альбумином, меченным родамином в течение 15 минут. Мазки вновь промывают забуференным физиологическим раствором, подсушивают, наносят каплю смеси 9 частей глицерина и одной части забуференного раствора и закрывают покровным стеклом. В препаратах, содержащих микробные клетки с капсулой, наблюдается их ярко-зеленое свечение.
Капсулообразование. Капсулообразование устанавливают "прямым" путем в результате бактериоскопии окрашенных (методами выявления капсул) мазков, приготовленных из фильтратов, а также мазков, приготовленных из посевов на питательные среды: Государственного Института им. Тарасевича, среду Томова или Буза.
Из различных способов окраски капсул наиболее простым и демонстративным является применение раствора Ребигера, который одновременно фиксирует и красит мазки. Берут 15 - 20 г генциана фиолетового и растворяют в 100 мл 40 % формалина. Раствор выдерживают при комнатной температуре несколько часов, затем фильтруют. Нефиксированный мазок покрывают краской на 15 - 20 секунд, после чего промывают водой и высушивают. Капсулы окрашивают в красно-фиолетовый цвет, а тело бациллы - в темно-фиолетовый.
Тест на капсулообразование in vivo по Шляхову и Груз проводится следующим образом. Исходный смыв с фильтров вводят по 0,5 мл внутрибрюшинно 6 - 8 белым мышам. После инокуляции материала животным, одну пару мышей оставляют под наблюдением 10 суток, как при классической биологической пробе. Остальных мышей забивают (по 2 мыши) через 1, 2 и 3 часа. Забитых мышей вскрывают. Из перитонеального экссудата и крови сердца делают мазки; из селезенки, почек, легких, печени делают мазки-отпечатки, окрашивают по Ребигеру или леффлеровской синькой и микроскопируют на предмет выявления капсульных палочек сибирской язвы.
Окончательное заключение дается на основании выделения чистых культур и их изучения.
Посев и идентификация чистых культур. Посев исходного материала производят на МПА или МПБ, приготовленные на переваре Хоттингера (аминного азота 100 - 110 мг%, pH среды 7,2 - 7,6). Посевы инкубируют при температуре 37° в течение 18 - 24 часов. На агаре сибиреязвенная палочка растет в виде серовато-белого сухого налета, по краям которого при малом увеличении видны локообразные завитки. В бульоне наблюдается рост на дне пробирки в виде комка ваты, бульон остается прозрачным.
На МПБ и МПА Bac. anthracis в обычных аэробных условиях растет в виде бескапсульных особей, что не позволяет определить один из важнейших признаков - капсулообразование. Для выявления последнего наилучшим, "прямым" способом является заражение животных (белых мышей) с последующим исследованием патолого-анатомического материала.
Существуют также другие лабораторные приемы выявления капсулообразования наряду с прочими признаками сибиреязвенного микроба. В частности, для этих целей предложен ряд элективных питательных сред: среда ГКИ, Томова, Буза.
Посевы на средах Томова и Буза инкубируют в атмосфере 20 - 40 % углекислого газа (в кристаллизаторе или микроанаэростате) в течение 18 - 24 часов, затем делают мазки, окрашивают и микроскопируют на предмет выявления капсульных палочек антракса. На средах Томова и Буза колонии сибиреязвенной палочки растут в S- или SM-форме: гладкие, блестящие, слизистой консистенции.
Идентификацию и дифференциацию выделенных культур проводят на основании главных и дополнительных опорных признаков. К ним относятся специфическая патогенность, капсулообразование, тест жемчужного ожерелья, лизабельность бактериофагом, люминесцентно-серологический тест. Дополнительными являются лецитиназная активность, неподвижность, отсутствие гемолиза, образование фосфатазы.
Описание этих методов приводится в практических руководствах по микробиологии, в том числе и в "Руководстве по микробиологической диагностике инфекционных болезней", М., 1973.
Санитарно-вирусологическое исследование почвы
При санитарно-вирусологических исследованиях почвы следует в первую очередь брать пробы из верхних слоев, так как установлено, что в природных условиях энтеровирусы адсорбируются главным образом верхними слоями почвы.
Отбор проб почвы для санитарно-вирусологических исследований производится так же, как и отбор для санитарно-бактериологического анализа, поэтому одни и те же пробы могут быть исследованы параллельно на наличие энтеровирусов и бактериальную обсемененность.
В отличие от санитарно-бактериологического анализа проб почвы, для которых все исследования необходимо производить непосредственно по доставлении проб в лабораторию, санитарно-вирусологический анализ состоит из нескольких этапов, которые могут значительно отстоять друг от друга во времени, так как первично обработанные пробы могут храниться в холодильнике в замороженном состоянии.
Первичную обработку проб почвы для санитарно-вирусологического анализа рекомендуется проводить в день отбора проб, непосредственно после транспортировки в лабораторию. При невозможности немедленной обработки проб, их помещают в холодильник при температуре +4° и обрабатывают на следующий день. Производить обработку проб позже чем через 24 часа после отбора проб не следует, так как титр энтеровирусов в пробе значительно падает и снижается возможность их выделения.
Предварительная обработка почвы для проведения вирусологических исследований. С целью максимальной десорбции адсорбированных на почвенных частицах вирусов применяют специальные приемы первичной обработки пробы почвы. Для этого в навеску почвы 5 г добавляют в качестве десорбента стандартную среду № 199, содержащую 5 % нативной бычьей сыворотки с pH 8,5. Проба тщательно перемешивается в течение 5 минут для разрушения почвенных конгломератов.
Для механического отрыва вирусов с почвенных частиц проба в течение 5 минут интенсивно встряхивается в вертикальной плоскости. Полученная почвенная суспензия центрифугируется при 4000 об/мин в течение 15 минут. Надосадочную жидкость отсасывают и переносят в стерильные флаконы, добавляют равное по объему количество этилового эфира. Эфир и пробу тщательно смешивают пипетированием или встряхиванием на шуттель-аппарате до получения гомогенной эмульсии. Флаконы закрывают ватными пробками и помещают в холодильник при температуре 4 - 6 °C. После того как эфир испарится (3 - 4 дня), флаконы перекрывают резиновыми пробками и хранят в замороженном состоянии при -15 - 20° до последующего вирусологического анализа.
Выделение цитопатических вирусов. С целью полного выделения из исследуемой пробы почвы группы энтеровирусов необходимо использовать параллельно минимум два вида культур ткани: первичную и перевиваемую.
В качестве первичной культуры ткани можно использовать клетки почек обезьян, фибробласты эмбриона человека, клетки почек человека. Из перевиваемых линий можно рекомендовать: НЕР-2, HeLa, PM, ФК и др.
Заражение культуры ткани производят во флаконах емкостью 50 - 100 мл. В силу того, что материал может обладать выраженным цитопатическим действием, заражение следует проводить следующим образом: после удаления питательной среды на монослой клеток наносят 0,5 - 1,0 исследуемой пробы и флакон помещают на 30 минут в термостат при 37°. Затем пробу сливают и добавляют 10 мл поддерживающей среды. Зараженные культуры клеток инкубируют в термостате 7 - 9 дней.
При отсутствии цитопатического действия на культуру ткани при первичном заражении, проводят 2 слепых пассажа по общепринятой методике в пробирках (не менее 2 пробирок на каждое заражение). Результаты считают отрицательными, если во всех пассажах отсутствовал цитопатический эффект.
Идентификация выделенных цитопатических агентов проводится по общепринятой методике с учетом того, что в одной пробе могут присутствовать несколько типов вирусов, что создает трудности при их типировании.
V. Питательные среды, оборудование, посуда, реактивы
Питательные среды
Мясопептонный агар. К 1 л мясопептонного бульона прибавляют 20 г агара, нагревают до полного растворения, устанавливают pH 7,2 - 7,4, осветляют, фильтруют в горячем виде через ватно-марлевый фильтр и разливают во флаконы. Стерилизуют при 1 атм 20 мин.
При использовании питательного агара заводского изготовления его готовят по прописи на этикетке с добавлением мясопептонного бульона из расчета на 1 л среды 0,5 л мясопептонного бульона.
Мясопептонный бульон. К 1 л мясной воды прибавляют 10 г пептона и 5 г хлористого натрия, нагревают до полного растворения пептона и соли, устанавливают pH 7,2 - 7,4, осветляют, фильтруют, разливают во флаконы и пробирки, стерилизуют при 1 атм 20 мин.
Пептонная вода. К 1 л водопроводной воды добавляют 5 г пептона и кипятят 15 мин. В горячую жидкость вносят следующие соли: 1 г калия фосфорнокислого двузамещенного, 1 г калия фосфорнокислого однозамещенного, 0,5 г магния сернокислого, натрий хлористый - следы. При растворении солей раствор тщательно взбалтывают и фильтруют до полной прозрачности. Среду разливают в пробирки и стерилизуют при 1 атм 20 мин.
Среда Виноградского. К 1 л дистиллированной воды добавляют следующие соли: 2 г аммония сернокислого; 1 г калия фосфорнокислого двузамещенного; 0,5 г магния сернокислого и 1 г химически чистого мела. Среду разливают в пробирки и стерилизуют при 1 атм 30 мин. При приготовлении среды следует строго следить за чистотой реактивов. Они не должны содержать примесей нитритов и нитратов, которые могут обусловить ошибочные результаты анализа. Загрязненные реактивы заменяют другими или перекристаллизовывают, мел многократно кипятят с дистиллированной водой. Для посева используют среду совершенно свободную от нитритов и нитратов.
Среда Гетчинсона. В 1 л дистиллированной воды растворяют 1 г калия фосфорнокислого двузамещенного, 100 мг кальция хлористого, 300 мг магния сернокислого, 100 мг натрия хлористого, 10 мг хлорного железа, 2,5 г натрия азотнокислого. Устанавливают pH 7,2 - 7,3 и стерилизуют. Стерильную среду разливают в пробирки слоем не выше 2 см и помещают в нее стерильные полоски фильтровальной бумаги.
Среда Кесслера-Свенертона. К 1 л дистиллированной воды добавляют 10 г пептона и 50 мл желчи. Смесь кипятят 30 мин, фильтруют, добавляют 2,5 г лактозы, доводят водой объем до 1 л, устанавливают pH 7,8 - 8,2, затем добавляют 4 мл 1 % водного раствора генцианвиолета, разливают в пробирки и стерилизуют при 0,5 атм 15 мин.
Лактозный бульон с 2, 3, 5-трифенилтетразолийхлоридом (ТТХ). К 100 мл мясопептонного бульона прибавляют 0,5 г лактозы и после тщательного перемешивания устанавливают pH 6,2 - 6,4. Среду разливают в пробирки по 9 мл и стерилизуют при 0,5 атм 20 мин. Перед посевом в каждую пробирку с лактозным бульоном прибавляют 0,3 мл 2 % раствора ТТХ. Для его приготовления к 100 мл стерильной дистиллированной воды прибавляют 2 г ТТХ. Раствор хранят в темном месте не более 2-х месяцев.
Глюкозопептонная среда. К 1 л дистиллированной воды добавляют 10 г пептона, 5 г натрия хлористого, 5 г глюкозы, устанавливают 7,4 - 7,6 и разливают в стерильные пробирки с поплавками или комочками ваты, стерилизуют при 0,5 атм 12 мин.
Среда Вильсон-Блер. К 100 мл расплавленного и затем охлажденного до температуры 80° щелочного питательного агара с 1 % глюкозы добавляют 10 мл 20 % раствора сернокислого натрия и 1 мл 8 % раствора железа. Можно использовать и обычный питательный агар, но перед применением дополнительно добавляют 10 мл 20% глюкозы и 0,5 мл 10 % щелочи. Раствор хлористого железа готовят на стерильной дистиллированной воде, раствор сернистокислого натрия стерилизуют в течение часа текучим паром. Сернистокислый натрий можно заменить серноватистокислым натрием, а хлористое железо - сернокислым.
Почвенный агар. Воздушно-сухую почву, отобранную из верхнего горизонта или любой почвы, богатой органикой (торфяная, чернозем), очищают от растительных остатков и других включений, измельчают в ступке и просеивают через сито с диаметром отверстий в 1 мл. Измельченную почву помещают в колбу и заливают дистиллированной водой в соотношении 1:9.
В полученную суспензию добавляют 2 % агара и стерилизуют дважды при 120° 1 час. Среду охлаждают до 50 - 60° и добавляют стерильный дрожжевой автолизат в количестве 1 мл на 100 мл среды. Среду тщательно перемешивают и разливают в чашки Петри (в чашки должна попасть среда вместе с почвенными частицами).
Магниевая среда "М". Составные части среды в расчете на 500 мл исследуемой суспензии:
|
Хлористого магния кристаллического |
- 19,5 г |
|
|
Хлористого натрия |
- 4,0 г |
|
|
KH2PO4 (безводный) |
- 0,8 г |
|
|
10 % раствор пептона |
- 25 мл |
|
|
Дрожжевого экстракта |
- 11 мл |
|
|
0,1 % водного р-ра бриллиантового зеленого |
- 2,5 мл |
|
Селенитовый бульон по Лейфсону. К 1 л дистиллированной воды добавляется: пептон импортный 5 г; натрий фосфорнокислый двузамещенный б/водный 7 г; натрий фосфорнокислый однозамещенный 3 г и лактоза 4 г. Предварительно определяют точную пропорцию фосфатов, которая с используемым образцом пептона и кислого селенитового натрия дает pH не выше 6,9 - 7,1. После этого готовят раствор (№ 1) и стерилизуют текучим паром 2 дня по 30 мин. Можно приготовить среду двойной концентрации; в таком случае все ингредиенты вносятся в два раза больше.
Отдельно готовят 10 % раствор кислого селенитового натрия (без теллура) на стерильной дистиллированной воде (раствор № 2), который добавляется к раствору № 1 непосредственно перед началом работы из расчета 4 мл на 100 мл среды в классической прописи и 8 мл для приготовления селенитового бульона двойной концентрации.
Среда обогащения (вариант II) Молдавского НИИ гигиены и эпидемиологии для выделения и накопления сальмонелл. Среда состоит из смеси трех частей панкреатического гидролизата казеина и одной части кислотного гидролизата казеина с содержанием аминного азота от 125 до 140 мг%. Среду забуферивают: к 1 л среды вначале добавляют 3 г однозамещенного фосфорнокислого натрия безводного, доводят до кипения, затем 7 г двузамещенного фосфорнокислого натрия и снова доводят до кипения. Фильтруют, стерилизуют при 0,5 атм в течение 30 минут и устанавливают pH 7,0 - 7,2. Перед употреблением в среду вносят раствор кислого селенитового селена в тех же количествах, что и в селенитовой среде обогащения.
Бульон с желчью. К питательному бульону добавляют 10 - 25 % желчи, разливают во флаконы, стерилизуют при 112° в течение 20 минут.
Магниевая среда в модификации Московского НИИ гигиены им. Ф.Ф. Эрисмана. Среда состоит из 3-х растворов: 1) 4,2 г отечественного пептона, 7,15 г хлористого натрия, 1,43 г KH2PO4, 9,0 мл дрожжевого диализата и 890,0 мл дистиллированной воды; 2) 35,7 г кристаллического хлористого магния и 90 мл дистиллированной воды; 3) 0,9 мл 0,5 % водного раствора бриллиантового зеленого. Все три раствора смешиваются и стерилизуются при 0,5 атм 30 мин.
Среда Мюллера. В стерильные флаконы отвешивают мел из расчета 4,5 г на 90 мл бульона и стерилизуют сухим жаром. В каждый флакон наливают бульон с pH 7,0 - 7,1 в соответствии с количеством внесенного мела и стерилизуют при 1 атм в течение 30 мин. Затем, в стерильных условиях добавляют 2 мл раствора Люголя и 10 мл 50 % раствора серноватистокислого натрия (Na2SO3) на 90 мл бульона, перемешивают. Раствор Люголя состоит из 100 мл дистиллированной воды, 20 г йодистого калия и 20 г йода. Хранят в темной бутылке, предохраняя от света.
Приготовление серноватистокислого натрия: к 50 г химически чистого серноватистокислого натрия добавляют дистиллированную воду до объема 100 мл переносят в колбу и растворяют при нагревании, фильтруют через фильтровальную бумагу, разливают во флаконы и стерилизуют текучим паром один раз в течение 30 минут.
Среда Томова состоит из следующих ингредиентов: 50 мл пептонного агара (10 % раствор агара, 2,5 % раствор пептона, 0,5 % раствор хлористого натрия), 100 мл бычьей сыворотки, 50 мл белка куриного яйца, 25 мл 0,4 % гемина в н/100 растворе едкого натрия, 25 мл 100 раствора уксусной кислоты. В стерильном флаконе смешивают бычью сыворотку и яичный белок, нагревают до 50° и добавляют к расплавленному до 50° пептонному агару. Содержимое флакона тщательно перемешивают и раздельно добавляют стерильно предварительно подогретые растворы гемина и уксусной кислоты в указанных выше количествах. Готовую среду (pH 7,4 - 7,6) разливают в стерильные чашки Петри и после застывания она готова к употреблению.
Среда Буза. К 3 % голодного (без пептона) агара (pH 7,2 - 7,4) добавляют 15 % дефибринированной крови барана.
Среда Тароцци. Бычью печень или мясо нарезают мелкими кусочками и заливают трехкратным количеством питательного бульона (pH 7,4 - 7,6) кипятят 30 минут. Бульон фильтруют, а печень (мясо) промывают в сите водопроводной водой. Распределяют по пробиркам по 3 - 4 г печени или мяса и по 7 - 8 мл бульона. Стерилизуют при 1 атм 30 минут.
Полужидкий агар (Н.И. Клодницкий). В питательном бульоне растворяют 0,5 % глюкозы и 0,1 % агар-агара. Стерилизуют текучим паром 3 дня по 30 минут.
Среда Эндо, висмут-сульфит агар, Плоскирева - готовят из сухих препаратов по прописи на этикетке.
Десорбент для определения энтеровирусов в почве. За основу берут среду 199 и ex tempore готовят десорбент путем добавления в эту среду 5 % бычьей сыворотки. Добавляя раствор 0,1 % HCl или 0,1 % NaOH устанавливают pH 8,5.
Оборудование
- автоклавы электрические по ГОСТ 9586-61
- термостаты электрические с автоматическим регулированием
- холодильники бытовые, поддерживающие температуру на 4 - 6 °C
- холодильники походные (сумки) для транспортировки проб с теплоизоляцией
- микроскопы биологические
- осветитель ОИ-19
- лупа по ГОСТ 8309-57
- аппараты фильтровальные с диаметром фильтрующей поверхности 32 мм
- дистиллятор
- пеналы металлические для пипеток
- прибор для счета колоний
- pH-метр
- сушильные шкафы с регулированием температуры до 200 °C
- вакуум-насос по ГОСТ 1867-57
- пластинка с сеткой для счета колоний
- проволока из никелевых сплавов диаметром 0,3 - 0,5 мм по ГОСТ 492-52
- секундомер
- часы песочные на 1, 2, 5 минут
- центрифуга, дающая свыше 5000 об/мин
- размельчитель тканей (марка РТ-2)
- шюттель-аппарат
- весы технические
- разновесы
- лотки эмалированные
- ложки металлические из нержавеющей стали
- кастрюли эмалированные емкостью 3 - 5 л
- фарфоровые ступки с пестиком и фарфоровые чашки
- набор почвенных сит
- штыковые лопаты
- металлические ножи (почвенные)
- стерильные мешки из медицинской клеенки или широкогорлые банки 0,5 - 1 л
Лабораторная посуда
- колбы различной емкости (50, 100, 250, 500 и 1000 мл и др.)
- чашки бактериологические Петри по ГОСТ 7900-56
- шпатели стеклянные и металлические
- пипетки емкостью 1, 2, 5, 10 мл и др.
- пробирки бактериологические по ГОСТ 10515-63
- матрацы стеклянные для субкультуры тканей на 250 и 500 мл
- стеклянные банки
- стеклянные бусы
- воронки стеклянные
- колбы Бунзена для фильтрования под вакуумом по ГОСТ 6514-63
- цилиндры вместимостью 100, 250 и 500 мл
- мензурки различной вместимости
- стаканы лабораторные по ГОСТ 10394-63
- стекла покровные для микропрепаратов
- стекла предметные для микропрепаратов
- поплавки для пробирок и колб длиной 20, 45 и 75 мм и диаметром 5, 9, 10 мм
- пробки разные (резиновые, ватно-марлевые).
Реактивы
- сернокислое железо
- углекислый натрий
- пептон отечественный
- виннокислый калий
- бриллиантовый зеленый
- хлористый магний кристаллический
- хлористый натрий
- однозамещенный фосфорнокислый калий (безводный)
- дрожжевой экстракт
- дрожжевой автолизат
- стандартная среда 199 на растворе Хэнкса для культуры тканей
- сыворотка крупного рогатого скота без консерванта
- раствор трипсина
- раствор Версена
- соляная кислота
- едкий натр
- пептон импортный
- натрий кислый селенистокислый (без примеси теллура)
- натрий фосфорнокислый одно- и двузамещенный (безводный)
- набор углеводов
- дистиллированная вода
- диметилфенилендиамин
- α-нафтол
- ТТХ - трифенилтетразолийхлорид
- агар-агар по ГОСТ 17206-71
- сухой питательный агар
- вата
- желчь крупного рогатого скота свежая или сухая обезвоженная
- калий фосфорнокислый двузамещенный
- кислота розоловая
- спирт этиловый ректификованный
- индикатор кристаллический фиолетовый
- мембранные фильтры № 2 - 3, планктонные № 6
- фуксин основной
- фуксин кислый
- бумага фильтровальная
Приготовление специальных реактивов
Реактив Круппа. Смесь 1 части серной кислоты и 2 частей 1 % водного раствора фуксина, приготовленного из насыщенного спиртового раствора. Бумажки, пропитанные этим раствором, после высушивания бесцветны, их хранят в банке с притертой пробкой.
Реактив для определения оксидазной активности. 30 - 40 мг альфа-нафтола растворяют в 2,5 мл ректификованного этилового спирта, прибавляют 7,5 мл дистиллированной воды и растворяют 40 - 60 мг диметилфенилендиамина. Раствор готовят непосредственно перед определением.
Реактив для определения нитратов. 2 г дифениламина растворяют в 100 мл концентрированной серной кислоты, очищенной по Совалю, затем приливают к 20 мл дистиллированной воды. Реактив должен быть прозрачным и без окраски.
Список литературы
1. Альф С.А., Мишустин Е.Н., Перцовский М.Ш., Хлебников Н.И. Показатели санитарного состояния почвы населенных мест. 1957, Медгиз, 95 - 110.
2. Горбов В.А., Рябов В.Н., Пероцкая А.С., Чернаенко Т.Д. Микрофлора почвы и ее санитарное значение, в кн. "Основные вопросы санитарной охраны почвы". 1965, Из-во Медицина, 94 - 110.
3. Инструкция по санитарно-бактериологическому исследованию почвы населенных мест. Москва, 1958.
4. Лоранский Д.Н. (под ред.). Руководство по санитарной охране почвы. М., "Медицина", 1972.
5. Мац Л.И., Маркина-Перцовская М.И. Почва, в кн. "Справочник по микробиологическим и вирусологическим методам исследования" под ред. М.О. Биргера, М., 1973, 394 - 404.
6. Перцовская М.И., Васильева О.И. Почва населенных мест. В кн. "Методы санитарно-бактериологических исследований внешней среды" (под ред. Г.П. Калины), 1966, 238 - 241.
7. Перцовская М.И. Санитарная микробиология почвы. В кн. "Санитарная микробиология" (под ред. Г.П. Калины и Г.Н. Чистовича). 1969, Из-во "Медицина".
Приложение 1
ПРИМЕРНАЯ КАРТА САНИТАРНОГО ОБСЛЕДОВАНИЯ ЗЕМЕЛЬНОГО УЧАСТКА
|
1. Адрес местонахождения земельного участка ___________________________________________________________________________ 2. Дата и время обследования ___________________________________________________________________________ 3. Назначение (детская площадка, поля орошения и т.д.) ___________________________________________________________________________ 4. Принадлежность (предприятие, колхоз и т.д.) ___________________________________________________________________________ 5. Размер территории ___________________________________________________________________________ 6. Характеристика почвы (тип, механический состав и др.) ___________________________________________________________________________ 7. Рельеф ___________________________________________________________________________ 8. Уровень залегания грунтовых вод ___________________________________________________________________________ 9. Характеристика метеорологических условий в день обследования ___________________________________________________________________________ 10. Подробная характеристика источника загрязнения, его расположение от жилых зданий, игровых площадок, мест водозабора и т.д. ___________________________________________________________________________ 11. Возможные пути миграции загрязнений ___________________________________________________________________________ 12. Прямой и непрямой (через воду, воздух, выращиваемые растения) контакт человека с почвой ___________________________________________________________________________ 13. Особенности мест отбора проб почвы для лабораторного анализа Ф. И. О. санитарного врача или его помощника
|
|
Заместитель
Главного |
В.Е. Ковшило |
СОДЕРЖАНИЕ