Федеральная
служба по надзору в сфере защиты прав потребителей
и благополучия человека
4.4.
МЕТОДЫ КОНТРОЛЯ.
ОБЩИЕ ВОПРОСЫ ПО МЕТОДАМ КОНТРОЛЯ
Оценка действия вакцин на созревание
дендритных клеток человека
Методические
рекомендации
МР 4.4.0137-18
1. Разработаны ФБУН «Нижегородский научно-исследовательский институт эпидемиологии и микробиологии им. академика И.Н. Блохиной» Роспотребнадзора (В.Ю. Талаев, М.В. Талаева, Е.В. Воронина, О.Н. Бабайкина).
2. Утверждены руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации А.Ю. Поповой 23.11.2018.
3. Введены впервые.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ |
|
Руководитель Федеральной службы |
|
по надзору в сфере защиты прав |
|
потребителей и благополучия человека, |
|
Главный государственный санитарный |
|
врач Российской Федерации |
|
А.Ю. Попова |
|
23 ноября 2018 г. |
4.4.
МЕТОДЫ КОНТРОЛЯ.
ОБЩИЕ ВОПРОСЫ ПО МЕТОДАМ КОНТРОЛЯ
Оценка действия вакцин на созревание
дендритных клеток человека
Методические рекомендации
МР 4.4.0137-18
I. Общие положения и область применения
1.1. Дендритные клетки (далее - ДК) являются профессиональными антигенпрезентирующими клетками, способными вовлекать наивные Т-лимфоциты в иммунный ответ [1]. Участие этих клеток необходимо для запуска первичного иммунного ответа на Т-зависимые антигены. Жизненный цикл ДК разделен на две стадии. Клетки, находящиеся на первой стадии жизненного цикла носят название незрелых ДК. Незрелые ДК рассеяны в различных тканях организма, где они активно поглощают доступный для эндоцитоза материал, потенциально содержащий антигены. При распознавании отдельных, наиболее типичных для микроорганизмов молекул эти клетки быстро изменяют свои свойства, превращаясь в зрелые ДК. Переход в стадию зрелых ДК ведет к ослаблению сбора новых антигенов, но усиливает способность к представлению антигенов, собранных ранее. Для этого зрелые ДК экспрессируют большое количество молекул главного комплекса гистосовместимости для представления собранных антигенов Т-лимфоцитам, а также синтезируют мембранные белки и цитокины, необходимые для дополнительной стимуляции распознавших антиген Т-лимфоцитов [1 - 6].
Сигналом, индуцирующим созревание ДК, является обнаружение ими молекулярных признаков инфекции. Следует отметить, что ДК лишены антигенраспознающих рецепторов, подобных лимфоцитарным. Среди всего разнообразия молекул бактерий и вирусов ДК способны идентифицировать лишь наиболее типичные для больших групп микроорганизмов молекулы - молекулярные паттерны патогенов. Именно распознавание молекулярных паттернов инфекционных агентов или корпускулярных вакцин является специфическим стимулом, мобилизующим ДК к созреванию. Созревание ДК могут индуцировать эндогенные стимуляторы (провоспалительные цитокины и аллармины) [3 - 6]. При использовании вакцин, не содержащих молекулярные паттерны патогенов, основным источником сигналов, стимулирующих созревание ДК должны служить адъювантные компоненты вакцин [7, 8].
Участие ДК в запуске иммунного ответа обеспечивается не только их способностью поглощать микроорганизмы и презентировать их антигены лимфоцитам, но и уникальными миграционными свойствами, которые позволяют этим клеткам собирать антигены в различных тканях организма и транспортировать их в региональные лимфоидные органы - место индукции адаптивного (антигенспецифического) иммунного ответа [9 - 12]. При подготовке к миграции ДК снижают количество рецепторов для хемокинов периферических и, особенно, воспаленных тканей, а вместо них экспрессируют рецепторы хемокинов, направляющих клетки в лимфатические сосуды и лимфатические узлы. Среди этих, вновь экспрессируемых рецепторов, ключевую роль отводят рецептору CCR7, который направляет движение созревших ДК из периферических тканей к ближайшему лимфатическому капилляру, а после перемещения с током лимфы в лимфатический узел обеспечит дальнейшую миграцию в глубокий слой коры, в которой находится Т-клеточная зона лимфатического узла. В таком случае ДК будут представлять собранные антигены наивным Т-лимфоцитам, которые в поисках первого контакта с антигеном постоянно поступают в эту зону из кровотока [9 - 11]. Такой путь миграции классических ДК в Т-клеточные зоны лимфатических узлов не является единственным. Часть ДК наряду с рецептором CCR7 может экспрессировать хемокиновый рецептор CXCR5, который направит движение этих клеток в В-клеточные зоны лимфоидных органов для встречи с участниками гуморального иммунного ответа - В-лимфоцитами и фолликулярными Т-хелперами [12 - 14].
Таким образом, для эффективного запуска иммунного ответа на инфекцию или вакцину ДК должны поглотить содержащий антигены материал, запустить процесс функционального созревания и мигрировать в периферический лимфоидный орган для презентации собранных антигенов и запуска адаптивного иммунного ответа.
1.2. В настоящих методических рекомендациях (далее - методические рекомендации) рекомендован способ оценки действия вакцин на созревание ДК человека в условиях in vitro. Способ основан на получении дендритных клеток из клеток крови человека, их использовании в модели начальных этапов иммунной реакции в условиях in vitro и оценке результата реакции с помощью лазерной проточной цитофлюорометрии. Оценка созревания ДК проводится с помощью количественного определения экспрессии на поверхности ДК молекул, наиболее информативно характеризующих воздействие вакцины на ДК. Способ предназначен для использования в комплексе лабораторных методов оценки эффективности новых вакцин на этапе их разработки и доклинических испытаний, а также для поиска новых адъювантных компонентов вакцин.
1.3. Методические рекомендации предназначены для органов и организаций Роспотребнадзора, а также могут быть использованы научными и медицинскими организациями, занимающимися контролем эффективности вакцин, разработкой, доклиническим испытанием новых вакцин, поиском новых адъювантных компонентов вакцин.
II. Описание метода
2.1. Принцип метода
2.1.1. Незрелые ДК получают из моноцитов периферической крови человека с помощью инкубации с интерлейкином-4 (далее - ИЛ-4) и гранулоцитарно-макрофагальным колониестимулирующим фактором (далее - ГМ-КСФ) в условиях in vitro. Затем производят стимуляцию незрелых ДК вакцинами или их компонентами. Негативным контролем созревания служат незрелые ДК без стимуляции. Позитивным контролем - ДК, стимулированные смесью индукторов воспаления. Созревание ДК оценивают с помощью лазерной проточной цитофлюориметрии по экспрессии ключевых мембранных молекул, необходимых для презентации антигена и костимуляции Т-лимфоцитов: молекул главного комплекса гистосовместимости II класса HLA-DR, костимулирующих молекул CD83, CD86 и ICOSL (CD275). Миграционные свойства ДК оцениваются по экспрессии хемокиновых рецепторов CCR7 и CXCR5. Оценивается доля клеток, несущих соответствующие молекулы и плотность экспрессии молекул по геометрической средней интенсивности флюоресценции. Результат оценивается с помощью сравнения показателей ДК, стимулированных исследуемой вакциной с показателями отрицательного и положительного контролей созревания (ДК без стимуляции и ДК, стимулированные смесью медиаторов воспаления, соответственно).
2.2. Показания и противопоказания к применению метода
2.2.1. Метод предназначен для оценки эффективности вакцин на этапе их разработки и доклинических испытаний и для поиска новых адъювантных компонентов вакцин. Метод применим для определения свойств неживых вакцин и их компонентов, а также свойств живых микроорганизмов: производственных или разрабатываемых вакцинных штаммов микроорганизмов III - IV групп патогенности, а также вакцинных штаммов возбудителей I - II групп патогенности.
Противопоказаний нет.
2.3. Организация работы
2.3.1. Оценки действия неживых вакцин, а также оценка действия живых микроорганизмов (производственных или разрабатываемых вакцинных штаммов микроорганизмов III - IV групп патогенности; вакцинных штаммов возбудителей I - II групп патогенности) осуществляются в соответствии с законодательством в области обеспечения санитарно-эпидемиологического благополучия населения1.
____________
1 Санитарно-эпидемиологические правила СП 1.3.2322-08 «Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней», утвержденные постановлением Главного государственного санитарного врача Российской Федерации от 28.01.2008 № 4 (зарегистрировано Минюстом России 21.02.2008, регистрационный номер 11197), с изменениями, внесенными постановлениями Главного государственного санитарного врача Российской Федерации от 02.06.2009 № 42 (зарегистрировано Минюстом России 08.07.2009, регистрационный номер 14280), от 29.06.2011 № 86 (зарегистрировано Минюстом России 12.07.2011, регистрационный номер 21317) (далее - СП 1.3.2322-08 от 28.01.2008 № 4); санитарные правила СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности», утвержденные постановлением Госкомсанэпиднадзора России от 28.08.1995 № 14 (далее - СП 1.2.036-95 от 28.08.1995 № 14).
2.3.2. Все работы с клеточными культурами требуется осуществлять в стерильных условиях в боксах биологической безопасности II класса2.
____________
2 ГОСТ Р ЕН 12469-2010 «Технические требования к боксам микробиологической безопасности», утвержденный приказом Росстандарта от 29.12.2010 № 1144-ст.
2.3.3. Обеззараживание рабочих поверхностей, лабораторной посуды и инструментария, воздуха рабочих помещений, а также отходов, образующихся при использовании метода, осуществляется в соответствии с законодательством в области обеспечения санитарно-эпидемиологического благополучия населения3.
____________
3 Санитарно-эпидемиологические правила и нормативы СанПиН 2.1.7.2790-10 «Санитарно-эпидемиологические требования к обращению с медицинскими отходами», утвержденные постановлением Главного государственного санитарного врача Российской Федерации от 09.12.2010 № 163 (зарегистрировано Минюстом России 17.02.2011, регистрационный номер 19871); СП 1.2.036-95 от 28.08.1995 № 14; руководство Р 3.5.1904-04 «Использование ультрафиолетового бактерицидного излучения для обеззараживания воздуха в помещениях», утвержденное Главным государственным санитарным врачом Российской Федерации.
2.4. Материально-техническое обеспечение метода
2.4.1. Приборы и оборудование4
____________
4 Примечание: Допускается использование приборов и оборудования с аналогичными или лучшими характеристиками.
1) лазерный проточный цитофлюориметр;
2) шейкер с круговым движением платформы;
3) микроскоп инвертированный с увеличением не менее 400 раз;
4) микроскоп прямой с увеличением не менее 200 раз;
5) бокс биологической безопасности 2 класса;
6) СО2-инкубатор;
7) лабораторная центрифуга с охлаждением и роторами для пробирок и для планшетов;
8) автоматические дозаторы переменного объема одноканальные 2 - 20, 20 - 200, 100 - 1000 мкл;
9) камера Горяева;
10) одноразовые пластиковые наконечники для дозаторов;
11) пластиковые одноразовые стерильные полистиреновые планшеты для культур клеток 24-луночные;
12) пластиковые одноразовые кругло донные полистиреновые планшеты 96-луночные;
13) пластиковые одноразовые стерильные пробирки объемом 10 мл, 15 мл или 50 мл или стеклянные центрифужные пробирки объемом 10 мл;
14) пластиковые вакуумные пробирки для забора крови, содержащие гепарин натрия;
15) пробирки для проточной цитометрии, рекомендованные производителем проточного цитофлюориметра.
2.4.2. Реагенты5
____________
5 Примечание: Допускается использование реактивов с аналогичными или лучшими характеристиками.
1) растворы для жидкостной системы проточного цитофлюориметра (в соответствии с рекомендациями производителя прибора);
2) моноклональные антитела (далее - МКА) к молекуле HLA-DR человека, меченные флюоресцеинизотиоционатом (далее - FITC);
3) МКА к молекулам CD83, CD86, ICOSL (CD275) и CXCR5 (CD185) человека, меченные фикоэритрином (РЕ);
4) МКА к молекуле CCR7 (CD197) человека, меченные аллофикоцианином (АРС);
5) антитела соотв. изотопических контролей, меченные FITC, РЕ и АРС;
6) рекомбинантный человеческий ИЛ-4;
7) рекомбинантный человеческий ИЛ-1β;
8) рекомбинантный человеческий ИЛ-6;
9) рекомбинантный человеческий ГМ-КСФ;
10) рекомбинантный человеческий фактор некроза опухоли α (ФНОα);
11) простагландин Е2;
12) стерильный реагент с плотностью 1077 г/л для выделения мононуклеарных клеток крови центруфигированием (например, Фиколл-Пак или Hystopaque-1077 (или аналогичные);
13) среда RPMI-1640 стерильная;
14) эмбриональная телячья сыворотка (далее - ЭТС);
15) фосфатный солевой буфер Дюльбекко А (далее - PBS);
16) L-глутамин, стерильный раствор для культур клеток.
2.4.3. Дезинфицирующие растворы для обесценения санитарно-эпидемического режима в лаборатории при работе с ПБА III - IV групп патогенности и режимы обеззараживания используют в соответствии с законодательством в области обеспечения санитарно-эпидемиологического благополучия населения6.
____________
6 СП 1.3.2322-08 от 28.01.2008 № 4.
2.5. Выполнение метода
2.5.1. Приготовление среды для культур клеток
ЭТС предварительно инактивируют нагреванием при температуре +56 °С в течении 30 мин на водной бане, стерильно разливают во флаконы по 10 мл и хранят при -20 °С до использования.
Для приготовления полной питательной среды (далее - ППС) среду RPMI-1640 стерильно разливают во флаконы по 90 мл. Перед использованием во флаконы вносят по 10 мл ЭТС. При хранении готовой ППС более двух недель в среду дополнительно вносят стерильный раствор L-глютамина из расчета 58,4 мг L-глютамина на 100 мл среды.
2.5.2. Приготовление и хранение растворов реагентов
Используемые в работе стерильные лиофилизированные рекомбинантные цитокины и простагландин Е2 в стерильных условиях растворяют в ППС до следующих концентраций: ИЛ-4 - 400 нг/мл, ГМ-КСФ - 2 мкг/мл, ИЛ-1β - 1 мкг/мл, ИЛ-6 - 1 мкг/мл, ФНОα - 1 мкг/мл, простагландин Е2 - 40 мкг/мл. Затем, из полученных растворов готовят две смеси: смесь ГМ-КСФ и ИЛ-4, используемую при получении незрелых ДК, и коктейль стимуляторов созревания ДК. Для получения смеси ГМ-КСФ и ИЛ-4 смешивают соотв. растворы в соотношении 1:1. Для получения коктейля стимуляторов созревания смешивают растворы ИЛ-1β, ИЛ-6, ФНОα и простагландина Е2 в равных пропорциях. Полученные смеси разливают в стерильные пробирки типа «эппендорф» и хранят при -20 °С или -70 °С до использования. Размороженные смеси хранятся при +4 °С не более 2 недель. Повторное замораживание не допускается.
2.5.3. Стерильный забор венозной крови
Стерильный забор венозной крови проводят у практически здоровых доноров по общепринятой методике в вакуумные пробирки с гепарином натрия. Для выполнения эксперимента требуется забор 18 мл крови (2 вакуумные пробирки на 9 мл крови). Стерильно взятую гепаринизированную кровь хранят при +4 °С не более двух часов до начала лабораторных исследований.
Отбор, транспортировка и хранение проб крови производится в соответствии с законодательством в области обеспечения санитарно-эпидемиологического благополучия населения7.
____________
7 СП 1.2.036-95 от 28.08.1995 № 14; методические указания МУ 4.2.2039-05 «Техника сбора и транспортирования биоматериалов в микробиологические лаборатории», утвержденные Роспотребнадзором 23.12.2005.
2.5.4. Выделение мононуклеарных клеток крови и
приготовление
клеточных суспензий
Все работы с клетками крови проводят в стерильных боксах и ламинарных шкафах. Выделение мононуклеарных клеток периферической крови (далее - МНПК) проводят традиционным методом. Для этого пробы стерильной гепаринизированной крови разводят в 2 раза по объему средой RPMI-1640 или стерильным PBS, наслаивают на Фиколл-Пак или Hystopaque-1077 (или аналогичные) и центрифугируют при 450 g в течение 45 минут при комнатной температуре. Слой, содержащий МНПК, собирают с границы раздела фаз в центрифужную пробирку, доводят общий объем до 10 мл средой RPMI-1640 с 1 % ЭТС, тщательно перемешивают и осаждают клетки центрифугированием при 450 g в течение 15 минут. Затем надосадок сливают, клетки ресуспендируют в 10 мл среды RPMI-1640 с 1 % ЭТС и осаждают центрифугированием в течение 7 мин при 400 g. Надосадок сливают, клетки вновь ресуспендируют в 10 мл среды RPMI-1640 с 1 % ЭТС и подсчитывают количество клеток в камере Горяева. Клетки вновь осаждают, надосадок сливают и готовят суспензию МНПК в ППС с концентрацией 4,5×106 клеток/мл.
2.5.5. Получение незрелых дендритных клеток
Незрелые ДК получают из моноцитов периферической крови, выделенных адгезией на пластике. Для этого клеточные суспензии свежевыделенных МНПК с концентрацией 4,5×106 клеток/мл засевают в стерильные 24-луночные полистиреновые планшеты для культур клеток по 1 мл суспензии на лунку и инкубируют 2 часа в СO2-инкубаторе при температуре +37 °С и 5 % СO2. Затем неадгезировавшиеся клетки (лимфоциты) осторожно удаляют из лунок. Для этого лимфоциты ресуспендируют осторожным круговым движением планшета вручную или на программируемом шейкере типа «балерина» при минимальной амплитуде и скорости движения платформы. Смывание лимфоцитов многократным пипетированием не рекомендуется.
Суспензию неадгезировавшихся клеток удаляют, в лунки осторожно по стенке лунки вносят по 1 мл теплой (не более +37 °С) ППС, и повторяют ресуспендирование и удаление неприлипших клеток. Контроль чистоты удаления неприлипших клеток осуществляют с помощью инвертированного микроскопа и при необходимости процедуру повторяют. Обычно для полного удаления неприлипших клеток требуется 3 цикла ресуспендирования.
В лунки с оставшимися на пластике моноцитами вносят ППС по 720 мкл на лунку и проводят визуальный контроль под микроскопом. Рекомендуется использовать пробы крови, дающие однотипную картину адгезии во всех лунках и высокую плотность засева моноцитов. Культуры с низкой плотностью засева моноцитов (клетками занято менее 25 % площади лунки) отбраковываются. В лунки выбранных для работы культур добавляют по 80 мкл смеси ГМ-КСФ и ИЛ-4. Конечная концентрация ГМ-КСФ составляет 100 нг/мл, а ИЛ-4 - 20 нг/мл. Клетки инкубируют 7 суток при +37 °С и 5 % СO2, повторно добавляя по 80 мкл смеси ГМ-КСФ и ИЛ-4 на третьи сутки культивирования.
2.5.6. Стимуляция незрелых дендритных клеток
вакцинами и
индукторами созревания
Из лунок 7-суточных культур незрелых ДК осторожно отбирают среду, и в лунки вносят свежую ППС без стимуляторов или ППС, содержащую контрольные активаторы созревания или исследуемые вакцины. Для получения незрелых ДК (отрицательный контроль созревания) в лунки вносят по 1 мл ППС без стимуляторов созревания и вакцин. Для получения стандартных зрелых ДК (положительный контроль созревания) в лунки вносят 900 мкл ППС и 100 мкл коктейля стимуляторов созревания. В результате конечная концентрация стимуляторов в культуре составляет: 25 нг/мл ИЛ-1β, 25 нг/мл ИЛ-6, 50 нг/мл ФНО-α, 1 мкг/мл простагландина Е2. В опытные лунки вносят исследуемую вакцину в концентрациях 0,1 доза в 1 мл ППС. Затем ДК культивируют еще двое суток и собирают не менее 3×105 клеток из каждой лунки для цитофлюориметрического исследования.
2.5.7. Определение экспрессии маркеров созревания ДК
методом лазерной проточной цитофлюориметрии
Собранные ДК осаждают центрифугированием, разводят в 200 мкл PBS с 0,09 % азида натрия и каждую пробу клеток вносят по 50 мкл в 6 лунок круглодонных 96-луночных планшетов. В первую из этих лунок вносят антитела изотипического контроля. Во вторую лунку вносят МКА к HLA-DR, меченные FITC. В третью лунку вносят МКА к HLA-DR, меченные FITC, и МКА к CD83, меченные РЕ. В четвертую лунку вносят МКА к HLA-DR, меченные FITC и МКА к CD86, меченные РЕ. В пятую лунку вносят МКА к HLA-DR, меченные FITC и МКА к ICOSL, меченные РЕ. В шестую лунку вносят МКА к HLA-DR, меченные FITC, МКА к CXCR5, меченные РЕ, и МКА к CCR7, меченные АРС. МКА к клеткам добавляют в количестве, рекомендованном производителем антител.
При использовании цитофлюориметров, способных анализировать шесть цветов, допустимо применить схемы окрашивания с одновременным внесением в опытную лунку всех шести МКА, конъюгированных с различными флюорофорами, соответствующими возможностям детекции прибора. В этом случае при планировании панели антител в качестве флюорофоров, конъюгированных с МКА к молекулам CD83, CCR7, CXCR5 и ICOSL, рекомендуется выбирать красители с наибольшей интенсивностью флюоресценции.
Клетки инкубируют при температуре +4 °С 30 минут на мультишейкере при медленном круговом движении платформы. Затем во все лунки добавляют по 100 мкл PBS с 0,09 % NaN3, осаждают центрифугированием, надосадок сбрасывают, клетки ресуспендируют в 200 мкл PBS с 0,09 % азида натрия, вновь осаждают и ресуспендируют в 200 мкл 1 % раствора параформальдегида на PBS. Суспензию переносят в пробирки для проточной цитометрии.
Пробы анализируют на лазерном проточном цитофлюориметре для определения доли ДК, несущих маркеры созревания, и оценки интенсивности их флюоресценции в соотв. с инструкцией применения прибора. Общая схема обработки результатов выглядит следующим образом: ДК выделяют в гейт (R1) по характерному прямому и боковому светорассеиванию на графике dot plot FSC/SSC. При этом следует учитывать, что полученные in vitro дендритные клетки имеют очень крупный размер и на графике светорассеивания располагаются значительно дальше по шкале прямого светорассеивания, чем все лейкоциты крови. Обычно, для обнаружения этих клеток на графике светорассеивания перед проведением цитометрии необходимо уменьшить сигнал детектора прямого светорассеивания, а именно, в ходе настройки прибора снизить параметр «Voltage FSC» (напряжение на детекторе прямого светорассеивания) в 10 раз по сравнению с параметрами, рекомендуемыми изготовителем прибора для фенотипирования лимфоцитов. После обнаружения многочисленной группы крупных клеток их выделяют в гейт и проверяют на наличие маркера HLA-DR. При правильном выделении дендритных клеток подавляющее большинство клеток гейта R1 должно обладать выраженной экспрессией HLA-DR. Для устранения из анализируемых клеток примеси HLA-DR- клеток, которые могут в незначительном количестве попадать в гейт R1, необходимо выделить HLA-DR+ клетки в гейт R2. Затем среди выделенных дендритных клеток (последовательно гейтированных клеток - Gate R1×R2) оценивают процент клеток, несущих исследуемые маркеры созревания и определяют геометрическую среднюю интенсивности флюоресценции с помощью программного обеспечения цитофлюориметра.
2.5.8. Интерпретация результатов
Для получения достоверных результатов о влиянии вакцины или ее компонента на созревание ДК требуется использование не менее 10 проб крови, взятых у разных доноров. Статистической обработке подвергаются результаты экспериментов, в которых доля ДК, несущих CD83, и геометрическая средняя интенсивности флюоресценции CD86 в пробах стандартных зрелых ДК (пробы положительного контроля созревания) превышают соответствующие показатели в пробах с незрелыми ДК (пробы отрицательного контроля созревания) не мене чем в 1,5 раза. Статистический анализ полученных данных проводят с использованием критерия Стьюдента для зависимых выборок, сравнивая показатель ДК, инкубированных с вакциной, с соответствующим показателем контрольных незрелых ДК.
Способ позволяет сделать следующие выводы о характере действия исследуемого объекта (вакцины или адъювантного компонента вакцины):
1) в случае если доля клеток, несущих CD83 и геометрическая средняя интенсивности флюоресценции HLA-DR и CD86 (каждый из этих параметров) достоверно превышает соотв. показатели отрицательного контроля созревания и достоверно не отличается от показателей положительного контроля созревания делается вывод: «вакцина/компонент вакцины индуцирует полное созревание ДК»;
2) в случае если доля клеток, несущих CD83 и/или геометрическая средняя интенсивности флюоресценции HLA-DR и CD86 (любой из этих параметров) достоверно превышает соотв. показатели отрицательного контроля созревания, но достоверно ниже показателей положительного контроля созревания делается вывод: «вакцина/компонент вакцины индуцирует образование полузрелых ДК»;
3) в случае если доля клеток, несущих CD83 и геометрическая средняя интенсивности флюоресценции HLA-DR и CD86 (каждый из этих параметров) статистически не отличается от соотв. показателей отрицательного контроля созревания делается вывод: «вакцина/компонент вакцины не индуцирует созревание ДК»;
4) повышение геометрической средней интенсивности флюоресценции при окрашивании антителами к ICOSL расценивается как фактор, способствующий развитию гуморального иммунного ответа;
5) заключение о стимулирующем действии вакцины на миграцию ДК в Т-клеточные зоны лимфатических узлов выносится при обнаружении статистически достоверного увеличения доли ДК, несущих рецептор CCR7, в опытных пробах (ДК, стимулированные вакцинами) по сравнению с пробами незрелых ДК;
6) заключение о стимулирующем действии вакцины на миграцию ДК в В-клеточные зоны лимфатических узлов выносится при обнаружении статистически достоверного увеличения доли ДК, несущих рецептор CXCR5 (в том числе клеток, несущих CXCR5 и CCR7 одновременно), в опытных пробах по сравнению с пробами незрелых ДК.
III. Эффективность использования метода
3.1. Для разработки метода и оценки его эффективности
использованы вакцины с известными свойствами: туберкулезная вакцина БЦЖ,
рекомбинантная дрожжевая вакцина против гепатита В различных производителей, а
также адъвантный компонент - гель гидроксида алюминия. Эти вакцины являются
типичными представителями вакцин с принципиально различным и достаточно
охарактеризованным действием на иммунную систему. Живая вакцина БЦЖ является
стимулятором преимущественно клеточных иммунных реакций, требующих
преимущественной стимуляции дендритными клетками Т-лимфоцитов (Т-хелперов
первого типа и Т-киллеров) в Т-клеточных зонах лимфоидных органов. Вакцина
против гепатита В стимулирует преимущественно Т-зависимый гуморальный иммунный
ответ. Такая вакцина должна стимулировать ДК к созреванию и миграции в
Т-клеточные зоны, а также (оптимально) вызывать миграцию ДК в В-клеточные зоны
для дополнительной стимуляции локализованных здесь фолликулярных Т-хелперов -
профессиональных хелперов гуморального иммунного ответа.![]()
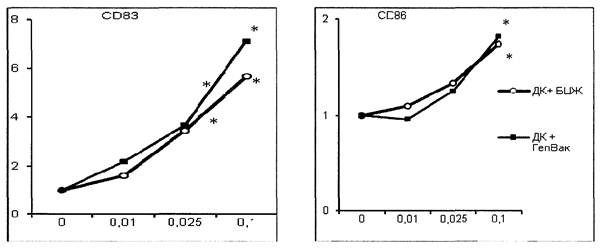
На подготовительном этапе работы определена дозовая зависимость действия вакцин на экспрессию ключевых маркеров созревания. Для этого незрелые ДК инкубированы с вакцинами в концентрациях от 0,001 до 0,1 дозы на 1 мл. Показано, что стимуляция незрелых ДК взрослых вакциной БЦЖ и вакциной против гепатита В в концентрации 0,1 доза в 1 мл в условиях in vitro индуцирует наибольший прирост экспрессии ключевых маркеров созревания без потери жизнеспособности клеток при культивировании (рис. 1 приложения к методическим рекомендациям). Концентрации вакцин менее 0,01 дозы на мл не оказывают достоверного эффекта на созревание ДК.
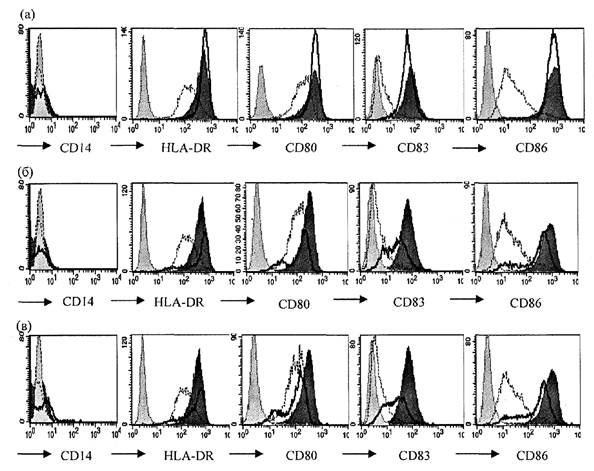
В дальнейшей работе использована концентрация вакцин 0,1 доза/мл или эквивалентная концентрация геля гидроксида алюминия. Внесение вакцин или гидроксида алюминия в этих концентрациях к незрелым ДК индуцирует выраженное усиление экспрессии маркеров созревания (рис. 2 приложения к методическим рекомендациям). Как уже было отмечено выше, все ДК экспрессируют молекулу HLA-DR. Инкубация с вакцинами увеличивает плотность экспрессии этой молекулы, что наглядно проявляется сдвигом пика окрашенных клеток вправо на гистограммах (рис. 2 приложения к методическим рекомендациям). Также инкубация с вакцинами ведет к увеличению количества клеток, несущих CD83 и CD86 и росту плотности экспрессии этих молекул на ДК. Представлен результат фенотипического анализа ДК, полученных из крови 20 взрослых здоровых доноров (рис. 3 приложения к методическим рекомендациям). Средние значения количества клеток, несущих маркеры созревания, показаны на верхней гистограмме, показатели геометрической средней интенсивности флюоресценции - на нижней гистограмме. Для сравнения приведены соотв. показатели у незрелых ДК отрицательного контроля созревания, зрелых ДК положительного контроля созревания, а также у дополнительного контроля, который использовался на подготовительном этапе - у полузрелых ДК. Как видно из графиков, оценка остаточной экспрессии моноритарного маркера CD14 не несет значимой информации для оценки действия вакцин. Экспрессия костимулирующих молекул CD80 и CD86 под действием вакцин или модельных стимуляторов созревания возрастает сходным образом, причем оценка экспрессии CD86 является предпочтительной из-за больших различий уровня экспрессии этой молекулы на контрольных незрелых ДК и зрелых ДК. Информативным показателем, отражающим особенности действия вакцин, является интенсивность флюоресценции этой молекулы, тогда как доля CD86+ клеток не позволяет дифференцировать зрелые и полузрелые ДК. Также дифференцировать незрелые, полузрелые и зрелые ДК позволяет интенсивность флюоресценции HLA-DR, окрашенной соответствующими антителами. Наконец, информативным показателем является доля клеток, экспрессирующих CD83. Незрелые ДК практически лишены этого маркера, который появляется на их мембране по мере созревания клеток, причем различные вакцины в разной мере стимулируют этот процесс.
Анализ полученных данных показал, что вакцина БЦЖ стимулирует дифференцировку незрелых ДК в зрелые ДК, тогда как вакцина гепатита В или входящий в её состав адъювант гидроксид алюминия слабее стимулирует экспрессию маркеров созревания, и полученные клетки соответствуют полузрелым ДК (рис. 3 приложения к методическим рекомендациям).
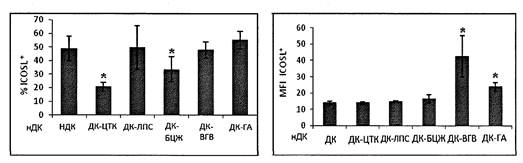
Дополнительную информацию о характере действия вакцин на созревание ДК получают, оценивая экспрессию молекул ICOSL. Эта костимулирующая молекула представлена на мембране существенной части незрелых ДК, плотность ее экспрессии на мембране незрелых клеток невысока. Стимуляторы созревания, способствующие клеточному иммунному ответу (провоспалительные цитокины, вакцина БЦЖ) снижают количество клеток, экспрессирующих эту молекулу, тогда как вакцина гепатита В и ее адъювантный компонент увеличивают плотность экспрессии ICOSL (рис. 4 приложения к методическим рекомендациям).
Анализ экспрессии хемокиновых рецепторов на ДК также может продемонстрировать ожидаемые для использованных вакцин результаты. Стимуляция незрелых ДК взрослых вакциной БЦЖ вызывает слабое, но достоверное увеличение экспрессии CCR7, необходимое для миграции в Т-клеточную зону лимфатического узла (рис. 5 приложения к методическим рекомендациям). При этом не наблюдается никакого увеличения экспрессии рецептора CXCR5. Вакцина против гепатита В или входящий в её состав адъювант индуцирует экспрессию на мембране ДК как хемокинового рецептора CCR7, так и рецептора CXCR5, направляющего миграцию клеток в В-клеточные зоны лимфатического узла.
Приложение
Примеры результатов использования метода
(примеры приведены на рисунках 1 - 5
приложения)
* - отличия от незрелых ДК отрицательного контроля созревания достоверны при р < 0,05.
Рис. 1. Дозовая зависимость действия вакцин БЦЖ и
вакцины гепатита В
на экспрессию CD83 (слева) и CD86 (справа). По оси X - концентрация
вакцин (доз./мл), по оси Y - кратность увеличения количества клеток,
экспрессирующих соотв. маркер
Рис. 2. Экспрессия CD14, HLA-DR, CD80, CD83 и CD86 на
ДК
после стимуляции вакциной БЦЖ (а), вакциной гепатита В (б) и суспензией
гидроксида алюминия (в) представлена толстой черной линией. Экспрессия тех же
молекул на незрелых ДК показана тонкой пунктирной линией, а на ДК
положительного
контроля созревания - гистограммой с темно серым полем. Светло серая
гистограмма с
точечной линией - изотопический контроль. Концентрации вакцин - 0,1 взрослая
доза/мл, гидроксида алюминия - 50 мкг/мл Аl3+.
По оси Y - количество событий.
Результат репрезентативного эксперимента (N = 15)
* - отличия от незрелых ДК отрицательного контроля созревания достоверны при р < 0,05.
Рис. 3. Средние показатели количества клеток (%),
экспрессирующих молекулы CD14,
CD80, CD83 и CD86 (верхняя гистограмма) и средняя интенсивность флюоресценции
(GMFI) окрашенных молекул HLA-DR, CD80, CD83 и CD86 (нижняя гистограмма).
Типы клеток и исследуемые стимуляторы обозначены в легенде справа
* - достоверные отличия от уровня нДК в парном t-тесте (р < 0,05).
Рис. 4. Процентное содержание ICOSL+ ДК
(слева) и геометрическая средняя
интенсивности флюоресценции ICOSL+ ДК (справа) после стимуляции
вакциной
БЦЖ (ДК-БЦЖ), вакциной гепатита В (ДК-ВГВ) и гидроксидом алюминия (ДК-ГА).
нДК - нестимулированные незрелые ДК (отрицательный контроль созревания),
ДК-ЦТК - клетки, стимулированные смесью медиаторов воспаления
(положительный контроль созревания)
* - достоверные отличия от нДК в парном t-тесте (р < 0,05). Обозначения типов ДК аналогичны рис. 4.
Рис.
5. Экспрессия CCR7 и CXCR5 на наружной мембране ДК после инкубации
с вакцинами. Сверху - результат цитометрического анализа распределения
хемокиновых рецепторов на ДК. Снизу - среднее процентное содержание CCR7+
и CXCR5+ ДК (N = 19)
Библиографические данные
1. Steinman, R.M. The dendritic cell system and its role in immunogenicity / R.M. Steinman // Annu. Rev. Immunol. 1991. V. 9. P. 271 - 296.
2. Mellman, I. Dendritic cells: specialized and regulated antigen processing machines. / I. Mellman, R.M. Steinman // Cell. 2001. V. 106. P. 255 - 258.
3. Guermonprez, P. Antigen presentation and T cell stimulation by dendritic cells / P. Guermonprez, J. Valladeau, L. Zitvogel et al. // Annu. Rev. Immunol. 2002. V. 20. P. 621 - 667.
4. Wu, L. Development of dendritic cell sysem / L.Wu, A. Dakik // Cell. Mol. Immunol. 2004. V. 1. P. 112 - 118.
5. Savina, A. Phagocytosis and antigen presentation in dendritic cells / A. Savina, S. Amigorena // Immunol. Rev. 2007. V. 219. P. 143 - 156.
6. Пащенков, M.B. Физиология клеток врожденной иммунной системы: дендритные клетки. / М.В. Пащенков, Б.В. Пинегин // Иммунология. 2006. Т. 27. N 6. С. 368 - 378.
7. Morel, S.A. Designing the optimal vaccine: the importance of cytokines and dendritic cells / S.A. Morel, M.S. Turner // Open Vaccine J. 2010. V. 3. P. 7 - 17.
8. Атауллаханов Р.И., Хаитов P.M. Адъюванты в составе вакцин. Сообщение 1. Микро- и наночастицы / Р.И. Атауллаханов, Р.М. Хаитов // Иммунология. 2011. V. 32(1). Р. 37 - 45.
9. Alvarez, D. Mechanisms and Consequences of Dendritic Cell Migration / D. Alvarez, E.H. Vollmann, U.H. von Andrian // Immunity. 2008. V. 29(3). P. 325 - 342.
10. Randolph, G.J. Dendritic-cell trafficking to lymph node through lymphatic vessels / G.J. Randolph, V. Angeli, M.A. Swartz //Nat. Rev. Immunol. 2005. V. 5. P. 617 - 628.
11. Талаев, В.Ю. Механизмы управления миграцией миелоидных дендритных клеток и клеток Лангерганса / В.Ю. Талаев // Иммунология. 2012. Т. 33. N 2. С. 104 - 112.
12. Топтыгина, А.П. Лимфоидный фолликул - территория иммунного ответа / А.П. Топтыгина // Иммунология. 2012. Т. 3. С. 162 - 169.
13. Saeki, Н. A migratory population of skin-derived dendritic cells expresses CXCR5, responds to В lymphocyte chemoattractant in vitro, and co-localizes to В cell zones in lymph nodes in vivo / H. Saeki, M.T. Wu, E. Olasz, S.T. Hwang // Eur. J. Immunol. 2000. V. 30. P. 2808 - 2814.
14. Leon, B. Regulation of TH2 development by CXCR5+ dendritic cells and lym-photoxin-expressing В cells / B. Leon, A. Ballesteros-Tato, J.L. Browning, R. Dunn, T.D. Randall, F.E. Lund // Nat. Immunol. 2012. V. 13(7). P. 681 - 690.
Список сокращений
ГМ-КСФ - гранулоцитарно-макрофагальный колониестимулирующий фактор
ДК - дендритные клетки
ИЛ - интерлейкин
МКА - моноклональные антитела
МНПК - мононуклеарные клетки периферической крови
ФНО-α - фактор некроза опухолей-α
ЭТС - эмбриональная телячья сыворотка
PBS - фосфатный солевой буфер Дюльбекко А