Скачать ГОСТ Р ИСО 22442-3-2011 Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 3. Валидация уничтожения и/или дезактивации вирусов и агентов инфекционной губчатой энцефалопатии
Дата актуализации: 01.01.2021

 ГОСТ Р ИСО 22442-3-2011
ГОСТ Р ИСО 22442-3-2011
Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 3. Валидация уничтожения и/или дезактивации вирусов и агентов инфекционной губчатой энцефалопатии
| Обозначение: |  ГОСТ Р ИСО 22442-3-2011 ГОСТ Р ИСО 22442-3-2011 |
| Обозначение англ: |  GOST R ISO 22442-3-2011 GOST R ISO 22442-3-2011 |
| Статус: | введен впервые |
| Название рус.: | Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 3. Валидация уничтожения и/или дезактивации вирусов и агентов инфекционной губчатой энцефалопатии |
| Название англ.: | Medical devices utilizing animal tissues and their derivatives. Part 3. Validation of the elimination and/or inactivation of viruses and transmissible spongiform encephalopathy agents |
| Дата добавления в базу: | 01.09.2013 |
| Дата актуализации: | 01.01.2021 |
| Дата введения: | 01.03.2012 |
| Область применения: | Стандарт устанавливает требования к процессу уничтожения и/или дезактивации вирусов и агентов TSE в процессе производства медицинских изделий (за исключением диагностических медицинских изделий in vitro), использующих животные ткани или продукты, произведенные из животной ткани, не являющиеся жизнеспособными или приведенными в это состояние. Стандарт применим в случаях, где этого требует процесс контроля риска, как описано в ИСО 22442-1. Он не касается других передающихся и не передающихся агентов. Стандарт не рассматривает влияние любого метода уничтожения и/или дезактивации на приемлемость медицинского изделия для предназначенного применения. |
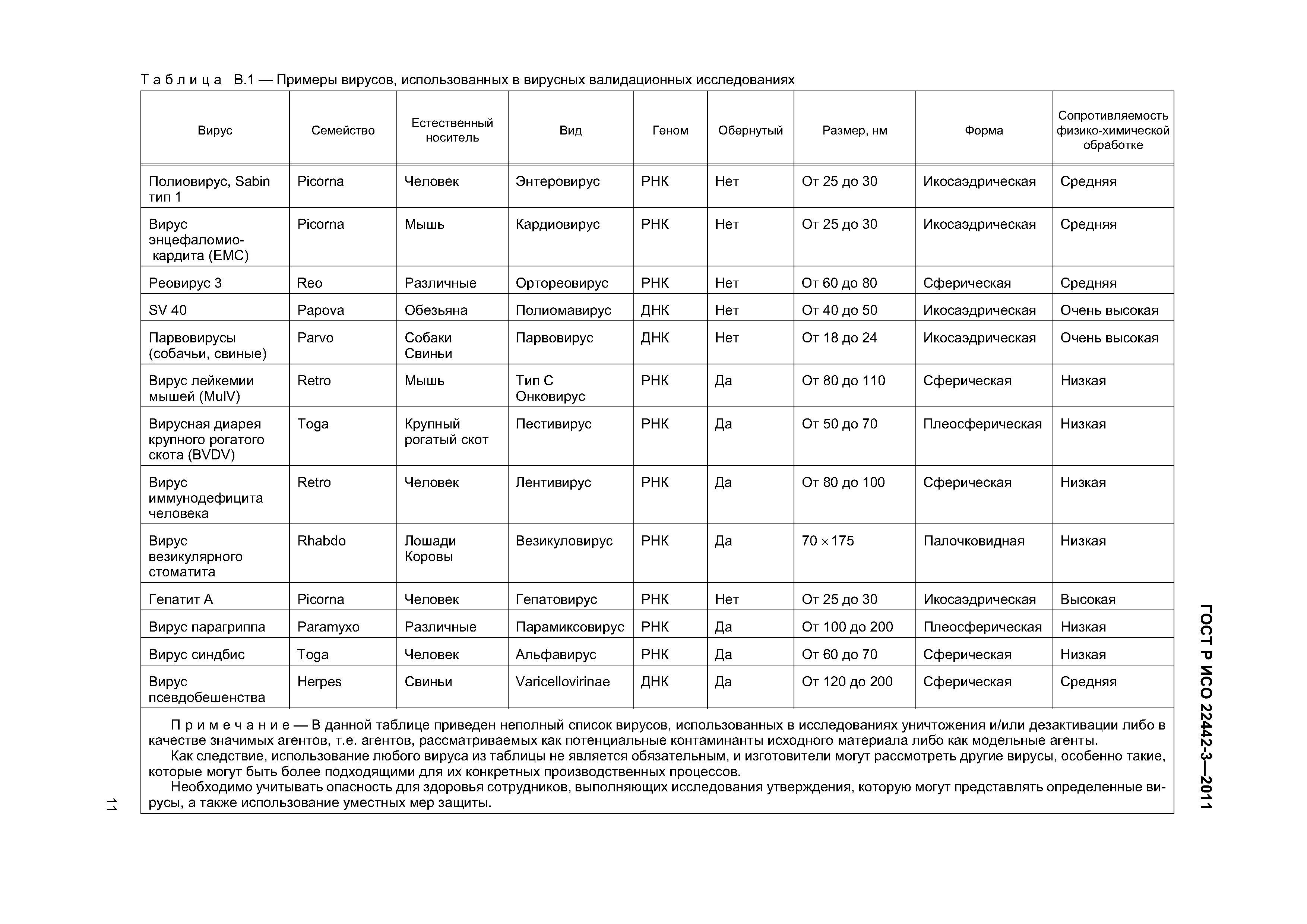
| Оглавление: | 1 Область применения 2 Нормативные ссылки 3 Термины и определения 4 Общие требования 4.1 Контроль риска 4.2 Процесс получения и производства 4.3 Общие требования, связанные с подтверждением 5 Обзор литературы 5.1 Проведение обзора литературы 5.2 Применение результатов обзора литературы 5.3 Вирусы 5.4 Агенты TSE 6 Исследование уничтожения и/или дезактивации вирусов и агентов TSE 6.1 Общая часть 6.2 Протокол 6.3 Проведение исследования 6.4 Интерпретация данных 7 Заключительный отчет 8 Пересмотр заключительного отчета 9 Регулярное наблюдение и контроль критических параметров процесса. Приложение А (справочное) Требования, связанные с обзором литературы Приложение В (справочное) Рекомендации по исследованию уничтожения и/или дезактивации вирусов Приложение С (справочное) Рекомендации по исследованию уничтожения и/или дезактивации агентов TSE Приложение D (справочное) Рекомендации по уменьшению масштаба Приложение Е (справочное) Статистическая оценка титров вирусов и коэффициентов сокращения и оценка их достоверности Приложение F (справочное) Вычисление коэффициентов сокращения Приложение G (справочное) Вероятность обнаружения агентов при низких концентрациях Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов национальным стандартам Российской Федерации Библиография |
| Разработан: | ТК 422 Оценка биологического действия медицинских изделий АНО ИМБИИТ |
| Утверждён: | 15.06.2011 Федеральное агентство по техническому регулированию и метрологии (125-ст) |
| Издан: | Стандартинформ (2011 г. ) |